Ad-TRAIL对人T淋巴瘤细胞的感染效果及体外抗肿瘤作用
2016-10-24张玲玲
张玲玲
(北京大学国际医院,北京102206)
·基础研究·
Ad-TRAIL对人T淋巴瘤细胞的感染效果及体外抗肿瘤作用
张玲玲
(北京大学国际医院,北京102206)
目的研究携带肿瘤坏死因子相关凋亡诱导配体(TRAIL)基因的重组腺病毒(Ad-TRAIL,AdT)对人T淋巴瘤Jurkat细胞株的感染效果及体外抗肿瘤作用。方法 人T淋巴瘤Jurkat细胞株应用携带绿色荧光蛋白(GFP)的重组腺病毒载体(Ad-GFP,AdG)处理,以流式细胞仪分析细胞的GFP表达率。以AdT处理Jurkat细胞后,RT-PCR检测AdT感染后1、3、5、7天TRAIL基因的表达情况;MTT法检测AdT单药以及和化疗药物阿霉素(ADM)、依托泊苷(VP-16)、长春新碱(VCR)、地塞米松(DXM)联合用药的细胞毒作用;采用流式细胞仪检测各组细胞凋亡率。结果腺病毒可成功感染Jurkat细胞,AdT感染Jurkat细胞后目的基因TRAIL可有效表达,并持续至感染后7 d左右。AdT作用细胞后,可抑制Jurkat细胞的增殖。MTT检测显示,AdT对肿瘤细胞的增殖抑制呈剂量依赖关系(P均<0.05)。流式细胞仪检测发现,AdT可诱导淋巴瘤细胞凋亡,且随着剂量增加,诱导凋亡作用增强(P均<0.05)。MTT和流式细胞仪检测发现,AdT和DXM联合对Jurkat细胞的增殖抑制和诱导凋亡起协同作用,AdT和ADM、VP-16、VCR联合对细胞的增殖抑制为单纯相加作用。结论 AdT可成功转染人T淋巴瘤Jurkat细胞株并诱导细胞凋亡,其和化疗药物联用对抑制细胞增殖可起到协同或相加作用。
T细胞淋巴瘤;肿瘤坏死因子相关凋亡诱导配体;感染;杀伤力
T细胞性非霍奇金淋巴瘤(T-NHL)在中国、日本等东南亚地区人群中发病率较高,占淋巴瘤发病率的25%~30%[1,2]。T-NHL的侵袭性强,临床过程凶险,预后较差[3], 5年总生存率只有25%左右[4]。亟需探寻新的治疗手段以改善T-NHL的疗效并降低治疗的不良作用。肿瘤坏死因子相关凋亡诱导配体(TRAIL)是近年发现的具有选择性诱导肿瘤细胞凋亡而对正常细胞没有毒性的肿瘤坏死因子家族成员。为改善T-NHL的治疗效果,2014年12月~2015年2月,我们研究了重组腺病毒载体携带人TRAIL基因(AdT)对T-NHL的体外抗肿瘤作用,为体内试验和进一步的临床研究提供理论依据。
1 材料与方法
1.1材料人T淋巴瘤Jurkat细胞株,购自中国医学科学院,培养于含10%胎牛血清的RPMI-1640(pH 7.4)培养基中,置于37 ℃、5% CO2的培养箱中培养,取对数生长期细胞进行实验,每组均设3个复孔。RPMI-1640培养液及胎牛血清购自Gibco公司,携带TRAIL基因的重组腺病毒(Ad-TRAIL, AdT)及携带绿色荧光蛋白(GFP)的重组腺病毒(Ad-GFP,AdG)由美国MD.Anderson癌症中心提供,四甲基偶氮唑蓝(MTT)及分析纯二甲基亚砜(DMSO)购自Sigma公司,PCR试剂购自上海申能博采公司,TRAIL引物及GAPDH引物购自上海英骏生物公司,ReverseTranscription System购自美国Promega公司,TRIzol试剂购自美国Invitrogen公司,Adeno-XTMRapidtiter试剂盒购自BD Biosciences公司。
1.2AdT和AdG的扩增、纯化及滴度测定按参考文献[5]进行,其滴度分别为AdT:7.42×1010PFU(空斑形成单位)/mL;AdG:8.02×1010PFU/mL。
1.3细胞感染效率的检测取对数生长期细胞制成单细胞悬液,以1×106/mL的密度接种于6孔板,每孔1 mL。以不同滴度的AdG感染细胞,感染复数(MOI)分别为0、200、400。并设空白对照。继续培养48 h后,收集细胞,以流式细胞仪检测细胞GFP的表达情况。GFP的表达率反映细胞的感染效率。
1.4TRAIL基因表达的检测采用RT-PCR法。以MOI=200的AdT或AdG感染细胞,分别于AdT感染后1、3、5、7 d,AdG感染后3 d收集细胞。用TRIzol提取细胞总RNA后,反应分两步进行,先按照mRNA 逆转录试剂盒的说明将总RNA 1 μg逆转录为cDNA,再以cDNA为模板根据PCR方法建立反应体系,反应条件为94 ℃预变性5 min;94 ℃ 1 min、53 ℃ 1 min、72 ℃ 1 min,共26个循环。目的基因TRAIL的上游引物为5′-TTCACAGTGCTCCTGCAGTC-3′,下游引物为5′-TCACCATTCCTCAAGTGCAA-3′,扩增长度为455 bp;内参照物为GAPDH,上游引物为5′-GAGTCAACGGATTTGGTCGT-3′,下游引物为5′-GACAAGCTTCCCGTTCTCAG-3′,扩增长度为185 bp。扩增产物取8 μL 用1%琼脂糖凝胶电泳分析。
1.5细胞增殖抑制率的检测采用MTT比色法。分别检测AdT单药以及和化疗药物阿霉素(ADM)、依托泊苷(VP-16)、长春新碱(VCR)、地塞米松(DXM)联合用药的细胞毒作用。将细胞以1×105/mL的密度接种于96孔板,每孔100 μL。AdT和AdG设立4个剂量滴度,MOI分别为25、50、100、200;AdT和药物联合组每孔加入MOI为100的AdT。继续培养24 h后,转移至含10%新生牛血清的RPMI-1640培养基100 μL。检测计算各药物的IC50值,以IC50为中心选取5个药物浓度,于AdT和药物联合组分别加入不同浓度的化疗药物。继续培养72 h后,收集细胞进行MTT检测。每孔加入浓度为5 mg/mL的MTT 溶液20 μL,继续孵育4 h后每孔加DMSO 150 μL,检测前水平摇床轻摇10 min,待MTT结晶充分溶解后置自动酶标仪测定各孔在540 nm波长处吸光度的A值。按以下公式计算细胞的增殖抑制率。细胞增殖抑制率(IR, %)=[(1-实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)]×100%(公式1);AdT和化疗药物联合的作用采用金(正均)氏公式计算:q=EA+B(实测合并效应)/EA+EB-EA*EB(预期合并效应)(公式2)。q的意义:0.85~1.15为单纯相加(+);>1.15~2为协同(++);>20为明显协同(+++ );<0.85~0.55为拮抗(-);<0.55为明显拮抗(-)。
1.6细胞凋亡率的检测 采用流式细胞术。将细胞以1×106/mL的密度接种于6孔板,每孔1 mL,分别以AdT、AdG、DXM、AdT+DXM联合处理各组细胞,并设置细胞对照组。以2%新生牛血清培养基稀释的AdT和AdG感染细胞,MOI分别为200、400;AdT+DXM联合组加入MOI为100的AdT,培养24 h后,转移至含10%新生牛血清的RPMI-1640培养基1 mL,DXM组和AdT+DXM联合组分别加入DXM 200 μmol/L,继续培养72 h。收集细胞,加入70%乙醇固定过夜。碘化丙啶进行DNA染色后,以流式细胞仪检测细胞凋亡情况。
2 结果
2.1AdG对Jurkat细胞的感染效率流式细胞仪检测显示,48 h后,MOI=200时细胞GFP的表达率为67.2%±3.5%;MOI=400时细胞GFP的表达率为81.5%±4.7% ,而空白对照细胞无GFP表达。
2.2AdT感染Jurkat细胞后TRAIL基因的表达提取的部分细胞总RNA用1%琼脂糖凝胶电泳分析,可见明显的三条目的条带,无明显的降解,OD260/OD280的比例都在 1.8~2.0。AdT感染Jurkat细胞后,TRAIL基因的表达逐渐增高,第 3天达到了高峰,随后,表达逐渐下降,第 7天只能检测到TRAIL基因微弱的表达。 AdG感染后的第3天的肿瘤细胞没有出现TRAIL的目的条带。见图1。

注:Lane 1、2、3、4 AdT感染第1、3、5、7天TRAIL mRNA的表达;Lane 5 AdG感染第3天TRAIL mRNA的表达。
图1Jurkat细胞TRAIL基因的表达
2.3AdT单药及与化疗药联用对Jurkat细胞的增殖抑制率的影响见表1。AdT对肿瘤细胞的增殖抑制呈剂量依赖关系,当MOI为200的AdT感染细胞72 h后,抑制率为39.60%±6.19%,而AdG感染细胞后,并没有明显抑制Jurkat细胞的增殖。单用浓度为0.012 5、0.025、0.05、0.1、0.2 μmol/L的ADM作用72 h后对Jurkat细胞的抑制率分别为7.7%±3.7%、8.5%±4.6%、9.6%±4.0%、14.8%±3.2%、15.0%±3.0%,联合MOI为100的AdT后对细胞的抑制率分别为43.0%±4.6%、43.4%±4.3%、45.6%±5.7%、46.6%±3.9%、50.2%±4.2%, 与各单药组相比,P均<0.05。单用浓度为0.625、1.25、2.5、5、10 μmol/L的VP-16作用72 h后对Jurkat细胞的抑制率分别为12.7%±4.7%、24.9%±4.4%、55.7%±3.1%、71.3%±1.8%、81.5%±0.9%,联合MOI为100的AdT后对细胞的抑制率分别为40.7%±2.9%、52.2%±3.1%、76.7%±0.6%、82.3%±1.6%、85.6%±1.3%,与各单药组相比,P均<0.05。单用浓度为0.006 25、0.012 5、0.025、0.05 mol/L、0.1 μmol/L的VCR作用72 h后对Jurkat细胞的抑制率分别为35.1%±4.9%、57.0%±3.7%、62.3%±3.5%、63.2%±3.0%、67.0%±3.9%,联合MOI为100的AdT后对各组细胞的抑制率分别为60.8%±2.9%、62.6%±2.8%、64.3%±1.2%、66.7%±2.2%、68.1%±1.5%,与各单药组相比,P均<0.05。单用浓度为12.5、25、50、100、200 μmol/L的DXM作用72 h后对Jurkat细胞的抑制率分别为0.6%±5.8%、2.9%±4.4%、4.0%±3.6%、15.2%±3.7%、17.6%±5.6%,联合MOI为100的AdT后对Jurkat细胞的抑制率分别为45.4%±2.9%、50.8%±3.6%、51.7%±3.6%、54.8%±4.2%、67.2%±5.7%,与各单药组相比,P均<0.05。AdT和ADM、VP-16、VCR联合对细胞的增殖抑制为单纯相加作用,其q值在0.85~1.15。
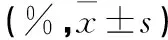
表1 不同MOI的AdT、AdG对Jurkat细胞的增殖抑制率比较
注:与AdG比较,*P<0.05。
2.4AdT单用及联用DXM诱导Jukat细胞的凋亡情况AdT可诱导淋巴瘤细胞的凋亡,且随着剂量增加,诱导凋亡作用增强。当MOI=200的AdT感染细胞72 h后,细胞凋亡率为36.5%±3.7%;MOI=400时,细胞凋亡率为51.8%±2.4%。与细胞对照组(3.1%±0.7%)相比,P均<0.05。而MOI为400的AdG感染细胞72 h后,与细胞对照组相比,凋亡率(3.3%±0.5%)未见明显增加(P>0.05)。流式细胞仪检测显示,MOI为100的AdT和DXM联用可增强DXM诱导的Jurkat细胞凋亡。200 μmol/L的DXM作用Jurkat细胞72 h后细胞的凋亡率为11.9%±0.0%,MOI为100的AdT作用细胞72 h后细胞的凋亡率为26.3%±2.8%,二者联合后细胞的凋亡率为59.6%±5.4%,与各单药组相比,P均<0.05。金正均公式计算显示,AdT和DXM联合对Jurkat细胞的增殖抑制和诱导凋亡有协同作用,其q值大于1.15。
3 讨论
T-NHL是亚洲人群中发病率较高的淋巴瘤亚型,在国内发病率占NHL的25%左右[2,5]。与B细胞淋巴瘤相比,其治疗效果欠佳。因此,寻找新的更为有效安全的治疗手段具有十分重要的意义。临床前的研究已经证实,TRAIL能诱导多种肿瘤细胞凋亡,抑制肿瘤生长并延长动物肿瘤模型的生存期,并与多种化疗药物如ADM、顺铂和依利替康以及放疗均有很好的协同作用,甚至对化放疗抵抗的肿瘤仍然有较好的疗效,提示其为一种非常有前途的抗癌药物。但可溶性TRAIL蛋白的体内半衰期过短[6];而且TRAIL蛋白对于经常以结外局部侵犯的T-NHL来说,作用于局部病灶的药物浓度相对较低。利用基因载体介导TRAIL基因在肿瘤细胞内的特异表达以克服TRAIL蛋白治疗的局限性成为近年来研究的热点。基因治疗能克服TRAIL的缺点,使TRAIL蛋白在肿瘤内部得到持续而稳定的表达,可以改善治疗效果。
本研究采用重组腺病毒载体携带人TRAIL基因针对T-NHL进行基因治疗,探讨AdT应用于T-NHL局部治疗的可行性。我们的研究发现腺病毒可以成功转染T淋巴瘤细胞,MOI=200时感染效率超过60%。已有多个研究证实腺病毒是介导TRAIL基因的合适载体[7~9]。腺病毒是通过细胞表面的两种受体介导的入胞作用而转染入细胞内的[10,11]。柯萨奇-腺病毒受体与腺病毒黏附然后通过αVβ3和αVβ5交联受体介导病毒内化。有研究证明,Jurkat细胞表面高表达这两类受体[8, 12],因此腺病毒能成功转染Jurkat细胞。
我们的实验观察到腺病毒感染Jurkat细胞后可持续有效地表达目的基因,TRAIL基因于感染后第1天开始表达,可持续至感染后第7天。这说明TRAIL基因治疗能克服TRAIL可溶性蛋白半衰期短的缺点,使TRAIL蛋白在肿瘤内部得到持续而稳定的表达。
TRAIL可与胞膜特异性受体DR4、DR5结合来激活死亡受体通路,继而通过线粒体通路和非线粒体通路引起肿瘤细胞凋亡[13]。有研究证明TRAIL蛋白可诱导Jurkat细胞株凋亡,且与多种药物如化疗药物、靶向药物等有协同作用。其诱导凋亡作用主要是通过外源性途径,并涉及多种凋亡相关蛋白的表达[14]。本实验中,我们采用MTT法检测腺病毒介导的TRAIL基因作用于肿瘤细胞后细胞的增殖率,结果发现AdT可抑制Jurkat细胞的增殖,随着浓度的增加和作用时间的延长抑制作用增大。其次,流式细胞仪的检测也发现,AdT感染Jurkat细胞后,可以诱导细胞凋亡。本实验首次发现T-NHL细胞株Jurkat对TRAIL基因治疗也是敏感的,证实了TRAIL是通过诱导T淋巴瘤Jurkat细胞株的凋亡而抑制其增殖的。但其机制是否和可溶性TRAIL蛋白诱导凋亡的机制相同,尚需进一步的研究。
因ADM、VP-16、VCR、DXM为临床常用的治疗T-NHL的化疗药物,因此我们进一步研究了AdT和上述药物联用对Jurkat细胞株的杀伤作用,以探讨AdT体内局部用药联合全身化疗的可行性。本研究发现,AdT和任何一种化疗药物联用对Jurkat细胞的杀伤效果均比化疗药物或AdT单用要强。提示AdT局部用药和全身化疗联合是可行的,并不会减弱全身化疗的抗肿瘤作用,但需要更进一步的试验和体内研究证实。
本试验表明AdT可成功转染T淋巴瘤Jurkat细胞株并诱导细胞凋亡,其和化疗药物联用对诱导细胞凋亡可起到协同或相加作用。首次探讨了腺病毒为载体的TRAIL基因在T-NHL治疗中应用的可能。初步显示了TRAIL基因治疗是一种有效的治疗策略,为T-NHL的治疗提供了一个潜在的治疗途径。今后应进一步研究AdT对化疗耐药的T-NHL细胞株的杀伤效果,并进行AdT的动物实验以探讨AdT体内局部用药以及与全身化疗联合对T-NHL的抗肿瘤作用。
[1] Lu D, Lin CN, Chuang SS, et al. T-cell and NK/T-cell lymphomas in southern Taiwan: a study of 72 cases in a single institute[J]. Leuk Lymphoma, 2004,45(5):923-928.
[2] Yang QP, Zhang WY, Yu JB, et al. Subtype distribution of lymphomas in Southwest China: analysis of 6,382 cases using WHO classification in a single institution[J]. Diagn Pathol, 2011,6:77.
[3] Armitage JO, Vose JM, Linder J, et al. Clinical significance of immunophenotype in diffuse aggressive non-Hodgkin′s lymphoma[J]. J Clin Oncol, 1989,7(12):1783-1790.
[4] Rudiger T, Weisenburger DD, Anderson JR, et al. Peripheral T-cell lymphoma (excluding anaplastic large-cell lymphoma): results from the Non-Hodgkin′s Lymphoma Classification Project[J]. Ann Oncol, 2002,13(1):140-149.
[5] 周立强,孙燕,谭文勇,等.非霍奇金淋巴瘤1125例临床病理分析[J].癌症治疗进展,2006,4(5):391-397.
[6] Lin T, Huang X, Gu J, et al. Long-term tumor-free survival from treatment with the GFP-TRAIL fusion gene expressed from the hTERT promoter in breast cancer cells[J]. Oncogene, 2002,21(52):8020-8028.
[7] Kagawa S, He C, Gu J, et al. Antitumor activity and bystander effects of the tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) gene[J]. Cancer Res, 2001,61(8):3330-3338.
[8] Lee J, Hampl M, Albert P, et al. Antitumor activity and prolonged expression from a TRAIL-expressing adenoviral vector[J]. Neoplasia, 2002,4(4):312-323.
[9] Griffith TS, Anderson RD, Davidson BL, et al. Adenoviral-mediated transfer of the TNF-related apoptosis-inducing ligand/Apo-2 ligand gene induces tumor cell apoptosis[J]. J Immunol, 2000,165(5):2886-2894.
[10] Wayner EA, Orlando RA, Cheresh DA. Integrins alpha v beta 3 and alpha v beta 5 contribute to cell attachment to vitronectin but differentially distribute on the cell surface[J]. J Cell Biol, 1991,113(4):919-929.
[11] Wickham TJ, Mathias P, Cheresh DA, et al. Integrins alpha v beta 3 and alpha v beta 5 promote adenovirus internalization but not virus attachment[J]. Cell, 1993,73(2):309-319.
[12] Chen Z, Ahonen M, Hamalainen H, et al. High-efficiency gene transfer to primary T lymphocytes by recombinant adenovirus vectors[J]. J Immunol Methods, 2002,260(1-2):79-89.
[13] Bossen C, Ingold K, Tardivel A, et al. Interactions of tumor necrosis factor (TNF) and TNF receptor family members in the mouse andhuman[J]. J Biol Chem, 2006,281(20):13964-13971.
[14] Du YW, Chen JG, Bai HL, et al. A novel agonistic anti-human death receptor5 monoclonal antibody with tumor icidal activity in duces caspase- and mitochondrial-dependent apoptosis in human leukemia Jurkat cells[J]. Cancer Biother Radiopharm, 2011,26(2):143-152.
10.3969/j.issn.1002-266X.2016.29.008
R733.4
A
1002-266X(2016)29-0024-04
2015-03-09)
