重组FIP的研究进展
2016-10-24段作文陈丽静李浩戈范文丽李天来林景卫
段作文,韩 笑,陈丽静,李浩戈,张 丽,张 良,范文丽,李天来,林景卫*
(1.沈阳农业大学生物科学技术学院,辽宁 沈阳 110866;2.沈阳农业大学园艺学院,辽宁 沈阳 110866)
真菌免疫调节蛋白(Fungal immunomodulatory protein,FIP)是近年在高等真菌中发现的一类与植物凝集素和免疫球蛋白的结构和免疫功能相似的小分子蛋白质。1989年,Kino等[1]在灵芝(Ganoderma lucidum)菌丝体提取物中分离得到第一个真菌免疫调节蛋白LZ-8(FIP-glu)后,人们又陆续在松杉灵芝(G. tsugae)、金针菇(Flammulina veltipes)、草菇(Volvariella volvacea)、紫灵芝(G. japoncium)、小孢子灵芝(G. microsporum)、紫芝(G. sinense)、樟芝(Antrodia camphorate)、茯苓(Poria cocos)、云芝(Trametes versicolor)、树舌灵芝(Ganoderma applanatum;Gene Bank:AEP68179)、黑灵芝(Ganoderma astum)、血红丛赤壳(Nectria haematococca)中发现了真菌免疫调节蛋白,分别命名为FIP-fve,FIP-gts,FIP-vvo,FIP-gja,FIP-gmi,FIP-gsi,FIP-aca,FIP-pcp,FIP-tvc,FIP-gap,FIP-gas,FIP-nha[2-10]。
目前已知的FIPs的基因编码区大小约为330~360 bp、分子量为13 kDa左右,由110~114个氨基酸残基组成。富含天门冬氨酸和缬氨酸,缺乏组氨酸、半胱氨酸和甲硫氨酸。其N端氨基酸均为乙酰化阻断氨基酸[11]。在目前所发现的FIPs中只有LZ-8中含有糖,含量约为1.3%,其他种类的FIPs都不含有糖。不同FIPs在一级结构上非常相似,进化上比较保守,氨基酸序列之间的同源性比较高,可达到60%~100%(图1)。
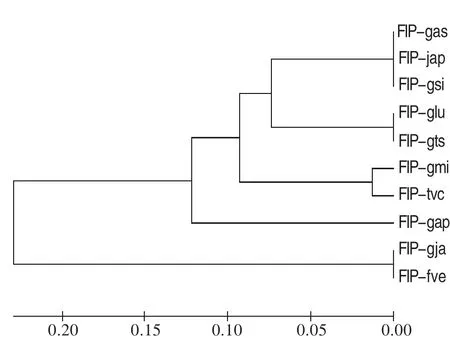
图1 不同FIP的系统进化树
台湾Lin等人利用酵母双杂交和定点突变的方法,发现天然有活性的FIPs为同源二聚体,其N端大约10个氨基酸形成α-螺旋,该结构对于FIPs二聚体的形成具有重要作用[12]。还发现FIPs的二级结构中富含β结构,包括2个α-螺旋,7个β-折叠和1个β-转角[13]。该结构特点与免疫球蛋白重链可变区结构非常相似[14]。
2003年,Seow等使用悬滴法获得了FIP-fve晶体。同年,Paaventhan等利用NaBr渗透对FIP-fve晶体进行单向不规则晶体衍射,发现FIP-fve的N端紧接着α-螺旋有一个纤连蛋白折叠结构——FNⅢ折叠,该结构是7个β-折叠S型和8个β-折叠h形中间过渡构型,也称为假-h-型拓扑结构。另外,安敏等利用滴气象扩散法得到了LZ-8的晶体结构,与金针菇的晶体结构非常相似[15]。因此表明,各种FIPs在一级结构、二级结构和高级结构上都有一定的相似性,并且在高级结构上与免疫球蛋白有着相似性。
1 真菌免疫调节蛋白的生物学功能
研究证实FIPs具有重要的生物学功能。具体包括以下几个方面。
1.1 血细胞凝集活性
目前已知的几种FIPs都被发现具有血细胞凝集活性,可以凝集不同哺乳动物的血红细胞,对血红细胞的凝集无种属特异性和专一性。
LZ-8和LZ-9能够凝集兔、鼠和绵羊血红细胞,但是它们都不能凝集人类四种类型的血红细胞(A、B、AB和O血型)[10]。而FIP-fve可以凝集人血红细胞(A、B、AB和O血型)。FIP-vvo能凝集Wistar大鼠和绵羊血红细胞[16],但它也不能凝集人血红细胞。FIP-tvc可凝集鼠血红细胞[8]。另外,研究发现FIP-nha可以凝集绵羊、家兔、小鼠以及人O型血红细胞[17]。
1.2 抗肿瘤活性
FIPs都具有抗肿瘤活性。重组表达的灵芝免疫调节蛋白(rLZ-8)可以诱导K562细胞、HL60细胞和白血病NB4细胞凋亡[18-19]。rFIP-fve和rFIP-gts都可以抑制A549肿瘤细胞的生长[20-23]。又发现FIP-gts还可抑制肿瘤细胞的移动,而人23-1型基因可以与其协同作用增强FIP-gts对癌细胞转移的抑制作用[24]。
1.3 抗过敏反应活性
FIPs具有抗过敏反应活性。研究发现,LZ-8,FIP-vvo和FIP-fve都可以明显地抑制小鼠足垫水肿反应(Arthus反应)和小鼠系统过敏性反应。LZ-8还可以预防自主免疫性糖尿病,并且可以提高兔胰腺移植和小鼠皮肤移植的移植率,而且没有任何副作用[25]。另外,还发现FIP-fve可以抑制嗜酸性粒细胞活性,这表明可能对与嗜酸性粒细胞有关的过敏症如支气管哮喘、过敏性鼻炎等具有疗效[26]。FIP-fve还可以抑制卵清蛋白(OVA)引起的食物过敏反应和治疗羽刺皮癣螨2型抗原(Dp-2)引起的呼吸道炎症[27]。
1.4 促进淋巴细胞增殖活性
FIPs可促进小鼠脾细胞和人类外周血淋巴细胞增殖,并且呈现出与植物凝集素相似的剂量效应曲线。LZ-8,FIP-fve和FIP-vvo能够刺激淋巴细胞的增殖[28-30]。同时,FIPs在促进淋巴细胞增殖过程中与植物凝集素具有协同作用,LZ-8,FIP-fve和FIP-vvo可分别与ConA,PHA和PHA共同促进淋巴细胞的分裂。
1.5 诱导细胞因子表达
研究发现LZ-8可以增强白细胞介素-2(interleukin-2,IL-2),IFN-γ,肿瘤坏死因子-α(tumor necrosis factor,TNF-α),IL-β等细胞因子的分泌[31]。FIP-fve可显著地增强IL-2和IFN-γ的分泌[29]。而FIP-vvo可以显著增强IL-2,IL-4,IFN-γ,TNF-α,淋巴毒素(LT)和IL-2的分泌。FIP-gsi也可以增强鼠脾细胞分泌细胞因子(IL)-2,IL-3,IL-4,IFN-γ,TNF-α和IL-2受体(IL-2R)[32]。
虽然FIPs具有重要的生物学功能,但是关于它们临床试验应用的报道不是很多,主要是因为不能大量稳定地获取这些蛋白。天然提取这些蛋白既耗时又费力,而且获得的产品率很低,活性也不高,因此,怎样高效率地表达这些FIPs,对于今后的实践应用至关重要。因此,目前人们广泛利用基因工程的手段构建一些表达载体使它们高效、稳定地表达,以期为将来的临床应用奠定基础。
2 FIPs的重组表达
目前,人们用于体外蛋白重组表达的系统主要有原核表达系统和真核表达系统两种,原核表达系统主要是大肠杆菌表达系统,而真核表达系统主要包括酵母表达系统、植物表达系统、昆虫细胞表达系统(见表1)。
2.1 LZ-8的重组表达
2.1.1 LZ-8在大肠杆菌表达系统中的重组表达
采用CTAB法提取灵芝DNA,通过PCR扩增LZ-8基因,扩增产物可分别与载体pET21a,pET28b,pET30a连接,将连接产物转化到宿主细胞大肠杆菌BL21(DE3)中,经诱导培养,检测出rLZ-8的产量分别是占菌体总蛋白的36.52%,70 mg/L,34.46 mg/L。
生物活性测定表明,rLZ-8蛋白在一定程度上可以延迟小鼠的免疫排斥过程,延长移植体存活时间,具有一定的免疫抑制活性,还可以凝集羊血红细胞[32-35]。
2.1.2 LZ-8在酵母表达系统中的重组表达
克隆LZ-8基因,克隆后的LZ-8基因可与载体pPIC9p和PICZαA连接,通过电击转化法将连接产物转化到毕赤酵母GS115中,经甲醇连续诱导培养,rLZ-8的表达效率分别为191.2 mg/L和350 mg/L[36-37]。
生物活性分析表明,rLZ-8可以刺激小鼠脾淋巴细胞的增殖、增强鼠脾细胞分泌细胞因子IL-2,也可以抑制人白血病-NB4细胞的增殖。
LZ-8基因还可与载体pPICZαA连接、转化到毕赤酵母X-33中,经培养,表达效率可达34.4 mg/L。

表1 各种重组表达系统的比较
生物活性测定表明,rLZ-8可以凝集兔、鼠、绵羊和人血红细胞[10]。
2.1.3 LZ-8植物表达系统中的重组表达
扩增LZ-8基因,与载体p3300GB连接,构成植物双元表达载体pCAMLz8,将该载体转化到农杆菌LBA4404中,最后通过叶盘转化法转到烟草中。经测定,rLZ-8在烟草中的表达量占烟草可溶性蛋白的0.18%,即每克新鲜叶片约含149.82 μg的rLZ-8[38]。
2.1.4 LZ-8在枯草芽孢杆菌和乳酸乳球菌中的重组表达
采用OE-PCR法扩增LZ-8基因,扩增后的LZ-8基因分别与载体pOA和pOAS连接,连接产物转化到芽孢杆菌WB800细胞中,经测定,rLZ-8表达效率分别是17.5 mg/L和13.2 mg/L。而在乳酸菌中的表达,LZ-8基因与载体pNZSLZ连接,转化到宿主细胞乳酸菌NZ9000细胞中,表达效率为1.24 mg/L。
生物活性测定表明,不同表达载体表达的rLZ-8具有不同的生物活性。枯草芽孢杆菌WB800(pOA-LZ8)中表达的rLZ-8可以促进hPBMC的增殖,而在乳酸乳球菌中表达的NZ9000(pNZSLZ)虽然可以促进hPBMC的增殖,但是不显著。枯草芽孢杆菌产生的rLZ-8也可以促进TNF-α的产生,而在NZ9000(pNZSLZ)产生的rLZ-8没有此活性。三种来源的rLZ-8都可以显著地增加IL-2/IL-4的比率[39]。
2.2 FIP-fve的重组表达
2.2.1 FIP-fve在大肠杆菌表达系统中的重组表达
构建重组表达载体PET30a-FIP-fve,该载体可分别转化到大肠杆菌DE3和M15中,经培养,表达效率分别为29.1 mg/L[40]和得到的可溶性蛋白占M15总可溶性蛋白的7.4%[30]。同时,FIP-fve基因也可与载体pGEX4t连接,转化到大肠杆菌DE3细胞中。经培养,表达效率为5.8 mg/L[41]。FIP-fve基因还可以连接到pET-28(+)载体上,通过热转化法转化到大肠杆菌BL21细胞中。经培养,表达效率可达30 mg/L。
生物活性分析表明,rFIP-fve可以增强鼠血清中细胞因子IL-2和IFN-γ的分泌[42],也具有刺激细胞分裂的作用。
2.2.2 FIP-fve在酵母表达系统中的重组表达
金针菇可以在酵母中进行诱导型和组成型表达。扩增金针菇和酵母三磷酸甘油醛脱氢酶启动子Pgap基因,然后构建毕赤酵母诱导型表达载体pPIC9-FIP-fve和组成型表达载体pPIC9-PGAp-FIP-fve,最后,将表达载体转化到毕赤酵母GS115细胞中。经培养,诱导型表达rFIP-fve的表达效率是158.2 mg/L,组成型表达rFIP-fve的表达效率为46.3 mg/L[43]。
生物活性分析表明,rFIP-fve可以凝集人血红细胞、刺激小鼠脾淋巴细胞的增殖,还可显著地刺激小鼠脾淋巴细胞分泌白介素IL-2。
此外,FIP-fve还可与载体pPICZαA连接,连接产物转化到毕赤酵母X-33细胞中,经甲醇连续诱导培养,表达效率为18.9 mg/L。
生物活性分析表明rFIP-fve可以凝集兔的血红细胞[10]。
2.2.3 FIP-fve在昆虫表达系统中的重组表达
采用PCR法扩增FIP-fve基因,PCR产物与转移载体质粒pAcUW21结合形成质粒pAcP10Fve,然后,该质粒pAcP10Fve与事先合成的SPbbx(单肽)片段结合,形成重组质粒pAcP10SPbbxFve,再与AcMNPV一起合成重组病毒vAcP10SPbbxFve,最后感染昆虫Sf21细胞。经培养,FIP-fve表达效率为6.25 mg/L。
生物活性测定表明rFIP-fve可以显著地刺激鼠脾细胞分泌IL-2[44]。
2.3 FIP-gts的重组表达
2.3.1 FIP-gts在大肠杆菌表达系统中的重组表达
扩增FIP-gts基因,扩增产物与载体pET-30a(+)连接,连接产物转化到大肠杆菌TG1细胞中,经培养,测定其表达效率为20 mg/L[2]。
2.3.2 FIP-gts在昆虫表达系统中的重组表达
扩增FIP-gts基因,从转移载体质粒pAcUW21中构建重组质粒pAcP10Fve,然后该重组质粒与AcRP23.LacZ DNA共转染Sf21细胞,产生重组杆状病毒vAcP10Fve。最后将vAcP10Fve转化到Sf21细胞中,经培养,测定3×106受感染的细胞rFIP-gts表达效率是47.2 μg。
生物活性测定表明,rFIP-gts可以增强鼠脾细胞分泌细胞因子IL-2[45]。
2.4 FIP-vvo的重组表达
扩增FIP-vvo基因,然后与载体pPICZaA连接。通过电转化法将连接产物转化到毕赤酵母X-33细胞中。经甲醇连续诱导培养,表达效率达到了410 mg/L。
生物活性测定表明rFIP-vvo可以凝集鼠和绵羊的血红细胞、刺激鼠脾细胞的增殖、增强鼠脾细胞中细胞因子IFN-γ的分泌[16]。
2.5 FIP-gja的重组表达
2.5.1 FIP-gja在大肠杆菌表达系统中的重组表达
采用PCR法扩增FIP-gja基因。扩增产物与载体pET-30a(+)连接,转化到大肠杆菌BL21细胞中,经培养,表达效率为36.46 mg/L[46]。
2.5.2 FIP-gja在植物表达系统中的重组表达
采用PCR法扩增FIP-gja基因。PCR产物先后与载体pBluecsriPt和p3300GB连接,得到FIP-gja植物双元表达载体pcAMGJA。并将该载体转化到农杆菌LBA4404中,通过叶盘转化法转入烟草。经鉴定,其表达效率为可溶性总蛋白的0.31%。
生物学功能分析表明,rFIP-gja可增强TNF-α的表达水平[46]。
2.6 FIP-gsi的重组表达
2.6.1 FIP-gsi在大肠杆菌表达系统中的重组表达
FIP-gsi基因与载体pET-30a(+)连接,连接产物可分别转化到大肠杆菌BL21和M15细胞中,通过IPTG诱导培养,表达的rFIP-gsi分别约占大肠杆菌总蛋白的46.1%和得到的可溶性蛋白占M15总可溶性蛋白的25%[47-48]。
生物活性测定表明,rFIP-gsi能够诱导细胞因子IL-2,IL-3,IL-4,IFN-γ,TNF-α,LT及IL-2R(IL-2 receptor)表达。
2.6.2 FIP-gsi在担子菌类灰盖鬼伞中的重组表达
构建重组质粒pBFIP-gsi,然后将重组质粒转化到灰盖鬼伞菌株LT2细胞中,经培养,表达效率为每千克新鲜的菌丝体中可以提取314 mg的rFIP-gsi。
凝血实验表明,rFIP-gsi可以凝集小鼠血红细胞,但不能凝集人的血红细胞[49]。
2.7 FIP-tvc重组表达
2.7.1 FIP-tvc在大肠杆菌表达系统中的重组表达
将扩增后的FIP-tvc基因与载体pET21a(+)连接,转化到宿主细胞大肠杆菌BL21细胞中。经IPTG诱导培养,重组表达的蛋白有20%是以可溶性蛋白的形式存在[8]。
生物学活性分析表明,rFIP-tvc可以凝集大鼠和小鼠血红细胞,可以有选择性地增强小鼠脾细胞分泌白细胞介素(IL)-1α,IL-2,IL-5,IL-6,TNF-α,LT[8]。
2.7.2 FIP-tvc在酵母表达系统中的重组表达
PCR法扩增FIP-tvc基因,然后与载体pPIC9连接,最后将连接产物转化到毕赤酵母GS115细胞中,经甲醇连续诱导培养,其表达效率可达41.06 mg/mL[50]。
2.8 LZ-9的重组表达
扩增LZ-9基因,与载体pPICZα-A连接,转化到毕赤酵母菌株X-33细胞中,经培养,表达效率为6.7 mg/L。
血凝试验分析表明,rLZ-9可以凝集兔、鼠和绵羊血红细胞[10]。

表2 已知的FIPs重组表达现状
2.9 FIP-nha的重组表达
2.9.1 FIP-nha在大肠杆菌表达系统中的重组表达
扩增FIP-nha基因,扩增产物与GST融合载体pGEX-4T-1连接,连接产物转化到大肠杆菌Rosetta细胞中。经培养,表达效率为42.7 mg/L[17]。
生物活性分析表明,rFIP-nha可以凝集人类和兔血红细胞、显著地刺激小鼠脾淋巴细胞增殖,且不具有协同效应,有增强鼠脾细胞分泌IL-2的能力,还可以诱导HL60,HepG2,MGC823癌症细胞的凋亡,抑制MGC-823和HepG2细胞的增殖[17]。
2.9.2 FIP-nha在酵母表达系统中的重组表达
从血红丛赤壳中获得FIP-nha基因,然后与载体pPICZα-A连接,连接产物转化到毕赤酵母菌株X-33细胞中,经培养,表达效率为18.9 mg/L。
生物活性测定表明rFIP-nha可以凝集鼠、兔、绵羊和胰蛋白酶处理过的人血红细胞[10]。
2.1 0 FIP-SN15的重组表达
FIP-SN15是通过基因改组技术,从LZ-8和FIP-gsi两种真菌免疫调节蛋白的基因中合成的重组DNA序列[51]。
扩增FIP-SN15基因,然后与载体pET-30a连接,连接产物转化到大肠杆菌BL21细胞中,经IPTG诱导培养,表达效率为35.95 mg/L[40]。
生物活性分析表明,rFIP-SN15可以凝集鼠血红细胞、显著地增强细胞因子IL-2,IL-4,IFN-γ,IL-2R和LT分泌[52],也可以诱导人类胶质母细胞瘤细胞系U-251 MG的凋亡。
以上关于已知的FIPs重组表达现状的总结见表2。
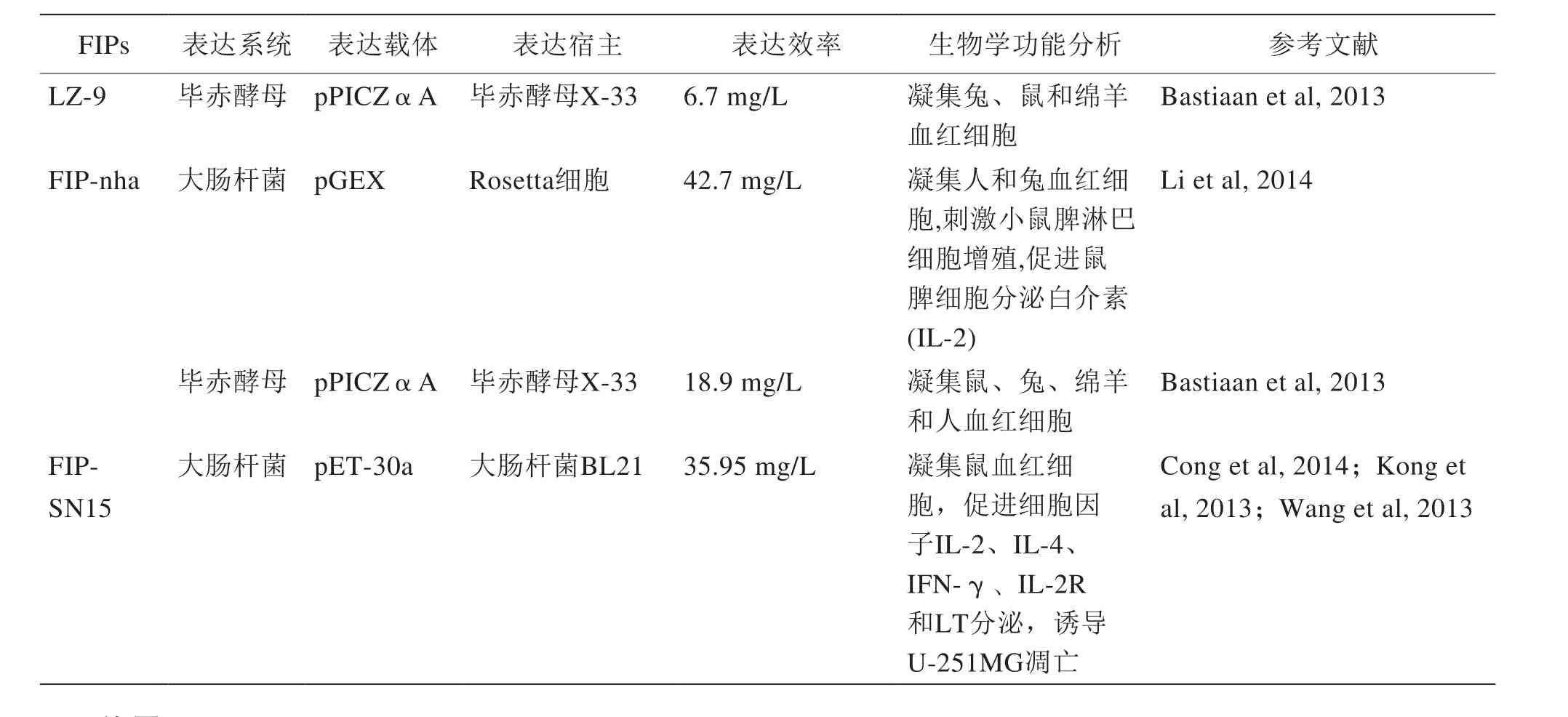
续表2
3 前景
真菌免疫调节蛋白是一种与植物凝集素和免疫球蛋白的结构和免疫功能相似的小分子蛋白质,具有抗肿瘤、抗过敏、刺激淋巴细胞增殖等免疫活性,同时研究结果未发现它们具有副作用,因此,FIPs的研究具有广泛的应用发展空间。但是,天然提取的FIPs的产出率很低,费时耗力且成本较高,所以,寻求一个可以高效重组表达这些FIPs的技术是今后研究的主要方向。近年来,随着分子生物学和生物工程技术的发展,人们可以利用基因工程菌株工业生产药用蛋白质,这就为人们后续进一步研究FIPs应用于实践提供了重要的手段。总之,关于FIPs的研究将会越来越受到重视,尤其作为新型免疫调节剂,或者食品添加剂方面具有重大应用潜力。
