福辛普利保护高尿酸血症性肾病大鼠的疗效分析
2016-10-22刘静巫斌
刘静,巫斌
厦门市仙岳医院内科,福建厦门361012
论著
福辛普利保护高尿酸血症性肾病大鼠的疗效分析
刘静,巫斌
厦门市仙岳医院内科,福建厦门361012
目的 分析研究福辛普利对高尿酸血症性肾病大鼠血浆血管紧张素Ⅱ(AngⅡ)和醛固酮 (ALD)水平的表达及肾间质纤维化的影响,从而探讨其在高尿酸血症性肾病大鼠中的保护作用。方法2014年6月—2015年6月间在厦门大学医学院动物实验中心选取清洁型SD大鼠80只,随机分为造模组60只,对照组20只;高尿酸血症性肾病大鼠模型的建立采用腺嘌呤+盐酸乙胺丁醇灌胃法,造模成功后将造模组动物随机分为模型组28只、福辛普利干预组28只。于实验第45、60天分别检测3组大鼠血浆AngII、ALD的表达,免疫组化法测定肾脏组织a-平滑肌肌动蛋白(a-SMA)的表达。结果①实验第60天福辛普利干预组治疗后血浆AngⅡ(68.75±20.56)pg/mL、ALD(246.56±59.69)pg/mL与同期模型组(86.56±23.30)pg/mL、(346.64±86.78)pg/mL比较有下降(P<0.05);②福辛普利干预组治疗后实验第45 d、60 d肾组织中a-SMA的浓度(0.27±0.16)、(0.33±0.56)与模型组(0.52±0.12)、(0.63±0.42)比较均有明显下降(P<0.05)。结论 福辛普利可能通过下调高尿酸血症性肾病大鼠模型血浆AngⅡ、ALD水平的表达,抑制肾脏炎症及肾素-血管紧张素系统活化,从而防治高尿酸血症性肾间质纤维化。
福辛普利;高尿酸血症性肾病;AngⅡ;ALD;a-SMA;肾间质纤维化
[Abstract]Objective To observe the effect of fosinopril on the expression of plasma angiotensin II(Ang II)and aldosterone(ALD)and renal interstitial fibrosis in rats with hyperuricemia nephropathy,Then investigate the protective effect of it in rats with hyperuricemia nephropathy.Methods From June 2014 to June 2015,in the center of animal experiment,xiamen university school of medicine,80 clean SD rats were randomly divided into 60 groups and the control group of 20;Adenine+ ethambutol hydrochloride by gastric method is used to establish the rat model of high uric acid nephropathy,After successful modeling,the model animals were randomly divided into Model group 28 and fosinopril intervention group 28.The expression of AngII and ALD in rat plasma was detected at forty-fifth and sixtieth days,respectively,and the expression of asmooth muscle actin(a-SMA)in renal tissue was determined by immunohistochemistry.Results①sixty days fosinopril intervention group after treatment plasma Ang II(68.75±20.56)pg/mL,ALD(246.56±59.69)pg/mL compared with the same period model group(86.56±23.30)pg/mL、(346.64±86.78)pg/mL compared with the decline(P<0.05);②fosinopril interven-tion group after treatment for forty-fifth days,sixty days,the concentration of a-SMA in renal tissue(0.27±0.16),(0.33± 0.56)and model group(0.52±0.12),(0.63±0.42)were significantly decreased(P<0.05).Conclusion Fosinopril may be down regulation of hyperuricemia nephropathy rat model of plasma Ang II,ALD levels of expression,Suppression of renal inflammation and activation of the renin angiotensin system,Therefore,the prevention and treatment of hyperuricemia renal interstitial fibrosis.
[Key words]Fosinopril;High uric acid nephropathy;AngⅡ;ALD;a-SMA;Renal interstitial fibrosis
近年来,高尿酸血症在肾脏疾病中的作用得到了新的重视,但是对于尿酸如何导致肾病的机理,多年来学者们一直存在争议。早期的研究显示主要是急性高尿酸在肾脏结晶引起的梗阻性损伤,但近年来研究发现尿酸可以导致肾脏炎症状态、肾小球前动脉病变以及使肾素-血管紧张素系统(RAS)活化,从而加重肾血管平滑肌的增殖和肾脏疾病的进展[1]。基于目前的研究热点,从2014年6月—2015年6月间该实验选取清洁型SD大鼠80只,着重研究高尿酸血症性肾病大鼠体内炎症及RAS活化情况,以及探讨福辛普利的保护机制。现报道如下。
1 资料与方法
1.1实验动物
清洁型SD大鼠80只,成年雄性,体重175~185 g(购于厦门大学医学院动物实验中心)。
1.2药物准备
1.2.1造模药物盐酸乙胺丁醇(E4630,25 g/瓶,国药准字号H21022349)+腺嘌呤(Amresco 0183,10 g/瓶,国药准字号H50020220),同时使用1 000 mL灭菌蒸馏水将盐酸乙胺丁醇25 g、腺嘌呤10 g配成悬浊液[2],放置4℃冰箱保存,临用时解冻。
1.2.2福辛普利片(国药准字H19980197,10 mg/片),按10 mg:20 mL蒸馏水配制。
1.3仪器及试剂
全自动生化分析仪;Allegra X-15R低速冷冻离心机;全自动染色机(MiCROM HMS760X)。AngⅡ、ALD放射免疫分析试剂盒,小鼠抗大鼠a-SMA单克隆抗体(1:100)、即用型SABC、显色剂DAB-0031/1032。
1.4实验方法
1.4.1造模方法按文献方法[2],SD雄性大鼠常规下饲养数天后随机分为2组:对照组20只,造模组60只,将配置好的混悬液按12 mL/(kg·d)的剂量给造模组大鼠灌胃20天,复制高尿酸血症性肾病模型,对照组灌服等量生理盐水。第21天随机抽取4只造模组大鼠杀检,观察肾脏病理变化。造模成功后,造模组大鼠继续灌胃至第30 d,以保持高尿酸血症性肾病模型的稳定性。
1.4.2分组给药模型稳定后开始将造模组随机分为模型组28只,干预组28只;干预组灌服已配置好的福辛普利溶液,按5 mg(kg·d)剂量给药,模型组及对照组灌服等量生理盐水,疗程为30 d。
1.4.3标本收集造模成功后实验开始第45、60天分别(每组每次5只)处死大鼠,处死前一天使用代谢笼收集所有大鼠24 h尿液,并目内眦取血待测;处死动物后迅速打开腹腔,摘取右侧肾脏,取部分肾脏组织置于10%福尔马林液中固定,用于病理相关指标的检测。
1.5相关指标检测
大鼠一般情况观察(活动、饮食、体重、尿量等)。生化指标:使用自动生化分析仪采用光电比色分别进行尿酸、肌酐的测定;AngⅡ、ALD的含量测定采用放射免疫法,严格按说明书步骤方法检测;采用磺柳酸比浊法测定大鼠24 h尿蛋白定量。病理组织学检查:A.光镜:肾脏组织标本做苏木素伊红(HE)和马松(Masson's)染色,观察肾脏结构病理及肾小管-间质纤维化情况。B.免疫组化检测a-SMA表达:采用SABC法,严格按照即用型SABC试剂盒说明书操作。a-SMA免疫组化结果半定量分析采用彩色病理图像分析软件,方法如下:以染色强度结合阳性细胞数百分比综合计分,组织切片中胞质染为淡黄色至棕褐色者为阳性标志。在显微镜下放大200倍中分别取10个不重复的肾小球、肾小管-间质视野,按阳性组织所占视野百分比进行半定量评分,测量平均光密度。
表1 各组大鼠治疗前后各指标变化比较
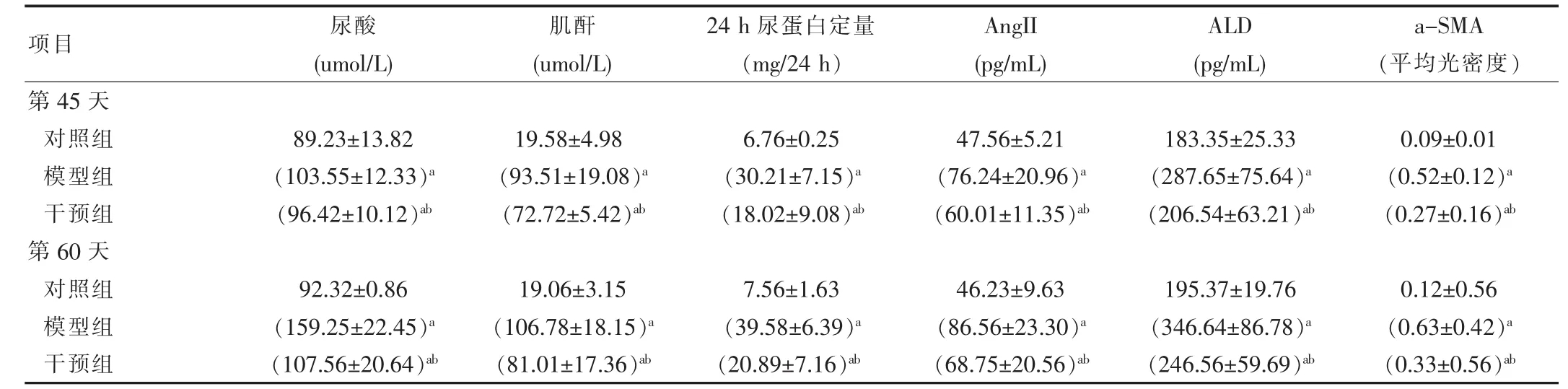
表1 各组大鼠治疗前后各指标变化比较
注:与对照组比较,aP<0.01,与模型组比较bP<0.05。
项目尿酸(umol/L)肌酐(umol/L)24 h尿蛋白定量(mg/24 h)AngII(pg/mL)ALD(pg/mL)a-SMA(平均光密度)第45天对照组模型组干预组第60天对照组模型组干预组89.23±13.82(103.55±12.33)a(96.42±10.12)ab19.58±4.98(93.51±19.08)a(72.72±5.42)ab6.76±0.25(30.21±7.15)a(18.02±9.08)ab47.56±5.21(76.24±20.96)a(60.01±11.35)ab183.35±25.33(287.65±75.64)a(206.54±63.21)ab0.09±0.01(0.52±0.12)a(0.27±0.16)ab92.32±0.86(159.25±22.45)a(107.56±20.64)ab19.06±3.15(106.78±18.15)a(81.01±17.36)ab7.56±1.63(39.58±6.39)a(20.89±7.16)ab46.23±9.63(86.56±23.30)a(68.75±20.56)ab195.37±19.76(346.64±86.78)a(246.56±59.69)ab0.12±0.56(0.63±0.42)a(0.33±0.56)ab
1.6统计方法

2 结果
2.1一般情况
造模组动物自实验10 d左右后,开始出现进食减少,倦怠;30 d后后明显加重,出现消瘦、蜷卧少动、夜间尿量增多、尿色浑浊等,其中以模型组表现尤为突出,而对照组动物反应机警,皮毛亮泽,食欲好、尿量可、体重增长正常;整个实验过程中,无动物死亡。
2.2血液相关指标结果显示
实验第45天,与对照组相比,干预组和模型组尿酸、Scr、AngⅡ、ALD、24 h尿蛋白定量等均有升高,统计学分析有显著性差异;而实验第60天,与模型组相比,干预组上述指标均有不同程度的下降。见表1。
2.3病理、免疫组化结果
2.3.1光镜观察HE染色光镜下对照组肾小管排列紧密,未见尿酸盐结晶及炎性细胞沉积,Masson's染色肾小管、小球结构和上皮细胞的形态完整,无异常物质沉积。第21天模型组及干预组大鼠可见针状、双折光样棕黑色尿酸盐结晶排列于肾小管-间质内;第45天,模型组受累小管、小球增多,可见炎症细胞呈灶性排列在肾间质中,肾小管上皮细胞弥漫性空泡变性,Masson's染色可见肾间质增宽,纤维组织增生,第60天模型组可见肾小管变性萎缩,管腔内有尿酸盐结晶,肾小球数量明显减少,肾间质可见成纤维细胞增生。干预组与同期模型组相比,细胞外基质增生情况较轻,小管、小球受累较少。见图1、图2。
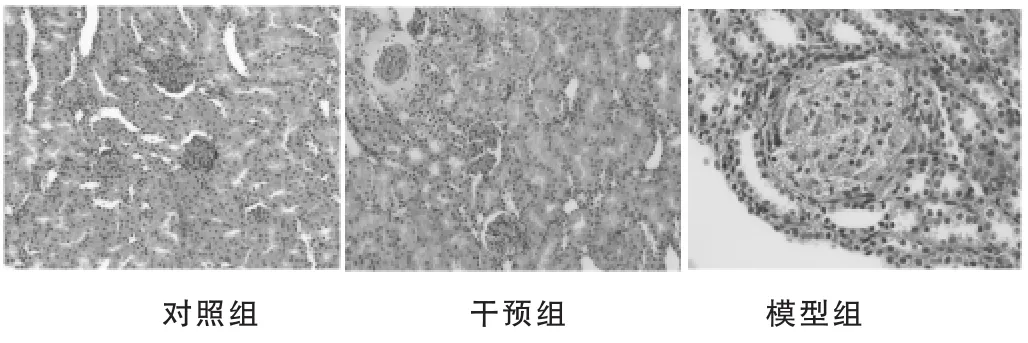
图1 实验第60天,各组大鼠光镜观察(HE×200)
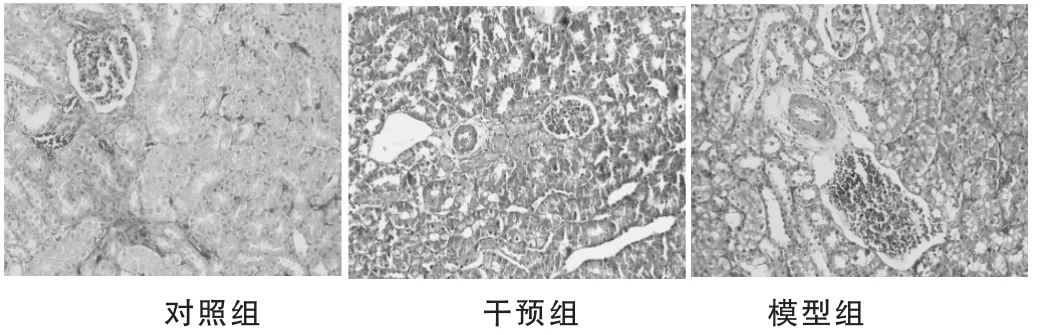
图2 实验第60天,各组大鼠光镜观察(Masson's×200)

图3 实验第60天,各组大鼠a-SMA免疫组织化学表达(免疫组化×400)
2.3.2免疫组化a-SMA的表达对照组肾小管间质中a-SMA几乎不表达。第45天模型、干预组在肾小管-间质区及血管平滑肌上可见较多a-SMA呈片状或线样分布。实验第60天,测量a-SMA平均光密度;干预组为(0.33±0.56)明显低于模型组(0.63±0.42)。可见福辛普利可以减轻a-SMA在肾组织中的表达,见表1及图3。
3 讨论
高尿酸血症发病率一直呈上升趋势,在患有高尿酸血症多年的患者中,90%具有肾脏损害,近期有学者研究发现,高尿酸是肾脏相关疾病的独立危险因素,故维持正常的血尿酸水平对人体是非常重要的。
那么高尿酸血症是如何引起或加重肾脏损害呢?基于当前学者们的研究热点,该试验观察到模型组大鼠实验45 d肾脏病理提示尿酸盐结晶沉积于肾小管-间质内,周围可见炎症细胞呈灶性排列,同期检测血尿酸(103.55±12.33)umol/L、尿白蛋白(30.21±7.15)mg/24 h、AngII(76.24±20.96)pg/mL和ALD(287.65±75.64)pg/mL表达即增加,与对照组(89.23±13.82)umol/L、(6.76± 0.25)mg/24 h、(47.56±5.21)pg/mL、(183.35±25.33)pg/mL比较差异有统计学意义。由此可见RAS活化、炎症反应等可能均参与了高尿酸血症所致的肾脏损害,与何宏明、陈丽川,李靖等[3-5]研究相似。a-平滑肌肌动蛋白(a-SMA)是肌成纤维细胞的标记物,金建生、巫斌等[6-7]研究报告发现肾间质纤维化大数肾小管间质中a-SMA表达在试验第14天明显增多,到28 d表达量进一步增加,且肾小管间质纤维化程度与肾小管间质中a-SMA表达呈明显正相关,预示a-SMA作为细胞表型转化的标志不仅可以早期预测肾间质纤维化,同时也客观预测着肾间质纤维化的情况。在该组研究中,我们发现实验第45天肾组织中a-SMA含量模型组(0.52±0.12)、干预组(0.27±0.16)均明显高于对照组(0.09±0.01),提示这时候已经出现了肾脏细胞外基质增生及早期间质纤维化,与金建生等研究报告相符。如此就给出这样一个提示:如果能在早期就有效地抑制RAS活化、保护平滑肌细胞、减轻肾内炎症状态,或许能起到保护高尿酸血症性肾病的作用。
福辛普利为血管紧张素转化酶抑制剂,它通过抑制RAAS系统,减少AngⅡ的生成,同时还可以抑制一些炎症因子如缩血管因子内皮素的生成和释放[8],那么它对高尿酸血症性肾病的保护作用及机制如何呢?该研究中,在造模成功后采用福辛普利干预,结果显示:试验第60天福辛普利干预后大鼠血清尿酸(107.56± 20.64)umol/L、Scr(81.01±17.36)umol/L、尿白蛋白(20.89± 7.16)mg/24 h、AngII(68.75±20.56)pg/mL和ALD(246.56± 59.69)pg/mL等指标与同期模型组(159.25±22.45)umol/L、(106.78±18.15)umol/L、(39.58±6.39)mg/24 h、(86.56± 23.30)pg/mL、(346.64±86.78)pg/mL相比均有明显好转下降,光镜显示福辛普利干预后大鼠肾小管、小球损害,尿酸沉积及细胞外基质增生程度均明显减轻,肾组织中a-SMA(0.33±0.56)的平均光密度与模型组(0.63± 0.42)相比较亦明显降低。由此可发现福辛普利具有减轻尿酸在肾组织中的沉积、抗炎、抑制RAAS活化,减轻肾间质纤维化的作用。与周杰研究结果相似[8]。
总之,该实验发现福辛普利可能通过下调高尿酸血症性肾病大鼠血浆AngⅡ、ALD水平的表达,抑制肾脏炎症及体内RAAS活化,从而起到保护高尿酸血症性肾病的作用。由此可见福辛普利在高尿酸血症性肾损害的防治中可能具有广阔的应用前景,值得进一步探索。
[1]Nishi S.Guidelines for the treatment of nephrotic syndrome[J]. Nihon Jinzo Gakkai Shi,2014,56(4):518-523.
[2]吴燕升,贺斐,高建东.尿酸诱导氧化应激致肾损害的实验研究进展[J].中国中西医结合肾病杂志,2016,17(2):162-164.
[3]何宏明,冯育林,张武岗,等.不同方法建立高尿酸血症动物模型研究进展[J].江西中医药,2015,46(12):72-75.
[4]陈丽川,张荒生,喻志华.痛风颗粒干预腺嘌呤、乙胺丁醇所致高尿酸性肾病模型大鼠肾脏形态学改变[J].中国组织工程研究,2012,16(28):5260-5263.
[5]李靖,任伟,王艳,等.依托考昔和秋水仙碱对高尿酸血症大鼠肾间质纤维化的影响[J].中国中西医结合肾病杂志,2012,13(1):62-64.
[6]刘静,巫斌.炎症因子与高尿酸血症性肾病大鼠的关系及药物干预研究[J].中华临床医师杂志:电子版,2015,9(23):4359-4363.
[7]刘静,金建生.三七总皂苷对腺嘌呤致大鼠肾间质纤维化影响的实验研究[J].中国临床药理学杂志,2010,26(4):287-291.
[8]周杰.氯沙坦与福辛普利治疗原发性高血压合并高尿酸血症分析[J].基层医学论坛,2013,17(17):2209-2210.
Analysis of the Therapeutic Effect of Fosinopril on the Protective Effect of Hyperuricemia Nephropathy in Rats
LIU Jing,WU Bing
Department of Nephrology,Xianyue Hospital in Xiamen,Xiamen,Fujian Province,361012 China
R5
A
1674-0742(2016)09(c)-0001-04
10.16662/j.cnki.1674-0742.2016.27.001
2016-06-25)
厦门市2012年度科技局指导性科研立项项目(2011S0448)。
刘静(1979.3-),女,福建浦城人,硕士,主治医师,研究方向:肾脏病的基础和临床研究。
