可见光催化脱卤反应研究进展
2016-10-22王帅王红许孝良
王帅,王红,许孝良
(浙江工业大学药学院,浙江杭州310014)
精细化工
可见光催化脱卤反应研究进展
王帅,王红,许孝良*
(浙江工业大学药学院,浙江杭州310014)
可见光催化反应由于其成本低、廉价易得、无环境污染、副产物少等优点已被广泛应用于有机化学合成反应中。活泼的碳-卤键在可见光催化剂作用下易形成碳自由基引起了人们广泛关注,对可见光催化脱卤反应进行了综述。
可见光催化;绿色化学;卤代物
可见光,一种清洁、廉价、几乎无限可用的资源逐渐受到人们的关注[1]。其实早在100多年前Ciamician就提出太阳光可为有机化学合成提供丰富、清洁、可再生的能源[2-3]。但由于大多数的有机分子并不能吸收可见光,限制了光化学的发展,因此开发可吸收可见光的光氧化还原催化剂成为化学家们研究的重点。近几年,发展起来的过渡金属络合物作为光敏剂,可见光化学合成在该领域才有了巨大的突破。2008年,MacMillan[4]课题组报道的可见光催化的一种新的绿色高效的有机合成反应,可见光催化才真正引起了化学家们的兴趣。
目前,最常用的可见光催化剂是金属Ir或Ru络合物。可见光催化循环包括3个步骤(图1),首先光催化剂(P.C.)受光激发到激发态(*P. C.),激发态时催化剂活性高,易被还原或被氧化,*P.C.可经历两种不同的电子转移过程:还原淬灭循环(得到一个电子生成P.C.-)和氧化淬灭循环(失去一个电子生成P.C.+),最后在金属中心发生反应[5-6]。图中A为电子受体,D为电子供体。

图1
自由基反应在有机化学合成中占有很大地位,为一些化合物的功能化提供了重要的方法,如:链的增长,烯烃的芳基化、烷基化、烷氧基化,二氟甲基化等。而C-X(I、Br、Cl)键的断裂是形成碳自由基的有效方法。近年来,基于碳自由基的广泛应用[7-9],活泼C-X键的还原得到了人们极大的关注[10]。本文主要根据反应类型的不同,对近几年报道的在可见光催化条件下相关的脱卤反应进行了综述。
1 烯烃的官能化及环化反应
1.1烯烃的官能化
Stephenson C R J等[11]用[Ir(dF(CF3)ppy)(dtbbpy)]PF6和Ru(bpy)3Cl2作催化剂,加入抗坏血酸钠做还原剂,卤代烷烃与烯烃或炔烃通过还原淬灭循环发生的原子自由基加成反应,改变了原有的氧化淬灭循环过程[12],缩短了反应时间并使其应用范围扩大(图2)。

图2
Boyer C等[13]介绍了一种带有烯烃侧链的聚合物的后功能化方法(图3),在可见光条件下,Ir(ppy)3作催化剂,卤代烷烃或α-卤代羰基的原子转移自由基聚合反应,已证明该方法可用于常见烯烃聚合物的后修饰。
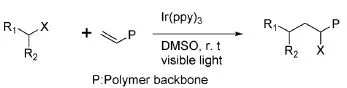
图3
2014年,Lei A W等[14]在光催化剂fac-Ir(ppy)3作用下得到了烯烃的烷氧基氰基甲基化的产物(图4),该方法一步实现了烯烃的烷基化和烷氧基化,同时其引进的氰基可进一步转化为更有用的官能团参与其它反应,但此反应底物中的烯烃仅适用于简单的苯乙烯。
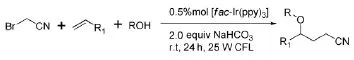
图4
Greaney M F等[15]在此基础上通过添加Zn(OAc)2扩大了烯烃范围,并且可用其它含氧的亲核试剂代替醇(图5)。但该方法不适用于乙烯基吡啶以及缺电子苯乙烯。
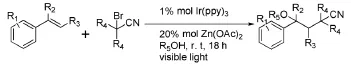
图5
Li JH等[16]通过改变底物烯烃,利用α-芳基烯丙基醇和α-羰基烷基溴通过脱卤加成合成了1,5-二羰基化合物,该方法在可见光条件下利用1,2-芳基迁移实现了烯烃的连续芳基化(图6)。
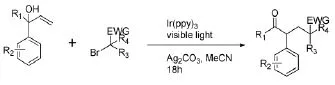
图6
Cho E J等[17]用烯烃与2-溴-2,2-二氟乙酸乙酯在光催化作用下,通过碱的选择和控制,得到了二氟烷基化的烷烃和烯烃[18-19](图7),为烯烃的二氟烷基化提供了新方法,拓宽了底物范围。
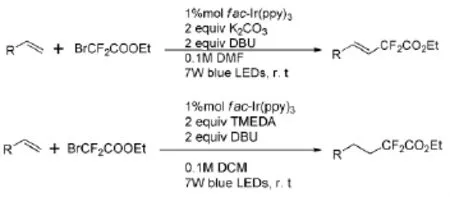
图7
Han SB等[20]总结了之前形成C-CF3键的方法[21-23],在可见光条件下Ru(Phen)3Cl2作催化剂,CF3SO2Cl作CF3和Cl源,得到了一种在烯烃上同时引入CF3和Cl的方法(图8),不论是终端烯烃还是分子内烯烃均可转换为邻位的氯代三氟甲基化产物。在本反应,中Ru(Phen)32+受光激发得到*Ru(Phen)32+,*Ru(Phen)32+还原CF3SO2Cl得到CF3自由基、SO2、以及氯离子,最后再经过一系列自由基加成、氧化等过程得到邻位的氯代三氟甲基化产物。
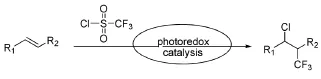
图8
Jr W R D等[24]在总结了之前对RX(X=Br,I)与富电子烯烃发生原子转移自由基反应报道的基础上,对在可见光催化下铜催化缺电子烯烃与氟代烷基磺酰氯的原子转移自由基反应进行了研究(图9)。该方法适应范围广,氟代烷基磺酰氯包括CF3SO2Cl,C4F9SO2Cl,CF2HSO2Cl,CH2FSO2Cl,CF3CH2SO2Cl,而缺电子烯烃包括α,β-不饱和酮、酰胺、酯、羧酸、砜、磷酸酯。

图9
Reiser O等[25]又提出一种新的形成C-CF键的方法,与之前所报道的光氧化还原催化剂([Ru(bpy)3]Cl2、[Ir(ppy)2(dtbbpy)]PF6、曙红Y等)在催化原子转移自由基反应的同时释放SO2[26-27]不同,[Cu(dap)2]Cl可催化形成α,β-三氟甲基乙基磺酰氯结构(图10),在本反应中,[Cu(dap)2]Cl在参与电子转移的同时又参与了键的形成,证明了铜和光共同催化的不对称原子转移自由基反应的可能。

图10
1.2烯烃的环化
在可见光条件下通过双电子转移得到了碳负离子[28-29],并将其应用到二溴烯烃的环丙烷化中[30](图11)。

图11
Fu W J等[31]用N-芳基丙烯酰胺和溴二氟乙酸乙酯在可见光作用下发生芳基二氟乙酰化作用,得到了3,3-双取代的氧化吲哚衍生物(图12),该方法很容易地实现将二氟酯基引入到羟吲哚骨架上。
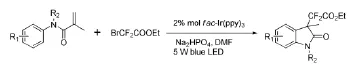
图12
Greaney M F等[15]基于之前报道的烯烃官能化的不足,进一步利用苯乙烯与溴代羧酸酯合成杂环(图13),为利用廉价易得的原料合成饱和或不饱和呋喃杂环化合物提供了新方法。
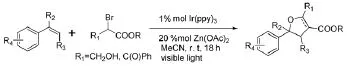
图13
2 芳烃的官能化
Osaw M等[32]在总结Pd/Cu I或TBAF/Ag2O作为共催化剂[33-35]催化芳基溴化物偶联反应的基础上,利用Pd(CH3CN)2Cl2作为催化剂,TB(P(t-Bu)3/[Ru(2,2-bipyridine)3]2PF6)代替CuI作为共催化剂,在可见光作用下,室温条件下催化芳基溴化物的偶联(图14),并尝试用此方法代替其它过渡金属催化的偶联反应。
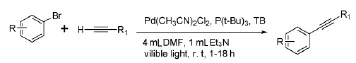
图14
Li P X等[36]在可见光作用下,Ir(ppy)3做光敏剂,在叔丁醇钾以及二甲基亚砜的存在下,室温得到了不活泼芳烃或杂环化合物与卤代芳烃直接芳基化的产物联苯及其衍生物(图15)。但由于C-Br键较C-I键难断裂,所以芳基溴代物与芳烃的均裂偶联反应需要在70℃下才可得到较理想的收率。

图15
Liu Q等[37]将溴二氟乙酰胺与不活泼的芳烃或杂环化合物直接发生二氟乙酰化作用[38](图16),各种酰胺的氨基部分比如哌啶、哌嗪、环辛胺、环丙基甲基胺、苯胺等取代,以及杂环化合物如吡啶、噻吩、吡嗪、哒嗪、嘧啶均可适用此方法。

图16
Cho E J等[39]用BrCF2CO2Et作为二氟甲基源在可见光作用下,fac-Ir(ppy)3作为光敏剂,对富电子芳烃和杂环化合物进行二氟烷基化作用(图17),并且可将产物经过传统的方法转变成各种含(-CF2-)的化合物[40]。

图17
Wang X S等[38]又特别对杂环化合物的二氟甲基化进行了研究,在可见光催化作用下,Ph-SO2CF2I作为二氟甲基化试剂与富电子的杂环化合物反应(图18),在该反应中,与P SBaran[41-42]报道的HCF2自由基不同,二氟甲基化发生在电子最多的C5位置,证明了此反应是通过亲电子自由基型机理进行的。

图18
3 脱卤还原
Ghosh I等[43]利用PDI在一次催化循环中连续两次光激发积累的能量还原芳基卤化物得到芳基自由基形成C-H键(图19),该方法克服了之前可见光氧化还原催化中光诱导能量转移的限制[44],拓宽了可见光催化含C-X化合物的范围,特别是C-Cl化合物,虽然其廉价易得,但由于其键能高,反应活性低,所以很少应用在可见光催化中[45],在本文中,在室温且无金属催化剂参与的条件下,由芳基卤化物得到了高活性的芳基自由基。

图19
Scaiano JC等[46]采用与以往的均相催化剂不同的二氧化钛附载铂纳米颗粒(PtNP@TiO2)作为多相光敏剂与电子供体(N,N-二异丙基乙基胺)结合,用于芳基或烯基碘化物的脱卤还原与环化,以及双共轭芳烃的环化(图20)。

图20
Zhang K A I等[47]又通过高内相乳液聚合得到了一种活性高、稳定性好的多相可见光催化剂:共轭多孔的聚-苯并二甲基硫基噻二唑(B2-FL2-BBT),并用于α-溴酮的脱卤还原(图21),且多相催化剂在光催化过程中损失小,可重复循环使用。在反应中,又将B2-FL2-BBT与不含BBT单元的B2-FL3做对比,发现前者的光催化活性远高于后者。

图21
Lee JH等[48]在Hantzsh酯参与下利用可见光催化还原α-卤代酮的脱卤还原立体选择性合成反式多环体系(图22)。本反应具有很高的化学选择性,在不影响乙烯基团的前提下使C-Br键断裂。
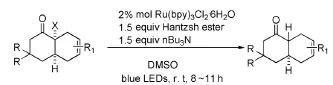
图22
Alaniz JR D等[49]发现一种廉价、高效、不含金属的光催化剂PTH,并用其催化还原C-X(X= I,Br,Cl)键[50-51](图23),PTH试剂温和、易受光激发且在空气中稳定,催化芳基和烷基碘化物、溴化物、氯化物脱卤形成碳自由基中间体,再与氢供体反应,底物范围广,收率高。
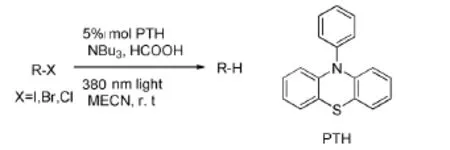
图23
4 其它涉卤反应
Sun JT等[52]总结了之前对将芳基溴化物转化为相应的醇并继续氧化芳甲基醇为相应醛类的报道[53-54],提出了一种条件温和、简单易控制的无金属参与的方法。在可见光作用下,DMSO中曙红Y作催化剂(图24),该方法收率高,应用范围广。
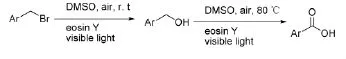
图24
Matyjaszewski K等[55]用噻吩嗪类衍生物代替之前的过渡金属催化剂,由光引发,通过原子转移自由基聚合得到了聚丙烯腈类衍生物(图25)。原子转移自由基聚合是一种高效的可逆钝化自由基聚合体系,与其它方法[56-57]相比,原子转移自由基聚合可以通过大量功能单体精确控制结构,且与之前报道的Cu催化的原子转移自由基聚合相比有更大的发展空间,如提高引发剂效率,提高分子量,降低分散度等。

图25
Hawker C J等[58]对无金属参与的催化剂体系进行了研究,得到了一种由光引发有机光催化剂(PTH)催化的ATRP的新方法(图26),PTH易合成,在ATRP反应中能精确控制分子量、低分散度、高效保留终端基,可用于制备多种共聚物。

图26
Yudin A K等[59]在光氧化还原催化作用下,α-甲基亚氨基二乙酸酯硼基醛和α-溴酮类化合物通过α-烷基化作用,第一次得到了含硼的1,4-二羰基化合物(图27),并且由于其是具有多官能团的两性化合物,所以更容易发生加成以及亲电取代反应,在本文中,用1,4二羰基化合物作为原料合成了C3含硼的五元杂环化合物(吡咯、呋喃、哒嗪类)[60-61]。
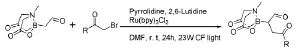
图27
5 总结与展望
综上所述,可见光催化已成为有机合成中一种经济高效的手段,越来越受到化学研究者们的关注,本文总结了近几年可见光催化在脱卤方面的应用,为烯烃或芳烃的烷基化、芳基化、烷氧基化、二氟甲基化以及环化等提供了更为有效的方法,由于绿色化学的提出,人们更加关注探索无金属的新型催化剂。毋庸置疑,可见光催化会带领我们开发更多新的有用的反应,改变我们的生活,真正实现绿色经济的化工过程。但是同样也存在一些问题,比如可见光催化剂价格比较昂贵、金属污染、催化剂的回收使用等,因此寻找新型无污染的催化剂,催化剂的循环使用以及提高光引发效率等都是可见光催化领域里需要进一步研究的问题。
[1]Lei A W.Synthetic applications of photoredox catalysis with visible light[J].Org.Biomol.Chem.,2013,11(15): 2387-2403.
[2]Ciamician G.The photochemistry of the future[J].Science,1912,36(926):385-394.
[3]A lbini A.1908:Giacomo ciam ician and the concept of green chenistry[J].ChemSusChem,2008,1(1):63-66.
[4]MacMillan D W C.Merging photoredox catalysis withorganocatalysis:the direct asymmetric alkylation of aldehydes[J].Science,2008,322(5898:77-80.
[5]Lu Z.Olefin difunctionalizations via visible light photocatalysis[J].Tetrahedron Lett.,2015,56(24),3732-3742.
[6]Zeitler K.Photoredox catalysiswith visible light[J].Angew. Chem.Int.Ed.,2009,48(52):9785-9789.
[7]MacMillan DW C.Visible light photoredox catalysiswith transition metal complexes:applications in organic synthesis[J].Chem.Rev.,2013,113(17):5322-5363.
[8]Yoon T P.Solar synthesis:prospects in visible light photocatalysis[J].Science,2014,343(6174):1239176.
[9]Barriault L.Photoredox transformations with dimeric gold complexes[J].Angew.Chem.Int.Ed.,2013,52(50):13342-13345.
[10]Alaniz JR D.A highly reducing metal-free photoredox catalyst:design and application in radical dehalogenations[J].Chem.Commun.,2015,51(58):11705-11708.
[11]Stephenson C R J.Visible light-mediated atom transfer radical addition via oxidative and reductive quenching of photocatalysts[J].J.Am.Chem.Soc.,2012,134(21): 8875-8884.
[12]Bernhard S.Single-layer electroluminescent devices and photoinduced hydrogen production from an ionic iridium(iii)complex[J].Chem.Mater.,2005,17(23):5712-5719.
[13]Boyer C.Photoredox catalyst-mediated atom transfer radical addition for polymer functionalization under visible light[J].Polym.Chem.,2014,5(10):3321-3325.
[14]Lei A W.Visible light-induced g-alkoxynitrile synthesis via threecomponent alkoxycyanomethylation of alkenes[J]. Adv.Synth.Catal.,2014,356(13):2873-2877.
[15]Greaney M F.Exploiting photoredox catalysis for the synthesis of tetra-and di-hydrofurans[J].Tetrahedron Lett.,2015,56(20):2571-2573.
[16]Li JH.Alkylation/1,2-arylm igration ofα-aryl allylic alcohols withα-carbonyl alkyl bromides usingvisible-light photoredox catalysis[J].Org.Chem.Front.,2015,2(11): 1457-1467.
[17]Cho E J.Selective difluoroalkylation of alkenes by using visible lightphotoredox catalysis[J].Chem.Commun.,2014,50(85):12884-12887.
[18]Fuchigami T.Photochemical substitution of olefins and aromatic compoundswith difluoromethyl radicals bearing ester and phosphonate groups[J].Tetrahedron,2006,62(15): 3761-3769.
[19]Hu JB.Radical(phenylsulfonyl)difluoromethylation with iododifluoromethyl phenyl sulfone[J].J.Org.Chem,2007,72(15):5824-5827.
[20]Han SB.Vicinal difunctionalization of alkenes:chlorotrifluoromethylation with CF3SO2Cl by photoredox catalysis[J]. Org.Lett.,2014,16(5):1310-1313.
[21]Gouverneur V.Catalytic hydrotrifluoromethylation of unactivated alkenes[J].J.Am.Chem.Soc.,2013,135(7): 2505-2508.
[22]Akita M.Three-component oxytrifluoromethylation of alkenes:highly efficient and regioselective difunctionalization of c=c bonds mediated by photoredox catalysts[J]. Angew.Chem.Int.Ed.,2012,51(38):9567-9571.
[23]Akita M.Intermolecular aminotrifluoromethylation of alkenes by visible-light-driven photoredox catalysis[J]. Org.Lett.,2013,15(9):2136-2139.
[24]JrW R D.Efficient Cu-catalyzed atom transfer radical addition reactions of fluoroalkylsulfonyl chlorides with elec tron-deficient alkenes induced by visible light[J].Angew. Chem.Int.Ed.,2015,54(14):4246-4249.
[25]Reiser O.Trifluoromethylchlorosulfonylation of alkenes: evidence for an innersphere mechanism by a copper phenanthroline photoredox catalyst[J].Angew.Chem.Int. Ed.,2015,54(24):6999-7002.
[26]Stephenson C R J.Intermolecular atom transfer radical addition to olefinsmediated by oxidative quenching of photoredox catalysts[J].J.Am.Chem.Soc.,2011,133(12): 4160-4163.
[27]Han SB.Vicinal difunctionalization of alkenes:chlorotrifluoromethylation with CF3SO2Cl by photoredox catalysis[J]. Org.Lett.,2014,16(5):1310-1313.
[28]Tanaka T.Tris(bipyridyl)ruthenium(II)-photosensitized reaction of 1-benzyl-1,4-dihydronicotinamide with benzyl brom ide[J].J.Chem.Soc.,Perkin Trans.2,1984,(10): 1705-1709.
[29]Tallec A.Cyclocondensation reactions from electrogenerated halomalonate carbanions-compared reactivity of bromo and chloro anions and influence of the supportingelectrolyte cation[J].Electrochim.Acta.,1990,35(2): 563-566.
[30]Guo H.Visible light induced cyclopropanation of dibromomalonates with alkenes via double-SET by photoredox catalysis[J].Chem.Commun.,2015,51(1):54-57.
[31]Fu W J.Visible-light-mediated radical aryldifluoroacetylation of n-arylacrylamides to give difluo roacetylated oxindoles[J].Asian J.Org.Chem.,2014,3(12):1273-1276.
[32]Osawa M.Photo-activation of Pd-catalyzed Sonogashira coupling using a Ru/bipyridine complex as energy transfer agent[J].Dalton Trans.,2007,(8):827-829.
[33]Mori A.Non-Sonogashira-type palladium-catalyzed coupling reactions of terminal alkynes assisted by silver(I)oxide or tetrabutylammonium fluoride[J].Org.Lett.,2000,2(19):2935-2937.
[34]Alper H.Recyclable Sonogashira coupling reactions in an ionic liquid,effected in the absence of both a copper salt and aphosphine[J].Chem.Commun.,2004,(11):1306-1307.
[35]Ryu I.A Copper-free Sonogashira coupling reaction in ionic liquids and its application to a microflow system for efficient catalyst recyling[J].Org.Lett.,2002,4(10): 1691-1694.
[36]Li P X.Visible-light photoredox in homolytic aromatic substitution:direct arylation of arenes with aryl halides[J]. Org.Lett.,2013,15(11):2664-2667.
[37]Liu Q.Visible-light-driven difl uoroacetam idation of unactive arenes and heteroarenes by direct C-H functionaliza tion at room temperature[J].Org.Lett..2014,16(22): 5842-5845.
[38]Wang X S.Visible light-mediated C-H difluoromethylation of electron-rich heteroarenes[J].Org.Lett.,2014,16(11): 2958-2961.
[39]Cho E J.Visible light-induced aromatic difluoroalkylation[J].Adv.Synth.Catal.,2014,356(13):2741-2748.
[40]Zhou Q.Direct synthesis of fluorinated heteroarylether bioisosteres[J].Angew.Chem.Int.Ed.,2013,52(14): 3949-3952.
[41]Baran P S.C-H Methylation of heteroarenes inspired by radical SAMmethyl transferase[J].J.Am.Chem.Soc.,2014,136(13):4853-4856.
[42]Baran P S.A new reagent for direct difluoromethylation[J]. J.Am.Chem.Soc.,2012,134(3):1494-1497.
[43]Ghosh I.Reduction of aryl halides by consecutive visible light-induced electron transfer processes[J].Science,2014,346(6210):725-728.
[44]Kudo A.[Co(bpy)3]3+/2+and[Co(phen)3]3+/2+electronmediators for overall water splitting under sunlight irradiation using Z-scheme photocatalyst system[J].J.Am.Chem. Soc.,2013,135(14):5441-5449.
[45]Li P X.Visible-light photoredox in homolytic aromatic substitution:direct arylation of arenes with aryl halides[J]. Org.Lett.,2013,15(11):2664-2667.
[46]Scaiano JC.Heterogeneous light-mediated reductive dehalogenations and cyclizations utilizing platinum nanoparticles on Titania(PtNP@TiO2)[J].Adv.Synth.Catal.,2014,356(13):2819-2824.
[47]Zhang K A I.A conjugated porous poly-benzobisthiadiazole network for a visible light-driven photoredox reaction[J].J.Mater.Chem.A.,2014,2(44):18720-18724.
[48]Lee JH.A Tin-free route to trans-Diels-Aldermotifs by visible light photoredox catalysis[J].J.Org.Chem.,2015,80(6):3309-3314.
[49]Alaniz JR D.A highly reducing metal-free photoredox catalyst:design and application in radical dehalogenations[J].Chem.Commun.,2015,51(58):11705-8.
[50]Fry A J.Electrolyte effects upon the polarographic reduction of alkyl halides in dimethyl sulfoxide[J].J.Org.Chem.,1976,41(1):54-57.
[51]Rondinini S.Silver as a powerful electrocatalyst for organic halide reduction:the critical role of molecular structure[J].Electrochim.Acta.,2001,46(20-21):3245-3258.
[52]Sun J T.Metal-free,visible-light photoredox catalysis: transformation of arylmethyl bromides to alcohols and aldehydes[J].RSC Advances,2014,4(91):49974-49978.
[53]Jiao N.Utilization of natural sunlight and air in the aerobic oxidation of benzyl halides[J].Org.Lett.,2011,13(9):2168-2171.
[54]Itoh A.Oxidative transformation of arylmethyl bromides and alcohols with a combination of mesoporous silica FSM-16 and alkali iodides under photoirradiation[J].Org. Lett.,2001,3(17):2653-2656.
[55]Matyjaszewski K.Photoinduced metal-free atom transfer radical polymerization of acrylonitrile[J].ACSMacro Lett.,2015,4(2):192-196.
[56]Julien N.Nitroxide-mediated polymerization[J].Prog.Polym. Sci.,2013,38(1):63-235.
[57]Shaver M P.Organometallic mediated radical polymerization[J].Prog.Polym.Sci.,2012,37(1):127-156.[58]Hawker C J.Metal-free atom transfer radical polymerization[J].J.Am.Chem.Soc.,2014,136(45):16096-16101.
[59]Yudin A K.Synthesis of previously inaccessible borylated heterocycle motifs using novel boron-containing amphotericmolecules[J].Angew.Chem.Int.Ed.,2015,54(31): 9038-9041.
[60]Wermuth C G.Are pyridazines privileged structures[J]. Med.Chem.Commun.,2011,2(10):935-941.
[61]Bryce M R.Functionalized heteroarylpyridazines and pyridazin-3(2H)-one derivatives via palladium-catalyzed cross-coupling methodology[J].J.Org.Chem.,2008,73(6):2176-2181.
Catalytic Dehalogenation Reaction is Reviewed in Visible Light
WANG Shuai,WANG Hong,XU Xiao-liang
(Institute of Chemical Industry,Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
Due to the visible light catalytic reaction is low cost,cheap and easy available,no environmental pollution and less by-products.So it has been widely used in organic chemical synthesis.Under visible light catalyst,active carbon-halogen bond is easy to form carbon free radicals,so it has been caused the wide attention by people.In this paper,the visible light catalytic reaction about dehalogenation reaction was reviewed.
visible light;green chemistry;halogen content
1006-4184(2016)9-0016-07
2016-01-18
国家自然科学基金项目(No.21476211)。
王帅(1991-),女,河北泊头市人,硕士研究生,从事的研究方向:可见光催化脱卤氧化。*
许孝良,E-mail:xuxiaoliang@zjut.edu.cn。
