葡糖醋杆菌RZS01发酵产细菌纤维素的研究
2016-10-22许云华
许云华,马 波,,张 衡,罗 丽,张 雷,郑 霞
(1.连云港师范高等专科学校 生命科学系,江苏 连云港 222006;2.南京理工大学 化学生物功能材料研究所江苏 南京 210094)
葡糖醋杆菌RZS01发酵产细菌纤维素的研究
许云华1,马波1,2,张衡2,罗丽1,张雷1,郑霞1
(1.连云港师范高等专科学校 生命科学系,江苏 连云港 222006;2.南京理工大学 化学生物功能材料研究所江苏 南京 210094)
采用葡糖醋杆菌(Komagataeibacter nataicola)RSZ01进行细菌纤维素发酵试验,利用单因素和正交试验对发酵培养基组成进行优化,并研究了菌株保藏时间、接种量和培养基初始pH对BC产量的影响。结果表明,保藏期限在30 d以内的菌种可基本保证BC产量;在接种量为8%、初始pH值为5.2时,最优发酵培养基组成为:葡萄糖2.50%,蔗糖3.00%,玉米浆2.2%,磷酸二氢钾0.35%,硫酸铵0.125%。在此条件下,葡糖醋杆菌RSZ01发酵产细菌纤维素的产量为12.05 g/L。
葡糖醋杆菌RSZ01;细菌纤维素;发酵;条件优化
近十多年来,由微生物发酵产生的纯天然细菌纤维素(bacterial cellulose,BC)获得了生物、材料、食品等实验室研究人员的密切关注[1-3]。它具有的许多优良的特性使其已应用于食品[4]、造纸[5-6]、组织工程[7]、医用敷料[8-9]等行业。然而,更高附加值的动态发酵絮状细菌纤维素的广泛应用却严重地受制于其易突变不稳定的菌株及较低的产量[10]。目前,BC的静态发酵工艺较为成熟,海南等地已可小批量进行工业化发酵生产。相对动态发酵,静态发酵的BC产量较高,但同时存在发酵周期长、占地面积大、产品应用范围较小等缺点,导致其生产成本高,工业化生产规模受限。而对于BC的纯动态发酵,尽管已有研究人员通过小试和中试试验研究解决摇瓶产量较低的问题,但迄今为止尚未完全形成细菌纤维素纯动态发酵的产业化生产。究其原因,不难发现影响BC动态发酵的主要问题如产量低、成本高、高产稳定生产菌种缺乏、生产工艺不稳定等仍未被完全解决。国内外的研究人员已从产BC的菌种筛选与复壮[11-13]和培养基组成与培养条件[14-16]等方面开展了大量的研究工作,最近国内有关研究主要集中在廉价碳源和氮源的应用[17-19]等方面,然而其产量基本集中在5 g/L以下,不利于实现工业化生产。因此,为进一步提高其纤维素动态发酵产量、探究如何保持菌株高产特性,本研究采用实验室保藏菌株葡糖醋杆菌(Komagataeibacter nataicola)RSZ01进行产细菌纤维素的动态发酵实验研究,以期为实现我国细菌纤维素的动态发酵工业化生产奠定坚实基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株
葡糖醋杆菌(Komagataeibacter nataicola)RZS01(保藏编号为CGMCC 10961):南京理工大学化学生物功能材料研究所筛选并保藏。
1.1.2试剂
葡萄糖、蔗糖、硫酸铵、冰乙酸、柠檬酸、硫酸镁、磷酸二氢钠、磷酸二氢钾、羧甲基纤维素钠(分析纯)、蛋白胨、酵母粉(生化试剂):国药集团化学试剂有限公司;玉米浆(生化试剂):上海西王淀粉糖有限公司。
1.1.3培养基[20]
斜面保藏培养基:葡萄糖20 g/L,硫酸镁0.4 g/L,柠檬酸1.5 g/L,磷酸二氢钠2.5 g/L,蛋白胨10 g/L,琼脂18 g/L,酵母粉0.1 g/L,pH 6.0;
种子培养基:葡萄糖20 g/L,硫酸铵6 g/L,磷酸二氢钾1 g/L,硫酸镁0.4 g/L,蛋白胨3 g/L,酵母粉2.25 g/L,羧甲基纤维素钠0.4 g/L,自然pH;
发酵培养基:葡萄糖22 g/L,蔗糖27 g/L,玉米浆18 g/L,硫酸铵1 g/L,磷酸二氢钾4 g/L,硫酸镁0.4 g/L,柠檬酸0. 6 g/L,醋酸1.0 mL/L,pH 5.2。
在进行培养或发酵前,上述培养基均应在灭菌锅中以121℃灭菌20 min,冷却备用。
1.2仪器与设备
YXQ-LS-75SII立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;SW-CJ-2D超净工作台:苏州净化设备有限公司;QHZ-98A恒温振荡培养箱:太仓市华美生化仪器厂;PH5-3CpH计:雷磁仪电科学仪器厂;XZ-21K离心机:长沙湘智离心机仪器有限公司;XMTD-8222烘箱:上海精宏实验设备有限公司;LWD300-38LT显微镜:上海测维光电技术有限公司。
1.3方法
1.3.1培养方法
将保藏于斜面培养基上的菌种接种至灭菌并冷却的种子培养基中,于30℃、160r/min的恒温培养振荡箱中培养2 d,制备得到葡糖醋杆菌种子液。将种子液以一定比例的接种量接种至发酵培养基中,于30℃、160 r/min的恒温培养振荡箱中培养7 d,过滤除去残留的发酵液。
1.3.2菌株保藏时间对细菌纤维素产量的影响
以实验室4℃冰箱中菌种的不同保藏时间(0、10d、20d、30 d、40 d、50 d、60 d)进行对比试验,30℃、以160 r/min的转速下动态发酵7 d,测定细菌纤维素产量,考察菌种保藏时间对细菌纤维素产量的影响。
1.3.3单因素试验
考察不同碳源(其中葡萄糖质量分数从0到3.50%,间隔0.25%;蔗糖质量分数从0.75%到4.00%,间隔0.25%)、氮源(其中玉米浆质量分数从0到2.2%,间隔0.2%;硫酸铵质量分数从0到0.300%,间隔0.025%)、无机盐(其中磷酸二氢钾质量分数从0到0.50%,间隔0.05%);接种量(6%、7%、8%、9%、10%、11%、12%)、初始pH值(4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8、6.0)对细菌纤维素产量的影响。
1.3.4正交试验
为考察不同培养基组分对细菌纤维素产量的影响,在单因素试验的基础上,选取葡萄糖、蔗糖、玉米浆、硫酸铵和磷酸二氢钾为考察因素,以细菌纤维素产量为评价指标,设计5因素4水平正交优化试验,正交试验因素与水平见表1。

表1 培养基组分优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for medium components optimization
1.3.5细菌纤维素产量的测定[24]
从发酵培养基中取细菌纤维素,过滤除去发酵液,收集絮状BC并分散在含3‰NaOH和3‰H2O2的水溶液中,于80℃水浴锅中处理2~4 h。用流动的自来水将细菌纤维素中残留的碱液冲洗干净,至pH值为中性后,将BC放置于80℃的干燥箱中干燥12 h,至质量恒定,计算每升发酵液中所含有的BC干质量即为BC产量。
2 结果与分析
2.1菌种保藏时间对细菌纤维素产量的影响
菌种保藏时间对细菌纤维素产量的影响,结果见表2。

表2 菌种保藏时间对细菌纤维素产量的影响Table 2 Effect of strain preservation time on the yield of bacterial cellulose
由表2可知,该菌种在4℃条件下,保藏超过30 d时,菌种产细菌纤维素滞后,且产量也有所减少。即实验中应该使用新复壮的、保藏时间在1个月内的菌种较为合适。
2.2单因素试验结果
2.2.1碳源质量分数对细菌纤维素产量的影响
分别选用葡萄糖、蔗糖为唯一碳源,考察发酵液中碳源质量分数对细菌纤维素产量的影响,结果见图1。由图1可知,随着葡萄糖质量分数的增大,细菌纤维素产量呈先增加后减少的趋势,当葡萄糖质量分数为2.25%时,细菌纤维素产量达到最大,为12 g/L;继续增加葡萄糖质量分数,细菌纤维素产量逐渐下降。这可能是由于葡萄糖在发酵合成细菌纤维素过程中作为营养物质和能源物质,被菌体快速利用,满足菌体的代谢,促进细菌纤维素的产生;随着葡萄糖质量分数的继续增加,渗透压增大,不利于菌体的新陈代谢,从而限制细菌纤维素的产生;蔗糖的加入对细菌纤维素产量影响相对葡萄糖较小,可能是由于蔗糖属于迟缓型碳源,较难被菌体利用,在有葡萄糖存在的培养液中随蔗糖质量分数的增加,细菌纤维素产量增加相对缓慢。因此选择葡萄糖和蔗糖最佳的质量分数分别为2.75%、2.25%进行正交试验。

图1 发酵液中碳源质量分数对细菌纤维素产量的影响Fig.1 Effect of carbon source concentration in fermentation liquid on the yield of bacterial cellulose
2.2.2氮源质量分数对细菌纤维素产量的影响
选用玉米浆、硫酸铵为唯一氮源,考察发酵液中氮源质量分数对细菌纤维素产量的影响,结果见图2。由图2可知,以硫酸铵为无机氮源时,随着硫酸铵质量分数的增加,细菌纤维素的产量呈现先增加后下降的趋势,当硫酸铵质量分数为0.100%时,BC产量达到最大;继续增加发酵液中硫酸铵质量分数,可能导致发酵过程中pH的下降,进而抑制菌体的生长和细菌纤维素的合成。
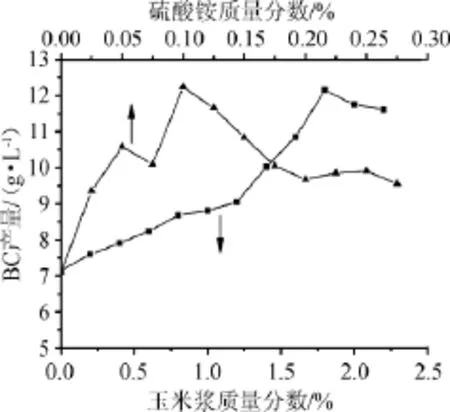
图2 发酵液中无机氮源和有机氮源质量分数对细菌纤维素产量的影响Fig.2 Effects of inorganic and organic nitrogen source concentration in fermentation liquid on the yield of bacterial cellulose
以玉米浆为氮源时细菌纤维素产量在一定范围内随玉米浆质量分数的升高而增加,可能是因为玉米浆中含有多种氨基酸、肽及生长因素,有利于菌体生长代谢和产物的积累,当玉米浆质量分数为1.8%时,BC产量达到最大值;继续增加玉米浆质量分数,BC产量不再增加,可能是有机氮太多,菌种生长旺盛而不利于产物积累。因此确定硫酸铵和玉米浆的最佳质量分数分别为0.100%和1.8%进行正交试验。
2.2.3发酵液中无机盐质量分数对细菌纤维素产量的影响
选用磷酸二氢钾为无机盐时,考察发酵液中无机盐质量分数对细菌纤维素产量的影响,结果见图3。由图3可知,随着磷酸二氢钾质量分数的增加,BC产量呈现上升的趋势,当磷酸二氢钾质量分数达到0.40%时,细菌纤维素的产量达到最高值(11.3 g/L);而当磷酸二氢钾质量分数继续增加时,BC产量开始下降。其原因可能是由于磷、钾参与细胞结构组成,并与能量转移等功能有关,添加适量的磷酸二氢钾能促进菌体的代谢,可以提高细菌纤维素的产量。因此选择磷酸二氢钾的最佳质量分数为0.40%进行正交试验。

图3 发酵液中磷酸二氢钾质量分数对细菌纤维素产量的影响Fig.3 Effect of monopotassium phosphate concentration in fermentation liquid on the yield of bacterial cellulose
2.2.4接种量和发酵培养基初始pH对细菌纤维素产量的影响
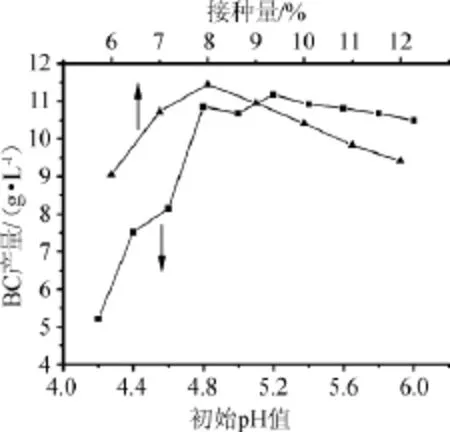
图4 发酵液接种量和初始pH对细菌纤维素产量的影响Fig.4 Effects of inoculum and initial pH of fermentation liquid on the yield of bacterial cellulose
考察接种量和初始pH值对细菌纤维素产量的影响,结果如图4所示。由图4可知,随着培养基的初始pH值的增大,细菌纤维素的产量先增加,在初始pH值为5.2时,BC产量达到最大值(11.2 g/L)。当初始pH值继续增加时,细菌纤维素产量略有下降。此外,发酵液的初始pH高易出现染菌现象。因此选择最佳初始pH值为5.2。当接种量由6%逐渐增加至8%时,细菌纤维素的产量也呈现逐步升高趋势,当接种量为8%时,BC产量达到最大值11.5g/L;继续加大接种量,BC产量开始下降,其原因可能是接种量过大时,培养液的菌浓度较高,对基质消耗过多,不利于产物的积累,从而使得细菌纤维素产量降低。因此确定最佳初始pH为5. 2,最佳接种量为8%。
2.3正交试验结果分析
结合单因素试验结果,以细菌纤维素产量为评价指标,选取葡萄糖、蔗糖、玉米浆、硫酸铵、磷酸二氢钾5因素进行正交试验优化,正交试验结果与分析见表3,方差分析结果见表4。
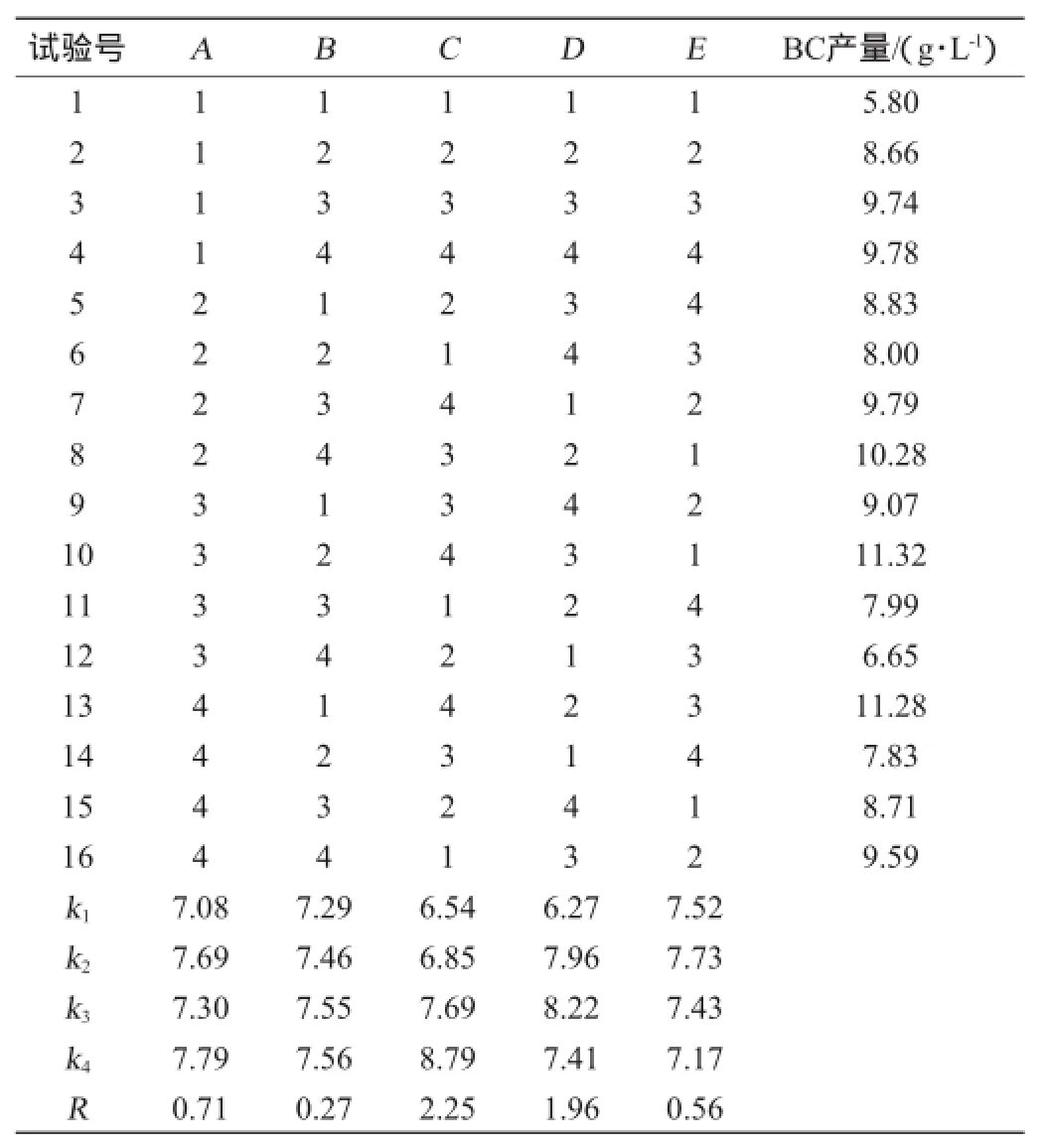
表3 培养基组分优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for medium components optimization
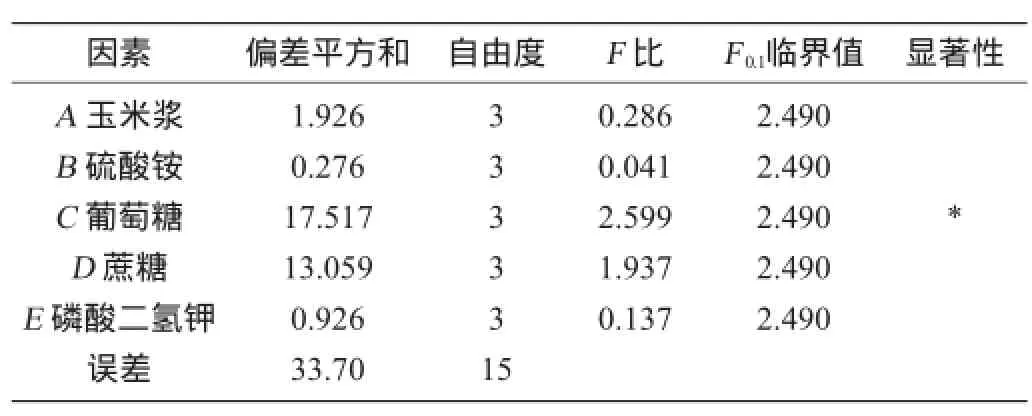
表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results
由表3中R值的大小得知,各因素对细菌纤维素产量影响的顺序依次为C>D>A>E>B,即葡萄糖的影响最大,蔗糖次之,之后是玉米浆、磷酸二氢钾和硫酸铵。葡糖醋杆菌RSZ01发酵产细菌纤维素的最优方案为A4B4C4D3E2,即葡萄糖2.50%、蔗糖3.00%、玉米浆2.2%、磷酸二氢钾0. 35%、硫酸铵0.150%。由表4可知,葡萄糖对BC产量影响最显著(P<0.1),与极差分析结果相一致。在此最佳条件下进行验证试验,葡糖醋杆菌RSZ01发酵产细菌纤维素的产量为12.05 g/L。
3 结论
本研究为提高葡糖醋杆菌(Komagataeibacternataicola)RSZ01发酵产细菌纤维素产量,采用单因素和正交试验对发酵培养基组成进行了优化,并研究了菌株保藏时间、接种量和培养基初始pH对BC产量的影响。结果表明,保藏期限在30 d以内的菌种可基本保证其稳定地发酵产BC产量的水平;在接种量为8%、初始pH值为5.2时,最优发酵培养基组成为:葡萄糖2.50%,蔗糖3.00%,玉米浆2.2%,磷酸二氢钾0.35%,硫酸铵0.150%。在此条件下,葡糖醋杆菌RSZ01发酵产细菌纤维素的产量为12.05g/L,较S-H培养基BC产量(1.02g/L)提高了约12倍。为细菌纤维素高产菌株及其工业化应用研究奠定了坚实基础。
[1]GINDL W,KECKES J.Tensile properties of cellulose acetate butyrate composites reinforced with bacterial cellulose[J].Compos Sci Technol,2004,64:2407-2413.
[2]王先秀.新型的微生物合成材料—醋酸菌纤维素[J].中国酿造,1999,10(1):1-2.
[3]XIAO L,MAI Y,HE F.Bio-based green composites with high performance from poly(lactic acid)and surface modified microcrystalline cellulose[J].J Mater Chem,2012,22(31):15732.
[4]NASEHI B,JAVAHERI S.Application of high hydrostatic pressure in modifying functional properties of starches:A Review[J].Mid-East J Sci Res,2012,11(7):856.
[5]YOUSEFI H,FAEZIPOUR M,HEDJAZI S,et al.Comparative study of paper and nanopaper properties prepared from bacterial cellulose nanofibers and fibers/ground cellulose nanofibers of canola straw[J].Ind Cro Prod,2013,43:732
[6]SARA M S,JOS?M C,ESTER Q,et al.Characterization of purified bacterial cellulose focused on its use on paper restoration[J].Carbohydr Polym,2015,116:173.
[7]WU J,ZHENG Y,SONG W,et al.In situ synthesis of silver-nanoparticles/bacterial cellulose composites for slow-released antimicrobial wound dressing[J].Carbohydr Polym,2014,102:762.
[8]LACIN N T.Development of biodegradable antibacterial cellulose based hydrogel membranes for wound healing[J].Int J Biol Macromol,2014,67:22.
[9]SILVA N H C S,DRUMOND I,ALMEIDA A F,et al.Topical caffeine delivery using biocellulose membranes:A potential innovative system for cellulite treatment[J].Cellulose,2014,21:665.
[10]范兆乾.细菌纤维素的生产研究进展[J].化学工业与工程技术,2013,34(1):51-54.
[11]孙勇慧,刘鹏涛,刘忠.细菌纤维素的应用研究进展[J].材料导报,2015,29(3):62-67.
[12]赵琼,杨谦.细菌纤维素高产菌株的紫外诱变育种研究[J].食品与发酵工业,2007,33(7):26-28.
[13]马霞.发酵生产细菌纤维素及其作为医学材料的应用研究[D].天津:天津科技大学,2003.
[14]薛璐,杨谦.醋杆菌产纤维素发酵培养基的优化[J].食品科学,2004,25(11):213-215.
[15]PARK J K,JUNG J Y,PARK Y H.Cellulose production byGluconacetobacter hanseniiin a medium containing ethanol[J].Biotechnol Lett, 2003,25:2055-2059.
[16]谢健健,洪枫.细菌纤维素发酵原料的研究进展[J].纤维素科学与技术,2011,19(3):68-77.
[17]杨光,王彩霞.以腐烂水果为营养源高效制备细菌纤维素[J].纤维素科学与技术,2015,23(4):67-70.
[18]李斌,钟春燕,王锡彬,等.椰子水与菠萝汁生产细菌纤维素的对比研究[J].中国酿造,2014,33(6):27-30.
[19]吕鸿皓,黄莉,党苗苗,等.利用大豆糖蜜制备细菌纤维素[J].食品研究与开发,2015,36(20):165-168.
[20]周伶俐.细菌纤维素生产菌的筛选、发酵及应用的研究[D].南京:南京理工大学,2008.
Fermentation of Komagataeibacter nataicola RZS01 for bacterial cellulose production
XU Yunhua1,MA Bo1,2,ZHANG Heng2,LUO Li1,ZHANG Lei1,ZHENG Xia1
(1.Department of Life Sciences,Lianyungang Normal College,Lianyungang,222006,China;2.Chemicobiology and Functional Materials Institute of Nanjing University of Science and Technology,Nanjingm,210094,China)
Komagataeibacter nataicolaRSZ01 was used to bacterial cellulose(BC)fermentation tests.The components of fermentation medium were optimized by single factor and orthogonal experiments,and the effects of strain preservation time,inoculum and medium initial pH on BC yield were researched.The results showed that bacteria can guarantee the BC yield basically within preservation time 30 d.In the conditions of inoculum 8%,initial pH 5.2,the optimal fermentation medium components were glucose 2.50%,sugar 3.00%,corn starch 2.2%,monopotassium phosphate 0.35% and ammonium sulfate 0.125%,the BC yield withK.nataicolaRSZ01 fermentation was 12.05 g/L.
Komagataeibacter nataicolaRSZ01;bacterial cellulose;fermentation;conditions optimization
Q939.97
0254-5071(2016)09-0038-05doi:10.11882/j.issn.0254-5071.2016.09.009
2016-05-16
国家自然科学基金(21206076);江苏省高校自然科学研究面上项目(16KJB180034);江苏省高等职业院校国内高级访问学者计划项目(2015FX032)
许云华(1968-),女,副教授,硕士,主要从事微生物及生理学研究工作。
