胰岛素泵强化治疗不同病程初诊2型糖尿病的临床观察及随访研究*
2016-10-22徐有伟
徐有伟
(青海省西宁市青海红十字医院中西医结合糖尿病科,青海西宁810001)
胰岛素泵强化治疗不同病程初诊2型糖尿病的临床观察及随访研究*
徐有伟
(青海省西宁市青海红十字医院中西医结合糖尿病科,青海西宁810001)
目的对不同病程初诊2型糖尿病患者(T2DM)给予短期持续皮下胰岛素注射(CSⅡ)治疗,并随访1年,比较对胰岛β细胞功能恢复及血糖控制的影响。方法将符合纳入标准的60例初诊2型糖尿病患者按照病程分为A组(1~6个月)、B组(6~12个月)及C组(≥12个月)3组,给予CSⅡ2周治疗。疗程结束后摘除胰岛素泵,并根据患者意愿、血糖结果及初始病情综合判断,选择胰岛素、口服降糖药物等继续治疗。出院后维持随访1年,每3个月门诊复查1次。统计1年内复查的血糖控制、胰岛β细胞功能及治疗方案调整情况,并对患者进行治疗前后的自身比较及组间比较。结果治疗后3组空腹血糖、餐后2h血糖及胰岛β细胞功能均较治疗前显著改善(P<0.01),且A组和B组在胰岛β细胞功能改善、胰岛素用量及血糖达标时间上优于C组(P<0.01)。随访1年过程中,3组间比较,A组和B组在糖尿病缓解率上优于C组(P<0.05),A组和B组比较差异无统计学意义(P>0.05)。3组患者于随访3个月与12个月时的胰岛β细胞功能比较无明显变化(P>0.05)。结论胰岛素强化治疗可以短时期内迅速降低血糖,还可以使有葡萄糖毒性的T2DM患者恢复胰岛β细胞功能、提高胰岛素敏感性,病程较短(≤1年)的初诊T2DM患者胰腺功能恢复更好,血糖达标时间更快、胰岛素用量更少。胰岛素强化治疗还具有“后续效应”,大部分患者1年后良好的血糖控制得到保持,部分患者不用任何降糖药而血糖控制良好,获得不同程度的糖尿病缓解期。本研究或能为临床工作提供一定的理论依据。
2型糖尿病;胰岛素泵;强化治疗;胰岛β细胞功能;糖尿病缓解期
糖尿病(diabetes mellitus,DM)已成为全球流行性疾病,近年来,我国糖尿病患病率显著增加,据最近流行病学调查结果表明,我国20岁以上的成年人糖尿病患病率约为9.7%,成人糖尿病患者总人数达9240万,我国可能已成为糖尿病患者数最多的国家[1]。其中2型糖尿病(type 2 diabetes mellitus,T2DM)占糖尿病患者总人数的90%以上,DM及其相关并发症成为威胁人民健康的主要问题。T2DM的显著特征是高血糖,高血糖是糖尿病进展并发生并发症的重要机制之一,慢性高血糖所致的胰岛β细胞分泌胰岛素的异常称为“葡萄糖毒性”作用。20年前的两个里程碑DCCT(diabetes control and complications trim)和UKPD(united kingdom prospective diabetes study)[2-3]研究提出糖尿病强化治疗的概念,证实了强化血糖控制的意义,提示胰岛β细胞功能不足在早期是可以逆转和控制的,也奠定了强化治疗在糖尿病管理中的地位。近年来的临床研究[4-6]均显示,对于新诊断的T2DM患者早期给予短期胰岛素强化治疗后,除了可以明显改善血糖控制,缓解高糖状态对机体造成的毒性外,还具有保护β细胞,恢复第一时相胰岛素分泌的作用,部分患者通过胰岛素强化治疗后,其β细胞功能甚至可以回到T2DM自然病程的起始阶段。本研究通过探讨胰岛素泵持续胰岛素皮下输注(continuous subcutaneous insulin infusion,CSII)对不同病程初诊T2DM患者血糖控制及胰岛β细胞功能的影响,并随访观察1年,以期为临床工作提供依据,现报道如下。
1 资料与方法
1.1一般资料
选取2013年10月-2014年10月于青海红十字医院糖尿病科住院的初诊T2DM患者。纳入标准:①采用WHO 1999年糖尿病诊断标准,年龄20~70岁;②初诊的T2DM患者,空腹血糖(fasting plasma glucose,FPG)≥11.1 mmol/L或糖化血红蛋白(HbA1c)≥9.0%;③入院前未正规治疗,从未接受口服降脂药、降糖药或胰岛素治疗。排除标准:①1型糖尿病或其他类型糖尿病;②糖尿病有严重急性并发症或伴发如酮症或酮症酸中毒、高渗性昏迷、严重应激状态在半年内;③严重肝、肾功能受损患者和严重心肺功能不全患者;④有明显影响血糖的各种疾病(如甲状腺功能亢进症、皮质醇增多症等);⑤怀孕或哺乳期妇女;⑥接受糖皮质激素治疗或激素替代治疗者;⑦胰岛素过敏患者。本研究方案获得本院伦理委员会批准,试验遵循了赫尔辛基宣言,所有受试者均自愿参加并签署了试验知情同意书。
1.2研究设计
筛选入住本院糖尿病科住院部的初诊T2DM患者,共纳入60例患者,按照病程分为3组,A组(病程:1~6个月)(n=20)、B组(病程:6~12个月)(n= 20)、C组(病程:≥12个月)(n=20)。记录研究对象的性别、年龄、身高(W)、体重(H)、血压(BP)、腰围(WC),并计算体重指数(body mass index,BMI)。于治疗前由糖尿病专科医生进行糖尿病教育、给予患者糖尿病标准热卡饮食,相对固定每日体力活动。入院后于空腹8 h以上,于次日清晨抽取空腹静脉血,100 g标粉馒头餐试验,0、30、60、120及180 min取血检测血糖、胰岛素、C肽水平。并检测糖化血红蛋白(HbA1c),三酰甘油(Triglyceride,TG),总胆固醇(total cholesterol,TC),高和低密度脂蛋白胆固醇(HDL-C、LDL-C)水平。之后患者按分组进行胰岛素泵强化治疗。血糖控制目标:空腹血糖(FPG)≤6 mmol/L;餐后2 h血糖(2 hPG)≤8.0 mmol/L。停用胰岛素24h后再次复查指标。
1.3胰岛素泵强化治疗
胰岛素泵采用美敦力(minimed)712泵,胰岛素(门冬胰岛素注射液,商品名诺和锐,丹麦诺和诺德公司生产,规格每支300u)起始剂量每日0.5~0.8u/kg,其中50%为基础量,50%为餐前大剂量,按照3餐1/3、1/3及1/3分配。特殊情况下根据饮食成分,特别是碳水化合物含量以及血糖情况个性化设定。采用德国罗氏优越四型血糖仪测定患者每日空腹、3餐前后及睡前指尖血糖,根据血糖情况调整胰岛素用量,至血糖控制目标。胰岛素泵剂量调整均由糖尿病专科医生进行。
1.4指标计算
BMI=体重(kg)/身高2(m2);用稳态模型(Homa)计算胰岛β细胞功能(homeostasis model assessment-pancreaticβcell,HOMA-β)及胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR):HOMA-β=20×空腹胰岛素/(空腹血糖-3.5);HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.5随访
以上3组治疗时间均为2周,要求于2周内将血糖控制平稳,2周疗程结束后摘除胰岛素泵,并根据患者意愿、血糖结果及初始病情综合判断,选择胰岛素、口服降糖药物等继续治疗。糖尿病缓解定义为:停用胰岛素泵治疗后,仅通过生活方式改善,未使用降血糖药物治疗情况下FPG<7.0 mmol/L,2 h PG<10.0mmol/L。出院后进行随访1年,每3个月门诊复查1次。复查时抽取空腹静脉血行100 g标粉馒头餐试验,0、60、120和180min取血检测血糖、胰岛素及C肽水平。并检测HbA1c、FPG及2 hPG水平,记录体重变化。
1.6统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,计数资料用%表示。治疗前后比较用配对t检验,计数资料及率的比较用χ2检验,3组间比较用单因素方差分析,两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1一般资料分析
60例初诊T2DM患者完成了本研究,其中男性29例,女性31例,年龄分布21~67岁,A、B、C 3组在性别、年龄、BMI、SBP、DBP、FPG、2 hPG、HbA1c、TC、TG、HDL-C和LDL-C等方面差异无统计学意义(P>0.05)。见表1。
表1 两组患者一般临床资料的比较(±s)

表1 两组患者一般临床资料的比较(±s)
组别男/女/例年龄/岁BMI/(kg/m2)SBP/(mmHg)DBP/(mmHg)FPG/(mmol/L)A组11/940.65±11.7424.88±1.72132.30±17.8085.40±10.2213.19±1.67 B组8/1242.25±8.5124.88±2.03132.40±17.3889.05±8.6713.02±1.29 C组F/χ210/10 0.627 38.85±11.07 0.522 24.98±1.82 0.019 131.40±16.88 0.020 87.05±9.12 0.763 12.95±1.62 0.136 P值0.9340.5960.9810.9800.4710.873组别2hPG/(mmol/L)HbA1c/%TC/(mmol/L)TG/(mmol/L)HDL-C/(mmol/L)LDL-C/(mmol/L)A组19.83±1.9911.17±1.146.27±0.432.82±0.270.98±0.793.26±0.28 B组19.97±2.2511.25±0.966.20±0.402.63±0.310.96±0.103.19±0.24 C组F/χ219.98±1.88 0.036 10.84±0.79 0.998 6.15±0.46 0.039 2.68±0.30 2.133 0.99±0.11 0.669 3.20±0.26 0.427 P值0.9640.3750.7140.1280.5160.655
2.2治疗前后3组患者血糖控制、胰岛β细胞功能、胰岛素用量及达标时间比较
3组治疗前后FBG、2 hPG、胰岛β细胞功能(HOMA-β)和胰岛素抵抗指数(HOMA-IR)均显著改善,组内比较差异有统计学意义(P<0.01)。A、B、C 3组治疗后FBG和2 hPG进行比较,差异无统计学意义(P=0.989和0.394)。A、B、C 3组治疗后HOMA-β进行比较,组间比较差异有统计学意义(P< 0.01),A组与B组的HOMA-β比C组的显著性增高,A组与B组比较差异无统计学意义(P=0.543)。A、B、C 3组治疗后HOMA-IR进行比较,组间比较差异有统计学意义(P<0.01),A组与B组的HOMA-IR比C组的显著性降低,A组与B组比较差异无统计学意义(P=0.897)。3组在胰岛素用量和血糖达标时间相比较差异有统计学意义(P<0.01),其中A组与B组比C组胰岛素用量少,且达标时间也较短,A组与B组比较差异无统计学意义(P=0.250和0.100)。见表2。
2.3随访3、6、9和12个月糖尿病缓解情况
随访治疗后3、6、9和12个月,3组均无受试者退出观察。3组糖尿病缓解率分别为:A组70%、70%、60%和50%;B组60%、60%、50%和45%;C组15%、15%、15%和10%。A组和B组明显优于C组,差异有统计学意义(P1<0.05),A组和B组差异无统计学意义(P2>0.05)。见表3及图1。所有患者1年后最终治疗方案的转归见图2。
表23 组治疗前后FPG、2 hPG、HOMA-β、HOMA-IR、胰岛素用量和达标时间比较(±s)

表23 组治疗前后FPG、2 hPG、HOMA-β、HOMA-IR、胰岛素用量和达标时间比较(±s)
注:P1值:A组治疗前后FBG、2 hPG、HOMA-β和HOMA-IR的比较;P2值:B组治疗前后FBG、2 hPG、HOMA-β和HOMA-IR的比较;P3值:C组治疗前后FBG、2hPG、HOMA-β和HOMA-IR的比较;P4值:治疗后3组FBG、2 hPG、HOMA-β、HOMA-IR、胰岛素用量及达标时间的比较;P5值:A与B组组间HOMA-β、HOMA-IR、胰岛素用量及达标时间的比较
组别FPG/(mmol/L)2hPG/(mmol/L)HOMA-βHOMA-IR胰岛素用量/u血糖达标时间/h A组治疗前13.19±1.6719.83±1.9929.10±5.277.90±0.64288.92±48.72122.56±4.20治疗后5.67±0.367.62±0.51122.34±15.222.78±0.27 P1值0.0000.0000.0000.000 B组治疗前13.02±1.2919.97±2.2527.05±4.747.95±0.85297.55±57.45126.11±7.66治疗后5.69±0.497.48±0.62119.59±15.562.76±0.26 P2值0.0000.0000.0000.000 C组治疗前12.95±1.6219.98±1.8825.88±4.747.98±0.80376.22±21.44226.16±7.70治疗后5.67±0.457.50±0.7093.87±11.484.51±0.92 P3值0.0000.0000.0000.000 P4值0.9890.3940.0000.0000.0000.000 P5值0.5430.8970.2500.100
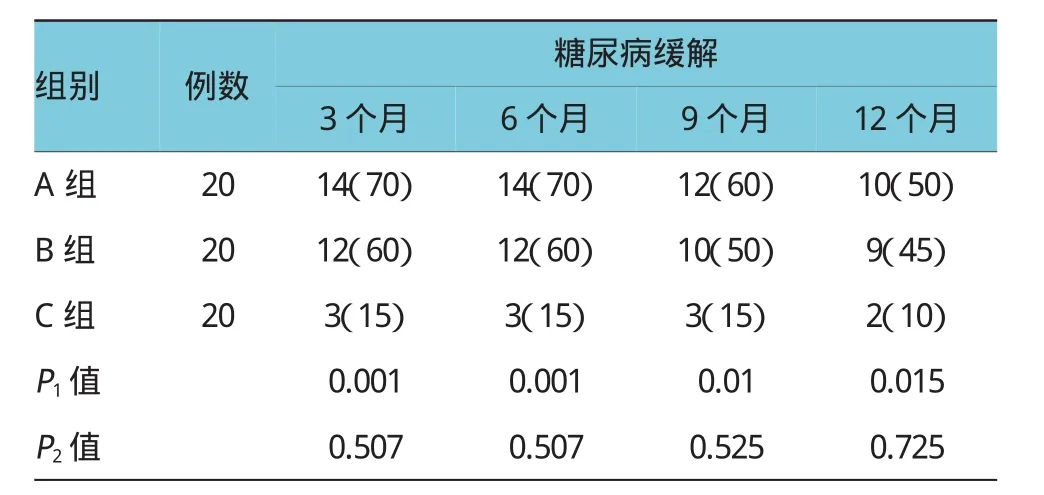
表3 随访3、6、9和12个月3组糖尿病患者缓解情况例(%)

图1 A、B、C 3组患者随访1年内不同治疗方案构成比
2.4随访3、6、9和12个月HbA1c及胰岛β细胞功能情况
随访治疗后3、6、9和12个月,3组均无受试者退出观察。组内比较,A、B、C 3组于随访3和12个月时的HbA1c有差异(P<0.05);而HOMA-β和HOMA-IR差异无统计学意义(P>0.05)。组间比较,3组HbA1c、HOMA-β和HOMA-IR比较,A组和B组明显优于C组,差异有统计学意义(P<0.01),A组和B组差异无统计学意义(P>0.05)。见表4。

表4 随访3、6、9和12个月3组HbA1c、HOMA-β及HOMA-IR情况

图2 所有患者1年后最终治疗方案的转归
3 讨论
T2DM的病理生理基础主要是胰岛β细胞分泌减退和(或)胰岛素抵抗,其中胰岛β细胞分泌功能的进行性减退是起病的中心环节,也是病情进展的主要驱动力[4]。而“高糖毒性”是胰岛β细胞分泌功能损伤的主要因素。葡萄糖是β细胞合成胰岛素最强有力的刺激因子,而长期高血糖使胰岛素需求不断增加,β细胞处于持续活化状态,从而出现β细胞的葡萄糖失敏感至最后耗竭。UKPDS研究[2]发现,T2DM患者于初诊时约50%的β细胞已经丧失功能,而且以后以每年4.5%的速度下滑。因此尽早的纠正高血糖状态,切断高血糖与β细胞分泌功能减退之间的恶性循环,逆转高血糖对β细胞的损害作用,最大限度地恢复β细胞功能对新诊断T2DM尤为重要。已有研究显示,对新诊断T2DM患者,短期胰岛素强化治疗可改善胰岛β细胞功能,并使部分患者病情缓解。据中华医学会糖尿病分会颁布的《中国2型糖尿病防治指南(2013年版)》指出:对于糖化血红蛋白>9.0%或空腹血糖>11.1 mmol/L的初诊糖尿病患者,可进行短期胰岛素强化治疗路径,结合临床推荐治疗时间在2周~3个月为宜[1]。胰岛素强化治疗是指在饮食控制和运动疗法的基础上,通过每日3次或4次注射胰岛素,或使用胰岛素泵使血糖得到满意控制。胰岛素泵持续胰岛素皮下输注(CSⅡ)是采用人工智能控制的胰岛素输注装置,是更符合生理模式分泌的胰岛素给药方式,已广泛应用于临床。一方面提供持续的基础胰岛素分泌量,另一方面可在餐前通过调节器给予追加剂量模拟餐后胰岛素分泌的增加,用以控制餐后高血糖,并能够减少血糖的波动。相比较传统的多次胰岛素注射,可有效规避低血糖发生风险,减少注射次数提高患者的生活质量。
既往关于胰岛素强化治疗的研究多集中在不同的治疗方案及治疗时间上的差异[7-8],但对不同病程的初诊T2DM患者强化治疗的研究较少,亟需开展临床研究积累更对的临床证据。本研究纳入60例血糖水平较高的初诊T2DM患者,按照病程分为A组(病程:1~6个月)、B组(病程:6~12个月)、C组(病程:≥12个月),结果显示,所有受试者经过为期2周的胰岛素泵强化治疗后,空腹及餐后2h血糖得到较好的控制,胰岛β功能也得到了显著改善。同时A组和B组,在改善胰岛β细胞功能上优于C组,而A组和B组比较差异无统计学意义。值得注意的是,3组患者在胰岛素用量、血糖达标时间等差异有统计学意义。A组和B组较C组胰岛素用量少,且血糖达标时间短,A组与B组比较差异无统计学意义。提示与C组患者糖尿病病程较长,胰岛β细胞功能破坏严重有关。
胰岛素强化治疗诱导T2DM缓解的机制如下,基础研究显示,葡萄糖对胰岛β细胞葡萄糖刺激的胰岛素分泌(glucose stimulated insulin secretion,GSIs)大体分3个阶段:①失敏感期(glucose desensitization)即对葡萄糖刺激反应能力下降;而β细胞中胰岛素或颗粒含量变化不大,胰岛β细胞对胰岛素刺激分泌偶联方面出现紊乱,但功能完全可逆;②β细胞疲劳期(β-cell exhaustion)是指β细胞胰岛素贮备耗竭,即可释放胰岛素缺乏;该阶段可以存在形态学的变化,可见β细胞的部分脱颗粒现象,但衰竭的胰岛细胞在胰岛素合成上无缺陷,在休息时细胞功能亦可完全恢复;③糖毒性期(glucotoxicity),如果高糖环境没有及时解除,β细胞功能损害进一步破坏进入不可逆阶段,开始时出现胰岛素基因表达缺陷。此后在结构破坏外,也会出现细胞的凋亡、数量减少[9-11]。第一、二阶段即糖尿病早期,为逆转β细胞功能损害的最佳和关键时期,如能在短时间内消除高糖环境,β细胞损害得到恢复,则可在一定程度上达到病情的缓解,进入“蜜月期”。故一、二期为胰岛素强化治疗的最佳时期。此外,UKPDS证明即使是强化血糖控制结束后,早期强化血糖控制具有“延续效应”。有学者[12]观察15例经胰岛素强化后仅通过饮食控制而不用任何药物的T2DM患者,在随访12、24及36个月时,仅用饮食控制而保持血糖稳态的患者比例分别为80%、53%及40%,最长缓解时间>4年。在胰岛素短期强化治疗3年后,仍有40%左右患者得到缓解。这与本研究结果相似。在本研究中,对3组患者进行为期1年的随访,结果显示,随访治疗后3、6、9和12个月,A组糖尿病缓解率70%、70%、60%和50%,B组糖尿病缓解率60%、60%、50%和45%,C组糖尿病缓解率15%、15%、15%和10%。A组和B组明显优于C组,差异有统计学意义,A组和B组差异无统计学意义。而在所有患者1年后最终治疗方案的转归中,糖尿病缓解率也高达35%,提示短期胰岛素泵强化治疗可改善初诊T2DM血糖控制和胰岛β细胞功能,达到短期糖尿病缓解,而且具有较好的远期效应。
本研究还发现,3组患者在随访1年的过程中,平均血糖水平(HbA1c)均较前有不同程度的上浮(如随访3和12个月时比较),差异有统计学意义,但胰岛β细胞功能(HOMA-β、HOMA-IR)与前比较,无明显差异。出现这种现象的原因,考虑为与年龄、规律的门诊随诊、院外自我控制饮食、适当运动等有关系。院外随访的患者由于个体差异性及随意性较大,缺乏与住院治疗时严格的饮食控制、规律用药及运动锻炼,从而造成血糖不同程度的上浮。而胰岛β细胞功能无明显差异更好地说明短期胰岛素强化治疗诱导出了较长期的T2DM的病情缓解。由于本研究样本量较少,随访时间较短,仍需扩大样本量高质量研究为临床提供更高级别证据,同时应加强对影响患者缓解率因素及后续治疗方案选择的研究。
综上所述,本研究发现,胰岛素强化治疗可以短时期内迅速降低血糖,还可以使有葡萄糖毒性的T2DM患者恢复胰岛β细胞功能、提高胰岛素敏感性,病程较短(≤1年)的初诊T2DM患者胰腺功能恢复更好,血糖达标时间更快、胰岛素用量更少。胰岛素强化治疗还具有“后续效应”,大部分患者1年后良好的血糖控制得到保持,部分患者不用任何降糖药而血糖控制良好,获得不同程度的糖尿病缓解期。本次研究或能为临床工作提供一定的理论依据。
[1]中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,(8): 2-42.
[2]The Diabetes Control and Complications Trial Research Group. The relationship of glycemic exposure(HbA1c)to the risk of development and progression of retinopathy in the diabetes control and complication trial[J].Diabetes,1995,44(8):968-983.
[3]UK Prospective Diabetes Study(UKPDS)Group.Effect of intensive blood glucose control with metformin on complication overweight patients with type 2 diabetes(UKPDS 34)[J].Lancet, 1998,352(9132):854-865.
[4]李光伟,宁光,周智广.2型糖尿病早期胰岛素强化治疗改善胰岛B细胞功能-是现实还是梦想[J].中华内分泌代谢杂志,2006,22(4): 309-312.
[5]HU Y,LI L,XU Y,et al.Short-term intensive therapy in newly diagnosed type 2 diabetes partially restores both insulin sensitivity and β-cell function in subjects with longterm remission[J]. Diabetes Care,2001,34(8):1853-1858.
[6]RYAN E A,LMES S,WALLACE C,et al.Short-term intensive insulin therapy in newly diagnosed type 2 diabetes[J].Diabetes Care,2004,27(5):1028-1032.
[7]姜丽燕,郑丽丽.胰岛素持续皮下注射治疗新诊断2型糖尿病1年随访疗效的观察[J].中国糖尿病杂志,2014,22(3):237-239.
[8]何继东,姚荷玲,张兰,等.新诊断2型糖尿病患者早期胰岛素泵强化治疗时间选择[J].中华临床医师杂志(电子版),2015,9(10): 1990-1993.
[9]KILPATRICK E D,RNBERTSON R P.Differentiation between gIucose-induce desensitization of insulin secretion and beta-cell exhaustion in the HIT-T15 cell line[J].Diabetes,1998,47(4): 606-611.
[10]BROWNLEE M.A radical explanation for glucose-induced beta cell dysfunction[J].J Clin Invest 2003,112(12):1788-1790.
[11]RUSTENBECK I,WIENBERGEN A,BLECK C.Desensitization of insulin secretion by depolarizing insulin secretagogues[J].Diabetes,2004,53(3):S140-S150.
[12]祝方,纪立农,等.新诊断2型糖尿病患者早期胰岛素强化治疗的随访研究[J].中国糖尿病杂志,2009,17(4):261-263.
(张蕾编辑)
Therapeutic effect of insulin pump on newly-diagnosed type 2 diabetes in different course*
You-wei Xu
(Department of Integrated Traditional Chinese and Western Medicine for Diabetes,Qinghai Red Cross Hospital,Xining,Qinghai 810001,China)
Objective To study the effects of transient intensive insulin therapy[continuous subcutaneous insulin infusion(CSⅡ)]on glycemic control,islet β-cell function and diabetes remission rate in newly-diagnosed type 2 diabetes patients of different course.Methods In accordance with the disease course,60 patients with type 2 diabetes were divided into three groups(group A:1-6 months,6 months<group B<1 year,group C≥1 year).After CSII,the patients were given insulin or oral hypoglycemic drugs according to comprehensive judgment.All the patients were given 1 year of follow-up and outpatient care every 3 months.Intravenous glucose tolerance tests were done,and blood glucose,insulin and proinsulin were measured before and after therapy and during 1-year follow-up.Results All the patients achieved target glycemic control and improvement of β-cell function after treatment(P <0.01).The patients of the groups A and B had better improvement of β-cell function with lower insulin dosage and shorter time to obtain glycemic control compared to the patients of the group C(P <0.01).During 1-year follow-up,the remission rate of the groups A and B was significantly higher than that of the group C(P <0.05).The islet β-cell function at 3 months and 1 year of follow-up had no statistical differences among the three groups(P >0.05).ConclusionsTransient intensive insulin therapy has favorable outcomes on recovery and maintenance of β-cell function and protracted glycemic remission in patients with newly-diagnosed type 2 diabetes.Furthermore,the patients with short course of disease(≤1 year)achieved better improvement of β-cell function with lower insulin dosage and shorter time to restore standard glucose level.The continuing hypoglycemic effect after 1 year might be due to the effect of metabolic memory.Some patients can even achieve long-term complete clinical remission without using any medicine.The study may provide theoretical basis for clinical work.
type 2 diabetes;insulin pump;intensive therapy;β-cell function;remission stage
R 587.1
A
10.3969/j.issn.1005-8982.2016.18.014
1005-8982(2016)18-0068-07
2016-01-11
青海省科学技术厅项目(No:2014-NS-123)
