新诊断2型糖尿病患者血清硫氧还蛋白、硫氧还蛋白相互作用蛋白与颈动脉粥样硬化的相关性
2016-10-22张红蕊房辉刘春梅赵轶群李春霞张古月张丹丹周蕾张鹤
张红蕊,房辉,刘春梅,赵轶群,李春霞,张古月,张丹丹,周蕾,张鹤
(1.河北省唐山市人民医院,河北唐山063000;2.河北省唐山市工人医院,河北唐山063000)
新诊断2型糖尿病患者血清硫氧还蛋白、硫氧还蛋白相互作用蛋白与颈动脉粥样硬化的相关性
张红蕊1,房辉2,刘春梅1,赵轶群1,李春霞1,张古月2,张丹丹2,周蕾2,张鹤2
(1.河北省唐山市人民医院,河北唐山063000;2.河北省唐山市工人医院,河北唐山063000)
目的探讨新诊断2型糖尿病(T2DM)患者血清硫氧还蛋白(Trx)、硫氧还蛋白相互作用蛋白(TX NIP)水平与颈动脉粥样硬化(CAS)的相关性。方法选取2014年2月-2015年11月于河北省唐山市工人医院内分泌科就诊的新诊断T2DM患者160例作为病例组。根据颈动脉超声检查结果将患者分为T2DM伴CAS组(CAS组,n=65例)和T2DM不伴CAS组(NCAS组,n=95例)。同时从医院健康体检中心选取非糖尿病健康人群140例作为正常组。记录其年龄、性别、体重指数(BMI)、收缩压(SBP)、舒张压(DBP),收集其临床检验结果,包括空腹血糖(FPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1C)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、同型半胱氨酸(Hcy),计算胰岛素抵抗指数(HOMA-IR)。采用酶联免疫吸附法(ELISA)检测血清Trx、TX NIP含量,采用胰岛素还原法检测血清Trx活性。结果与正常组比较,T2DM患者FPG、HbA1c、HOMA-IR、Trx、TX NIP水平升高,Trx活性下降(均P<0.05);T2DM患者CAS组较NCAS组年龄较大,FPG、HbA1c、SBP、Trx、TX NIP水平较高,Trx活性下降(均P<0.05);在T2DM患者中,Trx与HbA1c呈正相关,TX NIP与HbA1c、HOMA-IR呈正相关,Trx活性与TX NIP呈负相关(均P<0.05);在T2DM患者中,年龄、HbA1c、Trx、TX NIP及Trx活性为合并CAS的影响因素,其中年龄(O∧R =1.134,P=0.032)、HbA1c(O∧R =1.275,P=0.021)、Trx(O∧R =1.532,P=0.015)、TX NIP(O∧R =1.731,P= 0.005)为CAS发生的危险因素,而Trx活性(O∧R=0.507,P=0.002)为CAS发生的保护因素。结论新诊断T2DM患者血清Trx、TX NIP、Trx活性与其CAS相关,提示Trx系统可能参与了CAS的发生及发展。
新诊断2型糖尿病;硫氧还蛋白;硫氧还蛋白相互作用蛋白;颈动脉粥样硬化
2型糖尿病(type 2 diabetes,T2DM)是一种以血糖升高为特征的代谢性疾病,近年来随着生活水平提高,T2DM的发病率也在逐渐上升。长期的高血糖状态可以使T2DM患者可出现心、脑、肾、视网膜以及血管等组织器官的慢性并发症。动脉粥样硬化(Atherosclerosis,AS)是T2DM所致的血管并发症之一,研究表明T2DM患者发生AS的风险是非糖尿病人群的2~4倍[1],是糖尿病患者致死、致残的主要原因之一[2]。其中颈动脉粥样硬化(carotid atherosclerosis,CAS)作为全身动脉硬化的表现之一,其位置表浅且易于通过超声检测,因此成为早期评价全身动脉硬化的一个指标[3]。目前T2DM合并CAS的机制尚不明确,与多种因素相关。硫氧还蛋白(Thioredoxin,Trx)系统是一个调节细胞氧化还原状态和细胞增殖生存的氧化还原系统,参与了机体的氧化应激过程[4]。考虑到氧化应激在糖尿病血管并发症发病机制中的重要作用,因此本研究选择将硫氧还蛋白系统作为切入点,以探讨系统内Trx、硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)及Trx活性与新诊断T2DM患者CAS的相关性。
1 资料与方法
1.1研究对象
选取2014年2月-2015年11月在河北省唐山市工人医院内分泌科就诊的新诊断T2DM患者160例,均符合1999年WHO糖尿病诊断标准。同时从医院健康体检中心选取非糖尿病健康人群140例作为正常对照组。所有入组对象均排除以下情况:①急、慢性感染性疾病;②糖尿病急、慢性并发症;③类风湿/痛风等自身免疫性疾病;④甲状腺及甲状旁腺疾病或者其他与内分泌相关的疾病;⑤癌症、肝病、肾病、视网膜病、中重度高血压、冠心病、脑卒中;⑥正在服用炎症抑制剂、降糖药、降脂药、降压药以及维生素C、E等抗氧化剂。
1.2研究方法
1.2.1一般临床资料收集记录患者的人口学资料,包括年龄、性别、体重指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)。收集其临床检验结果,包括空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)、糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、总胆固醇(total cholesterol,TC)、三酰甘油(Triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)、同型半胱氨酸(Homocysteine,Hcy),根据[空腹血糖(mmol/L)×空腹胰岛素(mIU/L)÷22.5]计算胰岛素抵抗指数(homeostasis model of assessment for insulin resistence index,HOMA-IR)。
1.2.2血清Trx、TX NIP含量及Trx活性检测患者于晨起6~7时抽取空腹静脉血6 ml,室温放置30 min后3 000 r/s离心15 min,收集上清液放入-80℃冰箱中待用。采用酶联免疫吸附法(ELISA)检测血清Trx、TXNIP含量(试剂盒购自台湾Abnova公司)。采用胰岛素还原法检测血清Trx活性(原理是检测Trx对胰岛素A、B链之间二硫键的还原作用),将血清与胰岛素(美国Sigma公司)、硫氧还蛋白还原酶(thioredoxin reductase,TR)(美国Sigma公司)、NADPH(美国Sigma公司)一起孵育,酶标仪检测412nm处的光密度(optical density,)OD值,Trx活性=TR(+)管OD值-TR(-)管OD值。
1.2.3颈动脉超声检查采用多功能彩色多普勒超声诊断仪检测双侧颈动脉内膜厚度。患者去枕平卧位,头后仰并偏向对侧,充分暴露其颈部,探头自颈动脉起始部逐节段探测两侧颈总动脉、颈动脉分叉部及颈内动脉,测量颈动脉内膜—中层厚度(IMT),以IMT<0.9mm诊断颈动脉正常,IMT≥0.9 mm诊断CAS。
1.2.4分组将所有研究对象分为T2DM组和正常组;此外,根据颈动脉超声检查结果将T2DM组按照是否合并CAS分为两个亚组:T2DM伴CAS组(CAS组)65例和T2DM不伴CAS组(NCAS组)95例。
1.3统计学方法
应用SPSS 13.0统计软件进行数据处理。正态数据用均数±标准差(±s)表示,非正态数据用中位数(四分位数间距)[M(Q25,Q75)]表示。两组间计量资料比较采用t检验或秩和检验,计数资料比较采用χ2检验。单因素相关分析采用Pearson或Spearman分析,多因素相关性分析采用多元线性逐步回归,危险因素筛查采用非条件一般Logistic回归分析。P<0.05为差异具有统计学意义。
2 结果
2.1T2DM组和正常组人口学资料和临床检验指标比较
与正常人比较,T2DM患者FPG、HbA1c、HOMA-IR、Trx、TXNIP水平较高,Trx活性下降(均P<0.05)。两组年龄、性别、BMI、SBP、DBP、TC、TG、HDL、LDL、Hcy差异无统计学意义(均P>0.05)。见表1。
表1 T2DM组和正常组人口学资料和临床检验指标比较结果(±s)
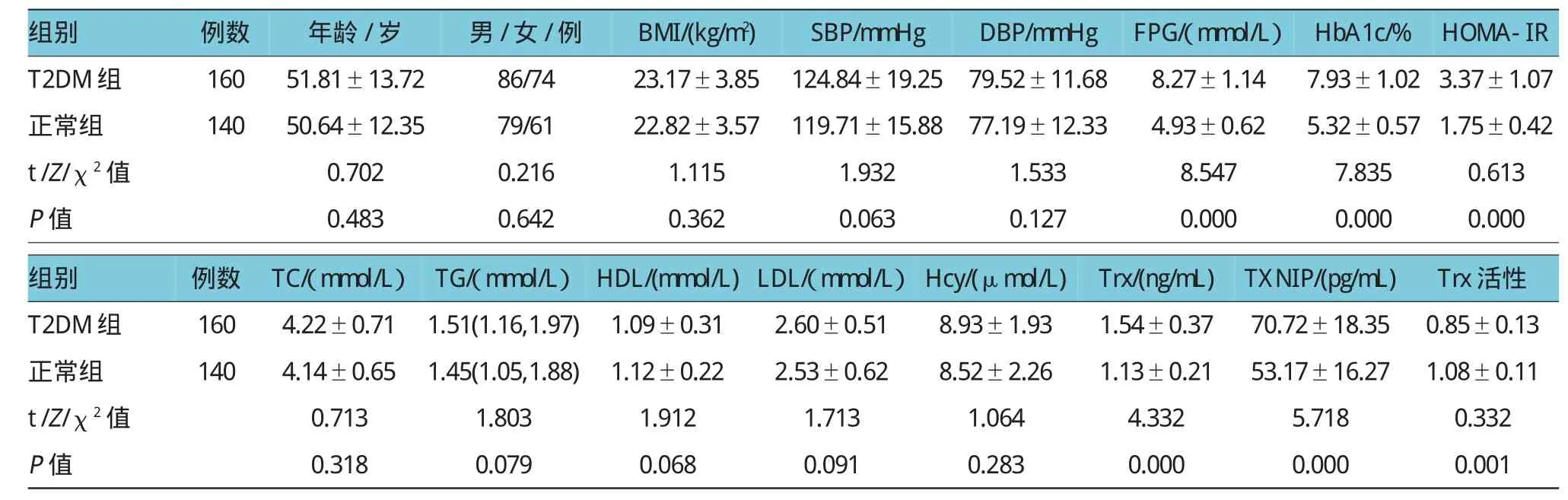
表1 T2DM组和正常组人口学资料和临床检验指标比较结果(±s)
组别例数年龄/岁男/女/例BMI/(kg/m2)SBP/mmHgDBP/mmHgFPG/(mmol/L)T2DM组16051.81±13.7286/7423.17±3.85124.84±19.2579.52±11.688.27±1.14正常组14050.64±12.3579/6122.82±3.57119.71±15.8877.19±12.334.93±0.62 t/Z/χ2值P值0.702 0.483 0.216 0.642 1.115 0.362 1.932 0.063 1.533 0.127 8.547 0.000 HbA1c/%HOMA-IR 7.93±1.02 3.37±1.07 5.32±0.57 1.75±0.42 7.8350.613 0.0000.000组别例数TC/(mmol/L)TG/(mmol/L)HDL/(mmol/L)LDL/(mmol/L)Hcy/(μmol/L)Trx/(ng/mL) T2DM组1604.22±0.711.51(1.16,1.97)1.09±0.312.60±0.518.93±1.931.54±0.37正常组1404.14±0.651.45(1.05,1.88)1.12±0.222.53±0.628.52±2.261.13±0.21 t/Z/χ2值P值0.713 0.318 1.803 0.079 1.912 0.068 1.713 0.091 1.064 0.283 4.332 0.000 TXNIP/(pg/mL)Trx活性70.72±18.350.85±0.13 53.17±16.271.08±0.11 5.7180.332 0.0000.001
2.2T2DM患者CAS组与NCAS组人口学资料和临床检验指标比较
与NCAS组比较,CAS组患者年龄较大,FPG、HbA1c、SBP、Trx、TXNIP水平较高,Trx活性下降(均P<0.05)。两组性别、BMI、DBP、HOMA-IR、TC、TG、HDL、LDL、Hcy差异无统计学意义(均P>0.05)。见表2。
2.3T2DM患者Trx、TXNIP含量及Trx活性与一般资料的相关性
单因素相关性分析发现,在T2DM患者中,Trx与HbA1c(r=0.363,P=0.007)、FPG(r=0.272,P= 0.032)呈正相关,TXNIP与HbA1c(r=0.525,P= 0.010)、HOMA-IR(r=0.193,P=0.022)呈正相关,Trx活性与TXNIP(r=-0.614,P=0.005)呈负相关。经多元线性逐步回归分析校正年龄、性别、BMI、SBP、DBP、FPG、HbA1c、HOMA-IR、TC、TG、HDL、LDL、Hcy、Trx、TXNIP、Trx活性的影响后,Trx与HbA1c(b=2.141,P=0.000)呈正相关,与FPG的相关性消失;TXNIP与HbA1c(b=2.513,P=0.001)、HOMA-IR(b=1.472,P=0.025)呈正相关;Trx活性与TXNIP呈负相关(b=-1.718,P=0.014)。见表3。
2.4T2DM患者颈动脉硬化危险因素Logistic回归分析
在T2DM患者中,以是否合并CAS为因变量,以年龄、性别、BMI、SBP、DBP、FPG、HbA1c、HOMA-IR、TC、TG、HDL、LDL、Hcy、Trx、TXNIP、Trx活性为自变量,经Logistic回归分析发现,T2DM患者年龄、HbA1c、Trx、TXNIP及Trx活性为CAS发生的影响因素,其中年龄(O∧R =1.134,P=0.032)、HbA1c(O∧R =1.275,P=0.021)、Trx(O∧R =1.532,P= 0.015)、TXNIP(O∧R=1.731,P=0.005)为CAS发生的危险因素,而Trx活性(O∧R =0.507,P=0.002)为CAS发生的保护因素。见表4。
表2 T2DM患者CAS组和NCAS组人口学资料和临床检验指标比较结果(±s)
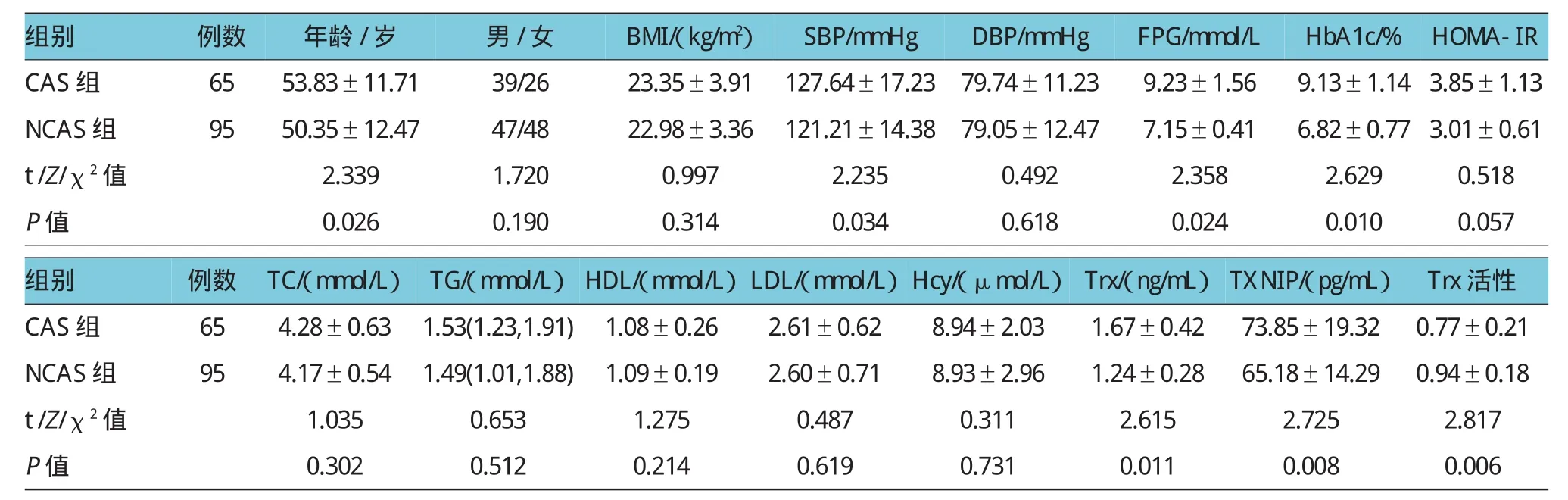
表2 T2DM患者CAS组和NCAS组人口学资料和临床检验指标比较结果(±s)
组别例数年龄/岁男/女BMI/(kg/m2)SBP/mmHgDBP/mmHgFPG/mmol/L CAS组6553.83±11.7139/2623.35±3.91127.64±17.2379.74±11.239.23±1.56 NCAS组9550.35±12.4747/4822.98±3.36121.21±14.3879.05±12.477.15±0.41 t/Z/χ2值P值2.339 0.026 1.720 0.190 0.997 0.314 2.235 0.034 0.492 0.618 2.358 0.024 HbA1c/%HOMA-IR 9.13±1.14 3.85±1.13 6.82±0.77 3.01±0.61 2.6290.518 0.0100.057组别例数TC/(mmol/L)TG/(mmol/L)HDL/(mmol/L)LDL/(mmol/L)Hcy/(μmol/L)Trx/(ng/mL)CAS组654.28±0.631.53(1.23,1.91)1.08±0.262.61±0.628.94±2.031.67±0.42 NCAS组954.17±0.541.49(1.01,1.88)1.09±0.192.60±0.718.93±2.961.24±0.28 t/Z/χ2值P值1.035 0.302 0.653 0.512 1.275 0.214 0.487 0.619 0.311 0.731 2.615 0.011 TXNIP/(pg/mL)Trx活性73.85±19.320.77±0.21 65.18±14.290.94±0.18 2.7252.817 0.0080.006
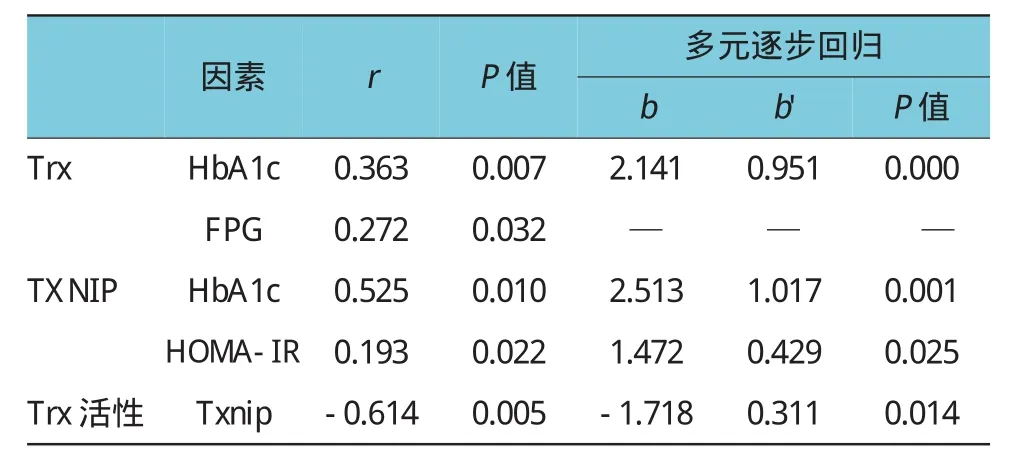
表3 Trx、TXNIP含量及Trx活性与T2DM患者一般资料的相关性
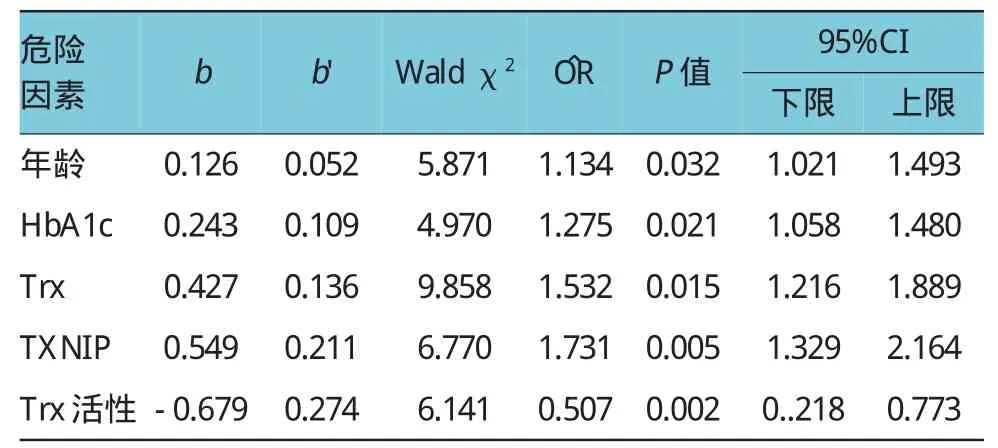
表4 T2DM患者CAS危险因素的Logistic回归分析
3 讨论
糖尿病患者常常合并多种心脑血管疾病的危险因素,是心脑血管疾病的高发人群。正如前言中所述,CAS不仅可以反映全身AS病变的情况,而且可以作为独立危险因素来预测糖尿病患者心脑血管疾病的发生风险[5]。早前UKPDS[6]研究报告指出部分新诊断的T2DM患者中已经出现不同程度的大血管并发症,而MOSTAZA[7]等人的研究也发现新诊断T2DM患者中CAS的发病率高达64.2%。因此明确CAS发病危险因素,寻找可能的治疗靶点,对于T2DM心脑血管疾病的预防至关重要。
Trx是一种广泛存在于原核、真核生物细胞中的小分子蛋白,它与Trx还原酶、NADPH共同构成了机体最重要的抗氧化应激系统,参与了细胞的氧化增殖、凋亡、基因表达以及机体的糖脂代谢、神经发育等过程[8]。研究发现[9]当机体存在氧化应激时,Trx从细胞中释放出来,血清或者血浆中Trx升高,是氧化应激的标志。本研究结果显示T2DM患者较正常人血清Trx水平增高,提示患者机体表现为氧化应激状态。糖尿病患者AS的发生与血糖、血脂升高以及高血压等有关,内皮细胞的炎症、凋亡以及黏附分子的表达均是AS的起始因素。作为机体内的还原系统,Trx可以通过与过氧化物还原酶的交互作用共同清除活性氧(reactive oxygen species,ROS),抑制ROS介导的细胞凋亡[10];Trx对于各种还原酶系统都有显著地调节作用,例如Trx可以上调超氧化物歧化酶(superoxide dismutase,SOD)的mRNA[11],间接活化SOD,从而抵抗体内的氧化应激。除了抗氧化的作用外,Trx可以调节一些凋亡转录因子与DNA结合的活性[12],如NF-kB、转录活化蛋白1(transcription factor AP-1,AP-1);Trx还能与凋亡信号激酶1(apoptosis signal-regulating kinase-1,ASK-1)结合,减少JNK和P38MAK通路的激活,从而抑制肿瘤坏死因子α(tumor necrosis factor α,TNFα)的诱导[13]。本研究结果显示T2DM伴CAS较不伴CAS患者血清Trx水平升高,说明T2DM伴CAS患者体内存在更多的氧化应激,此外Trx的升高可能起到一种代偿性保护作用。虽然T2DM及T2DM伴CAS患者血清Trx水平升高,但是本研究显示两组人群Trx的活性均是降低的,并且与TXNIP水平呈负相关。NISHIYAMA等[14]发现TXNIP可以与Trx结合,使Trx还原活性明显降低,而T2DM患者血清TXNIP水平明显升高,因此T2DM患者血清Trx活性降低可能是TXNIP过表达所致。
TXNIP称为维生素D3上调蛋白(vitamin D-upregulated protein 1,VDU P-1),最早在1,25-二羟维生素D3处理的HL-6细胞中发现。它可以与Trx结合来抑制其表达和活性,故又称为硫氧还蛋白结合蛋白[14]。研究表明高糖可以通过与TXNIP基因启动子上的碳水化合物应答元件(carbohydrate response element,ChRE)结合来上调TXNIP的表达,此外低氧、氧化应激也可以促进其表达增加[15]。T2DM本身表现为血糖升高,且伴有高糖刺激产生的一系列氧化应激,因此有研究发现糖尿病动物模型[16]及患者[17]TXNIP水平均升高,而本研究也得出了同样的结论。近来,一些证据表明糖尿病肾病[18]、视网膜病变[19]可能与TXNIP表达的上调密切相关,本研究结果显示T2DM伴CAS患者较不伴CAS患者血清TXNIP水平明显升高,并且TXNIP是CAS发生的危险因素,提示TXNIP可能参与了T2DM血管病变的发生,但是其确切的机制仍不明确。研究表明TXNIP表达上调与内皮细胞功能障碍密切相关[20-21],不稳定的血流可以作用于内皮细胞,引起TXNIP表达上调,通过TXNIP/Trx/ASK1通路引起内皮细胞炎症以及细胞间黏附分子(intercellular adhesion molecular,ICAM)和血管细胞黏附分子(vascular cell adhesion molecule,VACM)的增加,而沉默TXNIP基因可以抑制TNFα介导的ICAM和VACM表达的升高[20];TXNIP还可以作为转录抑制子抑制内皮细胞抗炎因子KLF2的表达[22]。此外,有证据表明TXNIP过表达可以直接导致糖尿病性血管新生功能障碍,研究[23]发现沉默TXNIP基因可以改善高糖诱导的内皮细胞迁移障碍和血管形成受损,恢复血管内皮生长因子(vascular endothelial growth factor,VEGF)的产生及其促进血管新生的能力,并且阻止高糖引起的内皮细胞一氧化氮水平的下降和eNOS的解耦联作用[24]。由此可见,TXNIP在血管性病变的进程中扮演着重要角色。
综上所述,血清Trx、TXNIP、Trx活性在新诊断T2DM患者CAS的发生及发展过程中可能起着重要的作用,这为T2DM患者血管并发症的预防和治疗提供了新的线索。由于本研究属于回顾性研究,样本量有限,且参与CAS的因素较多,因此,对于上述Trx系统与T2DM合并CAS是否存在因果关系及是否可以通过干预Trx系统来抑制或者缓解CAS的发生还有待大样本前瞻性试验来进一步明确。
[1]DORMANDY J A,CHARBONNEL B,ECKLAND D J A,et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive study(PROspective pioglitAzone clinical trial in macroVascular events):a randomised controlled trial[J].The Lancet,2005,366(9493):1279-1289.
[2]WACKERS F J,YOUNG L H,INZUCCHI S E,et al.Detection of silent myocardial ischemia in asymptomatic diabetic subjects: the DIAD study[J].Diabetes care,2004,27(8):1954-1961.
[3]MANCINI G B J,DAHLÖF B,DÍEZ J.Surrogate markers for cardiovascular disease structural markers[J].Circulation,2004, 109(25 suppl 1):IV-22-IV-30.
[4]YOSHIHARA E,MASAKI S,MATSUO Y,et al.Thioredoxin/Txnip:redoxisome,as a redox switch for the pathogenesis of diseases[J].Frontiers in immunology,2013,4(514):5141-5149.
[5]KIM C S,KIM H J,WON YJ,et al.Normative values of carotid artery intima-media thickness in healthy Korean adults and estimation of macrovascular diseases relative risk using this data in type 2 diabetes patients[J].Diabetes research and clinical practice,2006,72(2):183-189.
[6]UKProspectiveDiabetesStudy(UKPDS)Group.Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33)[J].The Lancet,1998,352 (9131):837-853.
[7]MOSTAZA JM,LAHOZ C,SALINERO-FORT M A,et al. Carotid atherosclerosis severity in relation to glycemic status:A cross-sectional population study[J].Atherosclerosis,2015,242(2): 377-382.
[8]BUTLER L M,ZHOU X,XU W S,et al.The histone deacetylase inhibitor SAHAarrests cancer cellgrowth,up-regulates thioredoxin-binding protein-2,and down-regulates thioredoxin[J]. Proceedings of the National Academy of Sciences,2002,99(18): 11700-11705.
[9]BURKE-GAFFNEYA,CALLISTER M E J,NAKAMURA H. Thioredoxin:friend or foe in human disease[J].Trends in pharmacological sciences,2005,26(8):398-404.
[10]RHEE S G,CHAE H Z,KIM K.Peroxiredoxins:a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling[J].Free Radical Biology and Medicine,2005,38(12):1543-1552.
[11]DAS K C,LEWIS-MOLOCK Y,WHITE C W.Elevation of manganese superoxide dismutase gene expression by thioredoxin[J]. American journalof respiratory celland molecular biology, 1997,17(6):713-726.
[12]POWIS G,MUSTACICH D,COON A.The role of the redox protein thioredoxin in cell growth and cancer[J].Free Radical Biology and Medicine,2000,29(3):312-322.
[13]MANOHARAN R,SEONG H A,HA H.Thioredoxin inhibits MPK38-induced ASK1,TGF-β,and p53 function in a phosphorylation-dependentmanner[J].Free RadicalBiologyand Medicine,2013,2013(63):313-324.
[14]NISHIYAMA A,MATSUI M,IWATA S,et al.Identification of thioredoxin-binding protein-2/vitamin D3 up-regulated protein 1 as a negative regulator of thioredoxin function and expression[J]. Journal of Biological Chemistry,1999,274(31):21645-21650.
[15]CHONG C R,CHAN W P A,NGUYEN T H,et al.Thioredoxin-interacting protein:pathophysiology and emerging pharmacotherapeutics in cardiovascular disease and diabetes[J].Cardiovascular Drugs and Therapy,2014,28(4):347-360.
[16]PARIKH H,CARLSSON E,CHUTKOW W A,et al.TXNIP regulates peripheral glucose metabolism in humans[J].PLoS Med, 2007,4(5):e158.
[17]ZHAO Y,LI X,TANG S.Retrospective analysis of the relationship between elevated plasma levels of TXNIP and carotid intima-media thickness in subjects with impaired glucose tolerance and early Type 2 diabetes mellitus[J].Diabetes Research and Clinical Practice,2015,109(2):372-377.
[18]TAN C Y R,WEIER Q,ZHANG Y,et al.Thioredoxin-Interacting Protein:A Potential Therapeutic Target for Treatment of Progressive Fibrosis in Diabetic Nephropathy[J].Nephron,2015, 129(2):109-127.
[19]SINGHLP.Thioredoxin interacting protein(TXNIP)and pathogenesis of diabetic retinopathy[J].Journal of clinical& experimental ophthalmology,2013,2013(4):1-29.
[20]YAMAWAKI H,PAN S,LEE R T,et al.Fluid shear stress inhibits vascular inflammation by decreasing thioredoxin-interacting protein in endothelial cells[J].J Clin Invest,2005,115 (3):733-738.
[21]WONGEAKIN N,BHATTARAKOSOL P,PATUMRAJ S.Molecular mechanisms of curcumin on diabetes-induced endothelial dysfunctions:TXNIP,ICAM-1,and NOX2 expressions[J].Bio Med Research International,2014,2014(2014):1-10.
[22]WANG X Q,NIGRO P,FUJIWARA K,et al.Thioredoxin interacting protein promotes endothelial cell inflammation in response to disturbed flow by increasing leukocyte adhesion and repressing Kruppel-like factor 2[J].Circulation research,2012, 110(4):560-568.
[23]DUNN L L,SIMPSON P J L,PROSSER H C,et al.A critical role for thioredoxin-interacting protein in diabetes-related impairment of angiogenesis[J].Diabetes,2014,63(2):675-687.
[24]NG M K C,WU J,CHANG E,et al.A central role for nicotinic cholinergic regulation of growth factor–induced endothelial cell migration[J].Arteriosclerosis,thrombosis,and vascular biology,2007,27(1):106-112.
(张蕾编辑)
Association of serum thioredoxin and thioredoxin-interacting protein with carotid atherosclerosis in newly-diagnosed type 2 diabetic patients
Hong-rui Zhang1,Hui Fang2,Chun-mei Liu1,Yi-qunZhao1,Chun-xiaLi1, Gu-yueZhang2,Dan-danZhang2,Lei Zhou2,HeZhang2
(1.Tangshan People's Hospital,Tangshan,Hebei 063000,China;2.Tangshan Gongren Hospital,Tangshan,Hebei 063000,China)
Objective To investigate the association of serum thioredoxin(Trx)and thioredoxin-interacting protein(TXNIP)with carotid atherosclerosis(CAS)in newly-diagnosed type 2 diabetic patients.Methods Totally 160 patients newly diagnosed as T2DM in the Department of Endocrinology of Tangshan Gongren Hospital were recruited and divided into two groups according to the result of carotid artery ultrasonography,i.e.T2DM with CAS group(CAS group,65 cases)and T2DM without CAS group(NCAS group,95 cases).During the same period,140 healthy controls without T2DM from the Medical Examination Center were recruited.Data including age,sex,BMI,systolicblood pressure(SBP),diastolic blood pressure(DBP),fasting plasma glucose(FPG),insulin(FINS),glycosylated hemoglobin A1c(HbA1c),total cholesterol(TC),triglyceride(TG),low-density lipoprotein(LDL),high-density lipoprotein(HDL)and homocysteine(Hcy)were collected.The homeostasis model assessment for insulin resistance(HOMA-IR)was calculated by FPG(mmol/L)×FINS(mU/L)/22.5.Serum Trx and TXNIP were measured by enzymelinked immunosorbent assay(ELISA),and Trx activity was measured by insulin reduction assay.Results Compared with the normal controls,FPG,HbA1c,HOMA-IR,Trx and TXNIP levels in the T2DM patients increased,but Trx activity decreased(allP <0.05).Compared with the NCAS group,the patients in the CAS group were older,with higher FPG,HbA1c,SBP,Trx and TXNIP levels and lower Trx activity(allP <0.05).In the T2DM patients,Trx was positively correlated with HbA1c;TXNIP was positively correlated with HbA1c and HOMA-IR,but inversely correlated with Trx activity(allP <0.05).In the T2DM patients,age,HbA1c,Trx,TXNIP and Trx activity were the influence factors of CAS.Age(O∧R =1.134,P=0.032),HbA1c(O∧R =1.275,P =0.021),Trx(O∧R =1.532,P = 0.015)and TXNIP(O∧R=1.731,P =0.005)increased the incidence of CAS,but Trx activity(O∧R =0.507,P = 0.002)was a protective factor for CAS.Conclusions Serum Trx,TXNIP and Trx activity are closely correlated with carotid atherosclerosis in newly-diagnosed type 2 diabetic patients,suggesting that Trx system may be involved in occurrence and development of carotid atherosclerosis of these patients.
newly-diagnosed type 2 diabetes;thioredoxin;thioredoxin-interacting protein;thioredoxin activity;carotid atherosclerosis
R 587.1
A
10.3969/j.issn.1005-8982.2016.18.010
1005-8982(2016)18-0049-06
2016-01-12
房辉,E-mail:fanghui@medmail.com.cn
