鲱鱼精dsDNA和联苯胺相互作用的光谱分析
2016-10-21马明明
马明明,张 彦,赵 强
西安工程大学环境与化学工程学院,陕西西安 710048

鲱鱼精dsDNA和联苯胺相互作用的光谱分析
马明明,张彦,赵强
西安工程大学环境与化学工程学院,陕西西安 710048
在pH值为 7.38的磷酸盐缓冲溶液(phosphate buffer saline,PBS)中,采用荧光光谱和紫外-可见吸收光谱,考察联苯胺(benzidine,BZ)与鲱鱼精双链脱氧核糖核酸(double-stranded deoxyribonucleic acid, dsDNA)的相互作用机制,运用离子强度验证结合体系(BZ-dsDNA)荧光光谱的影响和DNA熔点变化两种方法的结合模式.结果表明,BZ以嵌插方式与鲱鱼精dsDNA结合,结合作用力主要是氢键和范德华力,结合反应为自发过程.实验还发现,当dsDNA质量浓度为8.00×10-6~48.00×10-6g/L时,BZ荧光强度F0和结合体系BZ-dsDNA荧光强度F的比值(F0/F )与dsDNA质量浓度呈线性关系,dsDNA的检测限为2.00×10-6g/L,且其测定不受常见共存金属离子和抗坏血酸等的干扰.因此,基于BZ与dsDNA作用的荧光光谱建立的检测dsDNA的新方法,可用于检测实验室废水中的dsDNA,平均回收率在98.00%~103.00%.
分光光度法;荧光光谱;紫外可见吸收光谱;联苯胺;鲱鱼精双链脱氧核糖核酸;嵌插; 脱氧核糖核酸熔点
联苯胺(benzidine, BZ),又名4, 4-二氨基联苯,通常用作直接染料和酸性染料合成工业的中间体产品[1].BZ能够直接穿透细胞膜导致DNA损伤[2],从而诱发膀胱癌、肝癌、肾癌和胆管癌等多种癌症[3-4],BZ已被国际癌症研究机构(International Agency for Research on Cancer, IARC)认定为第1类致癌物.由于致癌性小分子与脱氧核糖核酸(deoxyribonucleic acid,DNA)的结合作用是DNA损伤反应和变异过程中关键的一步[5],因此,采取哪种化学方法简便研究BZ与DNA的结合机理,对预防和治疗癌症具有重要的现实意义.已有文献报道用极谱法[6]、圆二色光谱结合分子模拟技术[7]和电泳法[8]研究BZ与DNA的结合机制.以上方法各有优势,但也存在不足.极谱法由于采用汞电极作工作电极,易对环境和人体造成损害,因此,其应用受到限制;圆二色光谱实验成本高,操作程序复杂,不易推广;电泳法侧重研究BZ对DNA构象的影响,并没有研究两者结合的热力学机制,因此,开发简便、物美价廉的研究热力学机制的分析方法显得非常必要.荧光光谱和紫外-可见吸收光谱法操作简便、灵敏准确[8], 且测试成本低,因此,经常被用于研究小分子与DNA的作用[9].本研究应用荧光光谱和紫外吸收-可见光谱法研究了BZ与鲱鱼精双链脱氧核糖核酸(double-stranded DNA, dsDNA)相互结合机制,并借助鲱鱼精dsDNA对BZ荧光强度的猝灭建立了检测鲱鱼精dsDNA的荧光光谱新方法.
1 实 验
1.1仪器与试剂
RF-5301PC荧光分光光度计和UV-2450紫外分光光度计(日本岛津);H-60三用恒温水浴箱(国华化学仪器).联苯胺(天津市科密欧化学试剂有限公司,分析纯);鲱鱼精dsDNA (分析纯, Sigma 公司),浓度由紫外光谱260 nm处的光密度换算得到(ε=6 600 L/(mol·cm)),储备液冰箱保存备用;其他试剂均为分析纯,实验用水为二次蒸馏水.
1.2实验方法
1.2.1荧光光谱法
在一系列25 mL比色管中,分别加入2.5 mL 5.50×10-4mol/L的BZ溶液、2.0 mL pH=7.38的PBS以及一定量的dsDNA溶液,用二次蒸馏水稀释至比色管刻度,在恒温水浴箱中放置10 min测定混合溶液的荧光发射光谱,记录荧光发射峰波长.激发波长为275.00 nm,扫描范围为320.00~500.00 nm,荧光的激发和发射光谱扫描狭缝宽度均为5.00 nm.
1.2.2熔点实验
将配制好的dsDNA溶液和BZ-dsDNA混合液置于恒温水浴槽中,在30~100 ℃内,每隔5 ℃,以二次蒸馏水为参比溶液,扫描190.00~400.00 nm波长范围的dsDNA和BZ-dsDNA体系的紫外可见吸收光谱,记录最大吸收波长处的光密度.
2 结果与讨论
2.1BZ和BZ-dsDNA的荧光光谱
考察了BZ和BZ-dsDNA在HAc-NaAc、Britton-Robinson和PBS等缓冲溶液中的荧光光谱.结果显示,BZ和BZ-dsDNA在PBS中荧光光谱曲线峰型最好,两者荧光强度差最大.因此,本研究以PBS为缓冲溶液,考察了PBS 在pH值为6.64~7.73时,对BZ和BZ-dsDNA体系荧光光谱曲线峰强度的影响.结果发现,当PBS的pH=7.38时,两种体系的荧光光谱强度差最大,表明BZ与dsDNA的作用最强,因此,本研究选择pH=7.38的PBS作为缓冲溶液.图1是BZ和BZ-dsDNA体系在温度为298 K、dsDNA质量浓度为0.00~120.00×10-6g/L时的荧光光谱曲线.
如图1所示, 浓度为5.50×10-5mol/L的BZ在397.00 nm处有一荧光峰,荧光强度为900.13;加入8.00×10-6g/L的dsDNA后, 发射波长为396.78 nm, 荧光强度降为849.98;继续增加dsDNA质量浓度,BZ-dsDNA体系荧光强度不仅逐渐降低,而且发射波长也逐步紫移,说明dsDNA与BZ以非共价键形式结合为复合物,使BZ的荧光发生猝灭.
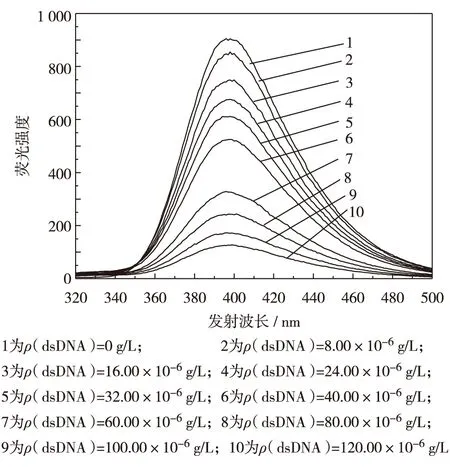
图1 加入不同质量浓度dsDNA 的联苯胺荧光光谱曲线(T=298 K, c(BZ)=5.50×10-5 mol/L)Fig.1 Fluorescence spectra of BZ in the presence of dsDNA with different mass concentrations
荧光猝灭机制分为动态猝灭、静态猝灭或动-静混合猝灭3种.对动态猝灭,遵循Stern-Volme方程[10-12]:
F0/F=1+Kqτ0ρ(Q)=1+KSVρ(Q)
(1)
其中, F0是荧光小分子的荧光强度; F为加入大分子后结合体系的荧光强度; Kq是猝灭速率常数; τ0是无猝灭剂时荧光小分子的平均寿命; KSV是动力学猝灭常数; ρ(Q)是猝灭剂的质量浓度.
动态猝灭与温度有关,表现为温度越高,猝灭常数越大.静态猝灭则为大分子猝灭剂使荧光小分子的荧光强度下降.考察了温度在298~323 K时,BZ和BZ-dsDNA体系的荧光光谱,由此计算出相应温度的Stern-Volmer方程,结果见表1.其中, τ0=1×10-8s.由表1可知,随温度增加, KSV没有明显的变化,因此猝灭机制不是动态猝灭,有可能是静态猝灭;从表1中进一步发现不同温度下的Kq均大于生物大分子的最大动态扩散猝灭常数2.0×1010L/(mol·s),因此,dsDNA引起的BZ荧光猝灭机制是静态猝灭.
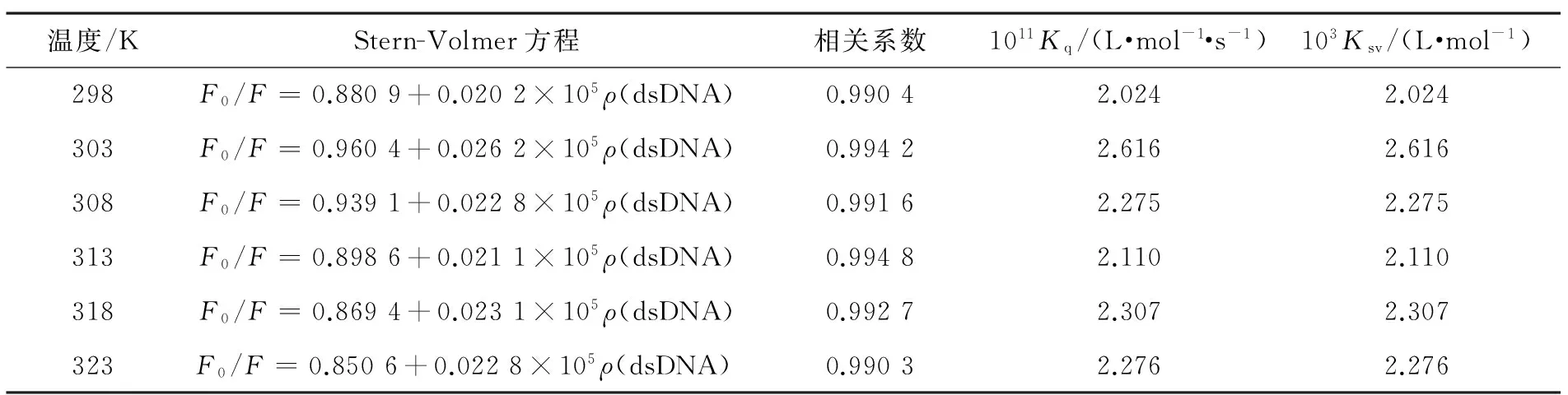
表1 不同温度下 BZ-dsDNA的 Stern-Volmer方程
当结合体系为静态猝灭机制时,满足方程[13-15],
lg[(F0-F)/F]=lgKA+nlgρ(Q)
(2)
其中, KA是猝灭剂与荧光性小分子的结合常数; n是猝灭剂与每个小分子的结合位点数.表2是不同温度下BZ-dsDNA体系的静态猝灭方程.
从表2可以发现,BZ-dsDNA结合位点约为1,但结合常数KA对温度变化比较敏感:在298~308 K内, KA随着温度升高而减小,说明这一温度范围内,温度越高,dsDNA与BZ的结合作用越弱;在308~318 K, KA随着温度升高迅速增加,表明此温度范围内,温度越高,BZ和 dsDNA的结合力越大;但超过318 K, KA快速下降,说明过高的温度下dsDNA与BZ之间的结合反而会变弱.因此温度对结合常数KA的影响可能与dsDNA对温度有较强的敏感性有关.
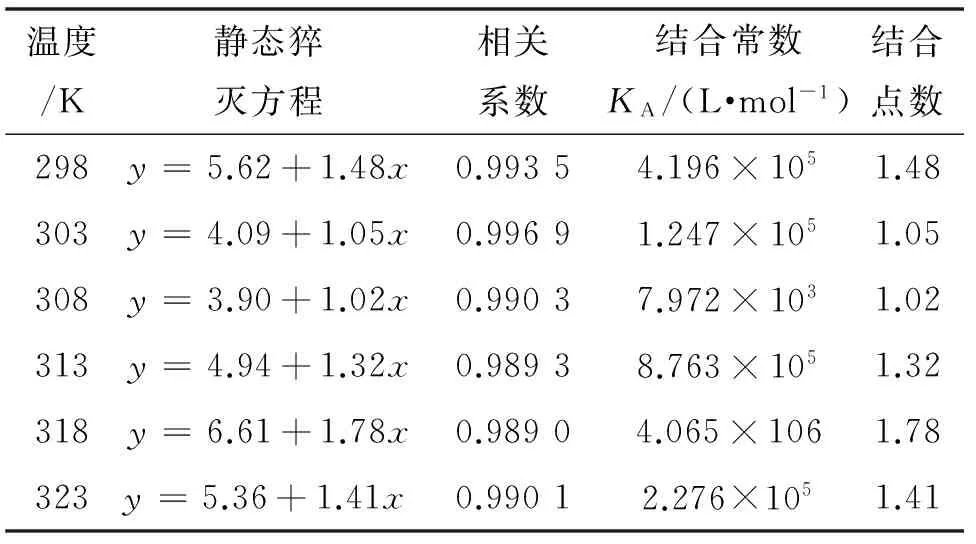
表2 BZ-dsDNA不同温度下的静态猝灭方程1)
1)方程中y代表lg[(F0-F)/F]; x代表lg[ρ(dsDNA)];每个温度实验平行测定5次.
2.2热力学参数的测定
小分子和生物大分子之间的非共价键作用力类型有疏水力、氢键作用、范德华力和静电库仑引力等.其区别主要取决于结合作用的热力学参数焓变(ΔHθ)和熵变(ΔSθ)的正负.通常,当ΔH>0,ΔS>0, 结合作用力主要是疏水作用力;当ΔH<0,ΔS<0, 主要是氢键和范德华力起作用; 当ΔH<0,ΔS>0, 静电库仑引力起主要作用[16-18].一般情况下,温度变化不大,ΔHθ可以看作是一个常量,其值和ΔSθ可用范特霍夫方程[19]确定为
lnKA=-ΔHθ/(RT)+C
(3)
其中, KA是在相应温度下的结合常数; R为气体常数; C为常数.取温度为298、303和308 K,可求得ΔHθ=-3.020×105J/mol, 由ΔGθ=-RTlnKA,ΔGθ=ΔHθ-TΔSθ,可求得不同温度下的ΔGθ和ΔSθ. 结果见表3.分析表3可知,不同温度下的ΔGθ均小于0,说明BZ与 dsDNA结合属于自发反应.由于ΔHθ和ΔSθ均小于0,因此,BZ与 dsDNA主要以氢键和范德华力结合.
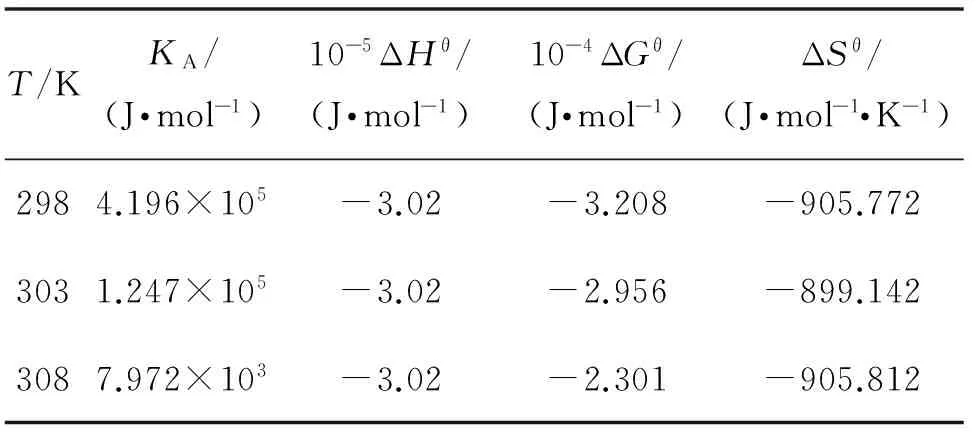
表3 BZ-dsDNA不同温度下的热力学参数
2.3BZ与dsDNA的结合模式
2.3.1BZ-dsDNA的紫外-可见吸收光谱
小分子与DNA的结合模式有嵌插、沟槽和表面结合[7].紫外-可见吸收光谱可被用来判断两者的结合模式.若结合体系与荧光小分子的紫外-可见吸收光谱相比发生红移减色效应,则小分子和DNA以嵌插方式结合[20-22].固定BZ浓度,加入不同质量浓度的dsDNA,考察BZ紫外光谱曲线的变化.图2是dsDNA质量浓度在0~40.00×10-6g/L内,BZ-dsDNA的紫外光谱曲线.如图2所示,随dsDNA质量浓度增加,BZ的最大紫外可见吸收波长由260 nm逐渐红移到300 nm附近,且光密度逐渐下降,为显著的红移减色效应.根据上述理论推断,BZ与dsDNA应以嵌插方式结合.这种结合模式与BZ的双苯环强共面性结构有关.BZ化学结构式如图3所示,两个—NH2非常对称,两个苯环的共平面性良好.由于BZ的良好共平面型结构,BZ易以嵌插方式进入DNA双螺旋相邻碱基对,进而导致DNA损伤[2].
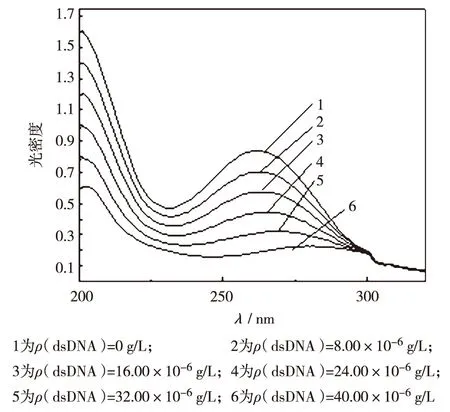
图2 不同质量浓度dsDNA存在下的联苯胺紫外可见光谱曲线(T=298 K, c(BZ) = 5.50×10-5 mol/L)Fig.2 UV-vis spectra of BZ in the presence of dsDNA with different mass concentrations
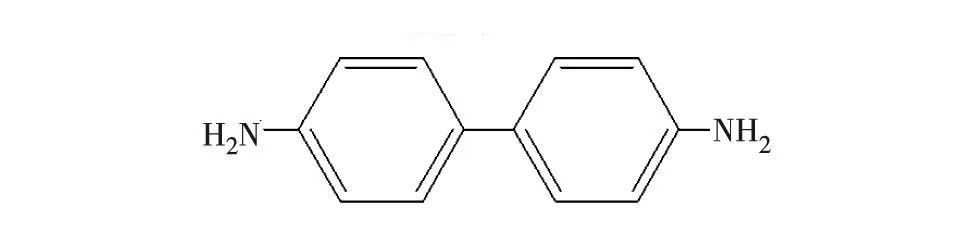
图3 联苯胺结构式Fig.3 Structural of benzidine
2.3.2离子强度实验
DNA是阴离子聚电解质,溶液离子强度的变化对小分子荧光光谱的影响可以说明小分子与DNA之间的作用模式.小分子与DNA若为嵌插式结合,由于碱基对的保护作用,溶液性质的变化对小分子的影响很小.若小分子以沟槽方式与DNA结合,小分子只存在于DNA的碱基对边缘,结合的小分子大部分会暴露在溶液中,随着离子强度的增加,部分小分子将会从DNA的沟槽中脱离出来,导致荧光光谱发生较大变化[23].
NaCl通常被用来调控溶液的离子强度.图4是NaCl浓度在0~0.1 mol/L内,BZ和BZ-dsDNA两个体系的荧光强度变化曲线.由图4可以观察到,随NaCl浓度增加, BZ-dsDNA体系的荧光强度基本不变,说明溶液离子强度的变化不影响体系的荧光光谱.为进一步说明NaCl浓度与BZ-dsDNA体系荧光强度的关系,实验还考察了NaCl浓度高于0.1 mol/L时, BZ-dsDNA体系的荧光强度变化.结果发现,增加NaCl浓度,BZ-dsDNA体系的荧光强度不变.这表明BZ与dsDNA不是沟槽结合.如果BZ与dsDNA是静电结合,由于Na+能与DNA的磷酸骨架以静电引力结合,会削弱BZ与dsDNA之间的静电结合,从而导致BZ-dsDNA体系荧光强度变化,这与实验现象不符,因此,BZ与dsDNA也不可能是静电结合.综上所述,BZ与dsDNA只能是嵌插式结合,这与紫外可见吸收光谱实验的结果一致.
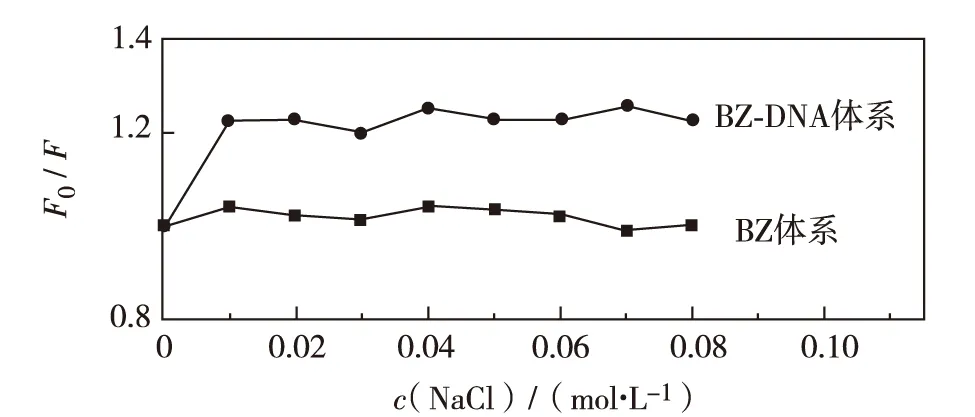
图4 氯化钠浓度对两体系荧光强度比的影响(T=298 K, c(BZ) = 5.50×10-5 mol/L,ρ(dsDNA) =12.00×10-6 g/L)Fig.4 The effect of NaCl concentrations on fluorescence intensity ratio of two systems
2.3.3DNA熔点实验
DNA在高温条件下其双螺旋结构会发生裂解,DNA的双螺旋结构解旋一半时的温度称为DNA的熔点,用tm表示.DNA的熔点受其与小分子作用方式的影响较大,如果两者为嵌插结合,这种作用方式会使得DNA双螺旋结构变得更加稳定[24],其熔点能增加5~8 ℃,而沟槽结合或静电结合则对DNA的熔点基本没影响.图5是鲱鱼精dsDNA在有无BZ时的的熔点曲线,温度为t时的光密度D(260)和20 ℃时的光密度D(260)的比值记作B. 由图5可得出鲱鱼精dsDNA的tm为(73.5±1)℃,加入BZ后,BZ-dsDNA体系的tm为(79.0±1)℃, 比纯DNA升高了5.5 ℃,因此BZ与dsDNA的结合方式为嵌插作用,与离子强度、紫外吸收光谱的结论一致.

图5 dsDNA在有无联苯胺添加时的熔点曲线(c(BZ)=5.50×10-5 mol/L, ρ(dsDNA)=12.00×10-6 g/L)Fig.5 Melting curves of dsDNA in the presence and absence of BZ
2.4分析应用
2.4.1标准曲线和检测限
按照荧光光谱实验方法,在c(BZ)=5.50×10-5mol/L的PBS 缓冲溶液(pH=7.34)中,加入不同质量浓度的dsDNA,在8.00×10-6~48.00×10-6g/L内F0/F与ρ(dsDNA) 呈正相关,线性方程为: F0/F=0.020 2×105ρ(dsDNA)+0.880 9 (n=7,r=0.990 4), 检测限为2.00×10-6g/L.
2.4.2方法选择性
试验了可能共存的金属离子、抗坏血酸对8.00×10-6g/L dsDNA 的F0/F测定结果影响,结果见表4.如表4所示,在±5%的误差范围内,质量浓度分别是dsDNA 50倍的Mg2+、130倍B2+、80倍Al3+、130倍抗坏血酸和270倍NH4+不干扰测定.说明本方法具有良好的选择性.
2.4.3样品检测
收集含有 Ba2+、Ca2+、NH4+和抗坏血酸的实验室废水检测,未检出dsDNA,采用加标法测试. 结果见表5.由表5可见,样品平均回收率在98.00%~103.00%,因此,该方法可用于dsDNA的检测.

表4 干扰倍数
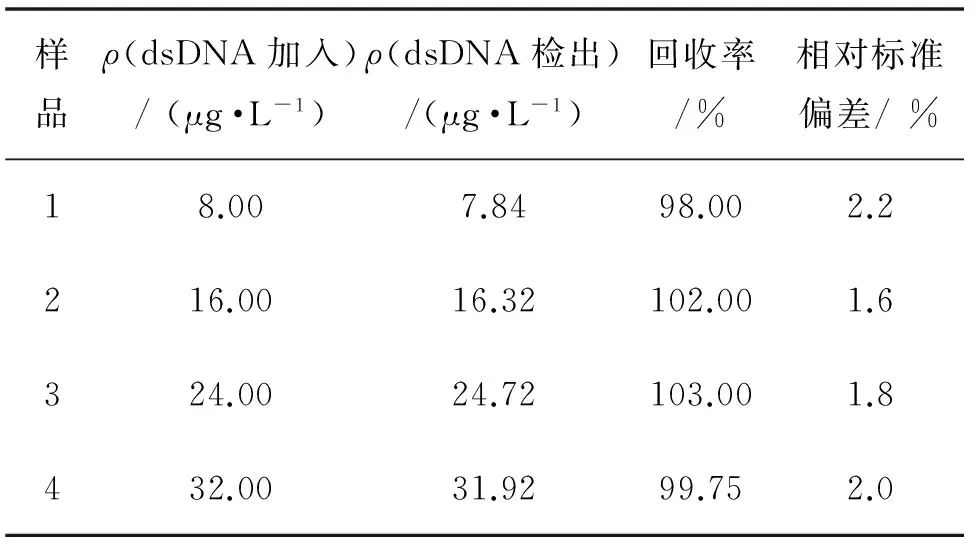
表5 样品分析结果(n=6)
结 语
联苯胺BZ和鲱鱼精dsDNA在pH =7.38的PBS中,以嵌插模式通过范德华力和氢键相互结合.两者结合常数与温度密切相关:在298~308 K,温度增加,结合常数下降.基于dsDNA与BZ的结合作用导致BZ荧光强度猝灭,建立了荧光光谱检测 dsDNA的新方法,该方法简便快捷,成本低廉.
致谢:感谢西安工程大学环境与化工学院测试中心的各位老师!
/
[1] Choudhary G. Human health perspectives on environmental exposure to benzidine: a review[J]. Chemosphere,1996,32(2):267-291.
[2] 王连生.有机污染物化学[M]. 北京: 高等教育出版社, 2004.
Wang Liansheng. Chemistry of organic pollution[M]. Beijing: Higher Education Press, 2004.(in Chinese)
[3] Hein D W. Acetylator genotype and arylamine-induced carcinogenesis[J]. Biophys Acta, 1988,948(1): 37-66.
[4] Vineis P. Genetically based N-acetyltransferase metabolic polymorphism and low-level environmental exposure to carcinogens[J]. Nature, 1994, 369(6476) :154-156.
[5] Wang Lirong, Qu Na, Guo Lianghong. An electrochemical displacement method for the investigation on the binding interaction of polycyclic organic compounds with DNA[J]. Analytical Chemistry, 2008, 80(10):3910-3914.
[6] 王瑞侠,王丽荣,葛俊彦,等. 联苯胺与 DNA 相互作用的电化学研究及应用[J].武汉大学学报理学版,2007,53(4): 421-425.
Wang Ruixia, Wang Lirong, Ge Junyan, et al. Voltammetric studies of the interaction of benzidine with DNA and its application[J]. Journal of Wuhan University Natural Science Edition, 2007,53(4): 421-425.(in Chinese)
[7] Amutha R, Subramanian V, Nair B U. Interaction of benzidine with DNA: experimental and modeling studies[J]. Chemical Physics Letters, 2001, 344(1/2): 40-48.
[8] 刘辉,刘伟民,周培疆. 联苯胺对鲫鱼肝线粒体DNA(mtDNA)作用的研究[J].环境科学与技术, 2011,34(8):18-21.
Liu Hui, Liu Weimin, Zhou Peijiang. MtDNA of crucian’s liver by benzidine[J]. Environmental Science & Technology, 2011,34(8):18-21.(in Chinese)
[9] Guo Yujing, Chao Jinchao, Pan Jinghao. Study on the interaction of 5-pyridine-10,15,20-tris-(p-chlorophenyl) porphyrin with cyclodextrins and DNA by spectroscopy[J]. Spectrochimica Acta A, 2007, 68(2): 231-236.
[10] Tyagi G, Charak S, Mehrotra R. Binding of an indole alkaloid, vinblastine to double stranded DNA: a spectroscopic insight in to nature and strength of interaction[J]. Journal of Photochemistry and Photobiology B: Biology, 2012, 108(6): 48-52.
[11] Kashanian S, Khodaei M M, Roshanfekr H, et al. DNA binding, DNA cleavage and cytotoxicity studies of a new water soluble copper(II) complex: the effect of ligand shape on the mode of binding[J]. Spectrochim Acta A, 2012, 86(86): 351-359.
[12] Lu Yan, Lv(Lyu) Juan, Zhang Guisheng, et al. Interaction of an anthracycline disaccharide with ctDNA: investigation by spectroscopic technique and modeling studies[J]. Spectrochim Acta A, 2010, 75: 1511-1515.
[13] Zhang Yezhong, Zhou Bo, Zhang Xiaoping, et al. Interaction of malachite green with bovine serum albumin:determination of the binding mechanism and binding site by spectroscopic methods[J]. Journal of Hazardous Materials, 2009, 163(2/3): 1345-1352.
[14] Wang Yanqing, Zhang Hongmei, Zhang Gencheng, et al. Spectroscopic studies on the interaction between silicotungstic acid and bovine serum albumin[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 43(5):1869-1875.
[15] Xiao Jianbo, Shi Jian, Cao Hui, et al. Analysis of binding interaction between puerarin and bovine serum albumin by multi-spectroscopic method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 45(4): 609-615.
[16] Shakir M, Azam M, Parveen S, et al. Synthesis and spectroscopic studies on complexes of N′-bis-(2- pyridinecarboxaldimine)-1,8-diaminonaphthalene (L); D A binding studies on Cu(U) complex[J]. Spectrochimica Acta, 2009, 71(5) : 1851-1856.
[17] Yuan Jianglan, Liu Hui, Kang Xu, et al. Characteristics of the isomeric flavonoids apigenin and genistein binding to hemoglobin by spectroscopic methods[J]. Journal of Molecular Structure, 2008, 891(1/2/3): 333-339.
[18] Ross P D, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11) : 3096-3102.
[19] Zhang Guowen, Zhang Yepeng, Zhang Yue, et al. Spectroscopic studies of cyanazine binding to calf thymus DNA with the use of ethidium bromide as a probe[J]. Sensors and Actuators B: Chemical, 2013, 182(3): 453-460.
[20] Long E C, Barton J K. On demonstrating DNA intercalation[J]. Accounts Chemical Research, 1990, 23(9):271-273.
[21] 彭俊峰, 凌建亚, 张晗星, 等. 虫草素与DNA作用的光谱研究[J].光谱学与光谱分析,2004,24(7):858-861.
Peng Junfeng, Ling Jianya, Zhang Hanxing, et al. Study on the interaction of cordycepin and DNA[J]. Spectroscopy and Spectral Analysis, 2004, 24(7): 858-861.(in Chinese)
[22] 张碧程,胡林,刘艳辉,等.喹诺酮药物与DNA分子相互作用的紫外光谱研究[J].山东大学学报理学版,2011,46(7):11-16.
Zhang Bicheng, Hu Lin, Liu Yanhui, et al.Study on interaction of both quinolones with DNA by ultraviolet spectroscopy[J]. Journal of Shandong University Natural Science, 2011,46(7):11-16.(in Chinese)
[23] Wu Fangying, Xie Feiyan, Wu Yumei, et al. Interaction of a new fluorescent probe with DNA and its use in determination of DNA[J]. Journal of Fluorescence, 2008,18(1):175-181.
[24] Pasternack R F, Brigandi R A, Abrams M J, et al. Interactions of porphyrins and metalloporphyrins with single-stranded poly (dA)[J]. Inorganic Chemisty, 1990, 29(22):4483-4486.
【中文责编:晨兮;英文责编:新谷】
2016-03-13;Accepted:2016-06-01
Spectroscopy of interaction of herring fine dsDNA and benzidine
Ma Mingming†, Zhang Yan, and Zhao Qiang
College of Environment and Chemical Engineering, Xi’an Polytechnic University, Xi’an 710048, Shaanxi Province, P.R.China
The interaction mechanism of benzidine (BZ) with herring fine dsDNA in PBS (pH=7.38) is investigated by the fluorescence spectroscopy and the UV-visible absorption spectroscopy. Their binding mode is verified by two methods. One examines the effect of the ionic strength on the fluorescence intensity of the binding system BZ-dsDNA. The other is an DNA melting experiment. The results show that BZ combines with dsDNA in the mode of intercalation mainly by hydrogen bonding and van der Waals forces, and the interaction reaction is spontaneous. In addition, the ratio of fluorescence intensity of BZ (F0) to BZ-dsDNA (F) is linearly proportional to the concentration of dsDNA in the range of 8.00×10-6-48.00×10-6g/L with a detection limit of 2.00×10-6g/L. The common co-existed metal ions and ascorbic acid do not interfere with the determination. A new fluorescence spectroscopy method for the determination of dsDNA is developed based on the interaction between dsDNA and BZ. This method is applied into determining dsDNA in waste water from the lab which achieves the average recovery between 98.00% and 103.00%.
spectrophotometry; fluorescence spectroscopy; ultraviolet visible; benzidine; herring fine double-stranded deoxyribonucleic acid (dsDNA); intercalation; DNA melting point
Ma Mingming, Zhang Yan, Zhao Qiang. Spectroscopy of interaction of herring fine dsDNA and benzidine[J]. Journal of Shenzhen University Science and Engineering, 2016, 33(5): 457-463.(in Chinese)
O 657.3
Adoi:10.3724/SP.J.1249.2016.05457
陕西省科技攻关资助项目(2013kj07-24)
马明明(1969—),女,西安工程大学教授. 研究方向:功能材料制备与应用.E-mail:18220593193@163.com
Foundation:Program for Science & Technology of Shaanxi Province (2013kj07-24)
† Corresponding author:Professor Ma Mingming. E-mail: 18220593193@163.com
引文:马明明,张彦,赵强.鲱鱼精dsDNA和联苯胺相互作用的光谱分析[J]. 深圳大学学报理工版,2016,33(5):457-463.
