2型糖尿病患者SLC22A1,SLC22A2基因多态性与二甲双胍胃肠道不良反应的关系
2016-10-21石建党王素莉1
符 婷,石建党,匡 霞,王素莉1,
2型糖尿病患者SLC22A1,SLC22A2基因多态性与二甲双胍胃肠道不良反应的关系
符婷1,2,石建党3,匡霞2,王素莉1,2
目的探讨2型糖尿病(T2DM)患者SLC22A1 1222A>G位点及SLC22A2 808G>T位点基因多态性与二甲双胍胃肠道不良反应之间的关系。方法随机选取130例就诊于我院内分泌科初次接受二甲双胍治疗的T2DM患者,从患者外周血白细胞中提取DNA,应用等位基因特异引物PCR反应(Allele-specific PCR,AS-PCR)及凝胶成像技术进行基因分型,分析1222A>G及808G>T位点多态性与二甲双胍胃肠道不良反应的关系。结果SLC22A1 1222A>G位点存在AA、AG、GG三种基因型,突变频率为64.62%,A等位基因与二甲双胍胃肠道不良反应的发生相关(P<0.05);SLC22A2 808G>T位点存在GG、GT、TT三种基因型,突变频率为11.15%,该位点不同基因型患者发生二甲双胍胃肠道不良反应的概率不存在统计学差异(P=0.559);二甲双胍胃肠道反应阳性组患者年龄大于胃肠道反应阴性患者(P=0.037);二甲双胍胃肠道反应阳性组患者收缩压高于胃肠道反应阴性患者(P=0.017)。结论T2DM患者SLC22A1 1222A>G基因多态性与二甲双胍胃肠道不良反应的发生相关,SLC22A2808G>T基因多态性与二甲双胍胃肠道不良反应的发生无关;老龄及高收缩压可能是造成二甲双胍胃肠道不良反应的危险因素。
二甲双胍;SLC22A1;SLC22A2;基因多态性;胃肠道不良反应
国内外指南均推荐二甲双胍作为T2DM患者的一线用药,因其不但能有效降低空腹及餐后血糖,还有保护心血管[1]、调节血脂[2-4]、改善肝脏纤维化[5]、治疗多囊卵巢综合征[6]等降糖外作用,因此也被广泛用于糖尿病以外的疾病。但二甲双胍可引起恶心、腹泻、腹胀、呕吐、消化不良、腹痛等较为明显的胃肠道不良反应[7],5%的患者因无法耐受而终止使用。二甲双胍在体内发挥临床药理学作用主要通过有机阳离子转运体OCT1、OCT2介导[8]。近期研究发现,有机阳离子转运体基因多态性不仅可对二甲双胍的药动学及药效学造成影响[9, 10],还与二甲双胍胃肠道不良反应相关[11, 12],但结论并不统一。依据基因位点多态性个性化用药可提高药物有效率、降低不良反应的发生、降低用药成本,也是转化医学及精准医疗的发展方向。在Latvian人群中SLC22A1 1222A>G多态性改变[11]和二甲双胍引起的胃肠道不良反应存在相关性。在OCT2的所有突变位点中,SLC22A2 808G>T变率最高,且所有种族均有发现。本研究通过对130例T2DM患者SLC22A1 1222A>G和SLC22A2 808G>T进行位点测定,分析其基因多态性与二甲双胍胃肠道不良反应之间的关系。
1 对象与方法
1.1对象随机选取2014-11~2015-06间就诊于我院的T2DM患者130例,男64例,女66例。所有患者在入组时均初次服用二甲双胍(格华止,上海施贵宝公司),口服剂量均为500~2000 mg/d。
1.2入选标准就诊前已确诊为T2DM或初发糖尿病且符合1999年WHO诊断标准,年龄30~80岁。
1.3排除标准(1)未服用二甲双胍的患者;(2)1型糖尿病、特殊类型糖尿病;(3)并发糖尿病酮症等急性并发症;(4)肝肾功能不全;(5)妊娠或哺乳期妇女;(6)合并急慢性胃肠道疾病者;(7)肿瘤患者;(8)合并其他疾病需同时服用肾上腺素、糖皮质激素等影响糖代谢药物者;(9)服用其他可引起胃肠道反应如阿卡波糖等药物者;(10)服用维拉帕米、奥美拉唑、螺内酯等OCT1抑制剂的患者;(11)服用可卡因、丙米嗪、普鲁卡因酰胺、奎尼丁等OCT2抑制药的患者。
1.4观察指标记录患者年龄、性别、糖尿病病程等;测量身高、体重,计算体重指数(BMI);血压,包括收缩压(SBP)及舒张压(DBP);测定糖化血红蛋(HbA1C)、血尿酸(BUA)、血肌酐(Scr)、尿素氮(BUN)、血总胆固醇(TC) 、低密度脂蛋白胆固醇(LDL-C)。
1.5基因型测定空腹采集患者外周血1 ml,抗凝处理;使用血液基因组DNA提取试剂盒(NEWBIO INDUSTRY公司提供)提取基因组DNA,使用凝胶电泳成像技术确定所提取DNA 纯度合格,纯度不合格者再次进行DNA提取;根据NCBI网站中Primer工具设计1222A>G及808G>T位点PCR引物,野生型位点及突变型位点分别设计引物,SLC22A1 1222A>G上游引物序列为5′-TGCTCTATCAGGGGCTCATCC-3′,下游野生引物序列为5′-CCCCGCCAACAAATTTGACAT-3′,下游突变引物序列为5′-CCCCGCCAACAAATTTGACAC-3′,PCR扩增片段长度为167 bp。SLC22A2 808G>T上游引物序列为5′-AGGCCTTTCATCCCATCTAC-3′,下游野生引物序列为5′-AAGAAGAAGTTGGGCAGAGC-3′,下游突变引物序列为5′-AAGAAGAAGTTGGGCAGAGA-3′,PCR扩增片段长度为382 bp。委托江苏金唯智公司合成引物序列。PCR反应体系均为25 μl,包括:模板1 μl,上游引物0.5 μl,下游野生引物0.5 μl或下游突变引物0.5 μl,PCR Master Mix12.5 μl,ddH2O10.5 μl(PCR Master Mix包括dNTP、loading buffer、Taq DNA聚合酶、Mg2+、稳定剂、染料等,由NEWBIO INDUSTRY公司提供)。SLC22A1 1222A>G位点的PCR反应条件为:95℃预变性3 min,然后95℃变性15 s、64℃延伸1 min,进行30个循环;72℃ 5 min,4℃保存30 s。SLC22A2 808G>T位点的PCR反应条件为:95℃预变性3 min,95℃变性15 s、60℃延伸1 min,共30个循环;72℃ 5 min,4℃保存30 s。PCR产物加至点样槽中进行琼脂糖凝胶电泳,在紫外灯下观察DNA条带,并鉴定位点基因型。
1.6胃肠道不良反应的界定在服用二甲双胍治疗过程中如出现恶心、腹泻、腹胀、呕吐、胃胀、消化不良、腹痛等其中一项及以上症状者为阳性组,无不适者为阴性组。得到阳性组40例和阴性组90例。

2 结 果
2.1一般资料临床病例资料分为阳性组和阴性组。两组性别、病程、BMI、DBP无统计学差异,HbA1C、TC、LDL-C、Scr、BUN、BNA无统计学差异(P>0.05);两组人群年龄存在统计学差异,阳性组患者年龄大于阴性组患者(P<0.05);两组收缩压存在统计学差异,阳性组患者收缩压高于阴性组患者(P<0.05,表1)。
2.2两组1222A>G基因型分布与等位基因频率比较1222A>G位点可见AA、AG、GG三种测序结果,基因型分布符合Hardy-Weinberg遗传平衡定律(χ2=1.58,P>0.05),说明该样本能代表群体的基因分布。胃肠道反应阳性组及阴性组基因型分布存在统计学差异,两组间等位基因A、G频率存在统计学差异,胃肠道反应阳性组A等位基因频率高于胃肠道反应阴性组(P<0.05,表2)。
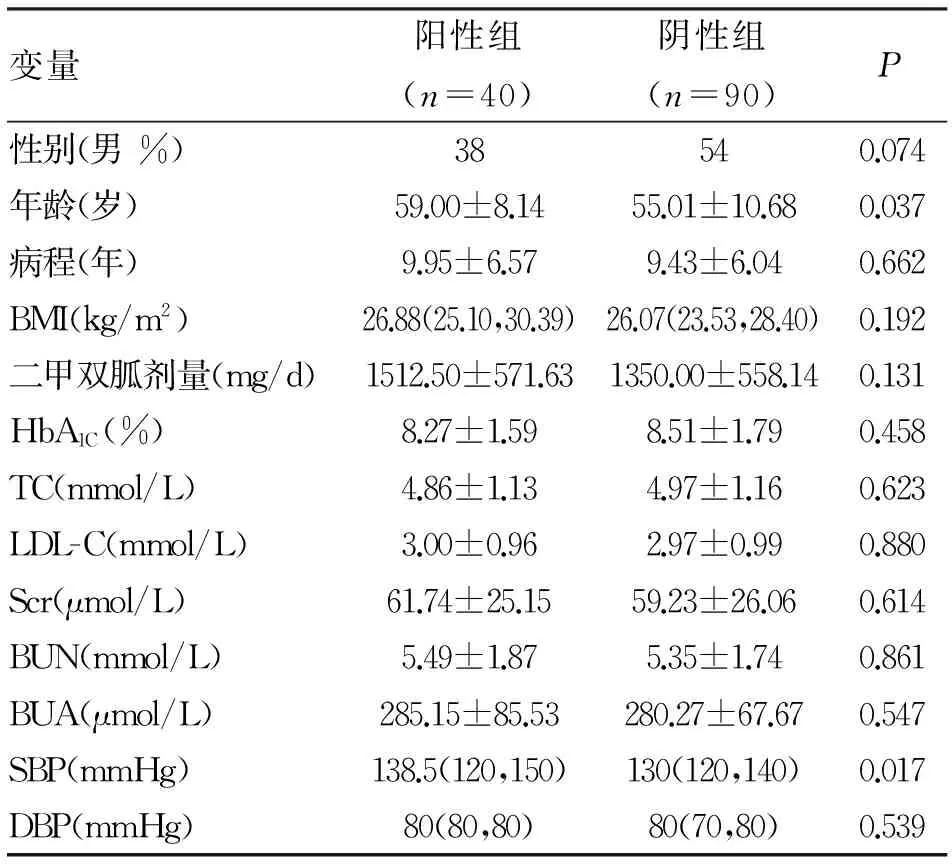
表1 胃肠道反应两组一般资料及生化指标比较
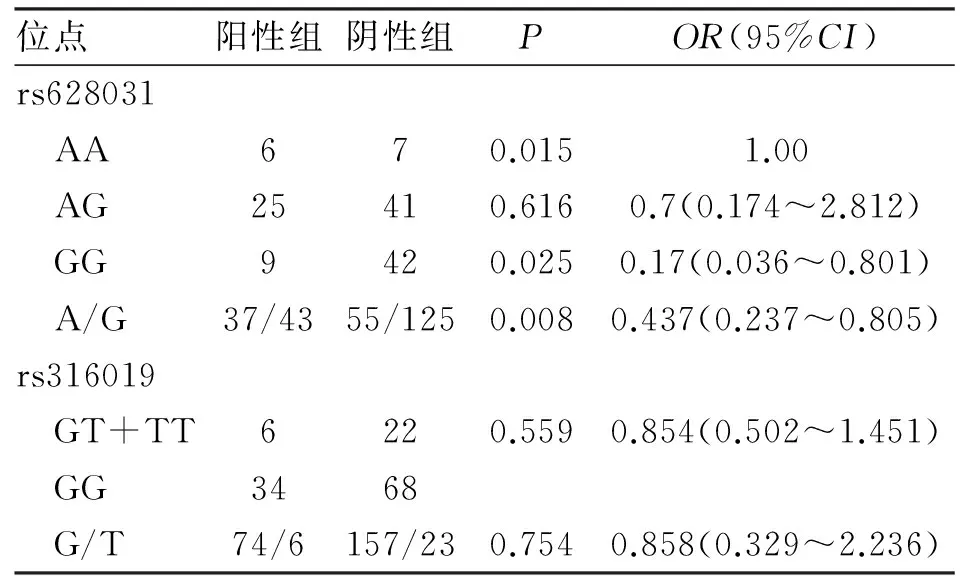
表2 胃肠道反应两组1222A>G、808G
2.3两组808G>T基因型分布与等位基因频率比较808G>T位点可见GG、GT、TT三种测序结果,基因型分布符合Hardy-Weinberg遗传平衡定律(χ2=0.298,P>0.05),说明该样本能代表群体的基因分布。由于TT基因型人数较少,故将GG型与GT+TT型进行比较,胃肠道反应阳性组及阴性组基因型分布不存在统计学差异(P=0.559),两组间等位基因G、T频率不存在统计学差异(P=0.754,表3)。
3 讨 论
20%~30%使用二甲双胍的糖尿病患者会出现胃肠道不良反应[13],二甲双胍造成胃肠道不良反应的具体机制并不明确,可能与药物在消化道黏膜聚集引起刺激有关。OCT1广泛表达于人体肠黏膜上皮细胞、肝细胞及肾脏基底膜细胞中,在二甲双胍胃肠道吸收、肝脏摄取、肾脏排泄中起着重要作用。OCT2主要位于人体肾脏基底外侧膜,二甲双胍从体内清除80%依靠OCT2的作用[8]。OCT1及OCT2基因多态性改变是导致二甲双胍药动学及药效学个体差异的重要因素[14, 15]。
SLC22A1 1222A→G改变可使408位氨基酸发生Met→Val(M408V)的转变,SLC22A2 808G→T改变可使270位氨基酸发生Ala→Ser(A270S)的转变。转运体编码区单核苷酸多态性导致的同义突变及非同义突变或可影响转运蛋白的功能。本研究中SLC22A1 1222A>G中A等位基因频率为35.38%,G等位基因频率为64.62%,与Latvian人群存在种族差异,且A等位基因与二甲双胍胃肠道不良反应的发生存在相关性。SLC22A2 808G>T位点在研究人群中存在GG、GT、TT三种基因型,突变率为11.15%,与以往研究报道的中国人群12.9%[16]、香港人群13.3%[17]、韩国人群11%[18]基本相近,该位点基因多态性改变与二甲双胍胃肠道不良反应不存在相关性,本实验研究结果与Tarasova等[11]的结论一致。Tarasova的研究表明M408V、delGTAAGTTG基因多态性改变与二甲双胍胃肠道不良反应存在相关性,A270S、G465R、R61C、M420del多态性与二甲双胍胃肠道不良反应的发生无关。
有学者认为,二甲双胍胃肠道不良反应的发生与基因多态性造成OCT1转运体功能下降、二甲双胍在胃肠道药物浓度增加有关[12]。该研究通过对服用二甲双胍的T2DM患者进行SLC22A1C88R、R61C、M420del、G401S、G465R五个位点(其中R61C、M420del、 G401S、G465R体外实验证实能减弱OCT1对二甲双胍的转运能力)检测,发现存在2个及2个以上突变位点的患者比存在一个或不存在突变位点的患者发生不良反应的概率高2倍。但目前未发现M408V、delGTAAGTTG两个位点多态性改变会减弱OCT1转运体对二甲双胍的转运能力,M408V基因多态性改变也并未对二甲双胍的肾脏清除率造成影响[19];而A270S突变却可导致OCT2对二甲双胍的摄取能力降低、血药浓度增高、肾脏清除率降低[18, 20]。基因多态性改变导致转运体对二甲双胍的转运能力下降或许只是原因之一。TanjaDujic研究还表明,老龄及女性均为胃肠道不良反应发生的危险因素,而本研究发现老龄是导致胃肠道不良反应的危险因素,这可能与老龄患者药物代谢减慢,对二甲双胍的作用更敏感有关。本研究首次发现,收缩压高是导致胃肠道不良反应的危险因素,具体机制有待后期研究进一步明确。
除OCT1、OCT2外,OCT3、MATE1、MATE2均参与二甲双胍在体内的转运过程。二甲双胍经肾小管分泌到尿液的过程需MATE1及MATE2介导,MATE2还参与二甲双胍由肠细胞转运至血液循环过程[21]。联合多个多态性位点共同分析其与二甲双胍胃肠道不良反应的关系或许会更有意义。
[1]Garber AJ, Abrahamson MJ, Barzilay JI,etal. American Association of Clinical Endocrinologists′ comprehensive diabetes management algorithm 2013 consensus statement-executive summary[J]. Endocr Pract, 2013,19(3):536-557.
[2]Ma J, Liu LY, Wu PH,etal. Comparison of metformin and repaglinide monotherapy in the treatment of new onset type 2 diabetes mellitus in China[J]. J Diabetes Res, 2014,2014:294017.
[3]Wang H, Ni Y, Yang S,etal. The effects of gliclazide, metformin, and acarbose on body composition in patients with newly diagnosed type 2 diabetes mellitus[J]. Curr Ther Res Clin Exp, 2013,75:88-92.
[4]Sin HY, Kim JY, Jung KH. Total cholesterol, high density lipoprotein and triglyceride for cardiovascular disease in elderly patients treated with metformin[J]. Arch Pharm Res, 2011,34(1):99-107.
[5]Fruci B, Giuliano S, Mazza A,etal. Nonalcoholic Fatty liver: a possible new target for type 2 diabetes prevention and treatment[J]. Int J Mol Sci, 2013,14(11):22933-22966.
[6]Tang T, Lord JM, Norman RJ,etal. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility[J]. Cochrane Database Syst Rev, 2010,(1):CD003053.
[7]Bouchoucha M, Uzzan B, Cohen R. Metformin and digestive disorders[J]. Diabetes Metab, 2011,37(2):90-96.
[8]Kimura N, Masuda S, Tanihara Y,etal. Metformin is a superior substrate for renal organic cation transporter OCT2 rather than hepatic OCT1[J]. Drug Metab Pharmacokinet, 2005,20(5):379-386.
[9]Chen Y, Li S, Brown C,etal. Effect of genetic variation in the organic cation transporter 2 on the renal elimination of metformin[J]. Pharmacogenet Genomics, 2009,19(7):497-504.
[10]Leabman MK, Huang CC, Kawamoto M,etal. Polymorphisms in a human kidney xenobiotic transporter, OCT2, exhibit altered function[J]. Pharmacogenetics, 2002,12(5):395-405.
[11]Tarasova L, Kalnina I, Geldnere K,etal. Association of genetic variation in the organic cation transporters OCT1, OCT2 and multidrug and toxin extrusion 1 transporter protein genes with the gastrointestinal side effects and lower BMI in metformin-treated type 2 diabetes patients[J]. Pharmacogenet Genomics, 2012,22(9):659-666.
[12]Dujic T, Zhou K, Donnelly LA,etal. Association of Organic Cation Transporter 1 With Intolerance to Metformin in Type 2 Diabetes: A GoDARTS Study[J]. Diabetes, 2015,64(5):1786-1793.
[13]Kirpichnikov D, McFarlane SI, Sowers JR. Metformin: an update[J]. Ann Intern Med, 2002,137(1):25-33.
[14]Evans WE, Relling MV. Pharmacogenomics: translating functional genomics into rational therapeutics[J]. Science, 1999,286(5439):487-491.
[15]Ieiri I, Takane H, Hirota T,etal. Genetic polymorphisms of drug transporters: pharmacokinetic and pharmacodynamic consequences in pharmacotherapy[J]. Expert Opin Drug Metab Toxicol, 2006,2(5):651-674.
[16]Li Q, Liu F, Zheng TS,etal. SLC22A2 gene 808 G/T variant is related to plasma lactate concentration in Chinese type 2 diabetics treated with metformin[J]. Acta Pharmacol Sin, 2010,31(2):184-190.
[17]Wang ZJ, Yin OQ, Tomlinson B,etal. OCT2 polymorphisms and in-vivo renal functional consequence: studies with metformin and cimetidine[J]. Pharmacogenet Genomics, 2008,18(7):637-645.
[18]Kang HJ, Song IS, Shin HJ,etal. Identification and functional characterization of genetic variants of human organic cation transporters in a Korean population[J]. Drug Metab Dispos, 2007,35(4):667-675.
[19]Tzvetkov MV, Vormfelde SV, Balen D,etal. The effects of genetic polymorphisms in the organic cation transporters OCT1, OCT2, and OCT3 on the renal clearance of metformin[J]. Clin Pharmacol Ther, 2009,86(3):299-306.
[20]Song IS, Shin HJ, Shim EJ,etal. Genetic variants of the organic cation transporter 2 influence the disposition of metformin[J]. Clin Pharmacol Ther, 2008,84(5):559-562.
[21]Zhou M, Xia L, Wang J. Metformin transport by a newly cloned proton-stimulated organic cation transporter (plasma membrane monoamine transporter) expressed in human intestine[J]. Drug Metab Dispos, 2007,35(10):1956-1962.
(2015-11-11收稿2016-03-01修回)
(责任编辑岳建华)
Association of genetic polymorphisms in SLC22A1 and SLC22A2 with intolerance to metformin in type 2 diabetes
FU Ting1,2,SHI Jiandang3,KUANG Xia2,and WANG Suli1,2.
1.Department of Internal Medicine,Hebei Medical University,Shijiazhuang 050000,China.2.Department of Endocrinology,The Affiliated Hospital of Logistics University of Chinese People’s Armed Police Force,Tianjin 300162,China.3.College of Life Sciences,Nankai University, Tianjin 300017, China
ObjectiveTo study the relationship between gene polymorphisms of 1222A>G in SLC22A1 and 808G>T in SLC22A2 with the gastrointestinal side-effects in metformin-treated type 2 diabetes patients.MethodsOne hundred and thirty type 2 diabetes patients treated with metformin at the first time were recruited.Genomic DNA samples were extracted from the patients’ leukocytes in the peripheral blood.The genotypes were determined by the allele-specific polymerase chain reaction(AS-PCR)and gel electrophoresismethod.ResultsThree genotypes of AA, AG, GG were found in SLC22A11222A>G site and the mutation frequency was 64.62%.An allele of 1222A>G was associated with the incidence of gastrointestinal side-effects of metformin(P<0.05).Three genotypes of GG, GT, TT were found in SLC22A2 808G>T site and the mutation frequency was 11.15%.The incidence of gastrointestinal side effects in metformin-treated type 2 diabetes patients with different genotypes had no significant differences(P=0.559).The patients in metformin intolerance group were older than the patients in metformin tolerance group. The patients in metformin intolerance group had higher systolic blood pressure than the patients in metformin tolerance group.ConclusionsSLC22A11222A>G gene polymorphis was associated with the incidence of gastrointestinal side effects in metformin-treated type 2 diabetes patients, however SLC22A2 808G>T is not.Older age and high systolic blood pressure may be the risk factors for metformin intolerance.
metformin;SLC22A1;SLC22A2;gene polymorphisms;gastrointestinal side-effects
符婷,硕士研究生,医师。
1.050000石家庄,河北医科大学内科教研室;2.300162天津,武警后勤学院附属医院内分泌科;3.300017天津,南开大学生命科学学院
王素莉,E-mail:wangslwsl@sina.com
R587.1
