温度敏感性瞬时受体电位通道调节精子功能的研究进展
2016-10-21张晓柯王晓烔胡廉
张晓柯,王晓烔,胡廉
·综述·
温度敏感性瞬时受体电位通道调节精子功能的研究进展
张晓柯,王晓烔,胡廉△
精子胞内信号分子及精子膜上的离子通道在调节精子功能中发挥作用。细胞膜上的瞬时受体电位(transient receptor potential,TRP)通道通过调节细胞内离子浓度,影响细胞的各种生理功能。温度敏感性TRP通道可以将温度信号转化成生物学信号,其中TRPV1、TRPV2、TRPV3和TRPV4属于热敏感TRP通道,TRPM8和TRPA1属于冷敏感TRP通道。对精子功能调节作用的研究主要在于TRPV1通道和TRPM8通道。TRPV1通道和TRPM8通道分布于精子不同部位,通道激活后可升高精子胞内Ca2+浓度,调控精子运动、顶体反应、趋热性等。TRPV1通道还能在精子脱离输卵管上皮细胞的黏附过程中发挥作用。TRPV1通道配体结合位点的变化,会导致TRPV1通道功能障碍,可能影响雄性生育力。
TRPV阳离子通道;TRPM阳离子通道;精子能动性;顶体反应;生育力
【Abstract】The intracellular signaling molecules and membrane ion channels regulate the sperm function. The transient receptor potential(TRP)channels participate in various physiological processes through regulating the intracellular ion concentrations.The thermo-TRP channels are a group of the TRP channelswhich can convert the temperature signal into biological signal,including the heat-gated ion channels such as TRPV1,TRPV2,TRPV3 and TRPV4,and the cold-gated ion channels such as TRPM8 and TRPA1.TRPM8 and TRPV1 located in the different segments of the sperm are involved in calcium signaling pathway.The activated TRPM8 and TRPV1 can regulate sperm motility,acrosome reaction,thermotaxis,etc.TRPV1 can also induce sperm to release from oviductal epithelia cell adhesion.Besides,the change of TRPV1 ligand binding sites can lead to the dysfunction of TRPV1 channel,whichmighthave negative effects onmale fertility.
【Keywords】TRPV cation channels;TRPM cation channels;Spermmotility;Acrosome reaction;Fertility
(JInt Reprod Health/Fam Plan,2016,35:390-394)
哺乳动物的精子在雌性生殖道内获能,从而获得与卵母细胞结合的能力,此过程中精子功能发生一系列变化,主要表现在运动方式的改变、发生顶体反应、精子胞内pH值和Ca2+浓度升高、精子质膜超极化、质膜成分改变、蛋白酪氨酸磷酸化增强以及分子水平上环磷酸腺苷/蛋白激酶A(cAMP/PKA)通路激活[1]。在受精过程中,输卵管扮演着贮精库的角色,发挥筛选精子的作用。进入输卵管的精子黏附在输卵管上皮细胞,在排卵相关信号的作用下,黏附的精子从输卵管上皮细胞脱离,向卵母细胞部位游动[2]。精子的运动能力、顶体反应、脱离输卵管上皮细胞的黏附等均与雄性生育力密切相关,并受多种物质的调节。
细胞膜上的瞬时受体电位(transient receptor potential,TRP)通道是位于细胞膜上的一类阳离子通道超家族,其家族成员多,激活条件各异,参与多种细胞的Ca2+信号通路,调节细胞功能。其中的一些温度敏感性TRP通道,在精子上有表达,参与调节精子功能。本文介绍温度敏感性TRP通道对精子运动、顶体反应、趋热性、脱离输卵管上皮细胞以及精子受精能力等方面的调控作用。
1 TRP通道概述
Cosens等[3]在对果蝇的突变体进行研究时发现,这种突变的果蝇感光能力降低。正常果蝇在持续性光刺激存在时表现出持续性峰电位,而突变果蝇仅做出瞬时电位改变,他们将这类能产生瞬时电位改变的非选择性阳离子通道称为TRP通道。对这种通道进行深入研究后发现了能够编码Trp的基因家族“trp基因”[4]。随后,研究者发现TRP通道以四聚体的形式发挥作用,其单体的羧基(C)-末端和氨基(N)-末端均位于胞内。单体具有6次跨膜结构域(S1~S6),其中,S5与S6之间存在1个孔环,4个单体的S5、S6及其孔环聚合在一起共同组成了TRP通道的孔区(图1)[5]。TRP通道可以被电压、温度、驱动力、压力、应激等生理性刺激和化学性刺激激活[6-7]。根据通道结构、功能、激活机制、组织分布等不同,哺乳动物TRP通道分为6种亚家族,即TRPC、TRPV、TRPM、TRPA、TRPML和TRPP,各亚家族又可分为不同的亚型。
TRP通道为非选择性阳离子通道,允许阳离子通过,对阴离子无通透性[8]。生理情况下,TRP通道开放引起Na+和Ca2+的快速内流[9]。离子流会导致细胞膜电位升高,胞膜去极化,调控电压依赖性离子通道的开放,激活多种Ca2+依赖性信号传导通路,继而调节细胞感受信息的功能[8]。多数TRP通道属于细胞调控的感应器,可以发挥温度感知、机械感受以及伤害性感受等感觉生理作用[8-10]。除细胞膜外,某些TRP通道的亚型也存在于细胞内膜或某些囊泡[8],其通过调控胞内离子通道,促进溶酶体、核内体、高尔基复合体、内质网等细胞器及突触囊泡中的Ca2+释放[4]。
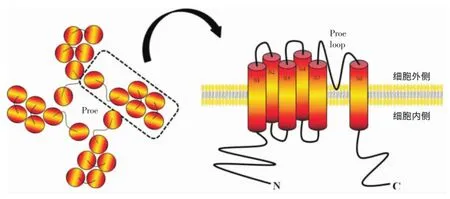
图1 TRP通道模式图
2 温度敏感性TRP通道
对生物体来说,温度敏感性是其适应环境和生存的必备条件。生物体在进化过程中形成的特异性温度敏感性分子探测器能够检测到周围环境中的温度变化,并将温度信号转化成生物学信号。高等生物的感觉神经元可以在不同温度范围内被激活,保证其能够区分过低(<15℃)或过高(>43℃)的温度、凉爽(15℃~25℃)或温暖(30℃~40℃)的环境[11]。随着对TRP通道的深入研究,其感知和区分温度的功能被陆续发现,如表达于神经元的TRPV1~4、TRPA1和TRPM8可以在4℃~52℃的范围内感受到温度变化,具有温度敏感性。其中TRPV1、TRPV2、TRPV3和TRPV4属于热敏感TRP通道,TRPM8和TRPA1属于冷敏感TRP通道[12]。
2.1热敏感TRP通道
2.1.1TRPV1 Cesare等[13]在研究感觉神经元时首次发现了热敏感离子通道。由于这一通道可以被辣椒素(capsaicin)激活,因而被命名为1型辣椒素受体。之后Caterine等[14]将其改名为TRPV1以强调此受体属于TRP通道家族,这是TRP家族中唯一能够被辣椒素激活的离子通道。TRPV1可以对有害的高温作出反应,激活阈值接近43℃[15]。此外,低pH、胞膜去极化、乙醇、内源性脂质等都属于TRPV1通道的激活因素。TRPV1通道被认为是多种有害刺激的信号整合器[16]。
2.1.2其他热敏感TRP通道TRPV2通道对辣椒素不敏感,其高温激活阈值为52℃[16],TRPV3较为特殊,恒温动物TRPV3的激活温度在30℃~39℃之间,而冷血动物TRPV3的激活阈值较低,16℃即可激活[12-17]。并且TRPV3的反应性可随温度的升高而增强[15],重复的温度刺激可以增强其敏感性[18]。TRPV4通道主要在温热(25℃~35℃)条件下激活,对持续的热刺激(≥42℃)不敏感[15]。除此之外,这些TRP通道还具有一些特点,如TRPV2通道与TRPV1有50%以上的序列相似性[19],不仅可以被渗透压应激、机械性拉伸等生理性刺激激活,还能被非选择性化学活化剂、外源性小分子2-氨基乙氧基二苯基硼酸盐(2-APB)、丙磺舒激活,而被钌红和钆抑制[16-19]。TRPV3通道则表现出一定的电压依赖性,细胞膜去极化达到比较高的正电位时可以使该通道激活[20]。TRPV4通道对二价阳离子有微弱的选择性,可优先转运Ca2+和Mg2+,环境中没有二价离子存在的情况下,TRPV4通道则会转运单价阳离子[21]。另外,低渗透性环境可以激活TRPV4通道,高渗透性环境则抑制TRPV4通道[15]。
2.2冷敏感TRP通道
2.2.1TRPM8 TRPM8是TRPM亚家族中唯一的一个温度敏感性离子通道[16]。无害的低温(≤26℃)、薄荷醇、留兰香、桉油精等都属于TRPM8的激活因素[15]。TRPM8的C-末端区域可以调控冷觉以及配体诱导的通道激活,C-末端还可以在传输TRPM8功能、TRPM8通道四聚体化以及温度、配体诱导的TRPM8激活中发挥作用[12-22]。不仅如此,其S4区和S4~S5连接部存在的电压感受器,使TRPM8通道表现出一定程度的电压敏感性,通道激活后可以影响膜电位[15]。
2.2.2TRPA1 TRP通道家族中另一个冷敏感通道是TRPA1,可以在有害的冷温度范围内(<17℃)激活,冷刺激导致细胞内Ca2+浓度升高,Ca2+与TRPA1 N-末端的EF手结构域结合可以激活TRPA1,可能是TRPA1感受冷刺激的主要原因[16]。Nakamura等[23]在研究中提到TRPA1可以被异硫氰酸烯丙酯、肉桂醛等刺激性物质激活。TRPA1通道还表现出一定的电压依赖性,这种特性可能与孔区存在的保守亮氨酸残基有关[4]。
2.3温度敏感性TRP通道结构差异及其激活部位
不同的温度敏感性TRP通道,其胞内N-末端和C-末端存在差异,并且有不同的激活部位。从N-末端来看,热敏感的TRPV1~4包含6个锚蛋白重复序列;冷敏感TRP通道中TRPA1含有14~19个锚蛋白重复序列,TRPM8则没有N-末端锚蛋白序列。从C-末端来看,热敏感的TRPV1~4包含1个保守的TRP框序列;冷敏感TRP通道中TRPM8包含1个保守的TRPM通道特异性氨基末端序列、1个卷曲螺旋序列以及TRP框序列,TRPA1的C-末端则没有TRP框[12]。TRPV1的C-末端、N-末端及孔区与其热激活有关[12];TRPV3、TRPV4的激活分别与孔区、S3上的酪氨酸残基有关[24-25];大鼠及小鼠TRPA1通道S5上存在的单甘氨酸残基决定该通道的冷敏感性;TRPM8通道C-末端及卷曲螺旋序列可能与通道的冷激活有关[12]。目前对温度敏感性TRP通道感受温度刺激的研究还处于探索阶段,主要在于结构方面的研究,通道激活后如何调节则不十分清楚。
3 TRPV1和TRPM 8对精子功能的调节作用
多种TRP通道分布在精原细胞和成熟精子的不同部位,这些分布差异决定着TRP通道可以调节精子不同的生理功能[26]。关于温度敏感性TRP通道对精子功能影响的研究目前仅限于TRPV1通道和TRPM8通道。通过免疫荧光定位检测,发现不同物种TRPV1通道分布稍有差异。其中南亚黑鲮(Labeo rohita)精子TRPV1通道主要分布于精子头部和颈部,在精子尾部也有微弱的表达;猪精子TRPV1通道则位于精子头部的顶体前区以及精子中部;人精子TRPV1通道主要在精子头部的顶体前区[27-29]。人、小鼠精子中的TRPM8通道位于整个鞭毛部以及精子头前区[30-31]。
3.1调节精子运动南亚黑鲮精子鞭毛部存在TRPV1通道,TRPV1激动剂N-花生四烯酰基多巴胺(NAND)可以明显延长南亚黑鲮精子的体外运动时间,其活力维持时间大约是不加药物组的8倍。相反,TRPV1抑制剂碘代树脂毒素(5′I-RTX)则能够显著抑制NAND的促精子运动作用,加入5′I-RTX后精子活力迅速下降,这些结果表明TRPV1通道可以调节南亚黑鲮的精子运动[27]。
TRPM8通道对Ca2+有通透性,Ca2+是调节精子运动的重要信号分子。TRPM8通道在小鼠、人精子鞭毛部有分布,用TRPM8激动剂薄荷醇处理小鼠精子后,精子胞内Ca2+浓度升高,小鼠精子鞭毛摆动频率增快,其中68%的小鼠精子Ca2+升高仅持续100 s左右,表现出瞬时升高现象,32%的小鼠精子在整个检测过程中则可以维持较高Ca2+状态[31]。薄荷醇处理人精子后,胞内Ca2+浓度同样表现出瞬时升高现象,40 s左右降至基线水平。但与小鼠精子不同,薄荷醇处理后并没有对人精子鞭毛运动频率以及其他运动参数产生影响[30],表明TRPM8通道在调节精子运动中的作用存在种属差异。
3.2影响精子顶体反应精子获能初期TRPV1通道处于失活状态,精子获能后被激活。TRPV1通道激活导致电压依赖性Ca2+通道开放,胞内Ca2+浓度升高,可能是诱导精子发生顶体反应的机制之一[32]。在对猪精子和人精子的研究中发现,用TRPV1特异性拮抗剂辣椒平(capsazepine,CPZ)处理精子后,猪精子和人精子自发性顶体反应较用药前分别提高了23.1%和11.3%。而在CPZ存在的条件下,孕酮只能诱导5%左右的猪、人精子发生顶体反应,显著低于只加入二甲基亚砜(DMSO)的对照组。这一结果显示CPZ能够明显升高精子自发性顶体反应,而降低孕酮诱导的顶体反应,TRPV1通道参与调控精子顶体反应[28-29]。
对TRPM8通道的研究发现,用TRPM8激动剂薄荷醇处理小鼠精子后,可以明显升高精子胞内Ca2+浓度,诱导小鼠精子发生顶体反应。TRPM8拮抗剂不仅可以抑制薄荷醇的作用,还能够明显抑制透明带和孕酮诱发的顶体反应[31]。De Blas等[30]研究发现,薄荷醇同样能够促进人精子发生顶体反应,并且此过程也可以被TRPM8拮抗剂抑制。这些结果表明,TRPM8通道参与小鼠、人精子的顶体反应过程。
3.3促进精子脱离输卵管上皮细胞输卵管作为功能性贮精区,其上皮细胞是为精子提供黏附的场所,这种黏附可以延长精子寿命、延迟精子获能,并在选择精子中发挥重要作用。生理情况下,未获能精子依然黏附在输卵管上皮细胞,而获能后的精子能够脱离输卵管上皮细胞的黏附,向卵母细胞所在部位游动并与卵母细胞结合[33]。大麻素(anandamide,AEA)作为一种内源性脂质,能激活TRPV1通道,促进细胞内Ca2+浓度升高、诱导牛精子从牛输卵管上皮细胞(bovine oviductal epithelium cells,BOEC)上脱离[2]。TRPV1激动剂辣椒素能明显促进AEA诱导的牛精子从BOEC上脱离。相反,这一作用可以被TRPV1拮抗剂CPZ完全抑制。以上研究表明,TRPV1可能作为AEA的作用靶点,参与精子与输卵管上皮细胞脱离的过程[2]。
3.4参与精子趋热性热敏感是细胞和微生物拥有的重要生物学特性,可以诱导它们迁移到适宜生存的温度。有研究表明兔、猪输卵管受精部位温度较贮精部位高出1~2℃,兔、人精子可以感受到周围环境的温度变化,并由温度较低部位游向温度较高部位,称为精子的趋热性运动[34]。对哺乳动物来说,精子趋热性在精子运动过程中有着重要的向导性作用。人精子能感受到周围环境中极小的温度变化(大约<0.000 6℃),并在29~41℃温度范围内可以对温度变化作出趋热性反应[35]。真核生物细胞拥有感受温度变化的温度敏感性离子通道,主要隶属于TRP通道家族[36]。
Ca2+参与到一些单细胞物种的趋热性信号传导通路。De Blas等[30]发现人精子感受到周围环境温度改变时,可以激活精子头部和鞭毛部的TRPM8通道,升高精子胞内Ca2+浓度,因此认为TRPM8可能是调节精子趋热性运动的离子通道。相反,Bahat等[36]发现,磷脂酶C抑制剂U73122以及三磷酸肌醇受体抑制剂2-APB均能够明显抑制人精子趋热性运动,而TRPM8拮抗剂甲酰胺却无明显影响。关于TRPM8通道是否参与到精子趋热性运动的调控还存在一定争议,尚需进一步深入研究。
3.5影响精子受精能力精子质量与雄性生育力密切相关。精液参数分析仍然是临床上诊断男性不育的常规方法,精子形态、精子结构完整性及顶体反应能力等精子功能检测是评估男性生育力的重要手段,但这些针对精子的常规检查并不能全面评估男性生育力,对于特发性不育以及生育力减退患者的诊断也缺乏特异性,因此,发掘男性生育力相关的小分子生物标记物仍是生殖领域的研究热点[37-38]。用TRPV1特异性拮抗剂CPZ处理人精子后,可以明显抑制黄体酮诱导的人精子穿透去透明带仓鼠卵母细胞的能力[28]。Lewis等[38]在对人精子研究时发现,与正常生育男性相比,少精子症、弱精子症、畸精子症导致的不育患者以及一些不明原因的不育男性精子中TRPV1 mRNA表达水平降低,TRPV1通道上的配体结合位点明显减少。研究者推测男性不育患者精子内部可能存在有某种物质占据TRPV1通道上的配体结合位点,使其不能与相应的配体结合,导致TRPV1通道功能发挥受到抑制,精子顶体反应发生率降低,精子与卵母细胞的相互作用受到抑制,可能是导致这些患者生育力降低的原因之一。
4 展望
TRP通道作为非选择性阳离子通道,家族成员众多,激活条件各异,在调节感觉生理中发挥重要作用。温度敏感性TRP通道,激活后可进一步影响Ca2+依赖性信号传导通路,调节细胞功能。热敏感的TRPV1通道和冷敏感的TRPM8通道激活后,导致精子胞内Ca2+浓度升高,可以调节精子运动、影响精子顶体反应。TRPV1通道作为AEA的作用靶点,参与到精子脱离输卵管上皮细胞的过程。精子趋热性是否与TRPM8通道有关,目前结论不一,还有待进一步研究。TRPV1在不育患者精子中表达量的减少及功能的缺陷,可能是引起男性不育的原因之一。尽管TRPV1通道和TRPM8通道与Ca2+浓度相关的精子多种生理功能有关,但两种通道激活后上调Ca2+的形式和作用机制尚不明确。除TRPV1通道和TRPM8通道之外,其他温度敏感性TRP通道是否存在于精子并能调节精子功能,还不清楚。另外,精子需要在附睾中经过一系列的形态结构、生理生化等改变成为成熟精子,才会获得运动能力、精卵识别能力及受精能力,而精子在附睾成熟过程中温度敏感性TRP通道是否起到调节作用,也未见到相关报道。因此,对温度敏感性TRP通道的研究具有广阔的前景。此外,现有研究表明TRPV1和TRPM8特异性拮抗剂可以抑制人和小鼠精子顶体反应、牛精子从BOEC上的脱离以及人精子的穿卵能力。这些拮抗剂通过抑制精子生理功能,有望在生育调节方面发挥作用,可能会成为雄性生殖领域研究的新方向。
[1]Navarrete FA,García-Vázquez FA,Alvau A,etal.Biphasic role of calcium inmousesperm capacitation signaling pathways[J].JCell Physiol,2015,230(8):1758-1769.
[2]Gervasi MG,Osycka-Salut C,Sanchez T,et al.Sperm Release From the Oviductal Epithelium Depends on Ca(2+)Influx Upon Activation of CB1 and TRPV1 by Anandamide[J].JCell Biochem,2016,117(2):320-333.
[3]Cosens DJ,Manning A.Abnormal electroretinogram from a Drosophilamutant[J].Nature,1969,224(5216):285-287.
[4]Nilius B,Szallasi A.Transient receptor potential channels as drug targets:from the science ofbasic research to the artofmedicine[J]. PharmacolRev,2014,66(3):676-814.
[5]Poletini MO,Moraes MN,Ramos BC,et al.TRP channels:a missing bond in the entrainment mechanism of peripheral clocks throughoutevolution[J].Temperature(Austin),2015,2(4):522-534.
[6]Nieto-Posadas A,Jara-Oseguera A,Rosenbaum T.TRP channel gatingphysiology[J].Curr Top Med Chem,2011,11(17):2131-2150.
[7]Jara-Oseguera A,Islas LD.The role of allosteric coupling on thermal activation of thermo-TRP channels[J].Biophys J,2013,104(10):2160-2169.
[8]Toro CA,Arias LA,Brauchi S.Sub-cellular distribution and translocation of TRP channels[J].Curr Pharm Biotechnol,2011,12(1):12-23.
[9]Arias-Darraz L,Cabezas D,Colenso CK,etal.A transient receptor potential ion channel in Chlamydomonas shares key features with sensory transduction-associated TRP channels in mammals[J]. PlantCell,2015,27(1):177-188.
[10]Weissgerber P,Kriebs U,Tsvilovskyy V,et al.Male fertility depends on Ca2+absorption by TRPV6 in epididymal epithelia[J]. SciSignal,2011,4(171):ra27.
[11]Mckemy DD.Themolecularand cellularbasisof cold sensation[J]. ACSChem Neurosci,2013,4(2):238-247.
[12]Cohen MR,Moiseenkova-Bell VY.Structure of thermally activated TRP channels[J].Curr Top Membr,2014,74:181-211.
[13]Cesare P,McNaughton P.A novel heat-activated current in nociceptive neurons and its sensitization by bradykinin[J].Proc Natl Acad SciUSA,1996,93(26):15435-15439.
[14]Caterina MJ,Schumacher MA,Tominaga M,et al.The capsaicin receptor:a heat-activated ion channel in the pain pathway[J]. Nature,1997,389(6653):816-824.
[15]Laing RJ,Dhaka A.ThermoTRPs and Pain[J].Neuroscientist,2016,22(2):171-187.
[16]Vay L,Gu C,McNaughton PA.The thermo-TRP ion channel family:properties and therapeutic implications[J].Br JPharmacol,2012,165(4):787-801.
[17]Saito S,Fukuta N,ShingaiR,etal.Evolution of vertebrate transient receptor potential vanilloid 3 channels:opposite temperature sensitivity betweenmammals and western clawed frogs[J].PLoS Genet,2011,7(4):e1002041.
[18]Kaneko Y,Szallasi A.Transient receptor potential(TRP)channels: a clinical perspective[J].Br JPharmacol,2014,171(10):2474-2507.
[19]Huynh KW,Cohen MR,Jiang J,et al.Structure of the full-length TRPV2 channelby cryo-EM[J].NatCommun,2016,7:11130.
[20]Nilius B,BíróT,Owsianik G.TRPV3:time to decipher a poorly understood familymember![J].JPhysiol,2014,592(2):295-304.
[21]Goldenberg NM,Ravindran K,KueblerWM.TRPV4:physiological role and therapeutic potential in respiratory diseases[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(4):421-436.
[22]Latorre R,Brauchi S,Madrid R,et al.A cool channel in cold transduction[J].Physiology(Bethesda),2011,26(4):273-285.
[23]Nakamura T,Miyoshi N,Ishii T,et al.Activation of transient receptor potentialankyrin 1 byquercetin and itsanalogs[J].Biosci Biotechnol Biochem,2016,80(5):949-954.
[24]Grandl J,Hu H,Bandell M,et al.Pore region of TRPV3 ion channel is specifically required for heat activation[J].Nat Neurosci,2008,11(9):1007-1013.
[25]Vriens J,Watanabe H,Janssens A,et al.Cell swelling,heat,and chemical agonists use distinct pathways for the activation of the cation channel TRPV4[J].Proc Natl Acad SciU SA,2004,101(1):396-401.
[26]Shukla KK,Mahdi AA,Rajender S.Ion channels in sperm physiologyandmale fertility and infertility[J].JAndrol,2012,33(5):777-788.
[27]MajhiRK,Kumar A,Yadav M,etal.Thermosensitive ion channel TRPV1 is endogenously expressed in the sperm of a fresh water teleost fish(Labeo rohita)and regulates sperm motility[J]. Channels(Austin),2013,7(6):483-492.
[28]Francavilla F,Battista N,Barbonetti A,et al.Characterization of the endocannabinoid system in human spermatozoa and involvement of transient receptor potential vanilloid 1 receptor in their fertilizingability[J].Endocrinology,2009,150(10):4692-4700.
[29]MaccarroneM,Barboni B,Paradisi A,et al.Characterization of the endocannabinoid system in boar spermatozoa and implications for sperm capacitation and acrosome reaction[J].JCell Sci,2005,118(Pt19):4393-4404.
[30]De Blas GA,Darszon A,Ocampo AY,et al.TRPM8,a versatile channel in human sperm[J].PLoSOne,2009,4(6):e6095.
[31]Martínez-López P,Treviño CL,de la Vega-Beltrán JL,et al. TRPM8 in mouse sperm detects temperature changes and may influence the acrosome reaction[J].JCell Physiol,2011,226(6):1620-1631.
[32]BernabòN,Palestini P,Chiarini M,et al.Endocannabinoidbinding CB1 and TRPV1 receptors as modulators of sperm capacitation[J].Commun Integr Biol,2012,5(1):68-70.
[33]Osycka-Salut C,Gervasi MG,Pereyra E,et al.Anandamide induces sperm release from oviductal epithelia through nitric oxide pathway in bovines[J].PLoSOne,2012,7(2):e30671.
[34]Eisenbach M,Giojalas LC.Sperm guidance in mammals-an unpaved road to the egg[J].Nat Rev Mol Cell Biol,2006,7(4):276-285.
[35]Bahat A,Caplan SR,Eisenbach M.Thermotaxis of human sperm cells in extraordinarily shallow temperature gradients over a wide range[J].PLoSOne,2012,7(7):e41915.
[36]Bahat A,Eisenbach M.Human sperm thermotaxis ismediated by phospholipase C and inositol trisphosphate receptor Ca2+channel[J].BiolReprod,2010,82(3):606-616.
[37]Soler L,Labas V,Thélie A,etal.Intact Cell MALDI-TOFMSon Sperm:AMolecular Test ForMale Fertility Diagnosis[J].MolCell Proteomics,2016,15(6):1998-2010.
[38]Lewis SE,Rapino C,Di Tommaso M,et al.Differences in the endocannabinoid system of sperm from fertile and infertilemen[J]. PLoSOne,2012,7(10):e47704.
Research Progress on the Regulation of Thermo-TRP Channels on Sperm Function
ZHANG Xiao-ke,WANG Xiao-tong,HU Lian.
Family Planning Research Institute,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Corresponding author:HU Lian,E-mail:hulian02@126.com
2016-06-08)
[本文编辑秦娟]
华中科技大学自主创新研究基金(2014TS002)
430030武汉,华中科技大学同济医学院计划生育研究所
胡廉,E-mail:hulian02@126.com
△审校者
