巨噬细胞移动抑制因子缺失加重苯肾上腺素诱导的小鼠心肌肥厚
2016-10-20肖珍朱杰宁唐春梅林秋雄胡志琴张灼符永恒张梦珍单志新
肖珍,朱杰宁,唐春梅,林秋雄,胡志琴,张灼,符永恒,张梦珍,单志新
(广东省人民医院广东省医学科学院广东省心血管病研究所医学研究部,广州510080)
巨噬细胞移动抑制因子缺失加重苯肾上腺素诱导的小鼠心肌肥厚
肖珍,朱杰宁,唐春梅,林秋雄,胡志琴,张灼,符永恒,张梦珍,单志新
(广东省人民医院广东省医学科学院广东省心血管病研究所医学研究部,广州510080)
研究巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)缺失对皮下注射苯肾上腺素(phenylephrine,PE)诱导的小鼠心肌肥厚的影响.利用MIF敲除(MIF-knockout,MIF-KO)小鼠及其野生型对照小鼠,分别建立皮下注射PE诱导的小鼠心肌肥厚模型.小动物心脏B超检测到小鼠心脏结构功能的改变.末端脱氧核苷酸转移酶介导的dUTP缺节末端标记(terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL)法检测到小鼠心肌细胞凋亡.分别用实时定量逆转录多聚酶链反应(quantitative reverse-transcription-polymerase chain reaction,qRT-PCR)和Western Blot方法检测SOD1,SOD2和Trx2的表达.①连续3d 20 mg/(kg·d)皮下注射PE可诱导小鼠发生心肌肥厚,注射PE诱导MIF-KO小鼠发生心肌肥厚的程度高于野生型对照小鼠;②TUNEL结果显示,注射PE诱导MIF-KO小鼠心肌发生凋亡的程度高于野生型对照小鼠;③注射PE诱导MIF-KO小鼠心肌中SOD1和Trx2表达水平降低,而且MIF-KO小鼠心肌中Trx2表达水平显著低于野生型对照小鼠.MIF缺失会降低SOD1和Trx2的表达水平,进而加重苯肾上腺素诱导的小鼠心肌细胞凋亡和心肌肥厚.
巨噬细胞移动抑制因子;苯肾上腺素;心肌细胞;心肌肥厚
心肌肥厚是心血管疾病中最为常见的并发症之一,长期的心肌肥厚很容易导致心力衰竭或猝死.长期压力和(或)容积负荷过度、机械性刺激和神经体液因素均可通过调节肥厚相关基因的表达,促进心肌细胞的肥大.心肌肥厚的分子机制非常复杂,发生心肌肥厚时多条信号通路介导心肌细胞肥大过程,而且多条通路之间相互作用,形成错综复杂的调控网络.尽管研究人员姜展心肌肥厚的相关研究已有几十年,但对于心肌肥大发生和维持的确切机制仍不清楚.
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种细胞因子,具有抗氧化作用,在T淋巴细胞、内皮细胞、平滑肌细胞、肝细胞和心肌细胞等多种组织细胞中均有表达;并参与多种有炎症反应的疾病过程,包括系统性感染、自身免疫性疾病、癌症、代谢性疾病如糖尿病和肥胖等[1].近期研究发现,MIF参与了心肌肥厚过程[2-3],但是具体作用机制尚不明确.本研究旨在探讨MIF缺失对皮下注射苯肾上腺素(phenylephrine,PE)诱导的小鼠心肌肥厚的影响.
1 材料和方法
1.1实验试剂与仪器
Trizol试剂盒(Invitrogen,Carlsbad,CA),逆转录试剂盒(Invitrogen,Carlsbad,CA),2×SYBR Green Mix(TaKaRa,Japan),RNAase free water(TaKaRa,Japan),BCA蛋白定量试剂盒(Thermo,USA),SDS-PAGE凝胶配置试剂盒(碧云天生物技术研究所,中国),TUNEL检测试剂盒(Roche,USA).抗体:GAPDH,anti-Rabbit,anti-Mouse(Protein Technology,UK),心钠素(atrial natriuretic peptide,ANP,Abcam,UK),β肌球蛋白重链(β-myosin heavy chain,β-MHC,Sigma,USA),SOD1,SOD2,Trx2(Proteintech,USA).蛋白Marker(Fermentas,USA),4×SDS loading buffer(Invitrogen,Carlsbad,CA),PVDF膜(Whatman,UK),ECL发光液(Bioword,USA),DMEM/F12细胞培养基(Hyclone,USA),特级澳洲胎牛血清(Gibco,USA),苯肾上腺素(Sigma,USA),胰蛋白酶粉末(广州威佳科技有限公司,中国).其他生化试剂均为进口分装或国产分析纯.
蛋白电泳、电转系统(BioRad,USA),超高分辨率VEVO2100小动物彩色B超仪MPX(二维M型,Visual Sonics,Canada),荧光定量PCR仪(MJ Research Opticon2,ViiA 7 Life Technologies,USA),倒置荧光显微镜(Olympus,Japan).
1.2实验方法
1.2.1皮下注射PE诱导小鼠心肌肥厚模型
参照文献[4],选用8~12周龄MIF敲除和正常对照雄性小鼠(美国Jakson实验室),体重20~25 g.将PE以20 mg/(kg·d)皮下注射3 d,继续饲养5 d,通过小动物心脏B超检测心脏结构,判定是否造模成功.对照组注射同量的生理盐水.
1.2.2小动物心脏B超检测小鼠心脏结构功能
小鼠在麻醉(异氟烷和氧气混合气麻醉)状态下,利用超高分辨率VEVO2100小动物彩色B超仪(二维M型)的13-MHz传感器进行超声心动图检查.检测指标包括左室前壁舒张末期厚度(left ventricular anterior wall end-diastolic,LVAWd)、左室前壁收缩末期厚度(left ventricular anterior wall end-systolic,LVAWs)、左室后壁舒张末期厚度(left ventricular posterior wall end-diastolic,LVPWd)、左室后壁收缩末期厚度(left ventricular posterior wall end-systolic,LVPWs)、左室射血分数(ejection fraction,EF)、左室短轴缩短率(fraction shortening,FS).
1.2.3末端脱氧核苷酸转移酶介导的dUTP缺节末端标记(terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL)检测
TUNEL检测方法简述如下:将小鼠心肌组织固定在10%福尔马林中隔夜.石蜡包埋样品,切出4µm厚度的贴片.心肌组织切片进行20µg/mL蛋白酶K处理.用Cy5-dUTP标记发生凋亡细胞中损伤的DNA链.利用荧光显微镜检测5个不同视野(每个视野大约有200个细胞)中TUNEL阳性细胞的数量.
1.2.4实时定量逆转录多聚酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)检测基因表达
用Trizol试剂盒提取心肌细胞总RNA.取2.0µg总RNA,加入5×逆转录试剂4µL(逆转录试剂盒),用oligo(dT)15和random primers逆转录出cDNA,用于检测目标基因mRNA表达水平.以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)作为内参照基因,利用合成的cDNA模板和特异的PCR引物检测目标基因mRNA的表达水平.扩增的DNA产物以荧光染料SYBR GreenⅠ标记,PCR反应在ViiA 7仪器上运行.以2-ΔΔCt法计算目标基因的相对表达水平.本研究所用PCR引物序列如表1所示.
1.2.5Western Blot检测蛋白表达
收集处理后的心肌细胞,加入RIPA蛋白裂解液,冰上裂解,于4°C 12 000 r/min离心10 min,取上清进行蛋白定量后分装,加入4×SDS loading buffer,于100°C加热10 min使蛋白变性,然后进行聚丙烯酰胺凝胶电泳.用聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜转膜,5%脱脂奶粉封闭2 h,分别用相应的抗体anti-ANP(1∶5 000),anti-β-MHC(1∶1 000),anti-SOD1(1∶5 000),anti-SOD2(1∶1 000),anti-Trx2(1∶1 000)4°C孵育过夜.TBST洗膜后,加入二抗(1∶5 000)4°C孵育2 h.用ECL发光试剂盒显影,以GAPDH(1∶5 000)为内参照,扫描灰度值并分析蛋白表达相对含量.

表1 qRT-PCR引物序列Table 1 Sequences of the primers for qRT-PCR
1.2.6统计学处理
用SPSS 21.0统计软件进行分析.数据均采用“均值±标准差”表示,组间比较采用单因素方差分析(one way ANOVA),两两比较独立样本t检验分析方法.P<0.05认为差异有统计学显著性.
2 实验结果
2.1MIF缺失加重皮下注射PE诱导的小鼠心肌肥厚
小动物心脏B超结果显示,皮下注射PE可诱发小鼠发生明显的心肌肥厚.与对照组相比,PE注射模型组心脏LVAWd,LVAWs,LVPWd,EF显著增加,而FS显著降低.与野生型小鼠相比,PE注射后MIF-KO小鼠心脏LVAWd和EF增加,FS降低更明显(见表2).小鼠心脏重量与体重比值结果也显示,PE注射可诱发小鼠发生明显的心肌肥厚,而MIF-KO小鼠心脏的肥大程度显著高于野生型小鼠(见图1).图1中HW(heart weight)为心脏重量,BW(body weight)为体重,相对于WT-saline,∗为P<0.05,∗∗为P<0.01,n=5~8.同样,Western Blot检测结果也证实,心肌肥大基因ANP,β-MHC表达水平在PE诱发心肌肥厚的小鼠心肌中显著升高,而MIF-KO小鼠心肌中ANP,β-MHC表达水平明显高于野生型小鼠(见图2).图2中,相对于WT-saline,∗为P<0.05,∗∗为P<0.01,n=5~8.
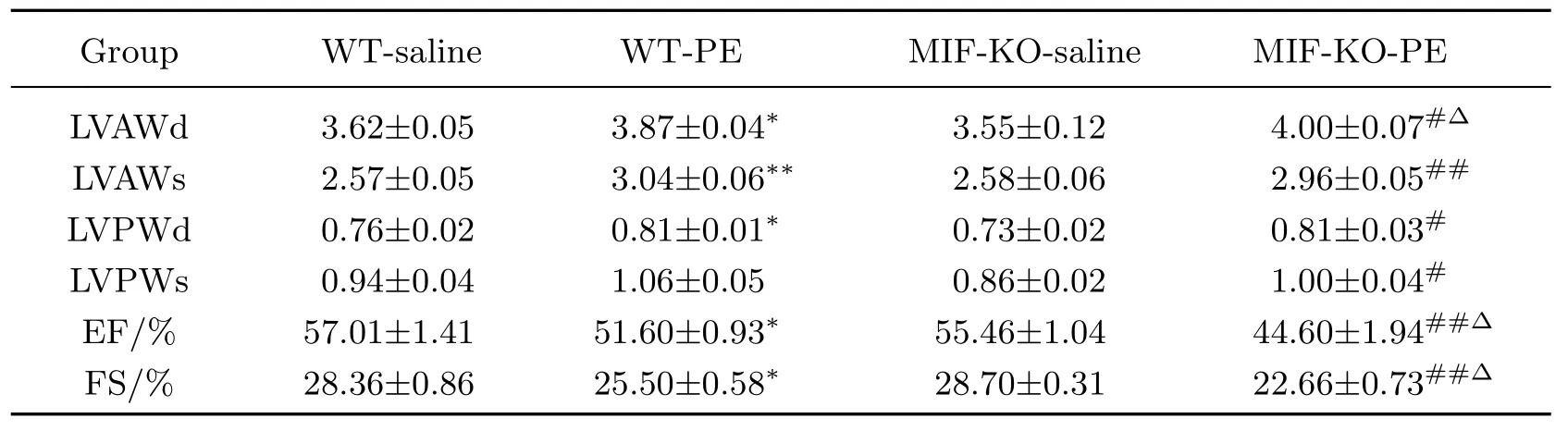
表2 利用超声心动图检测心脏功能Table 2 Assessment of the cardiac function by echocardiography
2.2MIF缺失加剧皮下注射PE诱导的小鼠心肌细胞凋亡
本研究利用TUNEL法检测小鼠的心肌细胞凋亡水平.TUNEL染色结果显示,皮下注射PE诱发心肌肥厚的小鼠心肌细胞凋亡水平明显升高;与野生型小鼠相比,PE注射后MIFKO小鼠心肌细胞凋亡率显著增加(见图3).图3中,相对于MIF-KO-saline,#为P<0.01,##为P<0.001,n=3~5.
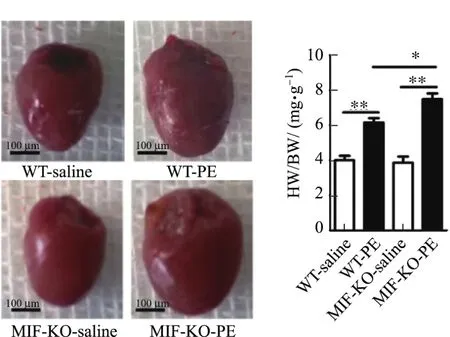
图1 皮下注射PE诱发的小鼠心肌肥厚Fig.1 Heart morphology of mice received hypodermic injection of PE
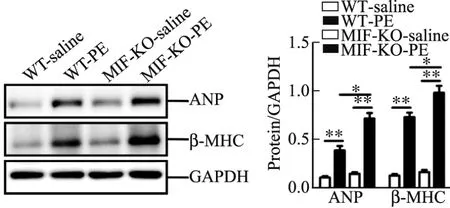
图2 皮下注射PE后小鼠心肌中ANP,β-MHC蛋白表达水平Fig.2 Protein expression of ANP and β-MHC in myocardium of mice received hypodermic injection of PE
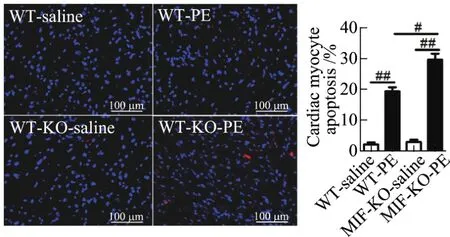
图3 TUNEL法检测皮下注射PE后小鼠心肌细胞凋亡水平Fig.3 Apoptosis of myocytes in myocardium of mice received hypodermic injection of PE by TUNEL assay
2.3MIF缺失降低小鼠心肌细胞中SOD1,Trx2表达水平
分别利用qRT-PCR和Western Blot法检测小鼠心肌中SOD1,SOD2和Trx2表达水平.qRT-PCR结果显示,与注射生理盐水对照组相比,PE注射后MIF-KO小鼠心肌中SOD1和Trx2表达水平明显降低(见图4).Western Blot结果亦确认PE注射后MIF-KO小鼠心肌中SOD1和Trx2表达水平明显降低.同时发现,PE注射后MIF野生型小鼠心肌中Trx2表达水平明显降低,而MIF-KO小鼠心肌中Trx2表达水平明显低于野生型小鼠(见图4).图4中,相对于WT-saline∗为P<0.05,∗∗为P<0.01,n=5~8.
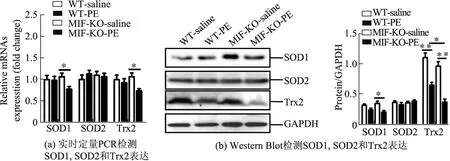
图4 皮下注射PE后小鼠心肌中SOD1,SOD2和Trx2的表达水平Fig.4 Expression of SOD1,SOD2 and Trx2 in the mouse myocardium after hypodermic injection of PE
3 讨论
MIF是一种由垂体和多种细胞分泌的多效蛋白分子,具有细胞因子、神经内分泌激素和酶等生物活性.MIF具有氧化还原酶活性,它包含一个巯基蛋白基序(cys57-x-x-cys60),具有类似过氧化物酶家族的氧化还原催化剂作用[5-6].已有研究发现,缺血再灌注后心肌中MIF分子Cys81的S-亚硝基化修饰增加,进而提高了MIF的抗氧化能力,降低了心肌细胞凋亡水平和心肌梗死面积[7].同时,MIF分子Cys81的S-亚硝基化修饰也有助于降低MIF与Jab1/CSN5的结合,从而保证心肌再灌注中MIF能够发挥生物学作用[8].也有研究发现,缺血再灌注中MIF可能通过维持较高的GSH/GSSG水平,降低蛋白氧化和线粒体损伤,从而减少心肌梗死面积并增强心肌收缩功能[9].除了内源性MIF的抗氧化活性,分泌到细胞外的MIF通过其CD74/CD44受体激活AMPK,Akt和ERK1/2信号通路,提高细胞存活率[10-11].
本研究利用皮下注射PE的方式诱导小鼠发生心肌肥厚.PE是α1肾上腺素能受体(α1-adrenoceptor,α1-AR)激动剂,可诱导心肌细胞肥大[12].本研究证实皮下注射PE可诱发明显的小鼠心肌肥厚,使心肌肥厚标志蛋白ANP和β-MHC表达水平升高,同时伴有细胞凋亡水平升高和心脏功能降低.与野生型小鼠相比,MIF-KO小鼠发生心肌肥厚、心脏功能降低和心肌细胞凋亡的程度均显著增加.上述研究结果表明,MIF缺失会加重PE诱导的心肌肥厚和心脏功能降低,提示MIF对心肌肥厚的发生有抑制作用.与本研究结果一致,已有研究显示利用MIF敲除小鼠建立的腹主动脉缩窄(abdominal aortic constriction,AAC)模型的心肌肥厚程度增加[2].同样地,通过建立小鼠横向主动脉弓缩窄(transverse aortic constriction,TAC)模型发现,MIF敲除小鼠的心肌肥厚程度和心肌纤维化程度显著增加[3].
氧化应激被认为是心肌肥厚发生的重要促发因素[13-14].本研究中,连续过量注射PE会对小鼠心脏造成毒害作用,引起较强的氧化应激反应和心肌细胞凋亡.与野生型小鼠相比,注射PE后MIF-KO小鼠心肌细胞凋亡的比例明显增加,更易引发代偿性的病理性心肌肥厚,这可能是导致MIF-KO小鼠心肌肥厚程度更显著的直接原因.检测抗氧化相关基因SOD1,SOD2和Trx2表达水平后发现,注射PE后MIF-KO小鼠心肌中SOD1和Trx2表达水平明显降低,尤其是MIF-KO小鼠比野生型小鼠心肌中Trx2表达水平降低更明显.因此,MIF缺失的小鼠心肌细胞中SOD1和Trx2表达水平降低可能促进了PE诱导的心肌细胞凋亡和心肌肥厚.与本研究结果相类似,已有研究发现,与野生型小鼠相比,在TAC诱发心肌肥厚的MIF-KO小鼠心肌中与ROS生成相关的NOX4显著上调,而清除ROS相关的SOD2和UCP3水平显著降低[3].
因此,本研究发现注射PE后MIF-KO小鼠比野生型小鼠发生心肌细胞调亡和心肌肥厚的程度显著增加,其可能的原因是MIF-KO小鼠心肌中发挥抗氧化作用的SOD1和Trx2表达水平显著降低所致.在后续研究中将进一步探讨MIF缺失降低抗氧化相关基因表达的分子机制.
[1]GRIEB G,MERK M,BERNHAGEN J,et al.Macrophage migration inhibitory factor(MIF):a promising biomarker[J].Drug News Perspect,2010,23:257-264.
[2]XU X,HUA Y,NAIR S,et al.Macrophage migration inhibitory factor deletion exacerbates pressure overload-induced cardiac hypertrophy through mitigating autophagy[J].Hypertension,2014,63:490-499.
[3]KOGA K,KENESSEY A,OJAMAA K.Macrophage migration inhibitory factor antagonizes pressure overload-induced cardiac hypertrophy[J].Am J Physiol Heart Circ Physiol,2013,304:H282-H293.
[4]SLAWSON S E,ROMAN B B,WILLIAMS D S,et al.Cardiac MRI of the normal and hypertrophied mouse heart[J].Magn Reson Med,1998,39:980-987.
[5]KLEEMANN R,KAPURNIOTU A,FRANK R W,et al.Disulfide analysis reveals a role for macrophage migration inhibitory factor(MIF)as thiol-protein oxidoreductase[J].J Mol Biol,1998,280:85-102.
[6]THIELE M,BERNHAGEN J.Link between macrophage migration inhibitory factor and cellular redox regulation[J].Antioxid Redox Signal,2005,7:1234-1238.
[7]LUEDIKE P,HENDGEN-COTTA U B,SOBIERAJSKI J,et al.Cardioprotection through S-nitros(yl)ation of macrophage migration inhibitory factor[J].Circulation,2012,125:1880-1889.
[8]SU H,LI J,MENON S,et al.Perturbation of cullin deneddylation via conditional Csn8 ablation impairs the ubiquitin-proteasome system and causes cardiomyocyte necrosis and dilated cardiomyopathy in mice[J].Circ Res,2011,108:40-50.
[9]KOGA K,KENESSEY A,POWELL S R,et al.Macrophage migration inhibitory factor provides cardioprotection during ischemia/reperfusion by reducing oxidative stress[J].Antioxid Redox Signal,2011,14:1191-1202.
[10]MILLER E J,LI J,LENG L,et al.Macrophage migration inhibitory factor stimulates AMP-activated protein kinase in the ischaemic heart[J].Nature,2008,451:578-582.
[11]QI D,HU X,WU X,et al.Cardiac macrophage migration inhibitory factor inhibits JNK pathway activation and injury during ischemia/reperfusion[J].J Clin Invest,2009,119:3807-3816.
[12]ZHANG T T,TAKIMOTO K,STEWART A F,et al.Independent regulation of cardiac Kv4.3 potassium channel expression by angiotensinⅡand phenylephrine[J].Circ Res,2001,88:476-482.
[13]MAULIK S K,KUMAR S.Oxidative stress and cardiac hypertrophy:a review[J].Toxicol Mech Methods,2012,22:359-366.
[14]SAG C M,SANTOS C X,SHAH A M.Redox regulation of cardiac hypertrophy[J].J Mol Cell Cardiol,2014,73:103-111.
Macrophage migration inhibitory factor deficiency aggravates cardiac hypertrophy induced by phenylephrine in mice
XIAO Zhen,ZHU Jiening,TANG Chunmei,LIN Qiuxiong,HU Zhiqin,ZHANG Zhuo,FU Yongheng,ZHANG Mengzhen,SHAN Zhixin
(Research Department of Medical Science,Guangdong Cardiovascular Institute,Guangdong Academy of Medical Sciences,Guangdong General Hospital,Guangzhou 510080,China)
To investigate the effect of macrophage migration inhibitory factor(MIF)deficiency on the cardiac hypertrophy induced by hypodermic injection of phenylephrine(PE)in mice.A mouse model of cardiac hypertrophy induced by hypodermic injection of PE was established based on MIF-knockout(MIF-KO)mouse and the wide type control(WT)mouse.The left ventricular(LV)structure and function variables were assessed by transthoracic echocardiography.Terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling(TUNEL)assay was performed to detect cardiomyocyte apoptosis.Expressions of SOD1,SOD2 and Trx2 were determined by real-time quantitative reverse transcription polymerase chain reaction(qRT-PCR)and Western Blot assay,respectively.①A mouse model of cardiac hypertrophy was achieved,induced by hypodermic injection of 20 mg/(kg·d)PE for 3 d.Compared with WT mice,PE injection induced more severe cardiac hypertrophy in MIF-KO mice.②TUNEL assay revealed that the level of PE injection-induced cardiomyocte apoptosis in the myocardium of MIF-KO mouse was higher than that in WT mice.③Expressions of SOD1 and Trx2 were significantly decreased in the myocardium of MIF-KO mice after PE injection,and reduction of Trx2 protein in myocardium of MIF-KO mice was more than that in WT mouse.MIF deficiency attenuates the expressions of SOD1 and Trx2,contributing to the aggravation of cardiomyocyte apoptosis and cardiac hypertrophy induced by hypodermic injection of PE in mice.
macrophage migration inhibitory factor(MIF);phenylephrine;cardiomyocyte;cardiac hypertrophy
R 329.21
A
1007-2861(2016)03-0336-08
10.3969/j.issn.1007-2861.2016.03.011
2016-04-19
国家自然科学基金资助项目(81270222,81470439);广东省自然科学基金资助项目(2014A030313635);广东省医学研究基金资助项目(A2015187)
单志新(1972—),男,研究员,博士生导师,博士,研究方向为心肌重构和心肌保护.
E-mail:zhixinshan@aliyun.com
