亚精胺对PEG渗透胁迫下白三叶种子萌发及幼苗抗旱效应的影响
2016-10-20彭丹丹王晓娟李亚萍
彭丹丹,王晓娟,李 州,李亚萍,彭 燕
(草业科学重点实验室 四川农业大学动物科技学院草业科学系,四川 成都 611130)
亚精胺对PEG渗透胁迫下白三叶种子萌发及幼苗抗旱效应的影响
彭丹丹,王晓娟,李 州,李亚萍,彭 燕
(草业科学重点实验室 四川农业大学动物科技学院草业科学系,四川 成都 611130)
以‘拉丁诺’白三叶(Trifoliumrepenscv. Ladino)为试材,研究不同浓度PEG-6000(聚乙二醇-6000)渗透胁迫下亚精胺(spermidine,Spd)对白三叶种子萌发和幼苗抗旱的影响。结果表明,20 μmol·L-1Spd浸种能够显著(P<0.05)提高10%和15% PEG-6000渗透胁迫下白三叶种子的萌发率和萌发指数,显著促进15% PEG-6000渗透胁迫下胚根的伸长生长和幼苗的单株鲜重,但对单株干重影响很小;20% PEG-6000渗透胁迫下,外源添加20 μmol·L-1Spd能不同程度地提高白三叶幼苗叶片超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性,降低电解质渗透率(EL)和丙二醛(MDA)含量,有效缓解叶片相对含水量(RWC)下降。表明渗透胁迫下Spd能有效促进白三叶种子的萌发,增强幼苗抗氧化能力,从而减轻渗透胁迫对白三叶幼苗的过氧化伤害,提高植株的耐旱性。
白三叶;渗透胁迫;亚精胺;种子萌发;抗氧化酶
白三叶(Trifoliumrepens)又称白车轴草,是优良的豆科牧草及草坪草,在我国西南和长江中下游等地区被广泛栽培和应用[1]。白三叶具有营养丰富、生长期长、草质柔嫩、粗纤维含量低、适口性好、产草量高等特点,为各种畜禽所喜食;又因其根系匍匐生长、扩展能力强、再生速度快,是较为理想的观花观叶冷季型草坪草。在国内外城镇绿化、水土保持、生态环境保护等方面起着重要作用。然而,白三叶喜冷凉湿润气候,根系浅,调控蒸腾能力弱,干旱成为限制其优质高产的主要因素之一[2]。
多胺(polyamines,PAs)作为新一类植物生长调节因子与信号分子,广泛参与植物多种生理过程,如种子萌发、形态建成、性别分化、果蔬成熟与衰老,并且在多种非生物胁迫条件下扮演着重要角色[3-5]。高等植物中常见的多胺包括腐胺(putrescine,Put)、尸胺(cadaverine,Cad)、亚精胺 (spermidine,Spd)和精胺(spermine,Spm)。研究表明,多胺作为一种小分子物质可能参与某些逆境信号的转导[6]。其中,以Spd与逆境胁迫关系的研究最为广泛,在植物抗逆中发挥着多方面重要的作用[7]。Spd浸种对植物种子的萌发具有促进作用,有利于提高干旱胁迫下种子的萌发率和种子的活力[8]。而且,萌发种子体内内源多胺(Spm和Spd)的含量还与种子的发芽能力呈一定的正相关关系[9]。此外,外源Spd还能有效缓解环境胁迫对种子幼苗的不利影响,如干旱[10]、低温[7]、高温[11]、高盐[12-13]等。干旱胁迫下外源喷施Spd显著降低番茄(Lycopersiconesculentum)幼苗O2-和H2O2以及MDA含量,诱导抗氧化酶活性及AsA和GSH含量升高,激发匍匐翦股颖(Agrostisstolonifera)内源多胺与其它植物激素含量增加,抗氧化酶活性增高[14-15],从而提高植物的抗旱能力。
随着全球气候环境的变化,干旱已成为限制农业可持续发展的重要因素。而种子萌发和幼苗建成是植物生命活动的初始阶段,其体内正经历着一个复杂的植物生理生化、物质代谢过程,易受内部或外部生长物质及环境因子调控的影响,干旱作为一种最主要的逆境因子,严重影响了种子萌发和幼苗建成时对环境的适应能力,从而直接或者间接影响植物后期的生长和发育[16-17]。已有研究表明,外源添加Spd能提高干旱胁迫下匍匐剪股颖抗氧化酶的活性[18]。在此基础上,本研究通过分析PEG渗透胁迫下Spd浸种预处理对白三叶种子萌发的影响,并结合水培法,探索根施Spd对渗透胁迫下白三叶幼苗抗氧化酶系统的影响,旨为探索提高逆境胁迫下植物建植的途径奠定理论基础,同时也丰富多胺在植物抗旱性方面的研究内容。
1 材料与方法
1.1供试材料
本研究以干旱敏感型白三叶‘拉丁诺’(T.repenscv. Ladino)种子为试材,供试种子来源于成都金种燎原种子有限公司。
1.2试验设计
1.2.1渗透胁迫下白三叶种子萌发试验选择两组籽粒饱满、大小一致的白三叶种子,先经0.1%的HgCl2消毒洗净后,用蒸馏水浸泡1 h,然后分别于Spd(浓度为20 μmol·L-1)和蒸馏水(作为对照CK)中浸泡2 h。该过程均在避光条件下进行。预处理的种子用蒸馏水反复冲洗数次后,选取50粒分别接种于经等体积的0、10%、15%、20%(w/w)PEG-6000渗透液浸湿的双层滤纸的培养皿中,每个处理4次重复。将培养皿置于光照培养箱中培养,光周期与昼夜温度分别为12 h/12 h,23 ℃/19 ℃,光照强度为350 μmol·(m2·s)-1,相对湿度为75%,并定期添加等量相应浓度的PEG-6000溶液,连续观察培养7 d,根据植物生长调节剂促进/抑制种子萌发试验准则[19]研究Spd浸种对不同浓度PEG-6000胁迫下白三叶种子萌发的影响。
1.2.2白三叶幼苗抗旱试验采用水培法培育白三叶幼苗。种子经HgCl2消毒后,均匀撒播在预先消毒的盛有石英砂的塑料育苗盆中,于24 h光照培养箱中(与上述培养箱环境一致)进行萌发,待种子出苗后更换为Hoagland’s营养液继续培养至30 d(第2片成熟叶片完全展开)时进行处理。试验共设3个处理组:1)对照(CK),使用Hoagland全营养液进行正常培养; 2)PEG,使用含有20%(w/w)PEG-6000的Hoagland全营养液进行水分胁迫处理;3)PEG+Spd,向Hoagland全营养液中加入20 μmol·L-1Spd后再加入20%(w/w)PEG-6000进行胁迫处理。每个处理4次重复,分别于处理后的0、4、8、12、16 d取样测定相关生理指标。
1.3指标测定及方法
1.3.1种子萌发相关指标的测定与方法于萌发后7 d时统计种子萌发相关指标。
萌发率(GR)=n/N×100%,
式中:n为萌发种子总数,N为供试种子数。
萌发指数(GI)=∑(Gt/Dt)。
式中:Dt为种子萌发数,Gt为相应萌发天数[20]。
胚根长及单株鲜、干重的测定:于每个处理的4次重复中各取15株幼苗,用直尺测量胚根长;再用干净的吸水纸吸干表面的处理液,称取鲜重,然后将样品用锡箔纸包裹置于105 ℃烘箱杀青45 min,再于75 ℃恒温72 h烘至恒重,称取样品干重[21-22]。
1.3.2幼苗抗旱生理指标测定与方法白三叶幼苗叶片粗酶液的提取:取0.1 g白三叶叶片,加入液氮用组织研磨机捣碎后,加入1.5 mL预冷的磷酸缓冲液(150 mmol·L-1,pH 7.0)和1%聚乙烯吡咯烷酮(PVP)充分冰浴研磨,4 ℃下15 000 r·min-1离心20 min,取上清液即为粗酶待测液,用于SOD、POD、CAT、APX、MDA以及可溶性蛋白含量的测定。
超氧化物歧化酶(SOD)活性采用核黄素-NBT法测定[23],过氧化物酶(POD)采用愈创木酚显色法测定[24],过氧化氢酶(CAT)采用紫外吸收法进行测定[22],抗坏血酸过氧化物酶(APX)活性参照Nakano和Asada[25]的方法测定,丙二醛(MDA)含量采用硫代巴比妥酸比色法测定[26],可溶性蛋白含量采用考马斯亮蓝法测定[27]。幼苗叶片相对含水量(RWC)采用烘干法测定并根据公式RWC=(鲜重-干重)/(饱和鲜重-干重)×100%进行计算[28];电解质渗透率(EL)采用电导率仪测定并根据公式[29]:相对电导率=煮前电导率/煮后电导率×100%计算。
1.4数据分析
每个试验处理随机设置4次重复。采用Excel 2003进行绘图与数据处理;SAS 8.0软件进行方差分析和显著性检验(P<0.05)。用平均值±标准误展示试验结果。种子萌发部分数据分析先分别对同一PEG浓度下不同处理进行单因素方差分析和多重比较,然后对同一处理不同PEG浓度进行单因素方差分析和多重比较,幼苗抗旱试验部分仅根据同一时间不同处理下的数据进行方差分析和多重比较。
2 结果
2.1Spd浸种对渗透胁迫下白三叶种子萌发的影响
2.1.1白三叶种子发芽能力正常条件下(PEG浓度为0),经Spd浸种处理与未经浸种处理的白三叶种子萌发的各项生理指标均没有显著差异(P>0.05)(图1)。渗透胁迫下,白三叶种子萌发率和萌发指数随PEG胁迫强度的增大而显著降低(P<0.05),且下降幅度逐渐增大。与未经Spd浸种处理相比,Spd浸种均不同程度地提高了渗透胁迫下白三叶种子萌发的各项指标,并在PEG浓度为10%和15%时达到显著影响(P<0.05),其萌发率和萌发指数较未浸种分别增高了3.6%、8.0%和4.6%、6.4%。当PEG浓度达到20%时,Spd浸种处理与未浸种处理之间已无显著差异(P≥0.05)(图 1)。
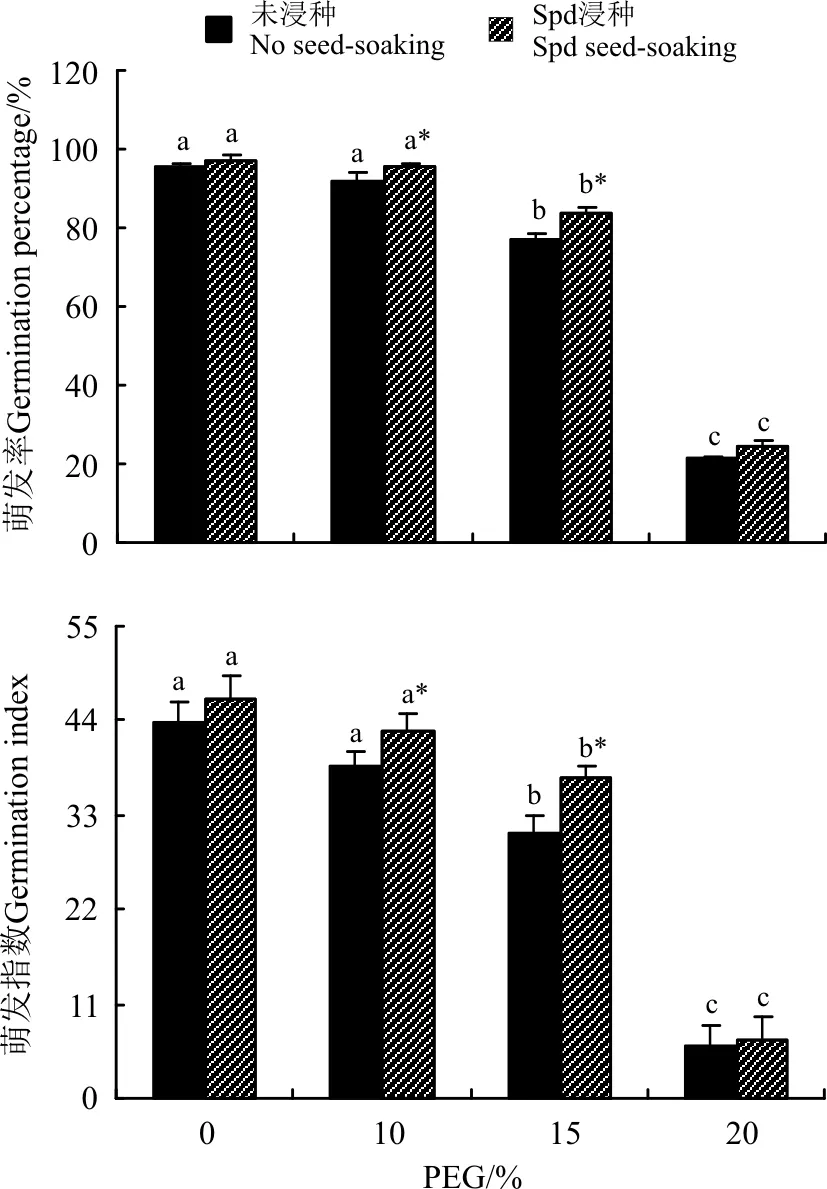
图1 亚精胺浸种对PEG渗透胁迫下白三叶 种子萌发能力的影响Fig.1 Effects of seed-soaking with spermidine on seed germination of white clover under osmotic stress
注:不同小写字母表示未浸种处理或者Spd浸种下不同PEG浓度间差异显著(P<0.05),“*”表示在同一PEG浓度下Spd浸种处理与未浸种处理间差异显著(P<0.05)。图2同。
Note: Different lower case letters for no seed-soaking or Spd seed soaking indicate significant difference among different PEG concentrations at 0.05 level, and * indicate significant difference between no seed-soaking and Spd seed soaking under the same PEG stress treatment at 0.05 level. The same in Fig.2.
2.1.2白三叶胚根长及幼苗单株鲜、干重 正常条件下(PEG浓度为0),Spd浸种处理能显著提高白三叶胚根长以及幼苗的单株鲜重(P<0.05)(图2)。PEG渗透胁迫均不同程度降低了白三叶种子胚根长以及幼苗的单株鲜、干重,并总体呈下降的趋势。随着PEG浓度的升高,胚根长和幼苗单株的鲜重下降幅度较为明显,幼苗干重下降幅度很小。Spd浸种处理有效提高了白三叶种子胚根长和幼苗鲜重,尤其在15% PEG胁迫下,较未浸种处理分别显著提高了20.46%和21.61%(P<0.05),而幼苗的干重几乎不受Spd浸种处理的影响,除20% PEG胁迫处理外,其它相同PEG浓度下浸种与未浸种间无显著差异(P≥0.05)(图2)。
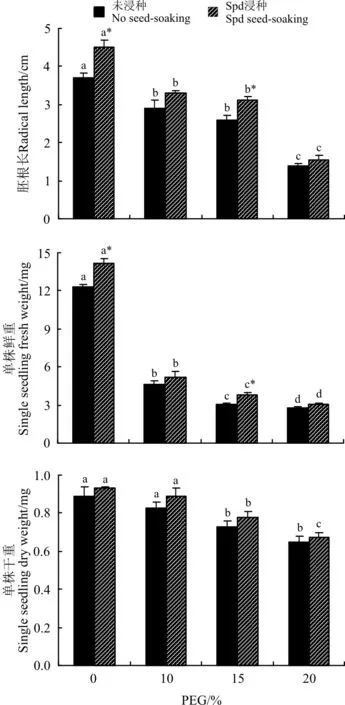
图2 亚精胺浸种对渗透胁迫下白三叶种子 胚根根长及单株鲜、干重的影响Fig.2 Effects of seed-soaking with Spermidine on root length, fresh weight and dry weight of white clover seedlings under osmotic stress
2.2Spd对渗透胁迫下白三叶幼苗抗旱性的影响
2.2.1Spd对白三叶叶片相对含水量(RWC)的影响PEG渗透胁迫显著降低了白三叶幼苗叶片的水分含量,并随着胁迫时间的延长总体呈下降趋势(图3)。外源添加Spd可明显减缓渗透胁迫下叶片相对含水量的降低,使植株在胁迫期间维持相对较高的水分含量,在胁迫的8和12 d时,与直接PEG胁迫相比,外源Spd使白三叶叶片相对含水量分别提高了18.60%和27.44%(P<0.05)。
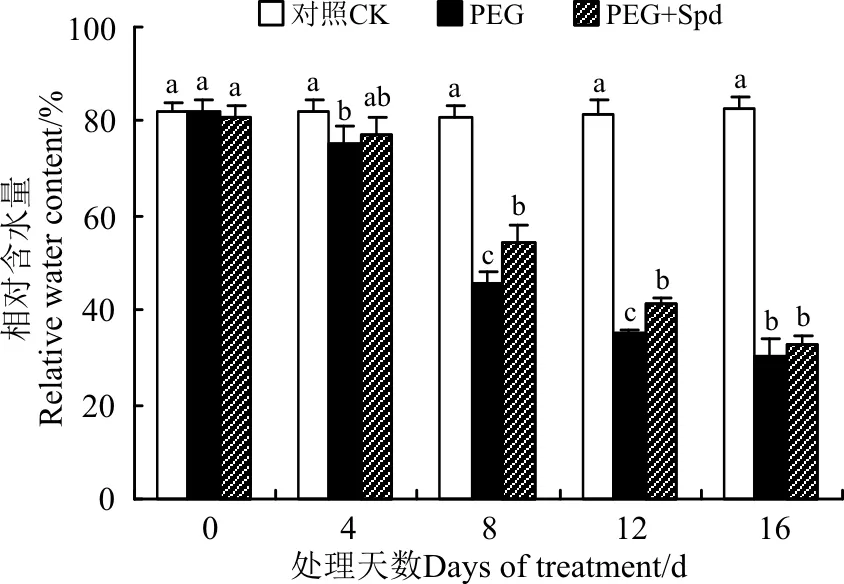
图3 亚精胺处理对渗透胁迫下白三叶叶片相对含水量的影响Fig.3 Effects of Spermidine on relative water content of white clover leaves under osmotic stress
注:不同小写字母表示同一时间不同处理间差异显著(P<0.05)。下同。
Note: Different lower case letters show significant difference among the different treatments at the same time at 0.05 level. The same below.
2.2.2Spd对白三叶叶片电解质渗透率(EL)及丙二醛(MDA)含量的影响PEG渗透胁迫下白三叶幼苗叶片电解质渗透率和MDA含量迅速升高,而外源添加Spd可有效抑制这种趋势,减轻渗透胁迫对细胞膜脂质的过氧化伤害,维持细胞膜的完整性。渗透胁迫4、8、12和16 d时,相比于直接PEG胁迫处理,外源添加Spd条件下电解质渗透率分别降低了26.08%、56.60%、18.36%和26.65%,MDA含量分别降低了12.34%、24.72%、27.36%和30.81%(P<0.05)(图4)。
2.2.3Spd对白三叶叶片抗氧化酶活性的影响外源Spd不同程度地影响了PEG渗透胁迫下白三叶叶片4种抗氧化酶的活性(图5)。渗透胁迫诱导SOD活性升高,外源添加Spd进一步诱导其活性的增强。在处于渗透胁迫的4和8 d时,外源添加Spd处理的SOD活性较直接PEG处理分别高出了12.39%和21.23%(P<0.05)(图5)。随着渗透胁迫时间的延长,POD活性总体呈降低的趋势,Spd处理可以有效减缓其下降的速率,使其POD活性显著高于直接PEG胁迫,缓解了渗透胁迫对POD活性的抑制作用(图5)。PEG胁迫下,CAT活性随PEG浓度的升高,呈先增高后降低的趋势,在胁迫8 d时,外源添加Spd处理的CAT活性显著高于直接PEG胁迫处理,提高了14.59%(图5)。渗透胁迫诱导激活了APX的活性,随着胁迫时间的延长,APX呈逐渐升高的趋势,外源添加Spd进一步提高了APX的活性,在胁迫的8 和12 d时较直接PEG处理分别增加了18.62%和23.86%(P<0.05)(图5)。
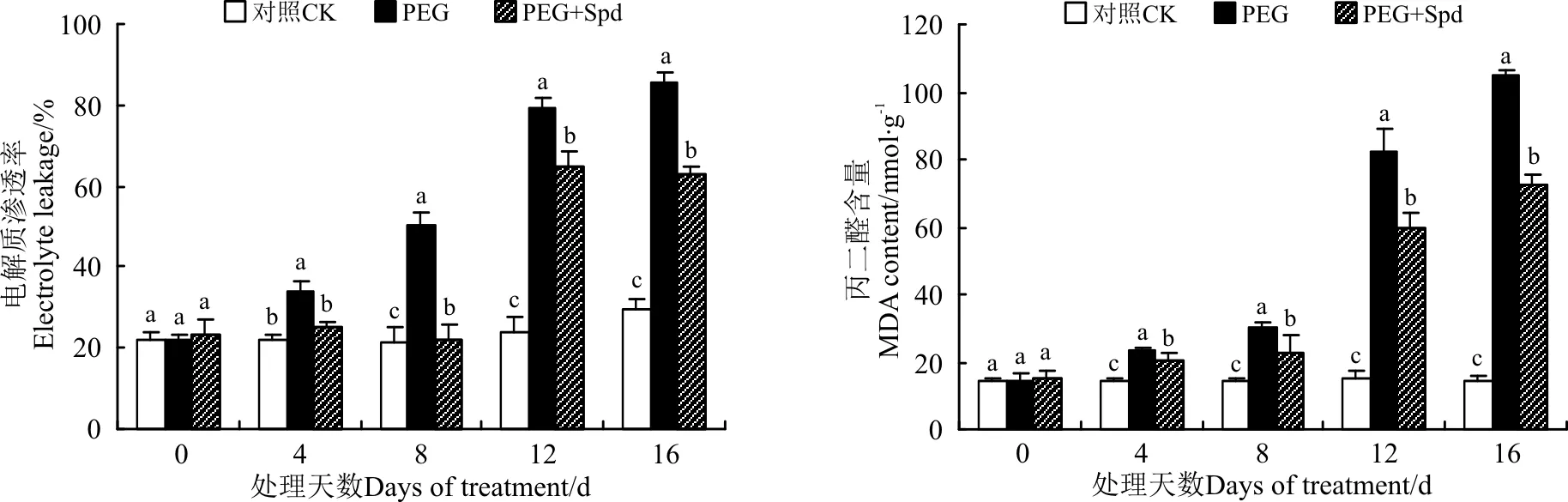
图4 亚精胺处理对胁迫下白三叶叶片电解质渗透率和丙二醛含量的影响Fig.4 Effects of spermidine on electrolyte leakage and MDA content of white clover leaves under osmotic stress
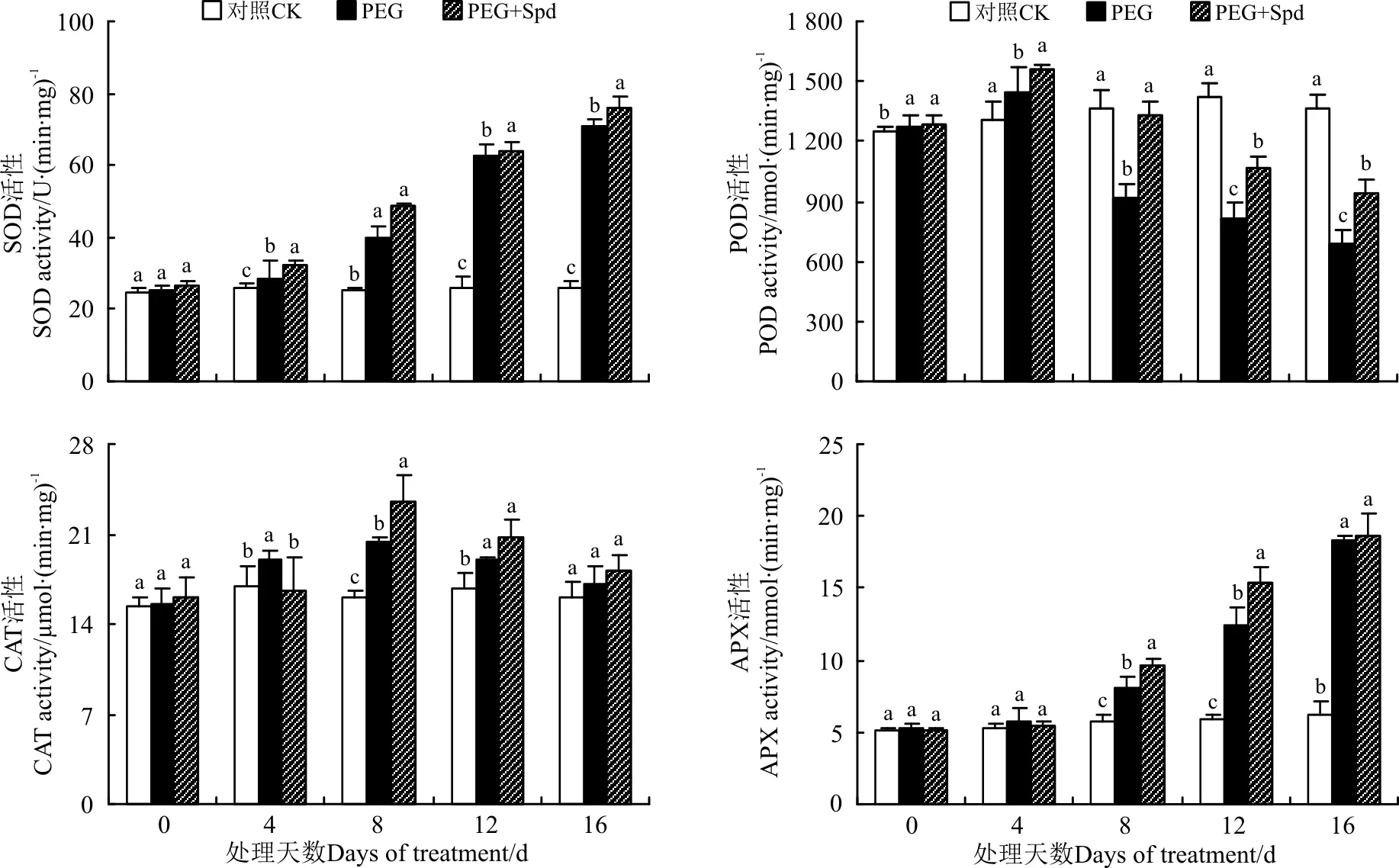
图5 亚精胺处理对渗透胁迫下白三叶叶片抗氧化酶活性的影响Fig.5 Effects of spermidine on antioxidant enzyme activities of white clover leaves under osmotic stress
3 讨论与结论
种子发芽的基本指标在一定程度上反映了种子发芽情况和幼苗对环境的适应能力[30],干旱等逆境胁迫具有显著影响种子萌发和幼苗生长时对环境适应能力的负面效应。多胺作为一种植物生长调节物质,可以促进番茄(Lycopersicon)[31]、玉米(Zeamays)[32]和莴苣(Lactucasativa)[33]等种子的萌发。本研究表明,Spd浸种处理对不同浓度PEG胁迫下供试白三叶种子的萌发均有一定的促进作用。正常条件下,Spd浸种处理能显著提高白三叶种子的胚根长和幼苗鲜重,而其余各项种子萌发的生理指标与未经浸种处理的均无明显的差异。随着渗透胁迫程度的加剧,Spd浸种处理对白三叶种子萌发的影响愈见明显,在PEG浓度为10%和15%下,其萌发率和萌发指数均显著高于直接PEG渗透胁迫,在15% PEG浓度下对种子胚根长和种子幼苗的单株鲜重具有显著的促进作用,但对种子幼苗的干重作用效果不明显。当PEG胁迫浓度达到20%时,Spd浸种处理与未浸种处理间已无显著差异。表明在一定的渗透胁迫范围内,Spd浸种处理能显著减缓PEG胁迫对白三叶种子萌发的抑制作用,当胁迫程度超出了Spd所能调控的范围,其缓解作用已非常微小。值得说明的是,本研究中,种子萌发时均在带盖的培养皿内进行,且保证各处理处于相同的试验环境并定时、定量地添加PEG溶液进行胁迫处理,始终保持滤纸处于湿润状态,确保了试验的合理性,但不能排除PEG溶液蒸发带来的试验误差。
叶片相对含水量反映了植物在逆境下自身保水能力的情况。本研究采用20% PEG产生的渗透胁迫引起了白三叶幼苗叶片相对含水量的显著降低。干旱胁迫下喷施Spd可减缓小麦(Triticumaestivum)叶片RWC的骤降,说明喷施Spd能够起到保水的作用[34]。本研究也发现,随着处理时间的延长,渗透胁迫程度不断加剧,白三叶叶片卷曲和萎蔫程度也逐渐加重,植株失水严重,在干旱胁迫的8和12 d时,外源Spd处理使白三叶叶片相对含水量比直接PEG胁迫提高了18.6%和27.44%(P<0.05),并表现出相对较轻的叶片萎蔫程度。表明外源Spd处理能有效减缓渗透胁迫下白三叶叶片的失水。
逆境胁迫下植物体内活性氧(ROS)迅速积累,过多的活性氧引发和加剧膜脂过氧化程度,细胞膜结构和稳定性遭到破坏,植物叶片电解质渗透率和MDA含量是显示细胞膜受损程度的重要指标[35]。植物受胁迫程度越大,叶片组织电解质渗透率和MDA含量越高[36]。本研究结果显示,随着渗透胁迫程度的加剧,白三叶幼苗叶片电解质渗透率和MDA含量不断增加,外源添加Spd能不同程度地减缓电解质渗透率和MDA含量的增高,降低膜脂过氧化程度,有效提高了渗透胁迫下白三叶叶片细胞膜结构的稳定性,减轻了PEG胁迫对白三叶幼苗生长的抑制作用。
植物在长期的进化过程中,形成了一套完整的抗氧化防御系统,增强了自身对外界不良环境的抵御能力,维持植物细胞内活性氧代谢的动态平衡,减轻植物受到的过氧化伤害[37]。SOD、POD、CAT和APX作为植物体内常见的抗氧化保护酶,其含量及活性高低反映机体内氧自由基及歧化反应产物H2O2的清除能力[38]。干旱胁迫能诱导大豆(Glycinemax)[39]、小麦[40]和玉米[41]等植株体内ROS清除酶活性的增强。多胺作为多聚阳离子化合物,对植物组织中的ROS自由基具有一定的清除作用。外源Spd通过提高大豆幼苗抗氧化酶活性以延缓大豆叶片叶绿素和蛋白质的降解速度[35]。本研究显示,PEG渗透胁迫诱导了白三叶幼苗SOD和 APX酶活性升高,POD和CAT酶活性先升高后降低,外源添加Spd不同程度地提高了SOD、POD 、CAT和APX酶的上升幅度,这一研究结果与水稻(Oryzasativa)[42-43]上的研究结果相一致。表明外源Spd能有效促进抗氧化保护酶活性的增高,从而减轻PEG胁迫对白三叶幼苗的过氧化伤害,提高白三叶幼苗的耐旱性。
综上所述,20 μmol·L-1Spd浸种能有效提高一定范围的PEG渗透胁迫下白三叶种子的萌发能力(萌发率、萌发指数及种子萌发时胚根的生长、植株的鲜、干重)和幼苗对逆境的适应能力。同时,外源添加Spd还能促进渗透胁迫下白三叶幼苗叶片的保水力,进一步诱导抗氧化保护酶活性的升高,降低膜脂过氧化程度,从而提高植株的耐旱性。
References:
[1]董宽虎,沈益新.饲草生产学.北京:中国农业出版社,1995:78-79.
Dong K H,Shen Y X.Forage Production.Beijing:Chinese Agriculture Press,1995:78-79.(in Chinese)
[2]李志亮,邢浩春,杨清,吴忠义,张秀海,黄丛林.白三叶转基因研究进展.北方园艺,2009,3(7):149-152.
Li Z L,Xing H C,Yang Q,Wu Z Y,Zhang X H,Huang C L.Advancement of the research on transgenic white clover.Northen Horticulture,2009,3(7):149-152.(in Chinese)
[3]Kusano T,Yamaguchi K,Berberich T,Takahashi Y.Advances in polyamine research in 2007.Journal of Plant Research,2007,120:345-50.
[4]Sarvajeet S G,Narendra T.Polyamines and abiotic stress tolerance in plants.Plant Signaling & Behavior,2010,5(1):26-33.
[5]Rubén A,Teresa A,Francisco M,Cristina B,Matthieu R,Csaba K,Pedro C,Antonio F T.Polyamines:Molecules with regulatory functions in plant abiotic stress tolerance.Planta,2010,231:1237-1249.
[6]Galston A W,Sawhney R K,Altabella T.Chilling-stress responses by rice seedlings growth with different ammonium concentrations and its relationship to leaf spermidine content.Journal of Plant Biology,2012,22:191-197.
[7]Yamamoto A,Shim I S,Fujihara S.Chilling-stress responses by rice seedlings grown with different ammonium concentrations and its relationship to leaf spermidine content.Journal of Plant Biology,2012,55:191-197.
[8]Farooq M,Basra S M A,Hussain M,Rehman H,Saleem B A.Incorporation of polyamines in the priming media enhances the germination and early seedling growth in hybrid sunflower (HelianthusannuusL.).International Journal of Agriculture and Biology,2007,9:868-872.
[9]Cao D D,Hu J,Zhu S J.Relationship between changes in endogenous polyamines and seed quality during development of sh 2 sweet corn (ZeamaysL.) seed.Scientia Horticulturae,2010,123(3):301-307.
[11]Tian J,Wang L P,Yang Y J,Sun J,Guo S R.Exogenous spermidine alleviates the oxidative damage in cucumber seedlings subjected to high temperatures.Jornal of the American Society for Horticultural Science,2012,137:11-19.
[12]He L,Ban Y,Inoue H,Matsuda N,Liu J,Moriguchi T.Enhancement of spermidine content and antioxidant capacity in transgenic pear shoots overexpressing apple spermidine synthase in response to salinity and hyperosmosis.Phytochemistry,2008,69:2133-2141.
[13]Parvin S,Lee O R,Sathiyaraj G,Khorolragchaa A,Kim Y J,Yang D C.Spermidine alleviates the growth of saline-stressed ginseng seedlings through antioxidative defense system.Gene,2014,537:70-78.
[14]张春梅,邹志荣,张志新.外源亚精胺对模拟干旱胁迫下番茄幼苗活性氧水平和抗氧化系统的影响.应用与环境生物学报,2009,15(3):301-307.
Zhang C M,Zou Z R,Zhang Z X.Effects of exogenous spermidine on reactive oxygen levels and antioxidative system of tomato seedling under polyethlene glycol stress.Chinese Journal of Applied Environment Biology,2009,15(3):301-307.(in Chinese)
[15]邹慧.亚精胺预处理诱导匍匐剪股颖抗旱性的生理机制研究.成都:四川农业大学硕士学位论文,2012,06.
Zou H.Mechanism research on drought tolerance ofAgrostisstoloniferaInduced by pretreatment of spermidine.Master Thesis.Chengdu:Sichuan Agricultural University,2012.(in Chinese)
[16]夏方山,毛培胜,闫慧芳,王明亚,郑慧敏,陈泉竹.水杨酸对植物种子及幼苗抗逆性的影响.草业科学,2014,31(7):1367-1373.
Xia F S,Mao P S,Yan H F,Wang M Y,Zheng H M,Chen Q Z.Effects of salicylic acid on stress resistance of seeds and seedling.Patacultural Science,2014,31(7):1367-1373.(in Chinese)
[17]赵波,杨秀云,沈向群.PEG与低温对法国百里香种子萌发的影响.草业科学,2015,32(11):1808-1814.
Zhao B,Yang X Y,Shen X Q.Effects of drought and cold stress on seeds germination ofThymusvulgaris.Patacultural Science,2015,32(11):1808-1814.(in Chinese)
[18]Zhou L,Hui Z,Yan P,Xin Q Z,Xiao M,Lin K H,Yan H Y.Exogenously applied spermidine improves drought tolerance in creeping bentgrass associated with changes in antioxidant defense,endogenous polyamines and phytohormones.Plant Growth Regulation,2015,76(1):71-82.
[19]中华人民共和国农业部农药室内生物测定试验准则 植物生长调节剂 第1部分:促进/抑制种子萌发试验 浸种法:中国,NY/T 2061.1-2011.
[20]Zhang S,Hu J,Zhang Y,Xie X J,Knapp A.Seed priming with brassinolide improves lucerne (MedicagosativaL.) seed germination and seedling growth in relation to physiological changes under salinity stress.Australian Journal of Agricultural Research,2007,58:811-815.
[21]高俊凤.植物生理学实验指导.北京:高等教育出版社,2006:144-148.
[22]李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:169-172.
[23]Giannopolitis C N,Ries S K.Superoxide dismutase I.Occurrence in higher plants.Plant Physiology,1977,59:309-314.
[24]Chance B,Maehly A C.Assay of catalase and peroxidase.Methods in Enzymology,1955,2:764-775.
[25]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts.Plant and Cell Physiology,1981,22:867-880.
[26]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry,1976,72:248-254.
[27]Dhindsa R S,Dhindsa P,Thorpe T A.Leaf senescence:Correlated with increased leaves of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase.Journal of Experiment Botany,1981,32:93-101.
[28]Barrs H D,Weatherley P E.A re-examination of the relative turgidity technique for estimating water deficits in leaves.Australian Journal of Biological Science,1962,15:413-428.
[29]Blum A,Ebercon A.Cell membrane stability as a measure of drought and heat tolerance in wheat.Crop Science,1981,21:43-47.
[30]Delachiave M E A,Pinho S Z.Germination ofSennaoccidentalislink:Seed at different osmotic potential levels.Brazilian Archives of Biology and Technology,2003,46(2):163-166.
[31]胡晓辉,邹志荣,杨振超.亚精胺对盐胁迫下番茄种子萌发的影响.北方园艺,2009,11(7):1-3.
Hu X H,Zou Z R,Yang Z C.Effects of exogenous spermidine on the germination of tomato seeds under salt stress.Northen Horticulture,2009,11(7):1-3.(in Chinese)
[32]张少颖,任小林,程顺昌,李善菊.外源一氧化氮供体浸种对玉米种子萌发和幼苗生长的影响.植物生理学通讯,2004,40(3):309-310.
Zhang S Y,Ren X L,Cheng S C,Li S J.Effects of seed soaking with exogenous nitric oxide on the seed germination and seedling growth of maize.Plant Physiology Communications,2004,40(3):309-310.(in Chinese)
[33]白旭,苏国兴,孙娜,王立伟,顾福根.外源多胺对莴苣种子萌发诱导及其与一氧化氮的关系.西北植物学报,2009,29(9):1860-1866.
Bai X,Su G X,Sun N,Wang L W,Gu F G.Relationship between exogenous polyamines and nitric oxide and their induced effects on lettuce seed germination.Acta Botanica Boreali-Occidentalia Sinica,2009,29(9):1860-1866.(in Chinese)
[34]史留功,周琳,刘怀攀.亚精胺浸种对小麦幼苗抗渗透胁迫能力的影响.河南农业科学,2008,7:29-32.
Shi L G,Zhou L,Liu H P.Effects of seed soaking with exogenous spermidine on tolerance of wheat (TriticumaestivumL.) seedling to osmotic stress.Journal of Henan Agricultural Science,2008,7:29-32.(in Chinese)
[35]柏素花.外源亚精胺对大豆离体叶片衰老的影响.中国农学通报,2008,24(6):243-246.
Bo S H.Effects of exogenous spermidine on senescence of detached soybean leaves.Chinese Agricultural Science Bulletin,2008,24(6):243-246.(in Chinese)
[36]金忠民,沙伟,臧威,孙微,柴华.干旱胁迫对白三叶幼苗保护酶的影响.东北林业大学学报,2010,38(7):52-53.
Jin Z M,Sha W,Zang W,Sun W,Chai H.Effects of drought stress on protective enzymes ofTrifoliumrepensseedlings.Journal of Northeast Forestry University,2010,38(7):52-53.(in Chinese)
[37]孙娜.多胺和一氧化氮信号分子在莴苣幼苗根系发育中的相互作用.苏州:苏州大学硕士学位论文,2011.
Sun N.The Interaction between polyamines and no signalling molecule in the process of root growth and development in lettuce seedlings.Master Thesis.Suzhou:Soochow University,2011.(in Chinese)
[38]何淼,徐鹏飞,赵保成,李海芯,李强,张彦妮.中国芒幼苗对 PEG 胁迫的生理响应.草业科学,2014,31(2):243-249.
He M,Xu P F,Zhao B C,Li H X,Li Q,Zhang Y N.Physiological responses ofMiscanthussinensisseedlings to PEG water stress.Patacultural Science,2014,31(2):243-249.(in Chinese)
[39]张胜,刘怀攀,陈龙,刘友良.亚精胺提高大豆幼苗的抗旱性.华北农学报,2005,20(4):25-27.
Zhang S,Liu H P,Chen L,Liu Y L.Spermidine enhanced resistance of soybean seedling under water stress.Acta Agriculturae Boreali-Sinica,2005,20(4):25-27.(in Chinese)
[40]段辉国,雷韬,卿东红,席德慧,孙歆,单娟,林宏辉.亚精胺对渗透胁迫小麦幼苗生理活性的影响.四川大学学报:自然科学版,2006,43(4):922-926.
Duan H G,Lei T,Qing D H,Xi D H,Sun X,Shan J,Lin H H.The Effects of spermidine physiological activities of wheat seedlings under osmotic stress.Journal of Sichuan University:Natural Science Edition,2006,43(4):922-926.(in Chinese)
[41]徐勤虎,董树亭,高荣岐.外源果糖、葡萄糖与一氧化氮供体(SNP)对玉米种子萌发的影响.玉米科学,2008,16(3):309-310.
Xu Q H,Dong S T,Gao R Q.The effects of exogenous glucose,fructose and no donor sodium nitroprusside(SNP) on maize seed germination.Journal of Maize Science,2008,16(3):309-310.(in Chinese)
[42]Mostofa M G,Yoshida N,Fujita M.Spermidine pretreatment enhances heat tolerance in rice seedlings through modulating antioxidative and glyoxalase systems.Plant Growth Regulation,2014,73:31-44.
[43]Farooq M,Wahid A,Lee D J.Exogenously applied polyamines increase drought tolerance of rice by improving leaf water status,photosynthesis and membrane properties.Acta Physiologiae Plantarum,2009,31:937-945.
(责任编辑武艳培)
Effects of spermidine on seed germination and seedling drought resistance of white clover under osmotic stress induced by PEG
Peng Dan-dan, Wang Xiao-juan, Li Zhou, Li Ya-ping, Peng Yan
(Key Laboratory of Grassland Science, Faculty of Animal Science and Technology, Sichuan Agricultural University, Huimin Street 211, Chengdu 611130, China)
The aim of this study was to investigate the effect of spermidine (Spd) on seed germination and seedling drought resistance ofTrifoliumrepenscv. Ladino under osmotic stress induced by different concentration of polyethylene glycol 6000 (PEG-26000). The results showed that 20 μmol·L-1Spd soaking significantly enhanced seed germination percentage and germination index under 10% and 15% PEG solution, and increased radicle length and seedling fresh weight under 15% PEG solution, whereas had no effect on dry weight. Meanwhile, when exposed to 20% PEG, seedlings treated with 20 μmol·L-1Spd showed a higher antioxidant enzymes activities including SOD, POD, CAT and APX, and leaf RWC, and decreased the electrolyte leakage and MDA content compared to control. In conclusion, these results indicated that Spd can effectively promote the ability of seed germination and environmental adaptability of whiter clover seedlings under osmotic stress, protect the structure of cell membrane, and alleviate the oxidative damage induced by osmotic stress resulting in the improved drought tolerance of white clover.
white clover; osmotic stress; spermidine; Seed germination; antioxidant enzyme
Peng YanE-mail:pengyanlee@163.com
10.11829/j.issn.1001-0629.2015-0657
2015-11-23接受日期:2016-05-30
国家自然科学基金(31372371);四川省科技支撑项目(2013NZ0013)
彭丹丹(1992-),女,陕西汉中人,在读硕士生,主要从事草坪草逆境生理与分子机制研究。E-mail:Diana-Peng@hotmail.com
彭燕(1970-),女,四川成都人,教授,博士,主要从事草坪草、牧草逆境生理及种质资源方面的研究。E-mail:pengyanlee@163.com
S541+203.4;Q945.78
A
1001-0629(2016)9-1739-08*
彭丹丹,王晓娟,李州,李亚萍,彭燕.亚精胺对PEG渗透胁迫下白三叶种子萌发及幼苗抗旱效应的影响.草业科学,2016,33(9):1739-1746.
Peng D D,Wang X J,Li Z,Li Y P,Peng Y.Effects of spermidine on seed germination and seedling drought resistance of white clover under osmotic stress induced by PEG.Pratacultural Science,2016,33(9):1739-1746.
