不同程度间歇低氧对3T3-L1脂肪细胞NF-κB、IL-10和内脂素的影响
2016-10-20韩苗苗周芹冯靖牛文彦何庆
韩苗苗,周芹,冯靖,牛文彦,何庆△
不同程度间歇低氧对3T3-L1脂肪细胞NF-κB、IL-10和内脂素的影响
韩苗苗1,周芹2,冯靖3,牛文彦4,何庆2△
目的测定不同程度间歇低氧(IH)处理的脂肪细胞中核因子(NF)-κB、白细胞介素(IL)-10及内脂素水平的变化,探讨IH导致胰岛素抵抗的机制。方法建立阻塞性睡眠呼吸暂停(OSA)模式间歇低氧/再氧合(IH/ ROX)细胞模型,将分化成熟的脂肪细胞3T3-L1随机分为10组,包括4个不同程度IH组(IH1、IH2、IH3、IH4,先充入1.5%O245 s,各组分别充入21%O22 min 15 s、4 min 15 s、5 min 45 s、8 min 45 s,每组60个循环)及各自的正常氧对照组(SC1、SC2、SC3、SC4,将各IH组中1.5%O2改为21%O2,其余同IH组处理)、持续低氧组(CH,10%O26 h)及持续正常氧对照组(CC,21%O26 h)。采用双抗夹心酶联免疫吸附试验(ELISA)法测定3T3-L1上清液中IL-10和内脂素水平;采用Western Blotting法测定脂肪细胞内脂素及细胞核NF-κB p65的蛋白水平;采用real-time PCR方法测定脂肪细胞IL-10、内脂素的mRNA水平。结果IH组和CH组IL-10蛋白及mRNA的表达水平明显低于各自对照组(P<0.01)。IH和CH组NF-κB p65蛋白水平高于各自对照组。IH1、IH2组和CH组内脂素蛋白及mRNA的表达水平高于各自对照组(P<0.01)。结论IH作为OSA的主要病生理特征,其可能通过导致脂肪细胞NF-κB、IL-10和内脂素的分泌异常,参与OSA患者胰岛素抵抗的发生。
睡眠呼吸暂停,阻塞性;间歇低氧;胰岛素抵抗;NF-κB;烟酰胺磷酸核糖基转移酶;白细胞介素10;内脂素
阻塞性睡眠呼吸暂停(OSA)是一种睡眠期间上气道反复发生完全(呼吸暂停)或部分(低通气)塌陷导致的以间歇低氧(IH)、高碳酸血症、胸内压改变和夜间反复觉醒为特征的常见慢性疾病。OSA在30~60岁人群中患病率为2%~4%,在老年人群中患病率约15%[1],严重影响患者的生活质量和寿命。研究表明,OSA是独立于肥胖等因素外导致胰岛素抵抗(IR)的重要危险因素[2]。作为OSA的主要病理特征,IH对机体造成的损伤更加严重,可引起系统性炎症,在代谢功能障碍的发生发展中起关键作用。目前,IH促进代谢紊乱的确切机制尚不完全清楚,其可能机制为交感神经持续兴奋和下丘脑-垂体-肾上腺轴兴奋性增高、活性氧(ROS)形成、核因子(NF)-κB等促炎通路的激活、抗炎细胞因子白细胞介素(IL)-10水平下降及内脂素水平改变等[2]。本研究通过建立脂肪细胞不同程度IH模型,探讨不同程度的IH对脂肪细胞中NF-κB、IL-10和内脂素分泌的影响,为临床治疗提供实验数据和理论基础。
1 材料与方法
1.1实验材料3T3-L1前脂肪细胞株(加拿大Amira Klip教授惠赠),细胞质提取液A、细胞质抽提液B、细胞核抽提液(美国,ActiveMotif),IL-10和内脂素酶联免疫吸附试验(ELISA)试剂盒(美国Invitrogen公司),β-actin引物序列(北京华大基因),内脂素、IL-10引物序列(北京奥科生物技术有限责任公司)。
1.2主要仪器细胞孵育箱(Thermo Electron Corporation,Model 3111),空气压缩装置(鞍山佳诚空压机有限公司),血气分析仪(瑞士AVILOMNI血气自动分析仪),高纯总RNA快速提取试剂盒(北京百泰克生物技术有限公司),real-time PCR仪7500型(Applied Biosystems,美国)。
1.3方法
1.3.1IH暴露脂肪细胞及分组参考文献[3],对3T3-L1前脂肪细胞株进行培养、诱导分化、处理。将分化成熟的细胞随机分为10组,包括4个不同程度IH组(IH1、IH2、IH3、IH4,先充入1.5%O245 s,各组分别充入21%O22 min 15 s、4 min 15 s、5 min 45 s、8 min 45 s,每组60个循环)及各自的正常氧对照组(SC1、SC2、SC3、SC4,将IH组中1.5%O2改为21% O2,其余同IH组处理)、持续低氧组(CH,10%O26 h)及持续正常氧对照组(CC,21%O26 h)。所有氧舱均放置在37℃细胞孵化器中,各实验组均在以上实验装置中每天暴露6 h,共暴露48 h。测定脂肪细胞培养基中的氧分压[p(O2)]、二氧化碳分压[p(CO2)]。
1.3.2标本采集与处理每组提取脂肪细胞培养基各3 mL。PBS清洗,刮下贴壁细胞,转移细胞悬液至离心管,4℃下600 r/min离心,收集细胞。细胞沉淀加入细胞质提取液A,漩涡振荡重悬细胞沉淀,冰浴后加入细胞质抽提液B,漩涡振荡后离心,弃去上清液;用细胞核抽提液重悬含细胞核的沉淀,反复重悬冰浴后离心,将上清液作为细胞核抽取物冻存待用。
1.3.3NF-κB p65、IL-10及内脂素的测定采用ELISA方法,严格按说明书进行操作,酶标仪测定脂肪细胞上清液中IL-10和内脂素平均吸光度(A)值,绘制标准曲线。采用Western blotting法测定脂肪细胞内脂素及细胞核NF-κB p65的蛋白水平,分别以β-actin和SP3蛋白水平作为内参。用real-time PCR检测脂肪细胞中IL-10、内脂素mRNA表达水平。PCR循环参数:95℃预变性5 min;95℃30 s,57℃1 min,72℃30 s,40个循环。以β-actin基因的表达量作为内参,结果以2-ΔΔCt表示。重复检测3次取平均值。
1.4统计学方法采用SPSS 17.0统计软件分析数据,数据以均数±标准差表示,组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1脂肪细胞IH模型成功建立成熟脂肪细胞胞质内含有串状脂滴,说明3T3-L1细胞已分化为成熟的脂肪细胞,见图1。IH组培养基p(O2)、p(CO2)及pH实测值范围分别为48.3~77.6 mmHg(1 mmHg= 0.133 kPa)、35.9~40.9 mmHg、7.33~7.42,本模型可在细胞水平产生IH暴露环境。
Fig.13T3-L1 adipocytes(HE staining,×10)图1 3T3-L1脂肪细胞(HE染色,×10)
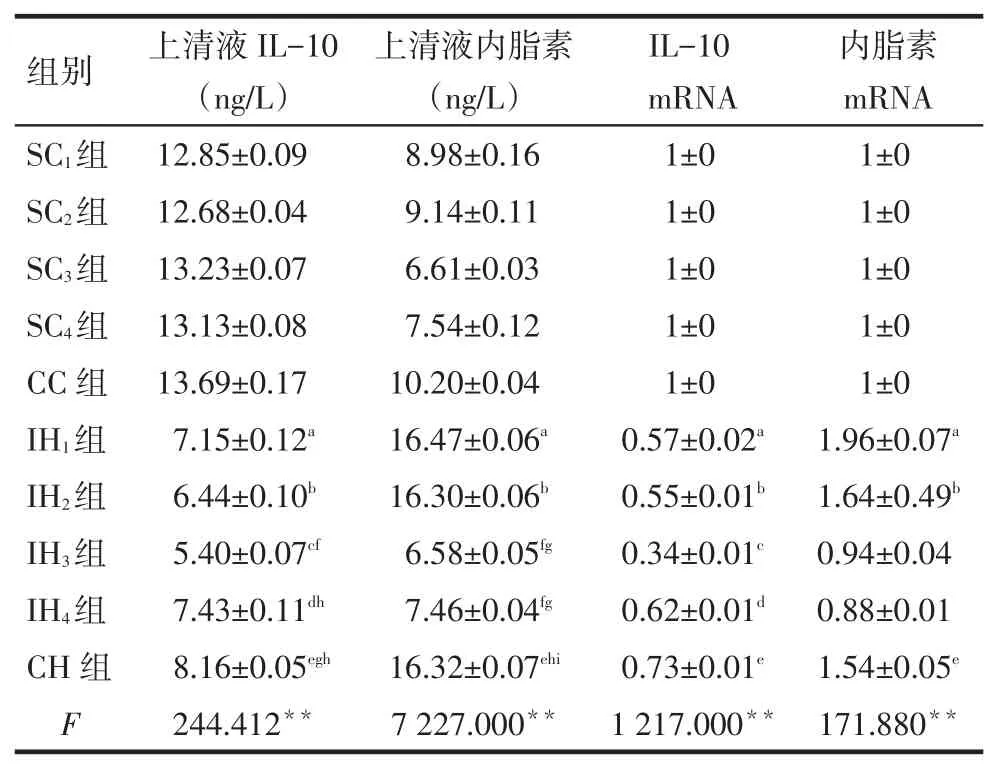
2.2上清液中IL-10、内脂素水平变化IH组和CH组细胞的上清内IL-10水平明显低于各自对照组(P<0.01),IH2、IH3组与CH组比较上清内IL-10含量降低(P<0.01),IH3组较IH1、IH4组明显降低(P<0.01)。IH1、IH2和CH组上清内脂素含量显著高于各自对照组(P<0.01),且IH3、IH4组上清内脂素含量明显低于IH1、IH2和CH组(P<0.01),见表1。
2.3脂肪细胞内脂素蛋白水平、NF-κB p65核转移变化IH1、IH2和CH组与SC1、SC2、CC组相比,内脂素蛋白表达量增多,而IH3、IH4组与SC3、SC4组相比,内脂素蛋白表达量降低,见图2。细胞核NF-κB p65蛋白水平在IH1~4组和CH组与SC1~4及CC组相比,蛋白表达量均升高;且IH组较CH组蛋白量增多明显,见图3。
2.4脂肪细胞IL-10和内脂素mRNA的水平结果显示,IL-10 mRNA表达IH组和CH组明显低于各自对照组。内脂素mRNA的表达IH1、IH2和CH组显著高于其各自对照组,见表1。
Tab.1The levels of supernate IL-10,visfatin protein and mRNA in different groups表1 各组脂肪细胞上清液中IL-10和内脂素蛋白及各组细胞中mRNA水平比较(n=3,)
Tab.1The levels of supernate IL-10,visfatin protein and mRNA in different groups表1 各组脂肪细胞上清液中IL-10和内脂素蛋白及各组细胞中mRNA水平比较(n=3,)
**P<0.01;a~d分别为与SC1~4组比较,e与CC组比较,f~i分别为与IH1~4组比较,P<0.01
内脂素mRNA 1±0 1±0 1±0 1±0 1±0 1.96±0.07a 1.64±0.49b 0.94±0.04 0.88±0.01 1.54±0.05e 171.880**组别SC1组SC2组SC3组SC4组CC组IH1组IH2组IH3组IH4组CH组F上清液IL-10(ng/L)12.85±0.09 12.68±0.04 13.23±0.07 13.13±0.08 13.69±0.17 7.15±0.12a 6.44±0.10b 5.40±0.07cf 7.43±0.11dh 8.16±0.05egh 244.412**上清液内脂素(ng/L)8.98±0.16 9.14±0.11 6.61±0.03 7.54±0.12 10.20±0.04 16.47±0.06a 16.30±0.06b 6.58±0.05fg 7.46±0.04fg 16.32±0.07ehi 7 227.000**IL-10 mRNA 1±0 1±0 1±0 1±0 1±0 0.57±0.02a 0.55±0.01b 0.34±0.01c 0.62±0.01d 0.73±0.01e 1 217.000**
3 讨论
3.1IH对脂肪细胞NF-κB分泌的影响在低氧状态下,脂肪细胞相应地表达大量的低氧反应基因并激活炎症因子转录来适应低氧状态,包括低氧诱导因子(HIF)-1和NF-κB等[4]。NF-κB通常与其抑制蛋白IκB相结合,IκB阻止NF-κB进入细胞核。炎性因子或细胞刺激因子暴露时,细胞信号转导通路激活,IκB降解,NF-κB由胞浆转位至胞核,调节炎症基因的转录激活,引发炎症反应[5]。研究证实,炎症反应是促进IR的一个重要因素。本实验结果显示,NF-κB p65蛋白水平在各IH组和CH组较各自对照组增加。与以往研究结果相符[6]。OSA模式下IH使NF-κB从IκB上解离,激活炎症因子转位至细胞核并转录,使机体处于炎症状态,导致胰岛素水平异常,诱导IR。Oliver等[7]研究表明IH主要通过经典信号通路的方式,增强NF-κB基础活性及LTα 1β2诱导的NF-κB活性。本研究还发现IH组脂肪细胞核NF-κB p65蛋白水平较CH组增加,说明IH后再氧合,产生ROS,亦可激活NF-κB,从而增加系统性炎症反应。
3.2IH对脂肪细胞IL-10分泌的影响IL-10具有炎症抑制作用,能抑制巨噬细胞和淋巴细胞介导的炎症免疫反应,抑制多种促炎细胞因子的生成,还可拮抗NF-κB对基因转录的活性[8]。研究表明,IL-10水平与胰岛素敏感性改善相关[9],而IL-10水平下降与IR发生有关[10]。IL-10可以通过胰岛素受体底物激活PI3K通路,并可以弱化肿瘤坏死因子(TNF)-α在脂肪细胞中的胰岛素受体信号,从而拮抗其毒害效应。本研究结果显示各IH组和CH组脂肪细胞的上清内IL-10水平的表达较各自对照组明显降低,这与既往研究相符。Li等[8]研究显示IH使大鼠血清IL-10水平下降,且在6周后达到最低点。另有研究表明,OSA患者IL-10水平降低,且其表达与OSA的严重程度呈负相关[11]。研究显示,脂联素诱导IL-10的表达,在OSA患者或动物及细胞IH模型中均已证明脂联素水平是下降的[12]。本研究中各IH组中IL-10水平均较对照组下降,笔者推测IH通过下调脂联素水平,使IL-10在3T3-L1脂肪细胞表达水平降低。本研究还发现IH3组较IH1、IH4组IL-10的水平明显降低。这与IH对IL-10的影响主要发生于再氧合阶段有关,IH3组比IH1、IH2组的再氧合时限长,炎症反应强,对细胞炎性损伤程度严重。而IL-10的水平并非随着再氧合时限的延长进一步降低,随着再氧合时限的延长,细胞功能有了恢复的时间,炎症反应反而减轻,故IH3组IL-10水平低于IH4组。
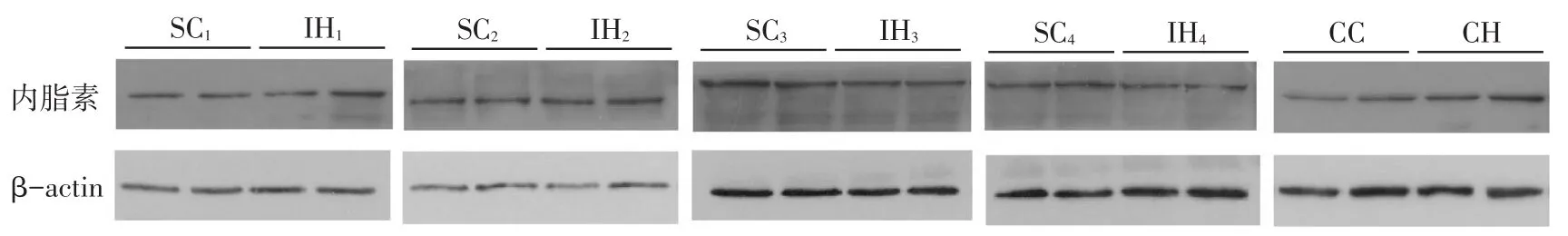
Fig.2The levels of visfatin protein in different groups图2 脂肪细胞内脂素的蛋白表达水平
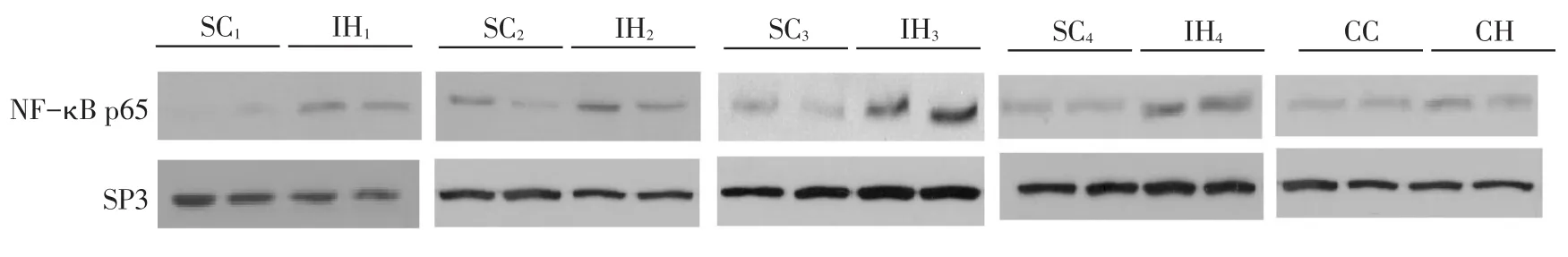
Fig.3The levels of NF-κB p65 protein in different groups图3 脂肪细胞核NF-κB p65的蛋白表达水平
3.3IH对脂肪细胞内脂素分泌的影响内脂素既是脂肪因子也是炎症因子,在IR状态下,其在血清中水平是升高的[13]。内脂素不仅可以通过类脂肪因子途径增加胰岛素的分泌,而且通过细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2和PI3K/蛋白激酶B(Akt)介导的通路,刺激β细胞增殖并抑制β细胞凋亡[14],说明内脂素对β细胞有潜在的积极影响。其与胰岛素受体结合,诱导胰岛素受体、胰岛素受体底物(IRS)-1和IRS-2的酪氨酸残基磷酸化,促进PI3K和IRS-1及IRS-2的结合;增加Akt和丝裂原活化蛋白激酶的磷酸化,表明内脂素具有类似胰岛素的降血糖作用[15]。本实验结果显示,与SC1、SC2、CC组相比,IH1、IH2和CH组脂肪细胞上清液内脂素蛋白和mRNA水平均明显增加。内脂素mRNA的表达通过缺氧诱导的HIF-1α途径激活,且HIF-1α诱导内脂素基因调控[16]。IH使NF-κB活性增高,从而促进内脂素的表达。ROS是OSA模式下IH导致内脂素生成增多的另一个原因。IR本身也是促进内脂素分泌的因素,当发生IR时,由于细胞感知到的胰岛素水平下降,生成更多的内脂素。因此,OSA模式下IH可以通过HIF-1α、NF-κB和JNK通路、糖皮质激素、炎症反应及氧化应激等途径促进内脂素的分泌。然而,在本研究中,IH3、IH4组蛋白及mRNA水平与其各自对照组无差异;考虑此时IH程度重,细胞炎症损害严重,上述促进内脂素生成的途径不能被激活有关。
综上,OSA模式IH与致炎因子的增加和抑炎因子的减少相关,IH作为OSA的主要病生理特征,可能是脂肪细胞炎症反应的基础,并参与OSA患者IR的发生。本研究在细胞水平讨论了IH所致炎症因子和脂肪因子的改变,为研究IH暴露后代谢和炎症改变的病生理分子机制提供了较好的实验依据。
[1]Feng J,Zhang D,Chen BY.Endothelial mechanisms of endothelial dysfunction in patients with obstructive sleep apnea[J].Sleep Breath,2012,16(2):283-294.doi:10.1007/s11325-011-0519-8.
[2]Hargens TA,Guill SG,Kaleth AS,et al.Insulin resistance and adipose-derived hormones in young men with untreated obstructive sleep apnea[J].Sleep Breath,2013,17(1):403-409.doi:10.1007/ s11325-012-0708-0.
[3]Yue JJ,Zhou Q,He Q,et al.Effect of different frequency of intermittent hypoxia on proinflammatory cytokines and adipokines in 3T3-L1 adipocytes[J].Tianjin Med J,2012,40(4):308-311.[岳晶晶,周芹,何庆,等.不同频率间歇低氧对3T3-L1脂肪细胞炎症因子和脂肪因子的影响[J].天津医药,2012,40(4):308-311].doi:10.3969/j.issn.0253-9896.2012.04.002.
[4]Michiels C,Minet E,Mottet D,et al.Regulation of gene expression by oxygen:NF-kappa B and HIF-1,two extremes[J].Free Radic Biol Med,2002,33(9):1231-1242.
[5]Taylor CT,Kent BD,Crinion SJ,et al.Human adipocytes are highly sensitive to intermittent hypoxia induced NF-kappaB activity and subsequent inflammatory gene expression[J].Biochem Biophys Res Commun,2014,447(4):660-665.doi:10.1016/j.bbrc.2014.04.062.
[6]Zhang J,Zheng L,Cao J,et al.Inflammation induced by increased frequencyofintermittenthypoxiaisattenuatedbytempol administration[J].Braz J Med Biol Res,2015,48(12):1115-1121.doi:10.1590/1414-431X20154487.
[7]Oliver KM,Garvey JF,Ng CT,et al.Hypoxia activates NF-kappa B-dependent gene expression through the canonical signaling pathway[J].Antioxid Redox Signal,2009,11(9):2057-2064.doi:10.1089/ARS.2008.2400.
[8]Li S,Qian XH,Zhou W,et al.Time-dependent inflammatory factor production and NFκB activation in a rodent model of intermittent hypoxia[J].Swiss Med Wkly,2011,141:w13309.doi:10.4414/ smw.2011.13309.
[9]Kim HJ,Higashimori T,Park SY,et al.Differential effects of interleukin-6 and-10 on skeletal muscle and liver insulin action in vivo[J].Diabetes,2004,53(4):1060-1067.
[10]Scarpelli D,Marina C,Francesco A,et al.Variants of the interleukin-10 promoter gene are associated with obesity and insulin resistance but not type 2 diabetes in Caucasian Italian subjects[J].Diabetes,2006,55:1529-1533.doi:10.2337/db06-0047.
[11]Qian X,Yin T,Li T,et al.High levels of inflammation and insulin resistance in obstructive sleep apnea patients with hypertension[J]. Inflammation,2012,35(4):1507-1511.doi:10.1007/s10753-012-9464-3.
[12]Yang QC,Zhou Q,Wang Y,et al.Effects of different degrees of intermittent hypoxia on inflammatory cytokines and adipokines in 3T3-L1 adipocytes[J].Tianjin Med J,2013,41(12):1142-1146.[杨庆婵,周芹,王彦,等.不同程度间歇低氧对3T3-L1脂肪细胞炎性细胞因子和脂肪因子的影响[J].天津医药,2013,41(12):1142-1146].doi:10.3969/j.issn.0253-9896.2013.12.002.
[13]Kowalska I,Karczewska-Kupczewska M,Adamska A,et al.Serum visfatin is differentially regulated by insulin and free Fatty acids in healthy men[J].J Clin Endocrinol Metab,2013,98(2):E293-297. doi:10.1210/jc.2012-2818.
[14]Cheng Q,Dong W,Qian L,et al.Visfatin inhibits apoptosis of pancreatic β-cell line,MIN6,via the mitogen-activated protein kinase/phosphoinositide 3-kinase pathway[J].J Mol Endocrinol,2011,47(1):13-21.doi:10.1530/JME-10-0106.
[15]Kershaw EE,Flier JS.Adipose tissue as an endocrine organ[J].J Clin Endocrinol Metab,2004,89(6):2548-2556.doi:10.1210/ jc.2004-0395.
[16]Mattu HS,Randeva HS.Role of adipokines in cardiovascular disease[J].J Endocrinol,2013,216(1):T17-36.doi:10.1530/ JOE-12-0232.
(2016-01-29收稿2016-06-23修回)
(本文编辑李鹏)
Effects of different degrees of intermittent hypoxia on NF-κB,IL-10 and visfatin in 3T3-L1 adipocytes
HAN Miaomiao1,ZHOU Qin2,FENG Jing3,NIU Wenyan4,HE Qing2△
1 Department of Endocrinology,Tianjin Xiqing Hospital,Tianjin 300380,China;2 Department of Endocrinology,3 Department of Respiratory Medicine,General Hospital of Tianjin Medical University;4 Tianjin Medical University△
E-mail:Hech69@hotmail.com
ObjectiveTo determine levels of nuclear factor(NF)-κB,interleukin(IL)-10,and visfatin in adipocytes treated by different degrees of intermittent hypoxia(IH),and to investigate the mechanism of IH leading to insulin resistance(IR).MethodsThe cell model of intermittent hypoxia/re-oxygenation(IH/ROX)in obstructive sleep apnea(OSA)was established.Differentiation mature 3T3-L1 adipocytes,were randomly divided into 10 groups including four differentfrequency intermittent hypoxia groups(IH1-4,fixed intermittent hypoxia scheme for 1.5%O245 s and then re-oxygen 21%O2for 2 min 15 s,4 min 15 s,5 min 45 s and 8 min 45 s,60 times circulation),and their normal oxygen control groups(SC1-4,instead each IH group 1.5%O2to 21%O2,the rest groups were treated as same as IH group),continuous hypoxia group(CH,10%O2for 6 h)and normal oxygen control group(CC,21%O2for 6 h).ELISA method was used to determine the levels of IL-10 and visfatin in the supematant of adipocytes.Western blot method was used to determine the protein levels of NF-κB p65 and visfatin.Real-time PCR method was used to determine the mRNA levels of IL-10 and visfatin.ResultsThe protein and mRNA expressions of IL-10 were significantly lower in IH group and CH group than those of control groups(P<0.01). The levels of NF-κB p65 protein were significantly increased in IH group and CH group than those of control group.The protein and mRNA expressions of visfatin were significantly higher in IH1,IH2and CH groups than those of control group(P<0.01).ConclusionAs a prominent feature of OSA pathophysiology,IH may take part in insulin resistance of OSA patients by abnormally secreting NF-κB,IL-10 and visfatin in adipocytes.
sleep apnea,obstructive;intermittent hypoxia;insulin resistance;NF-kappa B;nicotinamide phosphoribo⁃syltransferase;interleukin-10;visfatin
R587,R563
A
10.11958/20160041
1天津市西青医院内分泌科(邮编300380);2天津医科大学总医院内分泌科,3呼吸科;4天津医科大学
韩苗苗(1987),女,硕士研究生,住院医师,主要从事糖尿病研究
E-mail:Hech69@hotmail.com
