N-乙酰半胱氨酸对抑郁模型大鼠行为及神经递质的影响
2016-10-20罗国帅杨建立司纪剑王丽莉王承展
罗国帅,杨建立,司纪剑,王丽莉,王承展
N-乙酰半胱氨酸对抑郁模型大鼠行为及神经递质的影响
罗国帅1,杨建立2△,司纪剑2,王丽莉2,王承展1
目的观察N-乙酰半胱氨酸(NAC)对抑郁模型大鼠行为、各脑区单胺递质的影响,探讨NAC潜在的抗抑郁作用及机制。方法选取成年雄性SD大鼠32只,随机分为模型组、氟西汀(FLX)组、NAC组、对照组,每组8只;前3组单笼孤养,釆用连续6周慢性轻度不可预见性应激(CUS)的方法建立慢性抑郁大鼠模型,并于第3周末至第6周末对NAC组和FLX组分别给予NAC和FLX灌胃,模型组和对照组给予同体积生理盐水灌胃。CUS前、后及干预后以体质量测量、糖水消耗实验、旷场实验对大鼠行为进行评估;以库仑阵列电化学高效液相色谱法测定各组大鼠前额叶(PFC)、纹状体(ST)、杏仁核(AM)和海马(HIP)单胺神经递质去甲肾上腺素(NE)、5-羟色胺(5-HT)、多巴胺(DA)水平。结果(1)干预后对照组、NAC组、FLX组较模型组大鼠体质量增加多、糖水消耗量多、水平运动距离长、直立次数多、粪便粒数少(均P<0.05)。(2)与对照组相比,模型组大鼠前额叶、纹状体、杏仁核、海马等脑区单胺神经递质NE、DA和5-HT水平明显降低(均P<0.05);与模型组相比,NAC组、FLX组前额叶、纹状体、杏仁核、海马等NE、DA、5-HT浓度显著升高(均P<0.05)。结论NAC和FLX均可有效改善抑郁模型大鼠的抑郁行为,并在总体上提高前额叶、纹状体、杏仁核、海马等脑区单胺神经递质的水平。
抑郁症;乙酰半胱氨酸;氟西汀;物理刺激;大鼠,Sprague-Dawley
抑郁障碍(depression disorder)又称抑郁症(depression),是一种常见的、慢性、复发性精神科疾病[1]。抑郁症以显著而持久的心境抑郁及兴趣丧失为主要特点,临床上可伴有罪恶感、注意力下降、反复出现的自杀观念和行为等。Beyer等[2]研究显示,25%~50%的抑郁障碍患者一生中至少有1次自杀行为,其中约6%~19%死于自杀。随着社会的发展和社会压力的加大,抑郁障碍的发病率呈逐年上升,重度抑郁症全球患病率超过16%[3]。然而抑郁症的发病机制仍然并不完全清楚。
炎症/免疫反应在抑郁症发病中发挥作用的观点已得到广泛验证,但其机制并不完全清楚。有研究显示,在为期6个月的随机对照双盲试验中,服用N-乙酰半胱氨酸(NAC,1 000 mg每天2次)的患者较对照组蒙哥马利-艾斯伯格抑郁评分(Montgomer-Asberg Depression Rating Scale,MADRS)明显降低[4]。据此,本研究通过观察对抑郁模型大鼠灌胃NAC干预后的行为学及脑组织中单胺神经递质水平的改变,探讨NAC对抑郁症的作用,以期找到抑郁症治疗的新方案。
1 材料与方法
1.1实验材料
1.1.1实验动物清洁级成年雄性SD大鼠32只[许可证号:SYXK(京)2011-0039,北京维通利华实验动物技术有限公司],体质量180~200 g,喂养于湿度40%~50%,温度(20± 2)℃的独立通气笼(individual ventilated cages,IVC)系统,昼夜比为12 h/12 h(光照时间为07:00—19:00),食物和水充分供给,自由摄取。大鼠在动物房适应性饲养3 d后开始实验。本研究所有对动物的实验操作均遵守中国国家科学技术委员会颁布的《中华人民共和国实验动物管理条例》。
1.1.2药品及试剂NAC购自Sigma-Aldrich公司。氟西汀(fluoxetine hydrochloride,FLX)购自礼来苏州制药有限公司。注射用生理盐水(NS)购自北京化工厂。去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)购自美国Sigma公司。其余试剂均为实验室自制。
1.1.3主要设备与仪器Med旷场测验箱购自美国MED Associates公司;电子秒表(型号HS-80TW-1DF)购自日本CASIO公司;-80℃低温冰箱[MDF-C8V(N)]购自日本SANYO公司;冷冻高速离心机(Himac CR22)、台式高速离心机(Eppendorf)均购自日本HITACHI公司;组织匀浆器(Model PRO 2000)购自美国Pro Scientific公司;振荡仪(Vortex-Genie 2)购自Scientific Industries公司;ESA Model 5600A-HPLC系统购自惠泽(ESA)公司。
1.2方法
1.2.1动物分组及给药32只大鼠适应性喂养3 d,按照随机数字表法分为对照组、模型组、NAC组、FLX组,每组8只。对照组每笼4只、饲养6周,其余3组单笼孤养,接受6周造模,并于第3周末至第6周末对NAC组和FLX组分别给予NAC(150 mg/kg)和FLX(10 mg/kg)灌胃,模型组和对照组给予同体积生理盐水灌胃。各组均于每天上午9:00—10:00灌胃。
1.2.2慢性轻度不可预见性应激(CUS)参考Liu等[5]的抑郁症造模方法,每天随机给予7种应激因子中的1种,相同刺激不可连续出现,使大鼠不能预料刺激的发生,以避免产生适应性反应。应激因子包括:热应激(45℃,每次5 min,每天1次),潮湿垫料24 h,明暗颠倒24 h,夹尾巴(尾部近体端1/3处,每次1 min,每天1次),禁食24 h,禁水24 h,电击足底(电压60 V,每次电击10次,每次间隔5 s,每只大鼠每天10次)。
1.2.3行为评估采用体质量测量、糖水消耗实验和旷场实验分别于CUS前、后及干预后对大鼠行为进行评估。(1)体质量测量:记录CUS前、后和干预后体质量,并计算CUS后和干预后的体质量增加量。(2)糖水消耗实验:禁水24 h后,将所有大鼠均置于单笼内,给予1%浓度蔗糖水200 mL,1 h后取出水瓶并测量剩余糖水体积,以此作为糖水消耗量(mL)。(3)旷场试验:旷场设置于暗室,由不透明钢板制成,大小100 cm×100 cm×40 cm(长×宽×高),实验时将大鼠置于旷场的中心,由摄像机拍摄,Smart virsion2.5软件记录并分析大鼠5 min内的行为并记录运动总路程,人工同步记录大鼠直立次数、粪便粒数。实验前预跑30 s,每次实验后打扫旷场,清除粪便,并用医用乙醇擦拭以消除大鼠遗留气味。
1.2.4样本采集(1)大鼠最后一次行为学测试后各组大鼠断头取脑,置于预冷的PBS缓冲液中浸泡5 min,随即迅速于冰面上分离出前额叶(PFC)、纹状体(ST)、杏仁核(AM)和海马(HIP)组织,并根据实验要求分装2份于冻存管中,置于液氮中保存待测。(2)库伦列阵高效液相色谱法测定各组大鼠各脑区单胺神经递质的水平。以3,4二羟基苄胺(DHBA)为内标,测定大鼠各脑区NE、DA和5-HT的含量。色谱柱:Zorbax Eclipse XDB-18C(150 mm×4.6 mm,5 μm),加EasyGuard预柱;流动相:含一水柠檬酸80 mmol/L,柠檬酸三钠73.4 mmol/L,1-辛烷磺酸钠0.12 mmol/L,乙二胺四乙酸二钠0.1 mmol/L,18%甲醇的混合溶液,pH 4.3;流速1.0 mL/ min;柱温25℃;进样量10 μL;测定电极电势-150 mV和400 mV。
1.3统计学方法数据录入后使用Excel 2010进行整理,采用SPSS 16.0统计软件进行统计分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析(ANOVA),若存在差异,则进一步进行LSD-t法两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1CUS前大鼠行为评估各组大鼠在体质量、糖水消耗量、水平运动距离、直立次数以及粪便粒数差异均无统计学意义,各组大鼠行为基本一致,见表1。
Tab.1Comparison of behavioral assessment before CUS between four groups表1 CUS前各组大鼠行为测试结果比较(n=8,)
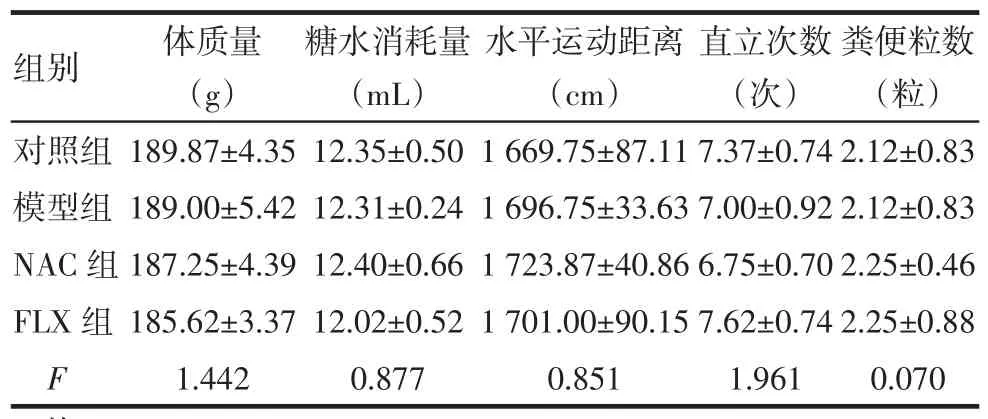
Tab.1Comparison of behavioral assessment before CUS between four groups表1 CUS前各组大鼠行为测试结果比较(n=8,)
均P>0.05
组别对照组模型组NAC组FLX组F粪便粒数(粒)2.12±0.83 2.12±0.83 2.25±0.46 2.25±0.88 0.070体质量(g)189.87±4.35 189.00±5.42 187.25±4.39 185.62±3.37 1.442糖水消耗量(mL)12.35±0.50 12.31±0.24 12.40±0.66 12.02±0.52 0.877水平运动距离(cm)1 669.75±87.11 1 696.75±33.63 1 723.87±40.86 1 701.00±90.15 0.851直立次数(次)7.37±0.74 7.00±0.92 6.75±0.70 7.62±0.74 1.961
2.2CUS后大鼠行为评估第21天后,模型组、NAC组、FLX组体质量增加量、大鼠糖水消耗量、水平运动距离、直立次数均较对照组少,粪便粒数多(P<0.05),而该3组间差异无统计学意义(均P>0.05),提示造模成功,见表2。
Tab.2Comparison of behavioral assessment after CUS between four groups表2 CUS后各组大鼠行为测试结果比较(n=8,)

Tab.2Comparison of behavioral assessment after CUS between four groups表2 CUS后各组大鼠行为测试结果比较(n=8,)
**P<0.01;a与对照组比较,P<0.05
组别对照组模型组NAC组FLX组F体质量增加量(g)119.75±9.75 57.25±3.84a 57.25±4.02a 57.13±4.94a 207.944**糖水消耗量(mL)12.73±0.47 7.62±0.47a 7.51±0.48a 7.51±0.47a 243.505**水平运动距离(cm)1 689.87±106.16 1 208.37±87.85a 1 212.50±95.11a 1 245.62±104.55a 45.137**直立次数(次)7.00±0.75 2.75±0.70a 2.62±0.74a 2.62±0.74a 69.005**粪便粒数(粒)2.25±0.70 4.12±1.24a 4.00±1.30a 4.25±1.03a 5.881**
2.3干预后大鼠行为评估干预后,模型组、NAC组、FLX组较对照组体质量增加量少,大鼠糖水消耗量少,但NAC组和FLX组均高于模型组。模型组较对照组水平运动距离短,直立次数少,粪便粒数多,而NAC组和FLX组较模型组水平运动距离长,直立次数多,粪便粒数少(P<0.05),且该2组与对照组差异无统计学意义(P>0.05)。上述指标在NAC组与FLX组间差异均无统计学意义(P>0.05),见表3。
Tab.3Comparison of behavioral assessment after intervention between four groups表3 干预后各组大鼠行为评估结果比较(n=8,)

Tab.3Comparison of behavioral assessment after intervention between four groups表3 干预后各组大鼠行为评估结果比较(n=8,)
**P<0.01;a与对照组比较,b与模型组比较,P<0.05
组别对照组模型组NAC组FLX组F体质量增加量(g)110.75±11.97 53.75±4.03a 74.25±2.54ab 75.25±4.23ab 97.464**糖水消耗量(mL)12.76±1.08 5.36±0.21a 8.17±0.53ab 8.26±0.58ab 162.985**水平运动距离(cm)1 540.1±77.2 834.3±55.6a 1 352.1±78.0b 1 397.5±72.7b 149.130**直立次数(次)5.87±1.12 2.37±0.74a 4.00±1.06b 4.25±1.28b 14.253**粪便粒数(粒)2.37±0.91 5.00±1.19a 2.75±1.03b 2.62±1.18b 10.000**
2.4干预后大鼠各脑区单胺神经递质结果干预后,模型组较对照组各脑区单胺神经递质水平均降低,NAC组、FLX组较模型组水平均升高(P<0.05);但NAC组和FLX组前额叶DA、NE水平,海马区DA水平仍低于对照组,而该2组4个脑区其他指标水平与对照组差异无统计学意义(P>0.05),见表4。
Tab.4Comparison of monoamine neurotransmitters of brain regions between four groups表4 各组大鼠各脑区单胺神经递质水平比较(n=8,)

Tab.4Comparison of monoamine neurotransmitters of brain regions between four groups表4 各组大鼠各脑区单胺神经递质水平比较(n=8,)
**P<0.01;a与对照组比较,b与模型组比较,P<0.05
脑区前额叶杏仁核海马纹状体组别对照组模型组NAC组FLX组F对照组模型组NAC组FLX组F对照组模型组NAC组FLX组F对照组模型组NAC组FLX组F DA(μg/L)268.37±19.40 114.50±10.54a 193.75±29.78ab 209.12±26.68ab 61.635**74.75±6.39 34.25±6.34a 65.25±7.46b 62.63±11.11b 37.434**146.75±16.87 47.12±9.61a 108.75±20.73ab 105.87±15.25ab 52.068**5 474.41±536.61 2 991.25±282.24a 4 616.75±673.38b 5 021.50±453.20b 36.456**NE(mg/L)219.37±42.27 95.37±21.48a 139.50±22.78ab 191.62±37.07ab 22.987**401.13±25.51 178.63±28.96a 362.87±38.16b 370.87±31.90b 83.438**456.50±30.42 218.12±29.00a 364.37±31.28b 365.62±38.98b 72.971**193.00±44.73 65.12±24.89a 174.75±22.88b 188.75±43.41b 23.437**5-HT(μg/L)302.87±34.62 118.12±24.70a 276.12±11.88b 261.62±22.43b 89.458**455.87±23.96 115.62±31.10a 413.37±21.11b 405.00±17.82b 338.508**186.37±17.17 69.75±14.64a 179.37±14.89b 177.00±22.61b 79.961**547.75±57.18 194.12±67.14a 369.87±29.14b 380.25±30.84b 69.698**
3 讨论
抑郁障碍病因复杂,研究者们已就抑郁障碍开展了大量的分子生物学研究,但确切的致病因素尚无定论。有研究表明免疫反应与氧化应激可能参与抑郁症的发病过程,一些炎症因子及氧化应激指标可能成为抑郁症的生物标志物,抗炎药物可能对抑郁症有辅助治疗作用[6]。
3.1NAC的抗抑郁作用首次行为评估各组大鼠行为差异无统计学意义。3周CUS后行为评估显示,模型组、NAC组、FLX组大鼠与对照组相比抑郁样行为增多,提示CUS可引起大鼠抑郁样行为,结果与Liu等[5]的结果一致。干预后的行为评估,模型组大鼠较对照组抑郁样行为多(糖水消耗量少、水平运动距离短、直立次数少、粪便粒数多),提示模型组抑郁状态得到维持;NAC组、FLX组大鼠抑郁样行为较模型组少,提示NAC、FLX均可能逆转模型组大鼠抑郁样行为。其中,FLX对模型组大鼠抑郁样行为的作用与张国栋等[7]的研究一致,NAC组与FLX组无差异,提示NAC对CUS大鼠抑郁样行为的逆转效果与FLX类似。
3.2NAC抗抑郁的机制抑郁障碍伴有免疫炎症系统的激活,此时核因子(NF)-κB活化并且海马类神经干细胞的增殖减少,NF-κB与应激所导致的抑郁样行为密切相关[8]。同时,NF-κB的活化伴随着白细胞介素(IL)-1、IL-2、IL-6、IL-8、肿瘤坏死因子(TNF)-α等炎性细胞因子水平的增高,而后者的分泌同时也可以促进NF-κB的活化,从而放大增效炎症反应,并使之持续[6]。国外已有研究证实,细胞因子在抑郁症的发病中起着重要作用,并认为抑郁症伴随免疫炎症反应系统(IRS)的激活,炎性细胞因子如IL-6、超敏C反应蛋白(hs-CRP)的分泌增加[9]。NAC可抑制NF-κB的激活和蛋白IκBα表达,减少NF-κBp65表达的核转位,减少细胞因子和炎症介质的释放,减轻免疫炎症反应。国内研究显示,NAC可减轻炎症细胞侵润[10]。
3.3NAC对大脑单胺类神经递质的影响既往研究指出,应激刺激如强迫游泳所产生的行为反应由大脑中神经回路调节,这种调节很大程度上是通过自主神经系统、神经内分泌系统和免疫系统来完成的[11]。与模型组大鼠相比,NAC组在干预后行为学的改变也是由中枢神经系统调节的。必须强调的是,这种行为学改变是抗抑郁药理研究方面特别有效的评估指标[12]。与模型组相比,NAC组、FLX组在前额叶区5-HT水平增加。前额叶皮质血清素可调节焦虑和情绪状态。前额叶区5-HT水平增加,表明这一脑区血清素降解降低,可能是因为单胺氧化酶的活性降低,这与多种抗抑郁药干预SD大鼠后的研究一致[13]。
杏仁核附着在海马的末端,呈杏仁状,作为边缘系统的一部分参与大脑对记忆与情感反应的处理,主要功能有产生情绪、识别情绪和调节情绪、控制学习和记忆等。与模型组相比,NAC组、FLX组杏仁核DA水平增加,有可能NAC及FLX是通过抑制杏仁核DA代谢来达到抗抑郁作用的。
海马是应激反应的作用靶区,参与情绪反应、学习、记忆、认知、行为和免疫调节等多种基本生理调节,其损伤与抑郁情绪的发生密切相关。与对照组相比,模型组大鼠大脑海马存在NE、5-HT、DA等神经递质功能的降低,NAC与FLX可以有效提高大鼠大脑海马NE、5-HT和DA等递质水平,从而发挥其抗抑郁作用。研究表明,这一大脑区域的单胺类神经递质减少与抑郁症的发病有关,海马NE浓度的增加,可以改善抑郁模型大鼠的学习任务[14],尤其是大脑发育的早期阶段[15]。
纹状体作为基底神经节的主要组成部分,包括豆状核和尾状核,作为边缘系统-皮质-纹状体神经环路的组成部分,参与抑郁症的病理生理改变。模型组大鼠大脑纹状体区存在5-HT、DA、NE等神经递质功能的降低,与模型组相比NAC、FLX亦可以有效提高大鼠大脑纹状体区5-HT、DA、NE等递质水平,从而发挥其抗抑郁作用。
综上所述,NAC和FLX一样,可以明显改善抑郁模型大鼠行为指标,如体质量增加、自主活动增加、快感兴趣提高、绝望无助行为减少。NAC和FLX能够提高抑郁模型大鼠前额叶、杏仁核、海马、纹状体等脑区单胺神经递质的水平,从而发挥其抗抑郁作用。
[1]Shen YC.Psychiatry[M].Beijing:People's Medical Publishing House,2009:548.[沈渔邨.精神病学[M].北京:人民卫生出版社,2009:548].
[2]Beyer JL,Weisler RH.Suicide behaviors in bipolar disorder:a review and update for the clinician[J].Psychiatr Clin North Am,2016,39(1):111-123.doi:10.1016/j.psc.2015.09.002.
[3]Bielczyk NZ,Buitelaar JK,Glennon JC,et al.Circuit to construct mapping:a mathematical tool for assisting the diagnosis and treatment in major depressive disorder[J].Front Psychiatry,2015,6:29.doi:10.3389/fpsyt.2015.00029.
[4]Berk M,Copolov DL,Dean O,et al.N-Acetyl cysteine for depressivesymptomsinbipolardisorder-adouble-blind randomized placebo-controlled trial[J].Biol Psychiatry,2008,64(6):468-475.doi:10.1016/j.biopsych.2008.04.022.
[5]Liu D,Wang Z,Gao Z,et al.Effects of curcumin on learning and memory deficits,BDNF,and ERK protein expression in rats exposed to chronic unpredictable stress[J].Behav Brain Res,2014,271:116-121.doi:10.1016/j.bbr.2014.05.068.
[6]Rosenblat JD,McIntyre RS.Bipolar disorder and inflammation[J]. Psychiatr Clin North Am,2016,39(1):125-137.doi:10.1016/j. psc.2015.09.006.
[7]Zhang GD,Dong J,Li Y,et al.Expression of S100B in hippocampus of depression model rats induced by chronic unpredictable stress and the effect of fluoxetine in bolcking it[J].Chin J Behav Med& Brain Sci,2013,22(11):978-981.[张国栋,董娇,李晏,等.慢性应激抑郁模型大鼠海马组织S100B表达及氟西汀的干预作用[J].中华行为医学与脑科学杂志,2013,22(11):978-981].doi:10.3760/ema.j.issn.1674-6554.2013.11.006.
[8]Koo JW,Russo SJ,Ferguson D,et al.Nuclear factor-kappa B is a critical mediator of stress-impaired neurogenesis and depressive behavior[J].Proc Natl Acad Sci U S A,2010,107(6):2669-2674. doi:10.1073/pnas.0910658107.
[9]Zunszain PA,Anacker C,Cattaneo A,et al.Glucocorticoids,cytokinesandbrainabnormalitiesindepression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(3):722-729. doi:10.1016/j.pnpbp.2010.04.011.
[10]Wang JY,Yu HZ,Wu JP,et al.The intervention of N-acetylcysteine on the pulmonary fibrosis of chronic ethanol ingestion in rats[J]. Tianjin Med J,2012,40(10):1034-1036.[王静宜,于洪志,武俊萍,等.N-乙酰半胱氨酸对慢性饮酒大鼠肺纤维化的干预作用[J].天津医药,2012,40(10):1034-1036].doi:10.3969/j. issn.0253-9896.2012.10.021.
[11]Jankord R,Herman JP.Limbic regulation of hypothalamo-pituitaryadrenocortical function during acute and chronic stress[J].Ann N Y Acad Sci,2008,1148:64-73.doi:10.1196/annals.1410.012.
[12]Cryan JF,Page ME,Lucki I.Differential behavioral effects of the antidepressants reboxetine,fluoxetine,and moclobemide in a modifi edforcedswimtestfollowingchronictreatment[J]. Psychopharmacology(Berl),2005,182(3):335-344.
[13]Shishkina GT,Iudina AM,Dygalo NN.Effects of fluoxetine on locomotor activity:possible involvement of dopamine[J].Zh Vyssh Nerv Deiat Im I P Pavlova,2006,56(4):523-528.
[14]Srikumar BN,Raju TR,Shankaranarayana Rao BS.The involvement of cholinergic and noradrenergic systems in behavioural recovery following oxotremorine treatment to chronically stressed rats[J]. Neuroscience,2006,143(3):679-688.
[15]Brummelte S,Mc Glanaghy E,Bonnin A,et al.Developmental changes in serotonin signaling:Implications for early brain function,behavior and adaptation[J].Neuroscience,2016,pii:S0306-4522(16)00177-9.doi:10.1016/j.neuroscience.2016.02.037.
(2016-03-04收稿2016-06-03修回)
(本文编辑李鹏)
Effects of N-acetylcysteine on behavior and monoamine neurotransmitters in rats with chronic unpredictable stress
LUO Guoshuai1,YANG Jianli2△,SI Jijian2,WANG Lili2,WANG Chengzhan1
1 Tianjin Medical University,Tianjin 300070,China;2 Tianjin Anding Hospital△
E-mail:yangjianli0722@163.com
ObjectiveTo investigate effects of N-acetylcysteine(NAC)on changes of the behavior and the monoamine neurotransmitters in prefrontal cortex(PFC),striatum(ST),amygdala(AM)and hippocampus(HIP)in rat model of chronic unpredictable stress(CUS),and to explore the possible mechanisms related to the NAC.MethodsThirty-two male Sprague-Dawle(SD)rats were divided into CUS group,fluoxetine group(FLX),NAC group and control group(n=8 for each group).Rats in CUS group,NAC group and FLX group were all fed alone and received CUS for 6 weeks to establish CUS model.Rats in NAC group and FLX group were given NAC and FLX by daily intragastric administration respectively during the last 3 weeks,while rats in CUS group and control group were given the same volume of solvent.Behavioral assessment including weight measurement,sucrose water consumption test,and opened field test were used for evaluation before and after CUS,and before and after intervention.The concentrations of the monoamine neurotransmitters(NE,DA,5-HT)in PFC,ST,AM and HIP were measured with Coul array HPLC.Results(1)There were more increases in weight gain,sucrose consumption,and distance of horizontal moving and number of up-right,while the number of feces was less,after intervention in control group,NAC group and FLX group than those of CUS group(P<0.05).(2)Neurotransmitters including NE,DA and 5-HT were significantly decreased in PFC,ST,AM and HIP in CUS group compared with that of control group(P<0.05).The monoamine neurotransmitter(NE,DA and 5-HT)were significantly increased in the brain region(PFC,ST,AM and HIP)in NAC group and FLX group than those of CUS group(P<0.05).ConclusionNAC and fluoxetine can effectively improve the depressive behavior of the CUS rats,increase the contents of monoamine neurotransmitters including NE,DA and 5-HT in PFC,AM,ST and HIP brain regions.
depressive disorder;acetylcysteine;fluoxetine;physical stimulation;rats,Sprague-Dawley
R749.4
A
10.11958/20160092
1天津医科大学(邮编300070);2天津市安定医院
罗国帅(1988),男,硕士在读,主要从事抑郁症及精神分裂症的治疗研究
E-mail:yangjianli0722@163.com
