炎症因子对非PCOS患者颗粒细胞活性氧水平及线粒体DNA拷贝数的影响
2016-10-20张暄琳李毅刘丽张文静孟祥烔徐凤琴
张暄琳,李毅,刘丽,张文静,孟祥烔,徐凤琴
炎症因子对非PCOS患者颗粒细胞活性氧水平及线粒体DNA拷贝数的影响
张暄琳,李毅,刘丽,张文静,孟祥烔,徐凤琴△
目的探讨炎症因子对非多囊卵巢综合征(PCOS)患者颗粒细胞活性氧(ROS)水平及线粒体DNA(mtDNA)的影响。方法选择体外受精-胚胎移植(IVF-ET)治疗的非PCOS患者50例,提取卵泡液中颗粒细胞进行体外培养,随机分为炎症因子处理组和对照组,处理组分别加入5 nmol/L的炎症因子白细胞介素(IL)-1、IL-6、肿瘤坏死因子(TNF)-α,对照组加入等量炎症因子稀释液,比较各组颗粒细胞ROS水平及mtDNA拷贝数是否存在差异。结果IL-1、IL-6、TNF-α处理组颗粒细胞ROS水平及mtDNA拷贝数均显著高于对照组(均P<0.05)。结论炎症因子IL-1、IL-6、TNF-α可导致颗粒细胞氧化应激水平增高和线粒体受损。
白细胞介素类;肿瘤坏死因子α;活性氧;DNA,线粒体;颗粒细胞
多囊卵巢综合征(PCOS)、子宫内膜异位症及部分免疫性不孕患者体内炎症因子,如白细胞介素(IL)-1、IL-6、肿瘤坏死因子(TNF)-α水平高于正常人群[1]。近年来研究发现慢性炎症反应影响女性生殖健康,高水平炎症因子降低卵母细胞质量,降低妊娠率[2]。另有研究显示氧化应激在PCOS等不孕症相关疾病的发病机制中起着关键的作用[3],氧化应激过程产生的活性氧(ROS)可损伤线粒体,引起线粒体DNA(mtDNA)拷贝数的改变,严重者可引起细胞凋亡[4]。颗粒细胞对卵母细胞的发育、成熟起重要的调控作用,影响卵泡启动、发育、成熟及闭锁的全过程,颗粒细胞受损会降低卵母细胞的质量及胚胎发育潜能[5]。目前关于慢性炎症状态是否对颗粒细胞产生影响尚不完全清楚。本研究旨在探讨炎症因子是否影响颗粒细胞ROS及mtDNA拷贝数,进一步明确高炎性状态与不孕的关系。
1 对象与方法
1.1研究对象选择2014年5月—2015年5月于我科接受体外受精-胚胎移植(IVF-ET)治疗的非PCOS患者50例。纳入标准:患者年龄<35岁,月经周期规律(25~35 d),基础内分泌检查无异常。排除甲状腺疾病、肾上腺疾病及其他可能影响内分泌系统的疾病,超声检查排除多囊卵巢、子宫内膜异位改变,所有患者均知晓并自愿签署知情同意书。
1.2超促排卵方案所有患者均采用长方案超促排卵。于排卵后5~7 d每日皮下注射促性腺激素释放激素激动剂GnRH-a(商品名达必佳,辉凌制药有限公司)0.05~0.10 mg。14~16 d后患者血清雌二醇≤50 ng/L,促卵泡激素(FSH)≤5 IU/L,黄体生成素(LH)≤5 IU/L,阴道B超监测子宫内膜厚度≤5 mm,多个卵泡直径≤5~8 mm时,达到降调标准后给予促性腺激素(Gn)促排卵,根据卵泡发育情况调整剂量。当1个卵泡平均直径超过18 mm或2个卵泡平均直径超过17 mm或3个卵泡平均直径超过16 mm时给予人绒毛膜促性腺激素(HCG)10 000 U肌内注射,36 h后取卵。
1.3颗粒细胞的提取留取所有卵泡液,将液体以2 000 r/min离心5 min,弃上清液。剩余细胞沉淀物重悬于DMEM/F12培养液(美国Gibco公司),以2∶3体积比将细胞悬液移至体积分数45%Percoll分离液(美国Sigma公司)的表面,以2 000 r/min离心20 min。吸出位于界面处的颗粒细胞层,加入5倍体积的PBS,1 000 r/min离心3 min后弃上清。加入等体积10%透明质酸酶消化1.5 min,用2倍体积含FBS(美国Gibco公司)的DMEM/F12培养液终止消化。再次用PBS洗涤细胞,用DMEM/F12培养液重悬细胞。
1.4颗粒细胞的培养取0.1 mL细胞悬液加等量台盼蓝(美国Sigma公司)染色,检测存活细胞在75%以上。血球计数板计算细胞浓度,调整细胞浓度为6×104/mL密度接种于12孔培养板,每孔内含1 mL培养液。每例患者接种4板,随机编号为1、2、3、4号,其中1号为IL-1组,2号为IL-6组,3号为TNF-α组,4号为对照组。1、2、3号分别加入IL-1、IL-6及TNF-α(IL-1、IL-6、TNF-α购自ProSpec公司,用18 MΩ·cm水稀释)至培养液中炎症因子浓度为5 nmol/L,4号加入等量18 MΩ·cm水。置于37℃、体积分数5%CO2培养箱中培养。每24 h换液1次,144 h后用PBS冲洗颗粒细胞,待测。
1.5颗粒细胞内ROS的测定应用ROS检测试剂盒(碧云天生物技术研究所)检测颗粒细胞内ROS水平。炎症因子处理组与对照组分别加入10 μmol/L的DCFH-DA 200 μL,置于37℃的细胞培养箱内避光孵育30 min,用PBS洗3遍。用流式细胞仪检测荧光强度。
1.6颗粒细胞mtDNA拷贝数测定按DNA提取试剂盒(TAKARA公司)说明提取DNA,首先制备mtDNA标准品并梯度稀释后制作标准曲线。采用Real-time PCR检测炎症因子处理组与对照组中颗粒细胞线粒体DNA拷贝数ND1(mtDNA管家基因)。ND1片段为mtDNA高度保守序列,可反映mtDNA的总量。应用ABI PRISM7900H T实时荧光定量PCR扩增仪(Applied Biosysterms)检测mtDNA拷贝数。运用Sequence Detector Systems Version 2.0软件(Applied Biosystems)进行数据处理。ND1基因扩增引物:上游5′-GGCTACATACAATTACGCAAAG-3′,下游5′-TAGAATGGA GTAGACCGAAAGG-3',目的片段长度221 bp。β-actin引物扩增片段:上游5′-ACACAACTGTGTTCACTAGC-3′,下游5′-CAACTTCATCCACGTTCACC-3′,目的片段长度110 bp。扩增条件:95℃预变性10 s,95℃变性5 s,61℃退火30 s,共40个循环。
1.7统计学方法采用SPSS 13.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1入组患者一般情况50例患者平均年龄(29.65±0.67)岁,体质指数(22.38±0.22)kg/m2,基础内分泌:FSH(6.18±0.24)IU/L,LH(3.65±0.39)IU/L,睾酮(0.79±0.08)nmol/L。基础窦卵泡数(9.50±5.26)个。Gn使用时间(14.20±1.20)d,Gn剂量(2 249.40± 245.70)IU。发育卵泡数(7.12±4.08)个,获卵数(6.02±4.62)个。
2.2炎症因子对颗粒细胞ROS水平的影响炎症因子IL-1、IL-6、TNF-α处理组的ROS水平和mtDNA拷贝数均高于对照组,差异有统计学意义(P<0.05),见表1。
Tab.1The level of ROS and copy number of mtDNA in granulosa cells in treatment group and control group表1 炎症因子处理组与对照组颗粒细胞的ROS及mtDNA拷贝数
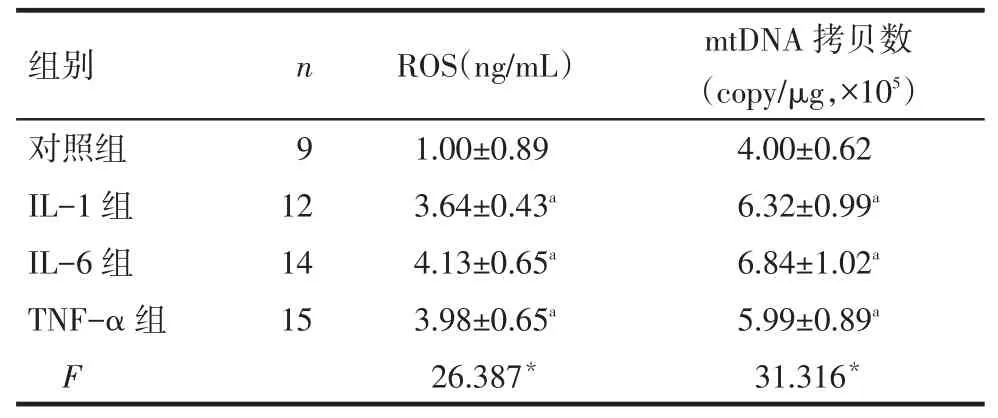
Tab.1The level of ROS and copy number of mtDNA in granulosa cells in treatment group and control group表1 炎症因子处理组与对照组颗粒细胞的ROS及mtDNA拷贝数
*P<0.05;a与对照组比较,P<0.05
组别n ROS(ng/mL)mtDNA拷贝数(copy/μg,×105)对照组IL-1组IL-6组TNF-α组F 91 2 14 15 1.00±0.89 3.64±0.43a 4.13±0.65a 3.98±0.65a 26.387*4.00±0.62 6.32±0.99a 6.84±1.02a 5.99±0.89a 31.316*
3 讨论
PCOS是不孕症的常见病因之一,研究证实患PCOS、子宫内膜异位症等疾病的女性体内炎症因子水平普遍高于正常人群[1],在IVF-ET治疗时表现为卵子及胚胎质量下降、妊娠率低而流产率高等特点。近年来慢性炎症反应对女性生殖健康的影响越来越受到关注。Ebejer等[6]认为PCOS患者妊娠率低可能与体内炎症因子导致卵巢功能障碍有关,但具体的作用机制尚不十分清楚。另有研究表明PCOS患者卵丘颗粒细胞凋亡率较非PCOS患者明显升高,卵母细胞质量降低与卵泡内颗粒细胞代谢功能异常及过度凋亡有关[7]。为了探讨PCOS患者体内高炎症状态是否影响颗粒细胞的代谢功能,从而寻找导致PCOS患者卵子及胚胎质量下降的可能因素,本研究选择非PCOS患者IVF-ET后卵泡液中的颗粒细胞体外培养,于培养液中添加炎症因子IL-1、IL-6、TNF-α模拟机体内慢性炎症状态对颗粒细胞的影响,从ROS及线粒体方面分析慢性炎症状态下颗粒细胞正常生理状态是否发生改变。
ROS是炎症反应的效应器,近年来多项研究发现,ROS在不孕症的发病机制中起着关键的作用。ROS启动窦卵泡颗粒细胞凋亡[8],诱发小鼠卵母细胞减数分裂中非整倍体形成[3]。Elizur等[9]研究认为卵泡液中ROS水平降低时,胚胎质量更高。本研究添加炎症因子IL-1、IL-6、TNF-α后体外培养颗粒细胞,结果提示炎症因子处理组颗粒细胞中ROS水平均显著高于对照组,这可能与炎症因子水平升高打破机体内ROS产生与清除的动态平衡有关[3]。另外,IL-1通过促进胰岛B细胞的一氧化氮生成和细胞凋亡而引起B细胞选择性的破坏[10];IL-6通过抑制胰岛素介导的脂肪合成、葡萄糖的转运及抑制胰岛素信号传导[1];TNF-α通过促进脂肪分解引起血浆游离脂肪酸水平增高[2],导致胰岛素抵抗的发生,过剩的糖类物质和游离脂肪酸氧化产生ROS,引发氧化应激[11],过多的ROS累积损伤颗粒细胞。
另外大量研究证实线粒体与卵母细胞成熟、胚胎发育密切相关,使用影响线粒体生成的药物处理成熟期小鼠后,卵子质量下降,线粒体移植可以改善IVF妊娠结局[12]。mtDNA拷贝数提示线粒体功能水平,当线粒体受损时通过提高mtDNA拷贝数以代偿减弱的线粒体呼吸功能[4]。本研究结果显示,3种炎症因子处理组颗粒细胞mtDNA拷贝数均显著高于对照组,提示高水平炎症因子损伤颗粒细胞内线粒体功能。这可以用经典的“ROS-线粒体损伤学说”解释,细胞内ROS累积破坏mtDNA,而mtDNA的损伤又会加剧ROS堆积,形成恶性循环[4],提示高炎症状态影响线粒体正常呼吸功能,导致ROS累积,ROS加剧线粒体损伤,导致mtDNA拷贝数代偿性增加。mtDNA缺乏组蛋白保护,较易发生基因变异,导致线粒体的能量代谢出现异常,影响颗粒细胞的正常生理功能,诱发颗粒细胞的凋亡。而颗粒细胞在雌激素合成、卵泡发育及卵子成熟上起重要作用。这可能是PCOS患者卵子及胚胎质量下降、妊娠率下降而流产率增高的因素之一,因此PCOS患者在进行IVF-ET前改善高炎症状态对改善患者的妊娠结局至关重要。
本研究初步解释了机体处于慢性炎症状态与颗粒细胞功能受损之间的关系。目前关于慢性炎症反应与女性不孕症关系的研究尚处于起步阶段,炎症因子是否影响卵巢微环境、不同炎症因子浓度下颗粒细胞生理功能是否存在差异、抗炎药物及抗氧化剂对提高IVF-ET成功率是否存在帮助等一系列问题,仍需进一步研究。
[1]Shorakae S,Teede H,de Courten B,et al.The emerging role of chroniclow-gradeinflammationinthepathophysiologyof polycystic ovary syndrome[J].Semin Reprod Med,2015,33(4):257-269.doi:10.1055/s-0035-1556568.
[2]Spritzer PM,Lecke SB,Satler F,et al.Adipose tissue dysfunction,adipokines,and low-grade chronic inflammation in polycystic ovary syndrome[J].Reproduction,2015,149(5):R219-227.doi:10.1530/REP-14-0435.
[3]Agarwal A,Aponte-Mellado A,Premkumar BJ,et al.The effects of oxidative stress on female reproduction:a review[J].Reprod Biol Endocrinol,2012,10:49.doi:10.1186/1477-7827-10-49.
[4]Shokolenko IN,Wilson GL,Alexeyev MF,et al.Aging:A mitochondrial DNA perspective,critical analysis and an update[J]. World J Exp Med,2014,4(4):46-57.
[5]Gilchrist RB,Ritter LJ,Armstrong DT.Oocyte-somatic cell interactions during follicle development in mammals[J].Anim Reprod Sci,2004,82-83:431-446.
[6]Ebejer K,Calleja-Agius J.The role of cytokines in polycystic ovarian syndrome[J].Gynecol Endocrinol,2013,29(6):536-540. doi:10.3109/09513590.2012.760195.
[7]Das M,Djahanbakhch O,Hacihanefioglu B,et al.Granulosa cell survival and proliferation are altered in polycystic ovary syndrome[J].J Clin Endocrinol Metab,2008,93(3):881-887.
[8]Luderer U.Ovarian toxicity from reactive oxygen species[J].Vitam Horm,2014,94:99-127.doi:10.1016/B978-0-12-800095-3.00004-3.
[9]Elizur SE,Lebovitz O,Orvieto R,et al.Reactive oxygen species in follicular fluid may serve as biochemical markers to determine ovarian aging and follicular metabolic age[J].Gynecol Endocrinol,2014,30(10):705-707.doi:10.3109/09513590.2014.924100.
[10]Escobar-Morreale HF,Luque-Ramírez M,González F.Circulating inflammatory markers in polycystic ovary syndrome:a systematic review and meta analysis[J].Fertil Steril,2011,95(3):1048-1058.doi:10.1016/j.fertnstert.2010.11.036.
[11]Robertson RP.Chronic oxidative stress as a central mechanism for glucose toxicity in pancreatic islet beta cells in diabetes[J].J Biol Chem,2004,279(41):42351-42354.
[12]El Shourbagy SH,Spikings EC,Freitas M,et al.Mitochondria directly influence fertilisation outcome in the pig[J].Reproduction,2006,131(2):233-245.
(2016-01-09收稿2016-04-12修回)
(本文编辑魏杰)
Effects of inflammatory markers on the level of reactive oxygen species and mitochondria DNA copy numbers in granulosa cells of patients without PCOS
ZHANG Xuanlin,LI Yi,LIU Li,ZHANG Wenjing,MENG Xiangtong,XU Fengqin△
Department of Reproductive,Tianjin First Center Hospital,Tianjin 300192,China△
E-mail:xufengqin1968@126.com
ObjectiveTo study the effect of inflammatory markers on the level of reactive oxygen species(ROS)and mitochondrial DNA(mtDNA)copy numbers in granulosa cells of patients without polycystic ovary syndrome(PCOS). MethodsFifty patients without PCOS treated with in vitro fertilization and embryo transfer(IVF-ET)were selected in this study.The granulosa cells were extracted and cultured in vitro.Cells were randomly divided into treatment group and control group.The 5 nmol/L interleukin(IL)-1,IL-6 and tumor necrosis factor(TNF)-α were given to treatment group,and same amount of inflammatory diluted solution was added to control group.The levels of ROS and copy numbers of mtDNA were compared between two groups.ResultsThe ROS levels and mtDNA copy number of granulosa cells were significantly higher in IL-1,IL-6 and TNF-α treatment groups than those of control group(P<0.05).ConclusionInflammatory markers of IL-1,IL-6 and TNF-α increase the level of ROS and damage mtDNA in granulosa cells.
interleukins;tumor necrosis factor-alpha;reactive oxygen species;DNA,mitochondrial;granulosa cells
R711.6
A
10.11958/20160013
天津市卫生局科技基金(2013KZ033)
天津市第一中心医院生殖医学科(邮编300192)
张暄琳(1989),女,硕士,主要从事生殖医学研究
E-mail:xufengqin1968@126.com
