清心Ⅱ号对病毒性心肌炎心肌纤维化内皮素1及转化生长因子β1表达的干预作用
2016-10-19刘旺王娟徐百鸿程志清
刘旺 王娟 徐百鸿 程志清
[摘要] 目的 研究清心Ⅱ号对病毒性心肌炎心肌纤维化内皮素1(ET-1)及转化生长因子β1(TGF-β1)表达的干预及抗病毒作用。 方法 150只清洁级体重14~16 g健康雄性BALB/c小鼠,采用随机数字表法分出10只作为正常组;其余140只作为造模组,采用腹腔注射含不同浓度柯萨奇病毒B3(CVB3)半数组织培养感染剂量为10-5的病毒液3次,每次每只2 mL,首次1∶2000浓度CVB3病毒液,2周后腹腔接种1∶1600浓度CVB3病毒液,4周后腹腔注射1∶800浓度CVB3病毒液。60 d后模型构建成功,存活小鼠94只。随机选取90只,分为清心Ⅱ號高、中、低剂量组各20只,卡托普利组20只,模型组10只。正常组和模型组给予生理盐水灌胃,治疗组分别给予卡托普利和清心Ⅱ号高、中、低剂量灌胃。实验结束后颈椎脱臼法处死动物,采集心脏组织液氮速冻。分别应用免疫组化方法检测TGF-β1含量,放免法检测各组血浆ET-1含量,RT-PCR技术检测CVB3 RNA,VG染色观察各组纤维化形成情况,并检测胶原阳性面积占测量面积的百分比,即容积分数。 结果 VG染色后正常组含少量胶原纤维,分布于血管周围;模型组心肌细胞排列紊乱,胶原纤维含量与正常组比较增生明显(P < 0.05);TGF-β1、ET-1、CVB3 RNA模型组及各治疗组均高于正常组(P < 0.05);治疗后各治疗组胶原纤维较模型组减少(P < 0.05),清心Ⅱ号各治疗组随剂量增加胶原纤维逐渐减少;各治疗组TGF-β1、ET-1、CVB3 RNA与模型组比较均相应减低(P < 0.05),清心Ⅱ号高剂量组TGF-β1与正常组比较,差异无统计学意义(P > 0.05);对减少ET-1,清心Ⅱ号高剂量组与卡托普利组疗效相当(P > 0.05)。 结论 血浆ET-1与TGF-β1在病毒性心肌炎心肌纤维化形成过程中发挥重要作用,清心Ⅱ号具有抗病毒、抗心肌纤维化作用。
[关键词] 内皮素1;转化生长因子β1;病毒基因检测;VG染色;心肌纤维化
[中图分类号] R285 [文献标识码] A [文章编号] 1673-7210(2016)02(c)-0009-05
Intervention effect of qinxin Ⅱ recipe on expression of ET-1 and TGF-β1 in mouse of viral myocarditis myocardial fibrosis
LIU Wang1 WANG Juan2 XU Baihong3 CHENG Zhiqing4
1.Department of General, Tumor Hospital of Hangzhou, Zhejiang Province, Hangzhou 310003, China; 2.Department of Infection, Children's Hospital of Hangzhou, Zhejiang Province, Hangzhou 310014, China; 3.Department of Cardiology, Puyang Hospital of Traditional Chinese Medicine, He′nan Province, Puyang 457001, China; 4.College of Basic Medicine, Zhejiang University of Traditional Chinese Medicine, Zhejiang Province, Hangzhou 310053, China
[Abstract] Objective To study intervention effect of qinxin Ⅱ recipe on expression of endothelin-1 (ET-1) and transforming growth factor-β1 (TGF-β1) in mouse of viral myocarditis myocardial fibrosis and ant-virus effect. Methods The 150 health male BALB/c mice (weight: 14-16 g) were randomly allotted into two groups: the normal group (n=10) and the model constructed group (n=140). The mice of the model constructed group were injected coxsackie virus B3 (CVB3) of median tissue culture infectious dose 10-5 poison by intraperitoneal. 2 mL CVB3 poison was injected by intraperitoneal for each mouse, repeating three times. The injected concentration and time were as following: 1:2000 of CVB3 at beginning, 1:1600 of CVB3 after two weeks and 1:800 of CVB3 4 weeks later. The model was constructed successfully after 60 days and 94 mice were live. 90 mice were selected randomly from 94 mice for following three groups: model group (n=10) and captopril group (n=20) and qinxin Ⅱ (high, medium and low dose) groups (20 mice in each group). The normal group and model group were fed normal saline by gavage, treatment groups were fed captopril and qinxin Ⅱ groups (high, medium and low dose), respectively. The mice were killed by cervical dislocation after experiment, heart tissue was collected and snap-frozen in liquid nitrogen. TGF-β1 and ET-1 contents in heart were detected using immunohistochemical method and radioimmunoassay, respectively; CVB3 RNA was assayed by RT-PCR; Fibrosis formation was observed by VG staining and percentage of positive area (volume fraction) of collagen was also detected. Results The results showed that collagen fiber in heart of mice in the normal group was detected by VG staining, distributing around the blood vessels; arrangement of myocardial cell in heart disorder in model group and collagen fiber in heart of mice in the model group was significant hyperplasia compared with those of normal group (P < 0.05). TGF-β1, ET-1 and CVB3 RNA in heart of each treatment group and model group were all higher than those of the normal group (P < 0.05). After treatment, the collagen fiber in heart of all treatment groups was lower than model group (P < 0.05), and with increasing dose of qingxin Ⅱ, the collagen fiber in heart of treatment group was decreased gradually. TGF-β1, ET-1 and CVB3 RNA in heart of treatment group cured by qingxin Ⅱ recipe were reduced compared to model group. TGF-β1 in heart of high qingxin Ⅱ recipe almost was close to normal group, there was no statistically significant difference (P > 0.05). For reducing ET-1, curative effect of high qingxin Ⅱ recipe group was almost same to captopril group (P > 0.05). Conclusion ET-1 and TGF-β1 of plasma play an important role in process of viral myocarditis myocardial fibrosis, and qingxin Ⅱ may have a role in anti-virus and anti-myocardial fibrosis.
[Key words] ET-1; TGF-β1; Virus gene detection; VG staining; Myocardial fibrosis
病毒性心肌炎是临床常见病、多发病。近年来发病率有增高趋势,很多患者由于症状不典型未引起重视,且由于本病为病毒性疾病,西医目前无特效抗病毒药物,因而无特效疗法,所以导致患者长期得不到有效治疗,经久不愈,给患者的生活以及精神带来极大的痛苦。病毒性心肌炎慢性期心肌纤维化是该疾病的晚期病理特征,表现为扩张型心肌病,可出现心律失常、顽固性心衰、心源性猝死等。因而,预防和控制病毒性心肌炎及心肌纤维化显得尤为重要,本研究从内皮素1(Endothelin-1,ET-1)及转化生长因子β1(transforming growth factor-β1,TGF-β1)角度探析病毒性心肌炎心肌纤维化形成机制及清心Ⅱ号干预作用。
1 对象与方法
1.1 实验动物
清洁级体重14~16 g,4周龄,雄性健康BALB/c小鼠,购自于中国科学院上海实验动物中心,浙江中医药大学动物实验中心饲养,动物质量合格证号:SCXK(沪)2003-0003,饲养于清洁动物房内,动物饲养设施条件合格证:SYXK(浙)2003-0003。温度20~25℃,相对湿度45%~70%,光照明暗各12 h,换气次数20 次/h;动物实验设施条件合格证:SYXK(浙)2003-0003。动物饮水为城市自来水,用净水器滤过后装入消毒后的饮水瓶内自由饮用,标准饲料喂养。
1.2 主要试剂及设备
石蜡切片机,MICROW HM34OE德国;荧光显微镜摄像机,日本OLYMPUS BX60型;BMJ-Ⅲ型包埋机及冷冻台,江苏;GNP-9080型隔水式恒温培养箱,上海精宏实验设备有限公司;抗体稀释液,北京中山生物有限公司;VITEK比色计,美国HACH公司;琼脂糖,上海Sangon生物工程技术公司;放免试剂盒,宝信生物科技有限公司;PCR试剂盒,大连宝生物工程有限公司;DL 2000 Marker,大连宝生物工程有限公司;5×TBE:Tris 54 g,硼酸27.5 g,0.5 mol/L EDTA(pH 8.0)200 mL溴化乙锭溶液(EB),浓度为10 mg/mL PCR合成仪,美国MJ Research;PTC-200。
1.3 实验用病毒及药物
柯萨奇病毒B3(CVB3)(Nancy株,TCID),复旦大学中山医院病毒性心肌病重点实验室惠赠,保存于-70℃低温冰箱备用。清心Ⅱ号由人参、丹参、苦参组成,浙江中医药大学药学院制剂室水煎醇提喷雾干燥后分高、中、低3种剂量,高剂量每毫升含生药为3 g,中剂量每毫升含生药2 g,低剂量每毫升含生药1 g。卡托普利片为上海施贵宝制药有限公司生产,批准文号为国药准字H44020747。PCR引物均由上海Sangon生物工程技术公司合成,Trizol及逆转录试剂盒购于上海Sangon生物工程技术公司。
1.4 模型复制
150只健康雄性BALB/c小鼠,采用随机数字表法分出10只作为正常对照组,参照以往模型复制方法[1],腹腔注射不含病毒的Eagle液,接种时间、次数同其余140只造模组。其余140只腹腔注射含不同浓度CVB3半数组织培养感染量(TCID50)=10-5的病毒液3次,每次每只2 mL,首次1∶2000,2周后腹腔接种1∶1600浓度CVB3病毒液,4周后腹腔注射1∶800浓度CVB3病毒液,60 d后模型成功。
1.5造模成功后分组
采用随机数字表法选取90只存活小鼠,分为模型组10只,卡托普利组20只,清心Ⅱ号高、中、低剂量组分别为20只。
1.6 治疗方法
正常组、模型组给予生理盐水2 mL/(次·d)灌胃,卡托普利组予卡托普利45 mg/kg灌胃,清心Ⅱ号高、中、低剂量分别予30、20、10 g/kg,每日1次、疗程45 d。
1.7 观察指标及检测方法
1.7.1 心脏组织石蜡切片 治疗结束后,将动物活杀断头取心脏,用滤纸吸干血迹后,将右心室和室间隔部置于液氮中,用作CVB3基因检测,其余部分立即放在10%中性福尔马林缓冲液(pH 7.4)中固定,石蜡包埋后连续切为4 μm厚之切片,60~62℃烘箱烤片后VG染色。
1.7.2 VG染色 二甲苯脱蜡20 min×2次;无水乙醇、95%、80%、70%乙醇、自然水水化;Weigert苏木精染液5 min,流水洗;1%盐酸酒精分化数秒,流水冲洗、蓝化;用Van Gieson染液1~2 min;倾去染液直接用95%乙醇分化脱水;无水乙醇直接分化,脱水;二甲苯透明,封片。200倍镜下观察各组纤维化形成情况,并检测胶原阳性面积占测量面积的百分比,即容积分数。VG染色试剂盒购于Maxin-Bio companyCat No.MST-8001 LOT:510208001。
1.7.3 TGF-β1免疫组化检测 石蜡切片后脱蜡至水,抗原修复,3%双氧水阻断内源性过氧化物酶10 min,PBS清洗,滴加一抗、二抗;37.0℃孵育40 min;DAB显色(Fibronectin为AEC显色,阳性呈红色),封片。以PBS代替一抗作空白对照。
1.7.4 放免法对血浆ET-1检测 动物摘眼球取血后分离血浆,加入标准品、样品及抗体后混匀,4℃孵育16 h,加入125I混匀,4℃孵育16 h;加入GAR和NRS混匀,室温孵育90 min,再加缓冲液混匀,离心20 min后吸取上清液,读数、推算结果。
1.7.5 RT-PCR检测CVB3 RNA水平 总RNA提取、鉴定:Trizol一步法抽提取心肌组织100 mg加1 mL Trizol匀浆混匀,加氯仿0.2 mL,再混匀,在4℃下离心12 000 r/min,15 min后转上层液400 μL到另一1.5 mL EP管中,加入异丙醇400 μL混匀,12 000 r/min,离心10 min后弃上清,加入用焦碳酸二乙酯(DEPC)水配且预冷后的75%乙醇1 mL,4℃情况下7500 r/min再离心5 min后弃上清,干燥5~10 min,溶于DEPC水中至20 μL(10~20 μL)。PCR反应条件:CoxsackieB3病毒95℃预变性5 min,94℃变性25 min,58℃退火35 min,72℃延伸15 s,72℃ 7 min终末延伸,35个循环,4℃保温。GAPDH:95℃ 5 min预变性,94℃变性30 s,60℃退火20 s,72℃ 30 s延伸,72℃ 7 min终末延伸。CoxsackieB3序列,5'端序列:TAACACACAC-CGATCAACAG,3'端序列:ATGGCCAATCCAATAACTAT,扩增产物长度522 bp;GAPDH,5'端序列:GAGGCCGG TGCTGAGT ATGT,3'端序列:CTTCTGG-GTGGCAGTGATGG,擴增产物长度294 bp。P-ERK1, 5'端序列:CTACGATCCGACAGATGGC,3'端序列:GAAGCA GCAAGGGCGTTA,扩增产物长度644 bp;GAPDH序列,5'端序列:TTCTTTGCA GCTCCTTCG,3'端序列:TCTCCATGTCGTCCCAGT扩增产物长度为298 bp。PCR反应产物的灰度定量分析:PCR扩增产物以基因GAPDH序列作为内参照,经琼脂糖凝胶电泳后,将电泳结果使用英国Syngene成像分析系统扫描分析灰度值,对阳性电泳条带进行吸光度峰值下面积积分,每一样本以CVB3、P-ERK和GAPDH条带灰度值比值作为样本量。
1.8 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 一般情况
在造模过程中,正常组BALB/c小鼠表现机警,反应快,皮毛致密整齐,有光泽,活动正常,饮食无异常,体重增长较快,无死亡。造模组腹腔注射病毒后从第4天开始出现死亡,存活小鼠精神不振,反应迟钝,皮毛无光泽,饮食减少,消瘦,活动减少,皮温降低,肛门坠粪,7~10 d以后死亡减少,皮毛渐转光泽,活动增多,皮温上升,但有少数小鼠出现烦躁不安,噬咬其他小鼠,1个月后几乎无死亡,造模期间共死亡46只。在治疗过程中,小鼠食量渐增,皮毛光泽度较前有改善,活动度增加,清心Ⅱ号高、中剂量及卡托普利组改善较明显,低剂量组皮毛光泽度改善较高中剂量及卡托普利组差。正常组治疗期间无死亡,模型组、卡托普利组、清心Ⅱ号高剂量组、清心Ⅱ号中剂量组、清心Ⅱ号低剂量组在治疗过程中分别死亡1、2、4、7只。
2.2 心肌纤维化观察
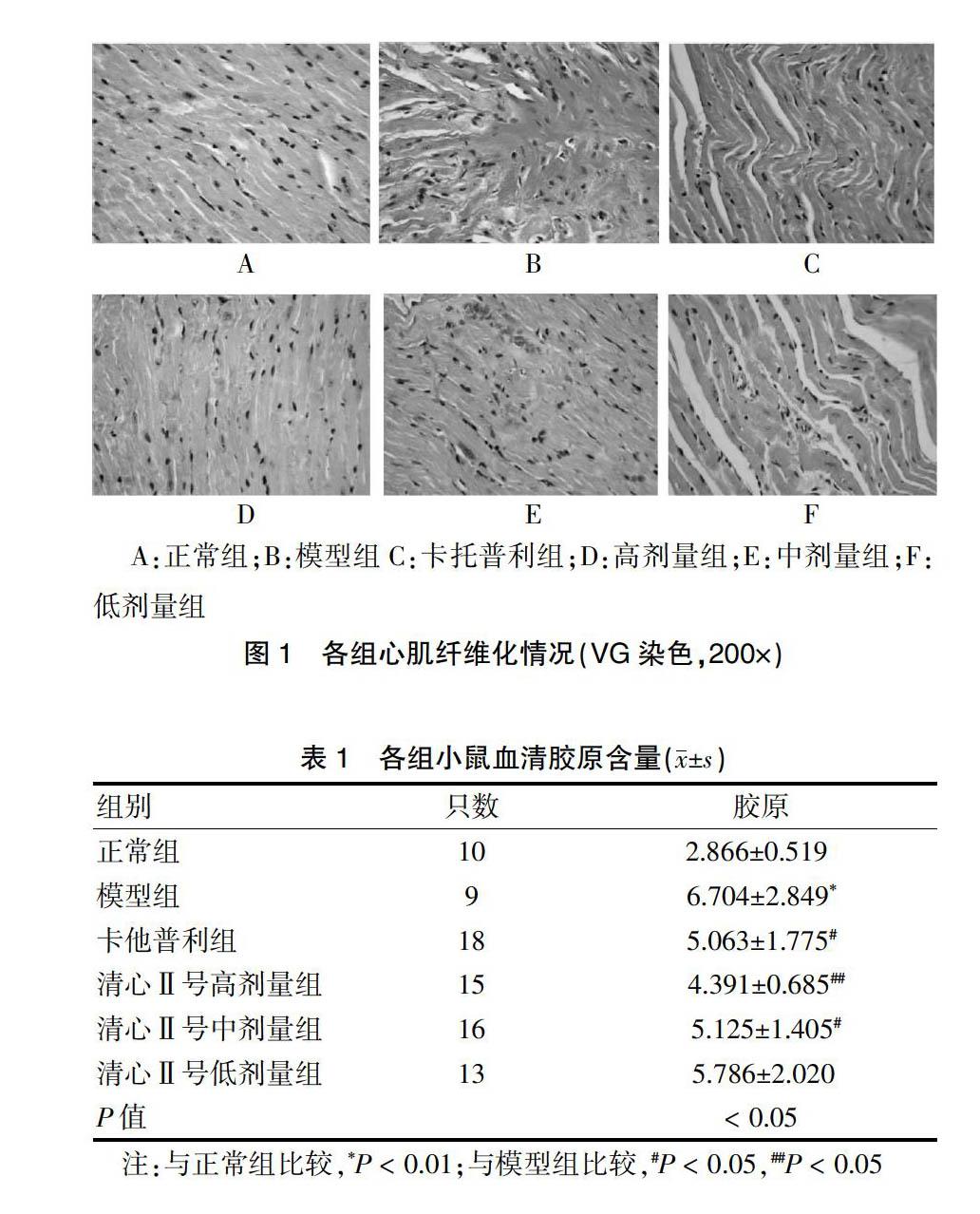
模型组血清胶原含量明显高于正常组,差异有高度统计学意义(P < 0.01);卡托普利组、清心Ⅱ号高剂量组、清心Ⅱ号中剂量组血清胶原含量与模型组比较,差异均有统计学意义(P < 0.05或P < 0.01);而清心Ⅱ号低剂量组与模型组比较,差异无统计学意义(P > 0.05),见表1。从图1可见,VG染色后心肌细胞呈黄色,胶原纤维呈红色,正常组含少量红色胶原纤维,分布于血管周围,模型组细胞红色染色较多,提示胶原纤维增生明显。模型组心肌细胞排列紊乱,血清胶原含量较高,而卡托普利组及清心Ⅱ号各治疗组红色染色减少,变淡,血清胶原含量较少,且清心Ⅱ号各治疗组随剂量增加红色范围逐渐减少,颜色逐渐变淡,亦即心肌细胞纤维化逐渐减轻。
A:正常组;B:模型组C:卡托普利组;D:高剂量组;E:中剂量组;F:低剂量组
图1 各组心肌纤维化情况(VG染色,200×)
表1 各组小鼠血清胶原含量(x±s)
注:与正常组比较,*P < 0.01;与模型组比较,#P < 0.05,##P < 0.05
2.3 心肌ET-1、TGF-β1表达及CVB3 RNA检测结果
造模后模型组TGF-β1、ET-1、CVB3 RNA均高于正常组,差异均有统计学意义(P < 0.05),治疗后各组TGF-β1、ET-1、CVB3 RNA均较模型组降低,差异均有统计学意义(P < 0.05),清心Ⅱ号高剂量组TGF-β1接近于正常组(P > 0.05);对于减少ET-1,清心Ⅱ号高剂量组与卡托普利组疗效相当(P > 0.05),而清心Ⅱ号中、低剂量组较卡托普利组疗效差(P < 0.05)。见表2。
3 讨论
病毒性心肌炎是一种以柯萨奇病毒感染为主的局限性或弥漫性心肌炎症性疾病,慢性期导致心肌纤维化,其形成心肌纤维化的机制尚不十分清楚,一般认为是病毒的直接损伤、局部炎症及自身免疫,释放多种细胞因子,导致炎性细胞浸润,心肌细胞坏死、纤维修复,胶原合成和降解失衡[2],特别是TGF-β1能诱导胶原、蛋白聚糖等细胞外间质成分合成,促进心肌纤维化[3-4],并且TGF-β1基因和蛋白表达水平与心肌纤维化指数呈正相关[5]。有学者认为,TGF-β1可通过多种信号转导途径,如Smads、蛋白激酶C(PKC)、细胞外信号调节激酶(MEK)、小分子G蛋白(Rho)及Rho相关激酶(Rho/Rock)信号通路,激活结缔组织生长因子(connective tissue growth factor,CTGF)[6-9],而CTGF可促进成纤维细胞增殖、胶原分泌[10]。
ET-1是主要由血管內皮细胞产生的、作用极强的缩血管活性多肽,在心肌成纤维细胞表达较强,可使心肌成纤维细胞合成胶原蛋白增加[11]。ET-1通过与内皮素A型受体(endothelin receptor typeA,ET-AR)结合促进心肌细胞肥大与增生[12]。TGF-β1与ET-1之间内在联系,尚不完全清楚,目前已知ET-1是CTGF的上游因子[13],ET-1会刺激多种细胞通过MEK/ERK通路,用U0126可阻断这一过程[14],但在病毒性心肌炎心肌纤维化中鲜有报道。
病毒性心肌炎慢性期由于病毒DNA整合到心肌细胞内形成缺陷病毒,致毒邪内蕴,瘀血阻络,耗伤气阴。清心Ⅱ号由苦参、人参、丹参组成,苦参清热解毒,人参益气养阴,丹参活血化瘀,与病毒性心肌炎的病机相吻合。苦参既有抗柯莎奇病毒病保护心肌细胞的作用[15],又通过抑制AngⅡ的水平、抗氧化以提高NO水平[16],下调心肌组织中TGF-β1的表达以抑制心肌纤维化[17]。人参可通过增加心肌细胞干扰素达到抗病毒的作用[18],通过下调TGF-β1、CTGF、ET-1降低心肌纤维化[19]。丹参有效成分丹参酮ⅡA可能通过抑制心肌同组基因蛋白A(RhoA)/ROCK信号通路,降低下游炎性细胞因子和促纤维化细胞因子分泌,从而减轻心肌纤维化[20]。
本实验,经柯萨奇病毒B3多次腹腔注射复制慢性心肌炎心肌纤维化模型成功后,CVB3 RNA及TGF-β1、ET-1、胶原纤维均较对照组明显增高(P < 0.05),心肌纤维化形成。治疗后上述4项指标均减少,进一步证明清心Ⅱ号抗心肌纤维化与与抑制CVB3 RNA合成的直接抗病毒作用,从而从源头掐断炎症所致心肌纤维化的成因,也揭示了ET-1、TGF-β1在病毒性心肌炎心肌纤维化成过程中起关键作用,其形成机制与Rho/Bock信号通路[8]、TGF-β-MAPK/ERK通路[9]及TGF-β-smads通路有关[21],其抗心肌纤维化作用与清心Ⅱ号剂量有关,随着剂量的增加抗心肌纤维化作用逐渐加强,心肌纤维化程度逐渐减轻,疗效与卡托普利相当(P > 0.05),且清心Ⅱ号未发现干咳等卡托普利的副作用。清心Ⅱ号抗病毒作用亦明显,显示高、中剂量与卡托普利相当,但未见有卡托普利抗病毒作用报道,其机制不明,可能与卡托普利改善免疫机制有关,值得医学界进一步研究。
[参考文献]
[1] 王保奇,刘旺,王娟.清心Ⅱ号对慢性病毒性心肌炎纤维化心肌细胞FN与整合素B1表达的影响[J].中国药理与临床,2009,25(4):63-65.
[2] 马金,丁春华.心脏成纤维细胞与心肌纤维化[J].中华心血管病杂志,2014,42(3):269-272.
[3] Dobaczewski M,Chen W. Transforming growth factor TGF-β signaling in cardiac remodeling [J]. J Mol Cell Cardiol,2011,51(4):600-606.
[4] Creemers EE,Pinto YM. Molecular mechanisms that control interstitial fibrosis in the pressure-overloaded heart [J]. Cardiovasc Res,2011,89(2):265-272.
[5] 张国刚,张赛丹,欧阳细平.缺血心肌病心肌纤维化指标的变化及其机制[J].中南大学学报:医学版,2005,30(4):410-412.
[6] Gu J,Liu X,Wang QX,et al.Angiotensin Ⅱ increases CTGF expression via MAPKs/TGF-β11/TRAF6 pathway in atrial fibroblasts [J]. Exp Cell Res,2012,318(16):2105-2115.
[7] Hu X,Wang H,Liu J,et al.The role of ERK and JNK signaling in connective tissue growth factor induced extracellular matrix protein production and scar formation [J].Arch Dermatol Res,2013,305(5):433-445.
[8] 王保奇,殷子杰,程志清.三参饮对病毒性心肌炎慢性期Rho/Bock信号通路的作用[J].中国实验方剂学杂志,2014, 20(6):140-144.
[9] 程志清,殷子杰,王保奇.TGF-β-MAPK/ERK通路在病毒性心肌炎慢性期病毒感染及纤维化中的作用及三参饮治疗机制[J].浙江中医药大学学报,2009,33(5):655-658.
[10] Sakai N,Chun J,Duffield JS,et al. LPA1-induced cytoskeleton reorganization drives fibrosis through CTGF-dependent fibroblast proliferation [J]. FASEB J,2013,27(5):1830-1846.
[11] Kong P,Christia P,Frangogiannis NG. The pathogenesis of cardiac fibrosis [J]. Cell Mol Life Sci,2014.7l(4):549-574.
[12] 油红文,陈曦,油红捷,等.内皮素及其受体对心脏细胞肥大与增殖的作用[J].中国医学科学院学报,2006,28(4):520-523.
[13] Cmara J,Jarai G. Epithelial-mesenchymal transition in primary human bronchial epithelial cells is Smad-dependent and enhanced by fibronectin and TNF-alpha [J]. Fibrogenesis Tissue Repair,2010,3(1):2.
[14] Corte GJ,Keir GJ,Dimopoulos K,et al. Bosentan in pulmonary hypertension associated with fibrotic idiopathic interstitial pneumonia [J]. Am J Respir Crit Care Med,2014,190(2):208-217.
[15] 陈曙霞,彭旭,刘晶星,等.苦参对感染柯萨奇B3病毒乳鼠搏动心肌细胞的保护作用[J].中华实验和临床病毒学杂志,2000,14(2):137-140.
[16] 范红艳,王艳春,任旷,等.苦参总黄酮对异丙肾上腺素所致大鼠心肌纤维化的影响[J].中药药理与临床,2013, 29(4):76-78.
[17] 郭春艷,汪翼,方艳妮,等.苦参素抗慢性病毒性心肌炎心肌纤维化作用的研究[J].中华儿科杂志,2010,48(4):273-278.
[18] 魏然,陈晨华,董杰德,等.黄芪、人参增强人心肌细胞抗病毒感染的实验研究[J].中国病毒学,1992,7(1):36-42.
[19] 孔宏亮,宋丽杰,李占全,等.人参皂甙对阿霉素心力衰竭大鼠致心脏纤维化因子表达的影响[J].南京医科大学学报:自然科学版,2012,32(1):26-29.
[20] 蔡辉,常文静,赵凌杰,等.丹参酮ⅡA对压力负荷增加大鼠心肌纤维化的影响[J].中华老年心脑血管病杂志,2013,15(12):1307-1311.
[21] 殷子杰,王保奇,侯雪琴,等.TGF-β-smads通路在病毒性心肌炎慢性期病毒感染中的作用机制及卡托普利干预研究[J].中国现代医学杂志,2011,21(32):3998 -4003.
(收稿日期:2015-07-17 本文编辑:任 念)
