PBLD通过MAPK通路抑制HepG2细胞的增殖、侵袭和转移
2016-10-19燕群赵芯梅钟结桃杨海云方堉欣李爱民
燕群 赵芯梅 钟结桃 杨海云 方堉欣 李爱民,2
·论著·
PBLD通过MAPK通路抑制HepG2细胞的增殖、侵袭和转移
燕群1赵芯梅1钟结桃1杨海云1方堉欣1李爱民1,2
目的分析PBLD对HepG2细胞增殖、侵袭及转移的影响,并初步探讨其发挥作用的分子机制。方法首先利用细胞转染技术构建PBLD过表达的HepG2稳转细胞株,CCK-8法检测PBLD过表达后肝癌细胞增殖能力的变化,Transwell实验检测PBLD过表达后HepG2细胞侵袭、转移能力的变化,最后利用W estern-blot技术筛选并验证PBLD可能的下游信号通路。结果PBLD过表达后HepG2细胞的增殖能力被显著抑制(P<0.05),同时,发生侵袭、迁移的细胞数量与空载对照细胞相比显著减低[(68± 12.5)vs.(19±10.21),P<0.01;(30±8.83)vs.(11±4.41),P<0.01]。进一步W estern-blot检测结果显示,PBLD过表达可显著抑制MAPK信号通路相关分子的表达。结论PBLD可通过MAPK信号通路抑制HepG2细胞的增殖、侵袭和转移。
PBLD;HepG2细胞;增殖;转移;信号通路
【Abstract】Objective To investigate the effectsof PBLD on the proliferation,m igration and invasion of HepG2 cells and to explore the underlyingmolecularmechanism.Methods Firstly,we constructed PBLD overexpression cell line using liposome transfection technique.CCK-8 proliferation assay was performed to examine theeffectsof PBLD on cellgrow th in vitro.Transwellm igration and invasion assaywas carried out to investigate the effects of PBLD on themigration and invasion of HepG2 cells.Finally,the downstream genes mediating the effectsof PBLD in HepG2 cellsw ere identified by W estern-blotexam ination.Results CCK-8 proliferation assay showed that upregulation of PBLD significantly inhibited the proliferation rate of HepG2 cells(P<0.05).Transwellmigration and invasion assay showed thatHepG2 cellsmigrated slowerand had less ability to invade through the M atrigel-coated insertsw hen PBLD wasupregulated[(68±12.5)vs.(19± 10.21),P<0.01;(30±8.83)vs.(11±4.41),P<0.01].Theexpressionsof genes in MAPK signalpathwaywere significantly inhibited in PBLD overexpression cells.Conclusion PBLD inhibited the grow th,m igration and invasion of HCC cells in vitro via MAPK signal pathw ay.
【Keywords】PBLD;HepG2 cell;Proliferation;Migration;Signalpathway
原发性肝细胞癌(hepatocellular carcinoma, HCC)的发病率位列全球第六,全球每年新发病例782 500,死亡病例达745 500之多[1-2],占所有成人肝脏恶性肿瘤的75%~90%[3]。HCC具有发病隐匿,恶性程度高、易转移复发等特点,预后不良,是一种严重威胁人类健康的疾病。目前,HCC发生发展的确切分子机制还不明确。因此,从分子水平开展对HCC发病机制的深入研究,对探索新的靶向治疗途径、改善肝癌预后意义深远。
Phenazine biosynthesis-like domain-containing protein(PBLD)又称为MAWBP,最早在2001年由Iriyama等人[4]利用酵母双杂交技术从人的肝脏cDNA库中分离发现。作为phenazinebiosynthesislike protein蛋白家族的惟一代表,PBLD广泛分布于人的大脑、心脏、肺脏、肝脏、胰腺和肾脏等各种组织中。已有研究发现,PBLD的表达水平在胰岛素抵抗、叶酸缺乏症和高血压等一些疾病中升高[5]。但是,该分子在人体各组织及其在各种肿瘤发生发展中的具体生物学功能及其发挥作用的分子机制目前还没有研究报道。迄今,关于该分子的有限认识仅仅来源于基因组和蛋白组学海量、笼统的筛选结果中。因此,本研究首先分析了PBLD对肝癌细胞株HepG2增殖、侵袭和迁移的影响,然后进一步对PBLD发挥这种生物学作用的下游信号通路进行了探索。
材料与方法
一、细胞系和实验动物
肝癌细胞株HepG2购自美国标准生物品收藏中心(American type culture collection,ATCC),普通高糖培养基购自Gibco公司,胎牛血清购自Hyclone公司,G418购自美国MPBiomedicals公司,PBLD过表达质粒pEGFP-N1/PBLD、空载质粒pEGFP-N1/vector及其相应菌液购自上海吉凯基因化学技术有限公司,转染试剂LipofectAM INE 2000购自Invitrogen公司,CCK-8液购自Beyotime公司,Matrigel基质胶购自BD公司,Transwell小室购自Corning公司,兔抗人ERK/pERK、p38/p-p38及JNK/pJNK一抗均购自CST公司,小鼠抗人Tubulin单克隆一抗购自三箭生物技术有限公司。
二、细胞培养
HepG2细胞株培养在含10%胎牛血清、100u青、链霉素双抗的高糖DMEM完全培养基中。稳定转染PBLD的HepG2细胞株及其空载对照细胞培养在含400μg/m L G418的高糖DMEM完全培养基中。以上所有细胞的培养在温度37℃,5%CO2的培养箱中。
三、细胞转染
调整HepG2细胞密度为1×105/m L接种于6孔板中,待细胞融合度达到70%左右时即可进行细胞转染。按照LipofectAM INE 2000说明书将PBLD质粒转染入肝癌细胞株中,然后在培养基中加入G418对转染细胞进行药物筛选,96孔板进行单克隆筛选,所得细胞株用于后续实验。
四、CCK-8检测
取处于对数生长期的细胞,按每孔2 000个细胞的密度接种于96孔板中培养。细胞贴壁后换液,分别在0、24、48、72 h四个时间点于每组细胞中随机选取5孔细胞进行CCK-8增殖检测。以培养基体积:CCK-8体积=10:1的比例配制工作液,在每孔中加入100μLCCK-8工作液继续培养2 h,使用酶标仪测定各孔在450 nm波长处的吸光值。以生长时间为横坐标,各组细胞在各个时间点的平均光吸收值与各组细胞贴壁0 h时测得的平均吸光值的比值作为纵坐标,进行生长曲线的绘制。
五、Transwell迁移、侵袭实验
将Matrigel按1:8的比例稀释,将稀释液用预冷的枪头缓缓加至Transwell小室基底膜的内室面上,37℃风干。消化细胞前一天饥饿细胞,常规胰酶消化细胞,用无血清培养基重悬后轻轻吹匀细胞制备单细胞悬液。分别将200μL细胞悬液加入基质胶(侵袭)和不含基质胶(迁移)的Transwell小室内室中,外室中加入500μL含20%FBS的培养基,常规条件下继续培养48 h。取出Transwell小室,用棉签擦去Transwell小室基底膜内室面残留的贴壁细胞,4%多聚甲醛室温下固定20 h,0.5%结晶紫室温下染色20m in,PBS洗净结晶紫染液,将染色后的Transwell小室倒置,室温下风干。于高倍镜下随机取5个视野,细胞计数。
六、Western-blot实验
裂解液冰上裂解细胞20m in,每隔10min混匀一次,4℃,12 000 rpm离心30m in,取上清。加入loading buffer后沸水中煮5m in使其充分变性。利用10%分离胶分离目的蛋白,200mA,90m in恒流转膜。将载有目的蛋白的PVDF膜5%的脱脂奶粉/ TBST室温封闭2 h,4℃摇床一抗孵育过夜(浓度均为1:1 000),之后常温二抗孵育1 h(1:3 000),发光。
七、统计方法
所有数据均采用SPSS19.0软件进行分析。两不同组间差异比较采用两独立样本t检验进行分析,P<0.05视为组间差异具有统计学意义。
结果
一、PBLD过表达抑制HepG2细胞株的增殖
为研究PBLD对肝癌细胞株增殖能力的作用,我们首先将稳定过表达PBLD的HepG2_PBLD及其相应的空载对照细胞进行CCK-8检测。结果如图1所示,在两组细胞贴壁后的24、48、72 h,PBLD过表达组的细胞量均显著小于它们所对应的空载对照组细胞数(P<0.05,图1)。因此,由CCK-8结果我们发现PBLD可显著抑制肝癌细胞的增殖能力。
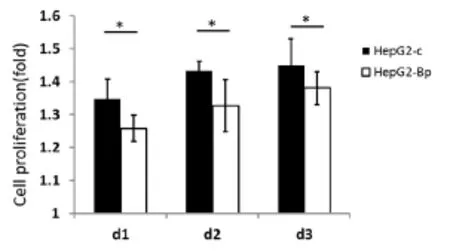
图1 CCK-8检测PBLD过表达对肝癌细胞增殖功能的影响
二、PBLD可抑制HepG2细胞侵袭、迁移能力
为研究PBLD对肝癌细胞侵袭、迁移能力的影响,我们分别将HepG2_PBLD和HepG2_vector接种于含有基质胶和无基质胶的Transwell小室中,48 h后结晶紫染色、计数。结果如图2所示,在没有基质胶存在的情况下,HepG2_PBLD细胞穿过基底膜的细胞数均明显少于空载对照细胞(P<0.01);同样,在有基质胶存在的条件下,HepG2_PBLD穿过基底膜的细胞数也均明显少于其对应的空载对照细胞(P<0.01)。由此可推断,PBLD能够显著抑制肝癌细胞的迁移、侵袭能力。
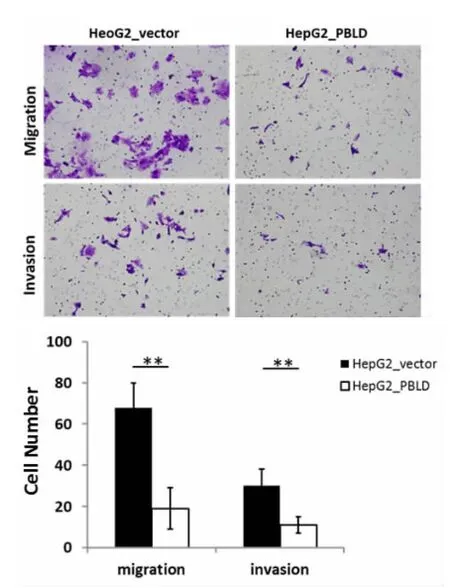
图2 Transwell迁移、侵袭实验检测PBLD过表达对肝癌细胞株迁移、侵袭能力的影响
三、PBLD通过抑制MAPK信号通路发挥作用
为进一步探索PBLD发挥生物学作用的下游分子机制,我们利用Western-blot检测了PBLD过表达之后MAPK信号通路关键分子p-ERK、p-p38以及p-JNK的表达变化,结果如图3所示,PBLD过表达后ERK、p38及JNK的表达无显著变化,但其对应的活化形式pERK、p-p38及pJNK的表达均被显著抑制。由此我们推断,PBLD可能抑制MAPK信号通路进而抑制肝癌细胞的增殖与侵袭、迁移。
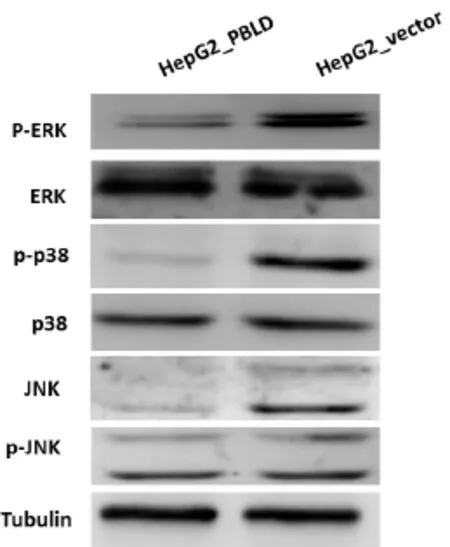
图3 Western-blot检测PBLD过表达后MAPK信号通路的变化
讨论
增殖能力和侵袭、转移能力是判断肿瘤恶性程度的重要指标。因此,为研究PBLD对肝癌恶性进展的影响,我们利用脂质体转染的方法将PBLD过表达质粒转染入HepG2细胞中,首先观察其对肝癌细胞增殖能力的影响。CCK-8结果显示,PBLD过表达可显著抑制肝癌细胞株的增殖能力。回顾以往有关PBLD与肿瘤的研究,除了组织的基因组和蛋白组学的筛选,关于PBLD生物学功能的研究仅有个别报道。Li等[6]以蛋白组学筛选的结果为基础,通过细胞转染分析了PBLD对胃癌细胞增殖能力的影响,并得出了PBLD可显著抑制胃癌细胞增殖的结论,与本研究结果相一致。
在前期的研究中,Xu等[7]利用蛋白组学对有门静脉癌栓的肝癌组织和没有门静脉癌栓的肝癌组织的差异蛋白进行筛选,其中,PBLD在有静脉癌栓的肝癌组织中表达显著降低,提示PBLD可能与肝癌细胞的侵袭、迁移相关。为验证此假设,在本研究的细胞学实验部分利用Transwell侵袭、迁移实验检测了PBLD对肝癌细胞株侵袭、迁移能力的影响,结果显示PBLD可以显著抑制肝癌细胞株的侵袭和迁移能力。该结果与Li等[6]在胃癌侵袭、转移研究中的研究结果相一致。
关于PBLD发挥作用的分子机制,目前的研究对其知之甚少。Li等[6]发现,MAWBP(PBLD)可通过抑制TGF-β1诱导的EMT从而抑制EMT相关的胃癌的进展的结论;Zhao等[8]推测PBLD可能通过MAPK通路对癌前病变溃疡性结肠炎发挥一定的调控作用。丝裂原活化的蛋白激酶(mitogen-activatedproteinkinaae,MAPK)是一组可被多种信号激活的丝/苏氨酸激酶。已有研究证实,MAPK信号转导通路存在于大多数细胞内,其作用过程涉及多层次的细胞调节。MAPK有多个亚家族,主要包括ERK、JNK/SAPK,p38MAPK等。已有研究证实,MAPK在HCC中表达上调[9],而被激活的MAPK在肿瘤的恶性进展中起到重要作用[10],抑制MAPK可显著抑制肿瘤的血管生成[11]及转移能力。本研究发现,PBLD过表达之后,MAPK信号通路关键分子的表达被显著抑制。由此可推断,PBLD可能通过抑制MAPK信号通路抑制HepG2细胞的增殖、侵袭和转移能力。
综上所述,PBLD作为一个潜在的候选抑癌基因,可能通过MAPK信号通路抑制HepG2细胞的增殖、侵袭和转移。
[1]FornerA,LlovetJM,BruixJ.Hepatocellularcarcinoma[J].Lancet,2012,379(9822):1245-1255.
[2]TorreLA,BrayF,SiegelRL,etal.Globalcancerstatistics,2012[J]. CACaancerJClin,2015,65(2):87-108.
[3]CenterMM,JemalA.Internationaltrendsinlivercancerincidence rates[J].CancerEpidemiolBiomarkersPrev,2011,20(11):2362-2368.
[4]IriyamaC,MatsudaS,KatsumataR,etal.Cloningandsequencing ofanovelhumangenewhichencodesaputativehydroxylase[J].J HumGenet,2001,46(5):289-292.
[5]SchvartzD,CouteY,BrunnerY,etal.Modulationofneuronal pentraxin1expressioninratpancreaticbeta-cellssubmittedto chronicglucotoxicstress[J].MolCellProteomics,2012,11(8):244-254.
[6]LiDM,ZhangJ,LiWM,etal.MAWBPandMAWDinhibitproliferationandinvasioningastriccancer[J].WorldJGastroenterol,2013,19(18):2781-2792.
[7]XuX,WeiX,LingQ,etal.Identificationoftwoportalveintumor thrombosisassociatedproteinsinhepatocellularcarcinoma:protein disulfide-isomeraseA6andapolipoproteinA-I[J].JGastroenterol Hepatol,2011,26(12):1787-1794.
[8]ZhaoX,KangB,LuC,etal.Evaluationofp38MAPKpathwayas amolecularsignatureinulcerativecolitis[J].JProteomeRes,2011,10(5):2216-2225.
[9]ChiuCC,ChenJY,LinKL,etal.p38MAPKandNF-kappaB pathwaysareinvolvedinnaphtho[1,2-b]furan-4,5-dioneinduced anti-proliferationandapoptosisofhumanhepatomacells[J].CancerLett,2010,295(1):92-99.
[10]HuberMA,AzoiteiN,BaumannB,etal.NF-кBisessentialfor epithelial-mesenchymaltransitionandmetastasisinamodelof breastcancerprogression[J].JClinInvest,2004,114(4):569-581.
[11]MukaidaN,MoritaM,IshikawaY,etal.Novelmechanismofglucocorticoid-mediatedgenerepression.Nuclearfactor-kappaBis targetforglucocorticoid-mediatedinterleukin8generepression[J]. JBiolChem,1994,269(18):13289-13295.
(本文编辑:南清振)
《现代消化及介入诊疗》杂志征稿、征订启事
《现代消化及介入诊疗》(ModernDigestion&Intervention)是国家科技部批准、广东省卫生和计划生育委员会主管、广东省医学学术交流中心主办、南方医科大学南方医院消化疾病研究所承办的中国科技论文统计源期刊(中国科技核心期刊),向国内外公开发行的学术性医学期刊。本刊宗旨是贯彻邓小平理论和“三个代表”思想,报道现代消化病与介入诊疗学的理论研究和临床经验,展示科技成果,加强学术交流,促进科技繁荣。遵循“三主三结合”原则:①以临床应用为主,基础理论与临床实践相结合;②以普及新技术新业务为主,普及与提高相结合;③以现代医学为主,中医与西医相结合,推动消化病与介入诊疗工作的开展与提高,为人类健康服务。本刊开设栏目有述评、专家论坛、论著(基础与临床)、短篇论著、综述、临床经验、诊疗技术、讲座、会议纪要、学术争鸣、病例分析与个案报道,欢迎投稿,欢迎订阅。国内发行:全国各地邮局订购,邮发代号46-356;国外:中国国际图书贸易总公司(100044,北京车公庄西路35号)订购,代号为M4270。本刊为大16开双月刊,国内统一刊号:CN44-1580/R,国际标准刊号:ISSN1672-2159,广告经营许可证号:4400004001080,每期定价15元,全年90元。
地址:广州市广州大道北1838号南方医科大学南方医院消化编辑部(邮编:510515)
联系电话:(020)61641547传真:(020)87280770E-mail:jmdi@vip.163.com
PBLD inhibits the p roliferation,invasion and m etastasis of HepG 2 cells through the M APK pathw ay
YANQun1,ZHAO Xin-mei1,ZHONG Jie-tao1,YANG Hai-yun1,FANG Yu-xin1,LIAi-min1,2.
1)Department of Gastroenterology,Guangdong Provincial Key Laboratory ofGastroenterology,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China;2)DepartmentofGastroenterology,Guangzhou Key Laboratory of Digestive Disease,Guangzhou FirstMunicipal People′s Hospital,Guangzhou Medical University,Guangzhou 510180,China.Correspondence to:LIAi-min,E-mail:lam0725@163.com
2016-07-10)
10.3969/j.issn.1672-2159.2016.04.001
1 510515南方医科大学南方医院消化科;2 510180广州医科大学附属广州市第一人民医院消化科
李爱民,E-mail:lam0725@163.com
国家自然科学基金青年项目(81402028);广东省自然科学基金(2015A030310082);广东省海外合作项目(2014A050503041)
