早期宫颈癌前哨淋巴结中高危型HPV16/18 DNA表达的检测及临床意义
2016-10-18蒋燕明杨岚弋文娟
蒋燕明 杨岚 弋文娟
柳州市人民医院妇科,广西柳州545006
早期宫颈癌前哨淋巴结中高危型HPV16/18 DNA表达的检测及临床意义
蒋燕明#杨岚弋文娟
柳州市人民医院妇科,广西柳州545006
目的探讨早期宫颈癌患者前哨淋巴结(SLN)中人乳头状瘤病毒(HPV)16/18 DNA表达检测对于微转移的临床意义。方法选取72例早期宫颈癌患者,予患者均行广泛性子宫切除加双侧盆腔淋巴结清扫术,术中采用染料法识别SLN的宫颈癌患者有46例,应用基因检测法(FQ-PCR)检测SLN中HPV16/18 DNA阳性表达情况,并分析其与各种临床病理因素的关系;对SLN病理阴性的33例患者进行长期随访,分析SLN中HPV16/18 DNA阳性与淋巴结转移的关系。结果46例宫颈癌患者SLN中HPV16/18 DNA阳性表达者共22例,其中13例淋巴结病理阳性患者中有10例阳性,而33例淋巴结病理阴性患者中仅12例阳性(P=0.013);46例患者共检出前哨淋巴结102枚,均用FQ-PCR法检测HPV16/18 DNA,结果13例淋巴结病理阳性患者检出的37枚SLN中有29枚HPV16/18 DNA阳性,而33例淋巴结病理阴性患者检出的65枚SLN中仅有36枚阳性(P=0.033);分析46例成功检出SLN的早期宫颈癌患者的临床资料,发现SLN中HPV16/18 DNA阳性表达仅与临床分期有关,具有统计学意义(P=0.034);长期随访33例SLN病理阴性的患者,发现HPV16/18 DNA阳性的患者复发率高于HPV16/18 DNA阴性的患者,具有统计学意义(P=0.02)。结论检测宫颈癌SLN组织中HPV16/18 DNA表达可能是预测早期宫颈癌淋巴结微转移的可行方法。
宫颈癌;前哨淋巴结;人乳头瘤病毒;微转移
Oncol Prog,2016,14(6)
淋巴结转移是影响早期宫颈癌患者预后的重要因素,也是术后辅助治疗的依据。研究表明,即使常规病理检查无淋巴结转移等高危因素存在,仍有10%~20%的患者出现复发和转移,这可能与肿瘤细胞微转移有关。人乳头瘤病毒(human papillomavirus,HPV)是导致宫颈癌发生的主要致病因子,99%的患者宫颈癌组织中可检测出HPV,其中高危型HPV16/18 DNA在宫颈癌中的检出率约73%[1]。因此,本研究拟对早期宫颈癌患者行常规广泛子宫切除及盆腔淋巴结清扫术,术中进行前哨淋巴结(SLN)识别、定位,术后对SLN和其余淋巴结及子宫附件标本进行常规病理检查,同时采用荧光定量聚合酶链反应(FQ-PCR)技术检测宫颈癌前哨淋巴结中高危型HPV16/18 DNA,协助发现淋巴结微转移病灶,探讨早期宫颈癌患者SLN中HPV16/18 DNA的检测对于微转移的临床意义,现报道如下。
1 资料与方法
1.1一般资料
经柳州市人民医院伦理委员会批准,选取2005年5月至2009年10月在柳州市人民医院收治的早期宫颈癌患者72例,患者均经病理诊断或宫颈环形电切术(LEEP)确诊后由同一组手术医师行广泛性子宫切除和盆腔淋巴结清扫术,术中行前哨淋巴结活检,其中有46例患者检出前哨淋巴结。纳入标准:临床分期Ⅰa2~Ⅱa(分期标准参照2009年国际妇产科联盟FIGO 2009)宫颈癌分期;术前检测宫颈癌组织中HPV均阳性;术前均未接受放疗或化疗;临床病理检查未发现盆腔及腹主动脉旁淋巴结转移;术前患者均知情并签署知情同意书。排除标准:具有手术禁忌证;其他恶性肿瘤史;对染料过敏等。46例患者平均年龄为(43.2± 11.6)岁,其中Ⅰ期32例,Ⅱa期14例;鳞癌38例,腺癌5例,腺鳞癌3例。
1.2方法
1.2.1SLN的定位和取材患者于术前当日清晨,取膀胱截石位,暴露及消毒宫颈,用亚甲蓝2~4 ml分4点分别注射到宫颈癌病灶四周,注射深度为0.5~1.0 cm。注射后行广泛子宫切除术+盆腔淋巴结清扫术。术中观察蓝染淋巴结为前哨淋巴结。收集前哨淋巴结组织一半送常规病理检查,另一半置于-20℃的生理盐水中保存用于检测HPV16/18 DNA(每例患者的前哨淋巴结作为一份标本)。
1.2.2FQ-PCR测定HPV16/18 DNA引物和试剂由中山大学达安基因股份有限公司提供,采用美国Roche公司LightcyclerⅡ型PCR仪检测。样本DNA的提取按试剂盒说明书进行。扩增条件为93℃2 min预变性,93℃45 s,55℃60 s,共10个循环,93℃30 s,55℃45 s预变性,30个循环后直接在PCR仪上分析,由电脑自动分析计算定量结果。每次试验按试剂盒提供的定量阳性标准品做标准曲线,同时设置阴性、空白对照,根据标准曲线读出数据。
1.3微转移的判定
检测HPV16/18 DNA阳性即判定为前哨淋巴结微转移。
1.4随访内容
对检出前哨淋巴结的患者全部进行随访。手术结束后,第1年每3个月随访1次,第2年每半年随访1次,第3年起每年1次或患者复发时随访。生存时间为手术当日至复发或截尾日期,以年为计算单位,随访截止日期为2015年10月30日,将至今未复发的患者和失访的患者统称为截尾患者。
1.5统计学方法
应用SPSS19.0软件对数据进行统计学分析,采用χ2检验。生存分析应用Kaplan-Meier法,采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1前哨淋巴结的检出率
72例早期宫颈癌患者有46例患者检出蓝染的前哨淋巴结,每例患者分别检出前哨淋巴结标本1~4枚不等,共检出102枚,检出率63.9%。
2.2前哨淋巴结组织中HPV16/18 DNA的检测结果
检测46例早期宫颈癌患者的前哨淋巴结中HPV16/18 DNA,结果显示22例患者HPV16/18 DNA阳性,其中13例淋巴结病理阳性患者有10例HPV16/18 DNA阳性,而33例淋巴结病理阴性患者仅有12例HPV16/18DNA阳性,差异有统计学意义(P=0.013)。采用FQ-PCR检测102枚前哨淋巴结标本HPV16/18 DNA,13例淋巴结病理阳性病例中检出的37枚前哨淋巴结有29枚阳性,而33例淋巴结病理阴性病例中检出的65枚前哨淋巴结仅有36枚阳性,差异有统计学意义(P=0.033)。
2.3前哨淋巴结组织中HPV16/18 DNA阳性与临床病理因素的关系
分析46例成功检出前哨淋巴结的早期宫颈癌患者的临床资料,发现前哨淋巴结HPV16/18 DNA阳性与年龄、组织类型和肿瘤直径无关,但与临床分期有关,具有统计学意义(P=0.034),详见表1。
2.4前哨淋巴结组织中HPV16/18 DNA阳性对早期宫颈癌患者预后及生存情况的影响
对SLB病理结果阴性的33例患者进行长期随访,随访时间6~10年,其中12例检测前哨淋巴结HPV16/18 DNA阳性的患者6例复发,复发率50%;而21例前哨淋巴结HPV16/18 DNA阴性的患者仅3例复发,复发率14%;复发最常见的部位是阴道残端及盆腔淋巴结,其中5例患者复发于阴道残端,3例复发于盆腔淋巴结,1例复发于直肠。前哨淋巴结HPV16/18 DNA阳性与阴性患者的预后及生存情况比较,差异有统计学意义(χ2=5.059,P= 0.02)。(图1)
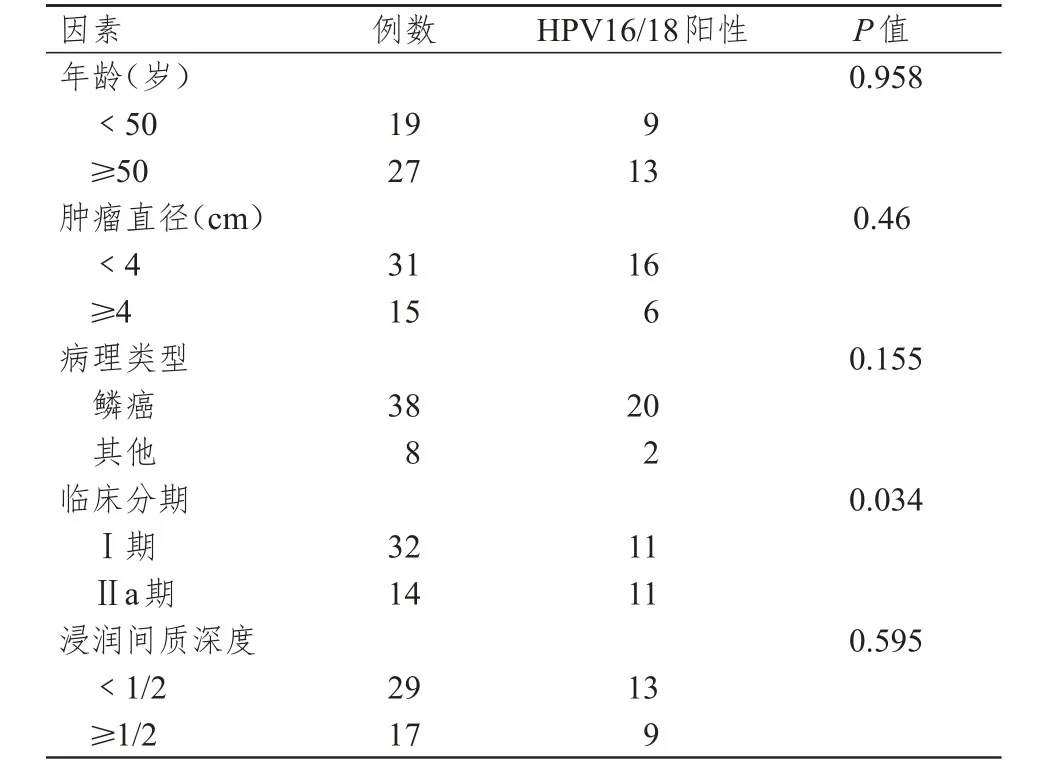
表1 宫颈癌前哨淋巴结中HPV16/18阳性率与临床病理因素的关系
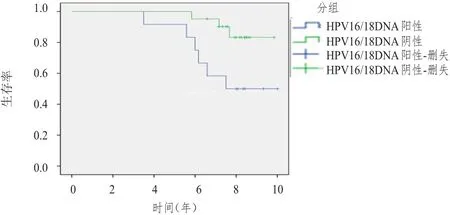
图1 前哨淋巴结HPV16/18 DNA阳性对早期宫颈癌患者预后及生存情况的影响
对SLB病理结果阳性的13例患者均予术后补充放疗,随访时间5年,其中10例检测前哨淋巴结HPV16/18 DNA阳性的患者6例复发,4例在5年内死亡;3例前哨淋巴结HPV16/18 DNA阴性的患者仅1例复发,复发时间为术后73个月,复发率33%。
3 讨论
宫颈癌是全球妇女恶性肿瘤中仅次于乳腺癌的常见恶性肿瘤,每年大约有53万宫颈癌新发和27.5万死亡患者[2],该病在中国女性中发病率居第一位。宫颈癌盆腔淋巴结转移是影响患者愈后的重要因素。研究表明Ⅰb~Ⅱa期的宫颈癌患者若无盆腔淋巴结转移,其5年生存率可达85%~90%,而一旦有区域淋巴结转移,其5年生存率则降为30%~60%[3]。然而临床中发现部分临床分期较早、组织病理学检查阴性的淋巴结患者预后较差,复发率约20%[4],提示可能有病理检查未能发现的转移。组织病理学检查阴性的淋巴结中HPV16/18 DNA检出阳性可能与未能发现的微转移,由免疫活性细胞吞噬消化的微转移灶及经淋巴管运输扩散的游离HPV病毒颗粒有关[5]。
1869年,Ashworth首次在外周血中发现肿瘤细胞,至此微转移的概念获得了人们的重视,并成为研究热点。目前广泛接纳的是美国癌症联合委员会(AJCC)最新分期中定义的,微转移灶直径<2 mm,且>0.2 mm[6],而转移灶直径≤0.2 mm则称为孤立肿瘤细胞[7]。临床转移一般都由微转移发展而来,而微转移中只有少数患者能够发展为临床转移。特异性标志物的选择是微转移准确检出的关键,宫颈癌微转移的诊断主要在于检测技术的敏感度和特异度。目前对宫颈癌复发和转移的诊断技术仍然停留在传统组织病理学检查水平,但是常规的HE染色病理检查对于淋巴结微小的转移病灶(<2 mm)易漏诊,而淋巴系统中微转移病灶的存在,提示肿瘤已不再局限于原发病灶,而有发展为远端转移的可能,因此检测淋巴结微转移比检测外周血、骨髓中早期浸润的肿瘤细胞更具有意义。虽然对所有的淋巴结均进行分子生物学检测,可提高宫颈癌淋巴结微转移诊断的准确性,但是因工作程序复杂而难以在临床上常规开展。有学者认为,在80%的早期宫颈癌患者中,前哨淋巴结是唯一包含隐匿性转移灶的淋巴结,由此这也促使人们对宫颈癌淋巴结微转移的研究越来越集中在SLN的检测[8]。
前哨淋巴结是原发肿瘤引流区域发生转移必经的第一站淋巴结,如果SLN未发生转移,则其他淋巴结发生转移的可能性小于1%。理论上对于SLN无转移的患者可免行淋巴结清扫术,从而避免了手术并发症。宫颈癌SLN识别技术目前正处于探索阶段,以SLN活检取代淋巴结清扫术可能为今后的发展方向。用于检测SLN微转移的方法有免疫组织化学法、病理连续切片法、基因检测法、基因芯片技术及流式细胞学技术等。基因检测法优点在于其敏感度高,而且不需要大量的切片、染色工作,故本研究采用FQ-PCR基因检测法检测SLN微转移。目前关于宫颈癌SLN的微转移研究报道较少,本研究从分子水平检测宫颈癌前哨淋巴结HPV16/18 DNA,有助于发现组织病理学不易检出的淋巴结微转移,从而弥补了病理诊断的不足。
已有研究证实HPV感染中,尤其是HPV16/18是已知的宫颈癌致病因素[9-10],鳞状上皮细胞一般较易感染HPV,盆腔淋巴结组织则不易感染。因此,淋巴结组织检测HPV阳性提示宫颈癌淋巴结微转移[11]。Coutant等[12]采用PCR法检测了59例患者的肿瘤组织及SLN中HPV DNA表达,研究表明检测宫颈癌患者SLN中HPV DNA可能有助于识别淋巴结转移和复发的风险。本研究结果表明,早期宫颈癌转移淋巴结组织中HPV16/18 DNA阳性表达率增高,提示HPV16/18可作为淋巴结微转移的分子标志物,且FQ-PCR技术能检测出常规病理检查未发现的微转移病灶,从而提高了淋巴结微转移的检出率,也可提高对SLN转移诊断的敏感度及准确率,降低假阴性的发生率,使SLN活检技术在临床广泛应用。因此,在对早期宫颈癌患者进行根治术治疗前,通过检测SLN中HPV16/18 DNA或许有助于对手术方法的选择。而常规病理检测阴性的淋巴结患者若检测为HPV16/18 DNA表达阳性,应考虑患者有淋巴结微转移的可能,术后需予辅助治疗并密切随访。Rolla等[13]研究发现淋巴结中HPV DNA可能为宫颈癌早期转移的标志物,故可能用于预测肿瘤复发,该研究还认为通常未经治疗的患者有这种标志可以接受辅助治疗。
本研究通过分析早期宫颈癌患者前哨淋巴结中HPV16/18 DNA检测结果还发现,患者淋巴结微转移与年龄、组织类型和肿瘤直径无关,但与临床分期有关,考虑可能因为临床分期高则肿瘤细胞发生转移的概率增加所致,进一步提示SLN中HPV16/18 DNA阳性与微转移的密切关系。经对患者进行长期随访,还发现SLN中HPV16/18 DNA阳性患者复发例数多于HPV16/18 DNA阴性患者,该结果与Dürst等[14]研究结果一致,进一步证实SLN中HPV16/18 DNA的检测可能有助于更准确地诊断淋巴结微转移,并予以适当的辅助治疗,对宫颈癌的预后指导具有极其重要的意义。然而Lukaszuk等[15]采用PCR法检测宫颈癌盆腔淋巴结HPV,并对患者随访7~8年,发现淋巴结HPV阳性与病理检查阳性患者的预后无明显差别。该结果与本研究结果不一致,考虑可能因为患者不是前哨淋巴结所致。对于本研究今后还需扩大样本量,并对所有患者继续进行长期随访,以便明确早期宫颈癌前哨淋巴结中HPV16/18 DNA阳性与微转移、预后的关系,为早期宫颈癌患者转移和复发的防治提供理论依据。
[1]Crosbie EJ,Einstein MH,FranceschiS,et al.Human papillomavirus and cervical cancer[J].Lancet,2013,382(9895): 889-899.
[2]Gillison ML,Castellsagué X,Chaturvedi A,et al.Eurogin Roadmap:comparative epidemiology of HPV infection and associated cancers of the head and neck and cervix[J].Int J Cancer,2014,134(3):497-507.
[3]Moore DH.Cervical cancer[J].Obstet Gynecol,2006,107: 1152-1161.
[4]Sláma J,Drazd'áková M,Fischerová D,et al.Detection of HPV DNA in lymph nodes in early stages cervical cancers[J].Ceska Gynekol,2008,73(4):217-221.
[5]孙颖,刘国炳,余艳红.盆腔淋巴结HPV—DNA检出率与早期宫颈癌临床转移的关系[J].南方医科大学学报,2008,28:796-804.
[6]张珊珊,杨萌,娄阁.宫颈癌前哨淋巴结微转移的研究与应用现状[J].实用肿瘤学杂志,2013,27(3):219-222.
[7]Slama J,Drazdakova M,Dundr P,et al.High-risk human papillomavirus DNA in the primary tumor,sentinel,and nonsentinelpelviclymph nodes in patients with early-stage cervical cancer:a correlation with histopathology[J].Int J Gynecol Cancer,2009,19(4):703-707.
[8]Eiriksson LR,Covens A.Sentinel lymph node mapping in cervical cancer:the future[J].BJOG,2012,119(2):129-133.[9]Bosch FX,de Sanjose S.Human papillomavirus and cervical cancer-burden and assessment of causality[J].J Natl Cancer Inst Monogr,2003,31:3-13.
[10]Jemal A,Simard EP,Dorell C,et al.Annual Report to the Nation on the Status of Cancer,1975-2009,featuring the burden and trends in human papillomavirus(HPV)-associated cancers and HPV vaccination coverage levels[J].J Natl Cancer Inst,2013,105(3):175-201.
[11]Maynard MA,Ohh M.The role of hypoxia-inducible factors in cancer[J].Cell Mol Life Sci,2007,64:2170-2180.
[12]Coutant C,Barranger E,Cortez A,et al.Frequency and prognostic significance of HPV DNA in sentinel lymph nodes of patients with cervical cancer[J].Ann Oncol,2007,18(9):1513-1517.
[13]Rolla M,Berretta R,Patrelli TS,et al.A perspective study on correlation between HPV DNA and lymph nodes in surgically treated cervical carcinoma patients.Preliminary data[J].Eur J Gynaecol Oncol,2009,30(5):557-561.
[14]Dürst M,Hoyer H,Altgassen C,et al.Prognostic value of HPV-mRNAin sentinel lymph nodes of cervical cancer patients with pN0-status[J].Oncotarget,2015,6(26):23015-23025.
[15]Lukaszuk K,Liss J,Gulczynski J,et al.Predictive value of HPV DNA in lymph nodes in surgically treated cervical carcinoma patients-A prospective study[J].Gynecol Oncol,2007,104:721-726.
Detection of HPV16/18 DNAexpression in sentinel lymph nodes in early stages cervical cancer
JIANG Yan-ming#YANG Lan YI Wen-juan
Department of Gynecology,Liuzhou People’s Hospital,Liuzhou 545006,Guangxi,China
ObjectiveTo investigate the expression and significance of human papillomavirus(HPV)16/18 DNA in pelvic sentinel lymph nodes(SLN)in early stage cervical carcinoma.Method72 patients with early stages cervical cancer were enrolled in the study,and were administered with radical hysterectomy and pelvic lymphadenectomy,46 cases had SLN biopsies with staining,whose HPV16/18 DNA expression were examined by FQ-PCR,besides,the correlation with the clinical pathological factors were also investigated;long-term follow-up was conducted in 33 patients with pathologically negative SLN,and the association between lymph node micrometastasis and HPV16/18 DNA was analyzed.ResultOf the 46 patients,22 patients had positive expression of HPV16/18 DNA in SLN,in which there were 10 patients with positive DNA expression among 13 cases with lymph node metastasis,while in 33 patients with negative lymph node involvement,only 12 had positive expression(P=0.013);HPV16/18 DNA was detected using FQ-PCR,and a total of 102 SLNs were identified from the 46 patients,in the 37 SLNs of 13 cases with lymph node metastasis,there were 29 SLNs with positive HPV16/18,while in the 65 SLNs found in 33 cases of negative lymph involvement,only 36 SLNs were identified as positive(P=0.033);after reviewing the clinical profile of 46 cases with identified SLN,it was found that,the HPV16/18 DNA positive expression was associated with the clinical stage only,which was of statistical significance(P=0.034);in the long-term follow-up for 33 cases of negative SLN,a higher recurrence rate was observed in patients with positive HPV16/18 DNA than that in those with negative HPV16/18 DNA,which was of statistical significance(P=0.02).ConclusionDetecting the expression of HPV16/18 DNA of SLN tissues maybe an available option for identifying SLN micrometastasis examination in early stages cervical carcinoma.
cervical cancer;sentinel lymph node;HPV;micrometastasis
R737.3
A
10.11877/j.issn.1672-1535.2016.14.06.30
2016-01-08)
(corresponding author),邮箱:yanmingj@126.com
