PD-1/PD-L1在胃癌中的研究进展
2016-10-18骆飞孙昭白春梅
骆飞 孙昭 白春梅
中国医学科学院北京协和医学院北京协和医院肿瘤内科,北京100730
PD-1/PD-L1在胃癌中的研究进展
骆飞孙昭白春梅#
中国医学科学院北京协和医学院北京协和医院肿瘤内科,北京100730
胃癌是导致癌症患者死亡的主要疾病之一,而现有的治疗手段有限。当前免疫检测点抑制剂在肿瘤的治疗中取得了突破进展,相关研究迅速覆盖到胃癌。针对免疫检查点抗程序性死亡分子1(PD-1)/PD-1配体(PD-L1)抗体的临床研究正在广泛开展。本文对胃癌发生的免疫机制,PD-1/PD-L1表达,抗PD-1/PD-L1抗体早期临床研究及抗PD-1/PD-L1抗体预测疗效的生物标志物的研究进行文献复习。
免疫检验点;PD-1/PD-L1;胃癌
胃癌是全球癌症相关死亡的第二大因素,根据2012年数据每年预计约有72万人死于胃癌,已经成为全球第五大癌症[1]。预计我国2015年胃癌新发病例约为67.91万,病死例为49.8万,胃癌发病率仅次于肺癌,成为男性第二大常见的肿瘤,同时也为女性第三大癌症,5年生存率只有27.9%[2]。少数早期胃癌患者有可能通过综合治疗治愈,晚期胃癌的一线治疗大多基于铂类及5-氟尿嘧啶的方案,靶向治疗只能在一定程度上延长晚期患者生存期[3-4]。尽管肿瘤治疗手段不断发展,但总体上晚期胃癌的治疗有限、预后较差,亟须新的治疗手段。
免疫治疗已经使黑色素瘤治疗模式发生转变,且不断扩展到其他肿瘤的治疗。尤其是利用免疫检测点的抑制性抗体,如抗细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)、抗程序性死亡分子1(programmed death-1,PD-1)/PD-1配体(PD-1 ligand,PD-L1)抗体。本文就抗PD-1/PD-L1在胃癌相关治疗药物的研究进展进行综述。
1 肿瘤免疫逃逸的免疫机制
在肿瘤免疫中,免疫系统识别并清除肿瘤细胞从而抑制肿瘤的发生发展,但肿瘤可以通过免疫逃逸而逃脱免疫系统的识别和杀伤,从而达到恶性增殖[5]。肿瘤发生阶段,癌细胞通过改变抗原表型逃脱免疫监视;在进展转移阶段,通过肿瘤微环境中多种免疫抑制因子和免疫抑制细胞来抑制抗肿瘤免疫反应,如抑制免疫检查点及调节性T细胞等[6-7]。T淋巴细胞作为肿瘤免疫中的主要执行者,受到许多协同刺激分子和抑制性分子共同调节。这些抑制分子即为免疫检查点,在恶性肿瘤中,肿瘤细胞通过免疫检查点通路,抑制T细胞的效应来逃避免疫监视,导致肿瘤监视和肿瘤识别降低,最终形成免疫逃逸[8]。免疫检查点抑制剂的研制与应用,已经在多种恶性肿瘤中显示了治疗效果[9-10],干预免疫检查点相关信号通路已成为肿瘤治疗的新策略。
CTLA-4、PD-1为T细胞表面的主要抑制性分子[11-12]。PD-1的配体包括PD-L1和PD-L2,PD-L1与其T细胞上的受体PD1相互作用,在免疫应答的负性调控方面发挥着重要作用[13]。肿瘤微环境可诱导肿瘤细胞PD-L1的表达,干扰素γ可以上调其表达,在细胞及动物实验中均证实PD-L1的表达有利于肿瘤的发生和发展,诱导抗肿瘤T细胞的凋亡[14]。PD-L1在广泛的癌细胞和肿瘤浸润免疫细胞表达上调,抗原提呈细胞(APCs)及肿瘤细胞表达的PD-L1均可经PD-1/PD-L1信号通路抑制肿瘤抗原特异性T细胞的活化,下调T细胞介导的肿瘤免疫应答。CTLA-4可能在早期免疫应答发挥作用(主要是在淋巴组织发生),T细胞活化后在外周组织中PD-1表达上调,促进晚期免疫应答[15-16]。抗CTLA-4和抗PD-1/PD-L1抗体等免疫检查点抑制剂,可以消除免疫抑制作用、诱导和增强抗肿瘤免疫反应。(图1)
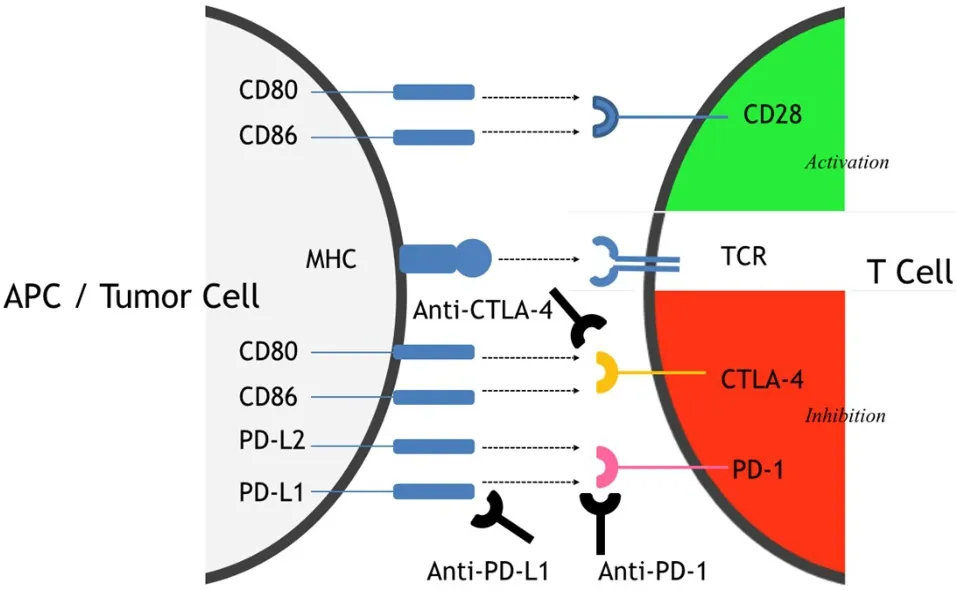
图1 免疫检查点及抑制剂作用示意图
2 PD-1/PD-L1在胃癌中的表达及与预后关系
在许多人类肿瘤组织中均可检测到PD-L1蛋白的表达,且肿瘤组织较正常组织中的PD-L1表达水平上调。Sun等[17]PD-L1表达的研究结果显示,102例胃腺癌组织中PD-L1表达阳性率为42.2%,而在对照组的正常胃组织中没有检测到,胃腺瘤中只有微弱表达。一些研究中,胃癌组织中PD-L1表达水平在40%~63%。IB期的临床研究KEYNOTE-012结果也与上述结果相似,在晚期胃腺癌中PD-L1表达比例为40%[18]。尽管需要更多的研究来证实这些结果,PD-L1的表达水平与上述结果相似的癌症,抗PD-1/PD-L1的免疫治疗已经取得了早期的成功[9,19]。
PD-1/PD-L1作用以抑制T细胞活化,逃避免疫杀伤,因此其表达常与较差的预后相关[20];也有研究发现晚期胃癌编码pd-1的PDCD1基因突变,可能为预后差的原因[21]。Sun等[17]的研究认为,PD-Ll在胃癌中的表达与肿瘤大小、浸润深度及是否有淋巴结转移相关,同时PD-Ll的表达水平是判断患者预后的重要指标,存活期短的患者PD-Ll表达的阳性率普遍较高。但癌症患者PD-L1的表达与预后关系仍然有争议(表1)。Kim等[22]研究结果显示,PD-L1在胃癌高表达预示良好的临床病理特征和预后。产生研究差异的原因可能与样本量,用于检测PD-L1的抗体差异,以及所使用的标本不同(冷冻与石蜡包埋组织)有关。抗体检测试剂商业化及同时检测其他免疫抑制蛋白将有助于提高检测方法的可靠性,提高研究的准确性。

表1 有关胃癌PD-L1表达及其与预后关系的研究
3 早期检验点抑制剂的临床研究
靶向CTLA-4及PD-1/PD-L1通路的单抗可以阻断抑制性信号,对多种肿瘤显示出抗肿瘤效应。靶向免疫检查点的抑制剂也在胃癌领域进行了一些探索和尝试。
3.1抗CTLA-4抗体
Ipilimumab:是一种全人源抗CTLA-4单抗。Ⅱ期临床试验NCT01585987中,入组了114例不可切除的局部晚期或转移性胃/胃食管结合部腺癌者,经标准一线化疗方案治疗后序贯Ipilimumab或最佳支持治疗(包括含氟尿嘧啶和不含氟尿嘧啶),从官网目前公布的临床试验数据分析,与最佳支持治疗相比,Ipilimumab治疗并未使患者有明显的获益[27]。
Tremelimumab:一种全人源化CTLA-4单抗。Ⅱ期临床试验中报道在18例胃/胃食管结合部腺癌患者中缓解率为5%,低于二线细胞毒性药物化疗疗效[19]。尽管这个试验未能达到预先设定的缓解率终点,仍有4例患者达到病情稳定,1例达到部分缓解,且部分缓解的患者显示出持久疗效,对于晚期胃癌治疗,这是相当振奋人心的结果。
3.2抗PD-1单抗
Nivolumab:是一种全人源化抗PD-1单抗,美国FDA已批准用于治疗晚期黑色素瘤及肺鳞癌。在Ⅱ期临床试验Checkmate-032中,入组了59例晚期胃癌患者给予Nivolumab单药治疗,总缓解率(ORR)为17%,6个月无进展生存期(PFS)率和总生存(OS)率分别为18%和49%[28]。Ⅲ期临床试验NCT02267343预计入组480例患者,用于评估其在不可切除的复发及进展期胃癌患者中的疗效。另一项正在日本进行的入组24例进展期实体瘤的Ⅰ期临床研究NCT00836888已经进入数据分析阶段。Ⅰ/Ⅱ期临床研究NCT01928394正在进行招募[29],用于比较Nivolumab单药和Nivolumab联合Ipilimumab在治疗进展期实体瘤中的疗效。
Pembrolizumab:是一种人源化IgG4的抗PD-1单抗,在黑色素瘤及肺小细胞肺癌中的疗效已被认可。Keynote-012研究从162例晚期胃癌患者中筛选出39例PD-L1阳性的患者给予pembrolizumab治疗,研究者回顾ORR为33.3%,6个月的PFS率和OS率分别为24%和69%,且PD-L1的阳性程度与无进展生存期呈正相关[18]。根据这个试验结果,设计了顺铂/5-FU联合pembrolizumab的Keynote-059的Ⅱ期临床研究。Keynote-012的结果优于Nivolumab的Checkmate-032中的结果,可能是前者筛选了PD-L1阳性患者入组。
3.3抗PD-L1单抗
MDX-1105(BMS-936559):为PD-L1的全人源化IgG4单抗,在多中心Ⅰ期临床试验NCT00729664中,207受试者中包括7例胃癌患者,虽然只在非小细胞肺癌、黑素瘤和肾细胞癌的晚期患者中得到了肿瘤消退和疾病长期稳定的结果,但研究结果显示MDX-1105在晚期胃癌患者中使用相对安全[30]。
MEDI4736:也是一种抗PD-L1的单抗,在一项Ⅰ期临床试验NCT01693562中纳入16例胃癌患者中两例患者PFS超过24周,超越了胃癌二线治疗方案的中位PFS[31]。一项ⅠB/Ⅱ期临床试验NCT02340975,拟评估MEDI4736、Tremelimumab单药或联用在复发或转移性胃/胃食管结合部腺癌中的安全性及疗效,预计2017年末结束。
Avelumab:是一种工程人源化PD-L1单抗[19],在转移性或局限晚期实体瘤中开展的Ⅰ期临床试验NCT01772004中计划入组1670例,其中胃/胃食管结合部腺癌者150例,用于评估Avelumab安全性及疗效。另一项在晚期实体瘤治疗的Ⅰ期临床试验NCT01943461已完成入组,该研究在完成剂量梯度后将主要观察在亚洲胃癌患者中的疗效。
更多的纳入胃癌队列的临床试验正在进行,未来将陆续有数据公布。
4 预测免疫检验点抑制剂疗效的生物标志物
抗PD-1/PD-L1抗体主要作用PD-1/PD-L1信号通路,因此,理论上患者肿瘤细胞上PD-L1的表达与药物疗效可能相关。Checkmate-032研究也认为PD-L1表达水平与治疗患者的ORR有关[28]。但PD-L1的表达水平与疗效之间并非简单的因果关系,免疫过程是连锁反应,可能会触发或抑制其他未知的通路;且肿瘤表达蛋白是动态过程,PD-L1表达会出现波动,是否需要动态观测。一些研究已经报道,PD-L1的阴性肿瘤也对抑制剂治疗有效[32-33];另外,目前检测PD-L1方法无统一标准,如何找到合适的cut-off值仍然存在问题;综上所述,大部分研究认为PD-L1可以预测PD-1及PD-L1类药物近期疗效而非生存获益,将PD-L1作为预测疗效的生物标志物仍有争议。由于检查点免疫抑制剂能增强预先存在的抗肿瘤细胞免疫反应,CTLA-4、Bim的表达以及干扰素-γ也可能影响肿瘤对抗PD-L1抗体的反应[34-35]。新的胃癌分子分型EBV感染型胃癌中有PD-L1扩增[36-37],此型患者可能受益于抗PD-1/PD-L1抗体治疗。
基于基因错配修复(MMR)状态的晚期癌症抗PD-1通路免疫治疗的Ⅱ期临床研究NCT01876511中[38],选取了三组患者:11例MMR缺陷(dMMR)大肠癌,21例MMR完全(pMMR)大肠癌,和9例dMMR非结直肠癌(包括胃癌1例)。均采用pembrolizumab方案,三组患者20周的免疫相关客观有效率分别为40%、0%、71%,20周免疫相关的无进展生存期分别为78%,11%,67%。尽管只是一个单臂Ⅱ期临床研究,却开辟了基于基因分型筛选免疫治疗受益人群的新方法。dMMR/MSI-H肿瘤由于表达新抗原,导致微环境中TH1/CTL活跃,且存在包括PD-1、PD-L1、CTLA-4、LAG-3和IDO多种免疫检查点表达上调[39],可能更有利于免疫治疗发挥疗效。因此,MMR/MSI检测可能成为预测抗PD-1/PD-L1通路对晚期胃癌患者疗效方法[39-41]。然而,在对抗PD-1/PD-L1治疗高度有效的黑色素瘤和非小细胞肺癌中,dMMR/MSI-H发生率低,是否存在不同于MMR的免疫修饰机制。在了解MMR、肿瘤与免疫治疗的关系上,还需要更多的研究。
5 展望
PD-1/PD-L1的单抗在肿瘤免疫治疗中应用正成为研究热点,但对于其他新的免疫检验点进行的研究仍在进行。活化T细胞、NK细胞及B细胞上的免疫抑制检验点分子淋巴细胞活化基因3(LAG-3)以及NK细胞表面的杀伤抑制受体KIR等,可能成为下一代免疫抑制剂的分子靶点[42-45]。提供更多不同靶点的免疫检验点抑制剂可能对晚期肿瘤患者的治疗及联合治疗带来曙光。
胃癌研究中,胃癌组织中PD-L1过度表达与预后的关系存在争议,鉴于表达与预后关系的重要性,仍需要进一步研究来揭示PD-L1表达与实体肿瘤预后的关系。目前可用于胃癌临床研究的数据很有限,需要在胃癌大样本研究中,获取药物疗效的更多信息,以及通过有效的生物标志物筛选出使用抗PD-1/PD-L1抗体治疗的获益人群。在药物联合治疗上,抗PD-1/PD-L1抗体与化疗、放疗及其他靶向药物联合方面的研究值得开展。
[1]Ferlay J,Soerjomataram I,Ervik M,et al.GLOBOCAN 2012 v1.0.Cancer Incidence and Mortality Worldwide: IARC Cancer Base No.11[Internet].Lyon,France:International Agency for Research on Cancer,2013,Available online:http://globocan.iarc.fr.
[2]Chen W,Zheng R,Zeng H,et al.Cancer statistics in China,2015[J].CACancer J Clin,2016,66(2):115-132.
[3]Bang YJ,Vancutsem E,Feyereislova A,et al.Trastuzumab in combination with chemothempy versus chemotherapy alone for treatInent of HER2-positive advanced gastric or gastro-oesophagealagealjunction cancer(ToGA):A phase 3,open-label,randomised controlled trial[J].Lancet,2010,376:687-697.
[4]Fuchs CS,TomasekJ,YongCJ,et al.Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(REGARD):an international,randomised,multicentre,placebo-controlled,phase 3 trial[J].Lancet,2014,383(9911):31-39.
[5]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[6]Wherry EJ.T cell exhaustion[J].Nat Immunol,2011,12: 492-499.
[7]Hayden EC.Antibody alarm call rouses immune response to cancer[J].Nature,2012,486(7401):16.
[8]Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-264.
[9]Topalian SL,Hodi FS,Brahmer JR,et al.Safet,activity,and immunecorrelatesofanti-PD-1antibodyincancer[J].NEngl JMed,2012,366:2443-2454.
[10]Hodi FS,O'Day SJ,McDermott DF,et al.Improved survival with ipilimumab in patients with metastatic melanoma[J].N Engl J Med,2010,363:711-723.
[11]Peggs KS,Quezada SA,Chambers CA,et al.Blockade of CTLA-4 on both effector and regulatory T cell compartments contributes to the antitumor activity of anti-CTLA-4 antibodies[J].J Exp Med,2009,206:1717-1725.
[12]Schneider H,DowneyJ,SmithA,et al.Reversal of the TCR stop signal by CTLA-4[J].Science,2006,313:1972-1975.
[13]Parry RV,Chemnitz JM,Frauwirth KA,et al.CTLA-4 andPD-1 receptors inhibit T-cell activation by distinct mechanisms[J].Mol Cell Biol,2005,25:9543-9553.
[14]Zou W,Chen L.Inhibitory B7-family molecules in the tumour microenvironment[J].Nat Rev Immunol,2008,8: 467-477.
[15]RibasA.TumorimmunotherapydirectedatPD-1[J].NEngl JMed,2012,366:2517-2519.
[16]Chen DS,Mellman I.Oncology meets immunology:the cancer-immunity cycle[J].Immunity,2013,39(1):1-10.
[17]Sun J,Xu K,Wu C,et al.PD-L1 expression analysis in gastric carcinoma tissue and blocking of tumor-associated PD-L1 signaling by two functional monoclonal antibodies[J].Tissue Antigens,2007,69:19-27.
[18]Muro K,Chung HC,Shankaran V,et al.Pembrolizumab for patients with PD-L1-positive advanced gastric cancer(KEYNOTE-012):a multicentre,open-label,phase 1b trial[J].Lancet Oncol,2016,17(6):717-726.
[19]Herbst RS,Gordon MS,Fine GD,et al.A study of MPDL3280A,an engineered PD-L1 antibody in patients with locally advanced or metastatic tumors[J].J Clin Oncol,2013,31:abstr 3000.
[20]Sznol M,Chen L.Antagonist antibodies to PD-1 and B7-H1(PD-L1)in the treatment of advanced human cancer[J]. Clin Cancer Res,2013,19(5):1021-1034.
[21]Sunakawa Y.Genetic variants in tumor immune checkpoints as prognostic markers in patients(pts)with localized advanced gastric cancer(AGC)[J].ASCO 52.Meet Abstr,2014,32:4018.
[22]Kim JW,Nam KH,Ahn SH,et al.Prognostic implications of immunosuppressive protein expression in tumors as well as immune cell infiltration within the tumor microenvironment in gastric cancer[J].Gastric Cancer,2016,19(1):42-52.
[23]Hou J,Yu Z,Xiang R,et al.Correlation between infltration of FOXP3 regulatory T cells and expression of B7-H1 in the tumor tissues of gastric cancer[J].Exp Mol Pathol,2014,96:284-2891.
[24]Jiang D,Xu YY,Li F,et al.The role of B7-H1 in gastric carcinoma:clinical significance and related mechanism[J]. Med Oncol,2014,31(11):268.
[25]Qing Y,Li Q,Ren T,et al.Upregulation of PD-L1 and APE1 is associated with tumorigenesis and poor prognosis of gastric cancer[J].Drug Des Devel Ther,2015,9:901-909.
[26]Zhang L,Qiu M,Jin Y,et al.Programmed cell death ligand 1(PD-L1)expression on gastric cancer and its relationship with clinicopathologic factors[J].Int J Clin Exp Pathol,2015,8(9):11084-11091.
[27]An Efficacy Study in Gastric and Gastroesophageal Junction Cancer Comparing Ipilimumab Versus Standard of Care Immediately Following First Line Chemotherapy[Internet].Available online:https://clinicaltrials.gov.
[28]Le DT,Bendell JC,Calvo E,et al.Safety and activity of Nivolumab monotherapy in advanced and metastatic(A/ M)gastric or gastroesophageal junction cancer(GC/ GEC):Results from the CheckMate-032 study[J].J Clin Oncol,2016,34(4):abstr 6.
[29]A Study of Nivolumab by Itself or Nivolumab Combined with Ipilimumab in Patients With Advanced or Metastatic Solid Tumors[Internet].Available online:https://clinicaltrials.gov.
[30]Brahmer JR,Tykodi SS,Chow LQ,et al.Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J].N Engl J Med,2012,366:2455-2465.
[31]Segal NH,Antonia SJ,Brahmer JR,et al.Preliminary data from a multi-arm expansion study of MEDI4736,an anti-PD-L1 antibody[J].J Clin Oncol,2014,32(15):abstr 3002.
[32]Rizvi NA,Mazières J,Planchard D,et al.Activity and safety of nivolumab,an anti-PD-1 immune checkpoint inhibitor,for patients with advanced,refractory squamous non-small-cell lung cancer(CheckMate 063):a phase 2,single-arm trial[J].Lancet Oncol,2015,16(3):257-265.
[33]Paz-Ares L,Horn L,Borghaei H,et al.Phase III,randomized trial(CheckMate 057)of nivolumab(NIVO)versus docetaxel(DOC)in advanced non-squamous cell(non-SQ)non-small cell lung cancer(NSCLC)[J].J Clin Oncol,2015,33(suppl):abstr LBA109.
[34]Wu C,Zhu Y,Jiang J,et al.Immunohistochemical localization of programmed death-1 ligand-1(PD-L1)in gastric carcinoma and its clinical significance[J].Acta Histochem,2006,108:19-24.
[35]Herbst RS,Soria JC,Kowanetz M,et al.Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J].Nature,2014,515:563-567.
[36]Network CGAR:Comprehensive molecular characterization of gastric adenocarcinoma[J].Nature,2014,513:202-209.
[37]Kim SY,Park C,Kim HJ,et al.Deregulation of immune response genes in patients with Epstein-Barr virus-associated gastriccancerandoutcomes[J].Gastroenterology,2015,148(1):137-147.
[38]Le DT,Uram JN,Wang H,et al.PD-1 blockade in tumors with mismatch-repair deficiency[J].N Engl J Med,2015,372:2509-2520.
[39]Liosa NJ,Cruise M,Tam A,et al.The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints[J]. Cancer Discov,2015,5:43-51.
[40]Xiao Y,Freeman GJ.The microsatellite instable subset of colorectal cancer is a particularly good candidate for checkpoint blockade immunotherapy[J].Cancer Discov,2015,5(1):16-18.
[41]Howitt BE,Shukla SA,Sholl LM,et al.Association of polymerase e-mutated and microsatellite-instable endometrial cancers with neoantigen load,number of tumor-infiltrating lymphocytes,and expression of PD-1 and PD-L1[J].JAMAOncol,2015,1(9):1319-1323.
[42]Luke JJ,Ott P.PD-1 pathway inhibitors:the next generation of immunotherapy for advanced melanoma[J].Oncotarget,2015,6(8):3479-3492.
[43]Sega EI,Leveson-Gower DB,Florek M,et al.Role of lymphocyteactivation gene-3(Lag-3)in conventional and regulatory T cell function in allogeneic transplantation[J]. PLoS One,2014,9(1):e86551.
[44]Benson DM Jr,Caligiuri MA.Killer immunoglobulin-like receptors and tumor immunity[J].Cancer Immunol Res,2014,2(2):99-104.
[45]Romagné F,André P,Spee P,et al.Preclinical characterization of 1-7F9,a novel human anti-KIR receptor therapeutic antibody that augments natural killer-mediated killing of tumor cells[J].Blood,2009,114(13):2667-2677.
R735.2
A
10.11877/j.issn.1672-1535.2016.14.06.01
2016-04-11)
(corresponding author),邮箱:baichunmei1964@126.com
