水稻SIDP301基因的克隆与功能分析
2016-10-18罗茂春陈艳菲罗成科
罗茂春,陈艳菲,罗成科,陈 亮*
(1.龙岩学院生命科学学院,福建龙岩364012;2.厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建厦门361102;3.宁夏大学环境工程研究院,宁夏银川750021)

水稻SIDP301基因的克隆与功能分析
罗茂春1,陈艳菲2,罗成科3,陈亮2*
(1.龙岩学院生命科学学院,福建龙岩364012;2.厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建厦门361102;3.宁夏大学环境工程研究院,宁夏银川750021)
水稻是一种重要的粮食作物,也是单子叶植物研究的模式植物,其抗逆相关基因的克隆与功能分析具有重要的理论和现实意义.水稻SIDP301基因编码的蛋白质含有DUF1644家族保守结构域和锌指结构域.实时荧光定量PCR(qRT-PCR)数据表明SIDP301基因在水稻各个组织中均有表达,其中在根和叶中表达水平较高.SIDP301基因的表达受高盐、高温和茉莉酸诱导.与对照相比,超量表达转基因植株的耐盐性不明显,而抑制表达转基因植株对高盐较敏感.进一步用qRT-PCR检测抗逆相关标记基因,结果表明P5CS、DREB2A、Rab16a和Lea3-1在超量表达转基因植株中的表达量高于野生型植株,而在抑制表达转基因植株中这些基因的表达变化不明显.上述结果说明SIDP301是一个抗逆相关基因,其表达量受抑制时会降低水稻的抗逆性.
水稻;抗逆;SIDP301基因
干旱、高盐和低温是影响农作物生产最严重的三大自然灾害[1].水稻作为一种重要的粮食作物,同时也是一种理想的模式植物,其生产状况直接影响着人类的粮食安全.近年来,随着世界人口急剧增加,环境不断恶化,粮食供需问题日益突出.提高作物对生物和非生物逆境的适应能力一直是农学家、生物学家关注的问题[2],其中对抗逆相关基因的挖掘目前正成为作物遗传育种和品质改良的研究热点.因此,克隆抗逆相关基因并进一步研究这些基因的抗逆机制,对于有效控制作物病害、灾害的发生与发展,减少经济损失,保证粮食安全具有重要意义.
DUF1644家族是一类植物特有的DUF蛋白家族,公共芯片数据表明水稻多数DUF1644基因受非生物胁迫诱导表达,暗示该家族基因可能与水稻的非生物胁迫耐受性有关.最近的研究报道证实,DUF1644家族基因SIDP361[3]和SIDP366[4]均属于抗逆相关基因,它们参与调控水稻的抗旱性和耐盐性.为了进一步了解该家族中另一个基因SIDP301的生物学功能,本研究利用生物信息学手段分析了该基因及其编码蛋白质的结构,应用实时荧光定量PCR(qRT-PCR)分析了该基因在不同组织及逆境下的表达模式,进而通过遗传转化获得了超量表达和抑制表达SIDP301基因的转基因水稻植株,并分析了转基因植物中抗逆相关标记基因的表达变化,以期为深入研究SIDP301基因的抗逆调控机制奠定基础.
1 材料与方法
1.1材料与处理
本研究以粳稻台北309(Oryzasativassp.Japonicavar.TP309)为实验材料,将水稻幼苗水培至四叶期,选择长势一致的幼苗分成三部分:1) 一部分提取叶片基因组DNA和总RNA,用于SIDP301基因的克隆. 2) 一部分进行干旱、高盐、低温、高温和H2O2胁迫以及脱落酸(ABA)、茉莉酸(JA)、水杨酸(SA)、2,4-二氯苯氧乙酸(2,4-D)和赤霉素(GA3)激素处理,用于逆境表达分析.胁迫处理方法:干旱处理是将正常生长的幼苗断水暴露在空气中;高盐和H2O2处理是分别将幼苗根部浸泡在150 mmol/L NaCl和1%(体积分数) H2O2溶液中;低温和高温处理是分别将幼苗转移至4和42 ℃生长箱,12 h光照/12 h黑暗培养.上述5种非生物胁迫处理均在0,1,3,6,12和24 h分别取样.植物激素处理方法:分别用100 μmol/L ABA、JA、SA、GA3和20 μmol/L 2,4-D溶液喷洒幼苗叶片,0,0.5,1,3,6和12 h后按不同处理分别取样. 3) 剩余一部分幼苗直接移栽至盆土中并置于室外自然条件下生长.待水稻生长至开花期,分别剪取根、茎、茎节、叶、花序和叶鞘用于组织表达模式分析.所有采集样品立即用液氮速冻后置于-80 ℃保存备用.
表1 本研究所用引物
Tab.1 Primers used in this study
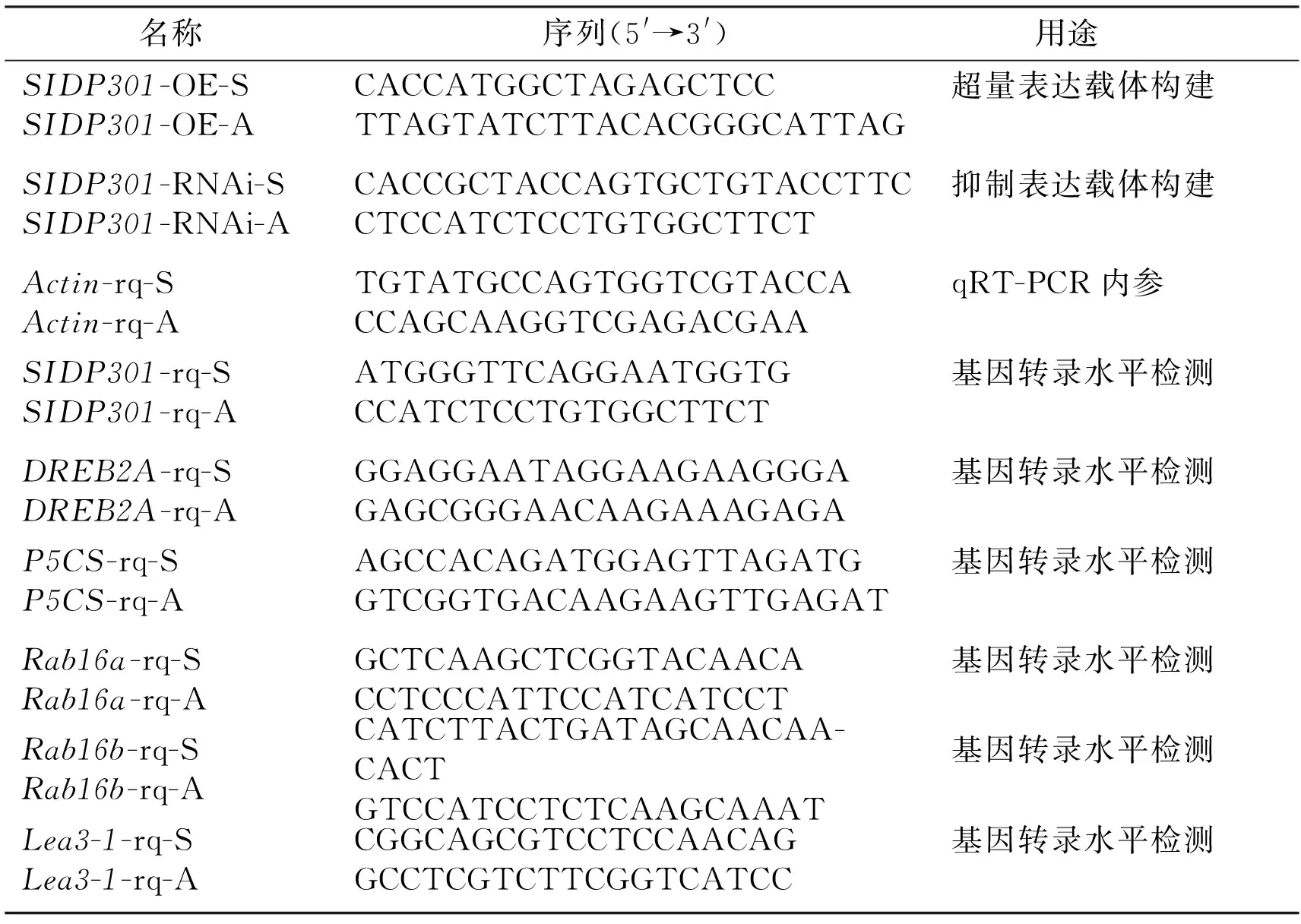
名称序列(5'→3')用途SIDP301-OE-SSIDP301-OE-ACACCATGGCTAGAGCTCCTTAGTATCTTACACGGGCATTAG超量表达载体构建SIDP301-RNAi-SSIDP301-RNAi-ACACCGCTACCAGTGCTGTACCTTCCTCCATCTCCTGTGGCTTCT抑制表达载体构建Actin-rq-SActin-rq-ATGTATGCCAGTGGTCGTACCACCAGCAAGGTCGAGACGAAqRT-PCR内参SIDP301-rq-SSIDP301-rq-AATGGGTTCAGGAATGGTGCCATCTCCTGTGGCTTCT基因转录水平检测DREB2A-rq-SDREB2A-rq-AGGAGGAATAGGAAGAAGGGAGAGCGGGAACAAGAAAGAGA基因转录水平检测P5CS-rq-SP5CS-rq-AAGCCACAGATGGAGTTAGATGGTCGGTGACAAGAAGTTGAGAT基因转录水平检测Rab16a-rq-SRab16a-rq-AGCTCAAGCTCGGTACAACACCTCCCATTCCATCATCCT基因转录水平检测Rab16b-rq-SRab16b-rq-ACATCTTACTGATAGCAACAA-CACTGTCCATCCTCTCAAGCAAAT基因转录水平检测Lea3-1-rq-SLea3-1-rq-ACGGCAGCGTCCTCCAACAGGCCTCGTCTTCGGTCATCC基因转录水平检测
本研究所用引物的名称、序列及用途见表1.
1.2方法
1.2.1qRT-PCR
采用TaKaRa公司的 SYBR®Premix ExTaqTMⅡ (Perfect Real Time)试剂,每个模板样品3个重复,每个实验重复2次.以Actin基因为内参.
反应体系(10 μL):SYBR®Premix ExTaqTMⅡ(2×)5 μL,正、反向引物(5 μmol/L)各0.4 μL,ROX 参比染料(50×)0.2 μL,cDNA模板 1 μL;ddH2O 3 μL.反应程序:95 ℃ 1 min;95 ℃ 5 s,60 ℃ 30 s,40个循环.
1.2.2表达载体的构建
十六烷基三甲基溴化铵(CTAB)法提取水稻基因组DNA,并以其为模板PCR扩增用于构建抑制表达(RNAi)和超量表达(OE)载体的平末端产物,该产物再与pENTRTM/D-TOPO载体进行TOPO反应[5].载体悬挂序列GTGG配对含有CACC的平末端产物,载体上自带的拓扑异构酶l结合在CCCTT特异位点切除产物中的GTGG,使PCR产物插入入门载体.PCR检测目的基因片段是否插入pENTRTM/D-TOPO载体,将含有阳性克隆质粒的菌液送Invitrogen公司测序验证.
1.2.3遗传转化
参照文献[5]方法,取TP309的成熟种子进行愈伤组织诱导,挑选生长旺盛的胚性愈伤组织用于转化.用农杆菌侵染愈伤组织,置于滤纸上晾干后转移至共培养培养基上培养3 d;共培养的愈伤组织用无菌水清洗,晾干后置于筛选培养基上进行抗性筛选培养;将新生长的抗性愈伤组织转移至新鲜培养基上继代,再转接于分化培养基上进行分化培养;抗性愈伤组织经过分化培养可长出苗,将分化苗转移至1/2 MS培养基上进行生根培养;最后炼苗并移栽于土壤中.
1.2.4转基因植株的鉴定
采用CTAB法提取野生型和转基因水稻植株的基因组DNA,分别作为模板,用潮霉素磷酸转移酶基因的特异引物HYG-f(5′-GGGCGTCGGTTTCCACTATC-3′)和HYG-r(5′-CGGCTCCAACAATGTCCTGA-3′)进行PCR扩增.
采用RNAprep pure 植物总RNA提取试剂盒(北京天根生化科技有限公司)提取野生型和转基因水稻植株成熟叶片的总RNA;用Invitrogen公司的反转录试剂盒进行反转录.取反转录后的cDNA模板,以水稻Actin基因为内参,qRT-PCR检测目的基因的表达水平.
1.2.5转基因植株的耐盐性分析
将T1代转基因植株(OE9和RNAi4)种子去壳后表面消毒(75%(体积分数)乙醇处理1 min,15%(质量分数)次氯酸钠溶液处理30 min,无菌水洗5~6次),播于含50 mg/L潮霉素的1/2 MS培养基上进行阳性筛选,野生型种子晚1 d消毒处理后播于不含潮霉素的1/2 MS培养基上萌发.3~4 d后挑选萌发好且长势一致的种子(芽高度4~5 mm)分别转移至不含和含有200 mmol/L NaCl的1/2 MS培养基上生长,培养条件为:26 ℃,14 h光照/10 h黑暗.移植14 d后分别小心取出野生型和转基因植株幼苗,观察表型差异并拍照记录,统计株高和鲜质量.
1.2.6转基因植株中抗逆相关基因的表达分析
分别对野生型和转基因植株进行高盐处理,处理方法见1.1,选择P5CS[6-7]、DREB2A[8]、Rab16a[9-10]和Lea3-1[11]4个逆境相关标记基因,利用qRT-PCR(参考1.2.1)分析高盐胁迫下这些基因在野生型和转基因植株中的表达变化.
2 结果与分析
2.1SIDP301基因的生物信息学分析
SIDP301基因在GenBank中编号为AK108771,在RGAP 6.1(Rice Genome Annotation Project,http:∥rice.plantbiology.msu.edu/)数据库中登录号为LOC_Os04g37530.1,位于水稻第4号染色体上.基因组序列全长2 392 bp,包含1个内含子,长1 038 bp(位于第1 145~2 182位核苷酸),开放阅读框区域长804 bp,编码一个由268个氨基酸组成的蛋白,其中包含一段ZnF_C2H2型锌指结构域(位于第148~172位氨基酸残基)和一段富含半胱氨酸的未知功能的DUF1644结构域(位于第47~202位氨基酸残基).
用PLACE工具(http:∥www.dna.affrc.go.jp/PLACE/)预测SIDP301基因上游1 000 bp启动子区的顺式元件,发现包括56个组织特异性表达元件、30个ABA响应元件、8个GA响应元件、11个干旱响应元件、12个低温响应元件、4个脱水应答元件等.由此预测该基因可能具有组织表达特异性,并参与多种逆境胁迫和激素的响应.
2.2SIDP301基因的组织表达分析
通过qRT-PCR 方法检测了SIDP301基因在水稻中的组织表达模式,结果如图1所示:SIDP301基因在花序、茎节、茎、根、叶和叶鞘中均有表达,叶鞘中的表达量显著高于其他组织(p<0.05),根和叶中的表达量次之,而在花序中表达量最低,其中在叶鞘中的表达量是花序的10倍以上,这些结果表明SIDP301基因的表达具有组织差异性.
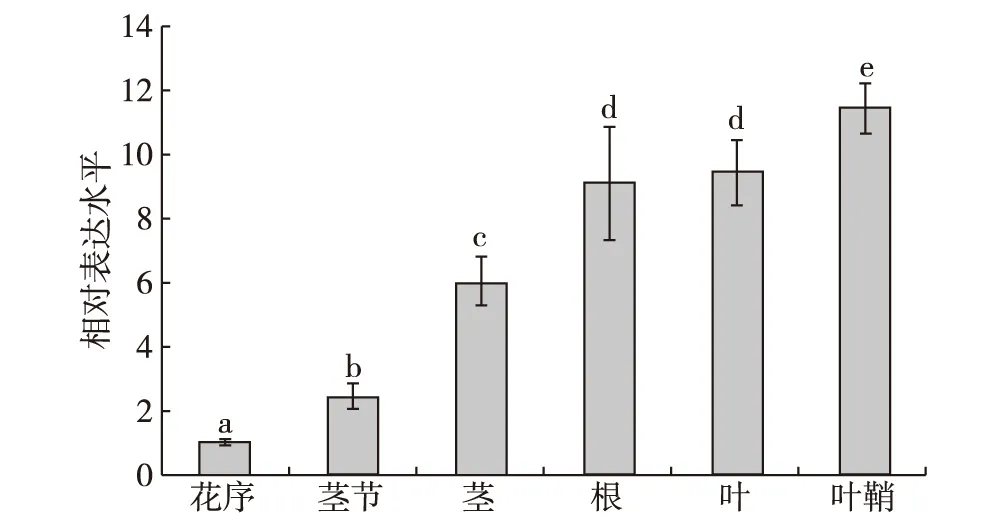
不同小写字母表示差异显著(t-检验,p<0.05).图1 SIDP301基因的组织表达模式Fig.1The tissue expression pattern of SIDP301 gene in O. sativa
2.3SIDP301基因的逆境表达分析
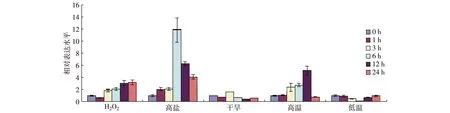
图2 SIDP301基因在非生物胁迫处理下的表达Fig.2The expression patterns of SIDP301 gene under abiotic stresses
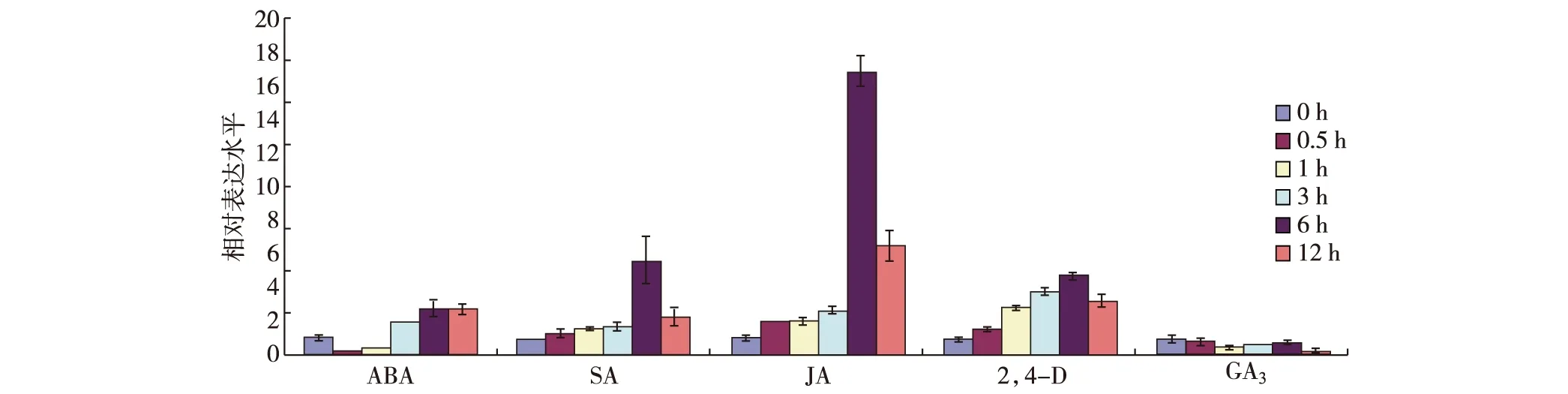
图3 逆境相关激素处理下的SIDP301基因表达Fig.3The expression patterns of SIDP301 gene after the treatments with stress related phytohormones
利用qRT-PCR方法分析了高盐、干旱、高温、低温和H2O25种非生物胁迫条件下水稻幼苗叶片中SIDP301基因的表达模式,结果如图2所示:SIDP301基因明显受H2O2、高盐和高温诱导表达,表达量分别在H2O2处理12~24 h、高盐处理6 h和高温处理12 h达到最大值.相比于上述3种处理,干旱和低温几乎不影响SIDP301基因的表达.
用同样的方法分析了ABA、SA、JA、2,4-D和GA35种逆境相关激素处理对水稻幼苗叶片中SIDP301基因表达变化的影响,结果如图3所示:SIDP301基因明显受JA、SA和2,4-D诱导表达,且表达量均在处理6 h时达到最大值;ABA处理对SIDP301基因的表达也有诱导作用,但效果不是很明显;GA3处理基本不影响SIDP301基因的表达.
2.4转基因植株的鉴定
通过农杆菌介导的转化方法,分别将构建好的超量表达和抑制表达SIDP301基因的重组质粒导入水稻TP309中,获得相应的转基因植株.对阳性转基因水稻进行qRT-PCR分析,结果显示:目的基因SIDP301在超量表达转基因植株(OE1~10)中的表达均高于野生型(WT)植株,在抑制表达转基因植株(RNAi1~7)中均明显低于WT植株,说明SIDP301基因相应地超量表达或抑制表达(图4).
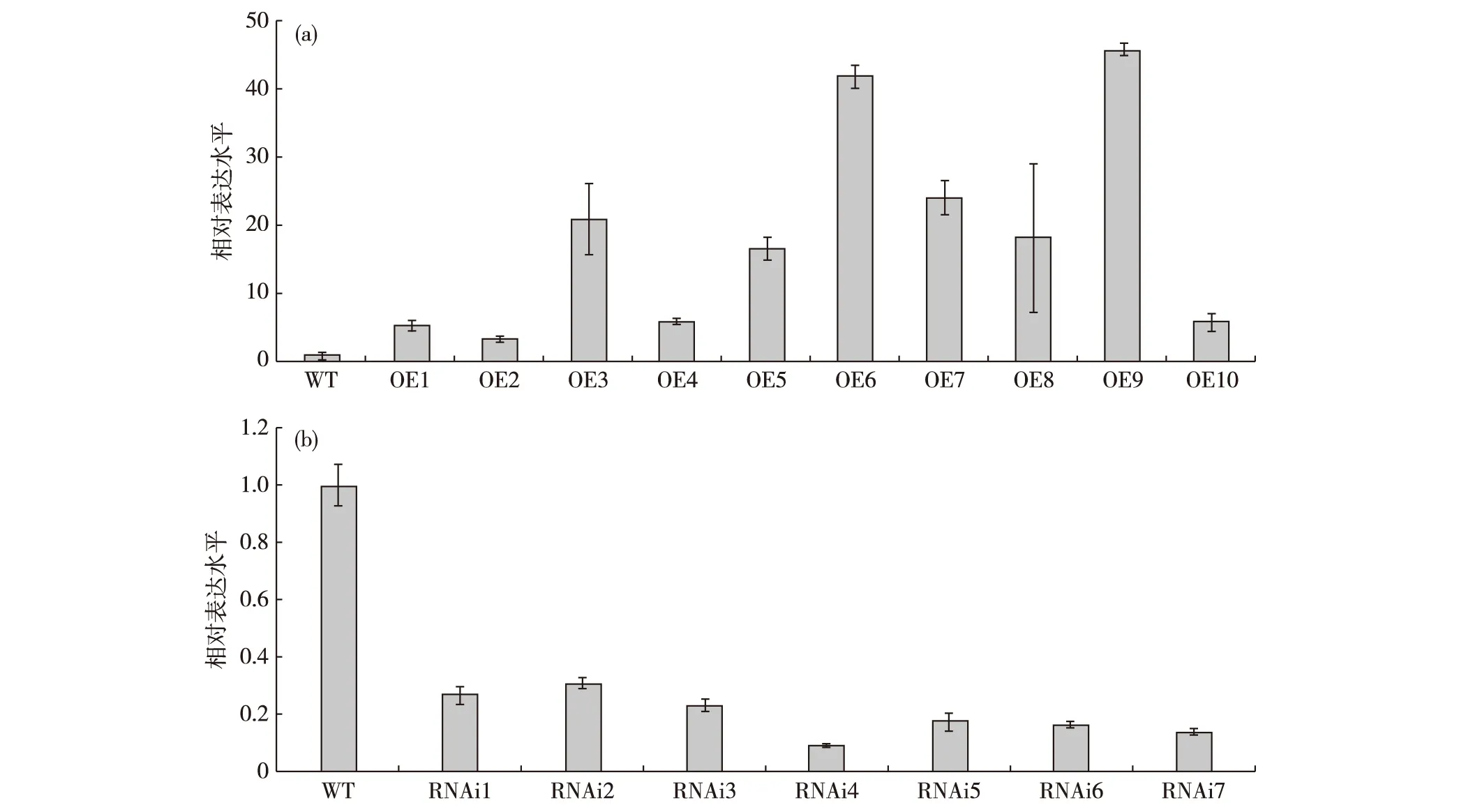
(a)超量表达转基因植株;(b)抑制表达转基因植株.图4 T0代转基因植株中SIDP301基因的相对表达水平Fig.4Relative expression levels of SIDP301 gene in T0 transgenic plants
2.5转基因植株耐盐性实验
通过对转基因植株的耐盐性分析,进一步了解SIDP301基因的生物学功能.挑选萌发一致的WT和转基因水稻种子,分别转移至正常培养基和200 mmol/L NaCl的高盐培养基上生长.结果发现:在正常培养基上,转基因植株与WT植株的表型无明显变化,说明SIDP301基因的超量表达或抑制表达不影响植株的正常生长发育;在200 mmol/L NaCl的高盐培养基上,OE植株和WT植株的表型没有明显差异,但RNAi植株的长势明显弱于WT植株(图5).对转基因植株和WT植株相应的生长指标进行统计分析,结果发现OE植株的株高和鲜质量与WT植株无显著差异,但RNAi植株的株高和鲜质量与WT植株存在显著差异(图6).这些结果说明SIDP301基因抑制表达的转基因水稻植株表现出对高盐胁迫耐受性的降低.

图5 高盐(200 mmol/L NaCl)胁迫下生长14 d的野生型和转基因植株的表型Fig.5Growth performance of transgenic seedlings under 200 mmol/L NaCl stress after transplanting for 14 d
2.6转基因植株中抗逆相关基因的表达分析
为了进一步说明转基因植株与野生型植株在高盐胁迫下存在的表型差异,利用qRT-PCR分析4个已经鉴定为逆境相关的标记基因(P5CS、DREB2A、Rab16a和Lea3-1)在转基因植株和野生型植株中的表达情况.结果表明:P5CS、Rab16a和Lea3-1的表达量在OE植株中显著高于WT植株,DREB2A的表达量在OE植株中略高于WT植株;然而,在RNAi植株中P5CS、DREB2A、Rab16a和Lea3-1的表达量均略低于WT植株.
3 讨 论
3.1SIDP301基因的表达模式
基因表达调控是现代分子生物学研究的重要课题之一.了解基因表达的时空表达变化及其表达调控机制,可以更好地理解生物的生长发育规律、形态结构特征及生物学功能.DUF1644基因家族是植物中一个高度保守且功能未知的基因家族,其蛋白保守结构域包括160个氨基酸残基,其中含有9个高度保守的半胱氨酸残基[12],推测为一个转录因子家族,该家族蛋白含有低复杂度(low complexity)区域、DUF1644结构域、ZnF_C2H2型锌指结构域和环状结构域(RING).DUF1644结构域的功能仍然未知,可能与锌离子的结合有关.ZnF_C2H2型锌指结构域是最多也是研究最为清楚的一类锌指蛋白,主要涉及植物的生长发育和对环境胁迫的应答反应[13].
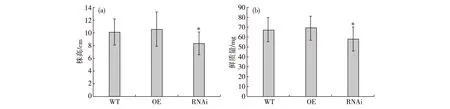
每个实验重复3次,每次重复10个样品;*表示转基因植株和野生型植株之间呈显著差异(t-检验,p<0.05).图6 转基因植株和野生型植株在高盐(200 mmol/L NaCl)胁迫下的株高(a)和鲜质量(b)Fig.6Plant height (a) and fresh mass (b) of transgenic plants and WT plants under 200 mmol/L NaCl stress
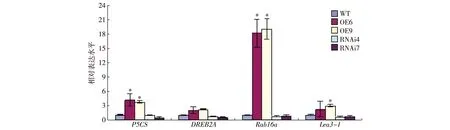
*表示转基因植株和野生型植株之间呈显著差异(t-检验,p<0.05).图7 非生物胁迫相关基因在转基因植株中的相对表达水平Fig.7Relative expression levels of the abiotic stress-related genes in transgenic plants
Li等[3]对DUF1644家族的SIDP361基因研究表明,该基因在水稻的根和叶中的表达水平较高,受高盐、干旱和ABA诱导表达,但对高温、低温和H2O2、JA以及SA处理不敏感.Guo等[4]对同家族基因SIDP366的研究结果显示,该基因主要在水稻的根、茎、叶、花药中表达,并且参与了种子的成熟过程,同时该基因还受盐、干旱、高温、H2O2、ABA和SA胁迫的诱导表达.SIDP301基因与SIDP361和SIDP366同属于DUF1644家族,它们的表达模式可能相似.为了验证这个假设,本研究对SIDP301基因的表达模式进行了分析,结果表明该基因在水稻的根和叶中的表达量高于其他组织,且其表达受高盐、高温、H2O2、SA、JA和2,4-D的诱导,但不受干旱、低温和GA3胁迫处理的影响.尤其是在受到高盐胁迫处理后,SIDP301基因的表达量在短期内迅速上升,最高可以达到处理前的10倍以上,可见其表达对高盐胁迫的响应迅速,说明该基因可能作为胁迫信号通路中较为早期的组分.结合基因上游1 kb启动子区顺式作用元件的分析,可知SIDP301基因在非生物胁迫尤其是在高盐胁迫中发挥重要作用.
3.2SIDP301与植株的耐盐性
SIDP301基因有一个ZnF_C2H2型锌指结构域,该结构域主要涉及植物的生长发育和对环境胁迫的应答反应[14].逆境表达模式结果显示SIDP301的表达明显受盐胁迫诱导,同时该基因启动子上存在多个胁迫相关的顺式作用元件.为确定SIDP301是否参与调控水稻的耐盐性,对SIDP301转基因植株幼苗进行了耐盐性分析,发现超量表达SIDP301的转基因T1代水稻的株高、鲜质量与WT植株相比并没有显著变化(t-检验,p>0.05),但抑制表达SIDP301的转基因植株与WT植株相比,株高和鲜质量均显著降低(t-检验,p<0.05),表现出对高盐胁迫更加敏感.有所不同的是,同一家族的SIDP361[3]和SIDP366[4]基因的超量表达转基因植株均表现出对高盐胁迫的耐性增强,抑制表达植株均表现出对高盐胁迫的耐性降低.
为了解释SIDP301转基因植株与WT植株在高盐胁迫下存在的表型差异,本研究分析了一些逆境相关标记基因的表达变化,如:P5CS、DREB2A、Lea3-1和Rab16a.SIDP301基因的超量表达上调了P5CS基因及信号通路下游Lea3-1基因的表达,且Rab16a的表达上调尤其强烈.这些基因的表达促进了水稻体内渗透调节物质以及保护水稻细胞免受水分胁迫伤害的功能蛋白的积累,可以提高水稻对高盐的耐受性.而SIDP301抑制表达转基因植株中,P5CS、DREB2A、Rab16a和Lea3-1的表达量与WT植株中相比没有显著差异.这些结果说明SIDP301是一个抗逆相关基因,在高盐条件下主要通过上调下游信号通路基因的表达发挥功能.
[1]曾洪学,王俊.盐害生理与植物抗盐性[J].生物学通报,2005,40(9):1-3.
[2]MAHAJAN S,TUTEJA N.Cold,salinity and drought stresses:an overview[J].Archives of Biochemistry and Biophysics,2005,444:139-158.
[3]LI M,GUO L J,GUO C M,et al.Over-expression of a DUF1644 protein geneSIDP361 enhances tolerance to salt stress in transgenic rice[J].Journal of Plant Biology,2016,59:62-73.
[4]GUO C M,LUO C K,GUO L J,et al.OsSIDP366,a DUF1644 gene,positively regulates responses to drought and salt stresses in rice[J].Journal of Integrative Plant Biology,2016,58(5):492-502.
[5]王艳杰.DUF1644家族基因OsSIDP409在水稻盐胁迫应答中的功能分析[D].厦门:厦门大学,2014:14-39.
[6]VERBRUGGEN N,VILLARROEL R,VAN MONTAGU M.Osmoregulation of a pyrroline-5-carboxy-late reductase gene inArabidopsisthaliana[J].Plant Physiology,1993,103(3):771-781.
[7]IGARASHI Y,YOSHIBA Y,SANADA Y,et al.Characterization of the gene forΔ1-pyrroline-5-carboxylate synthetase and correlation between the expression of the gene and salt tolerance inOryzasativaL.[J].Plant Molecular Biology,1997,33(5):857-865.
[8]MATSUKURA S,MIZOI J,YOSHIDA T,et al.Comprehensive analysis of rice DREB2-type genes that encode transcription factors involved in the expression of abiotic stress-responsive genes[J].Molecular Genetics and Genomics,2010,283(2):185-196.
[9]XIAO B,HUANG Y,TANG N,et al.Over-expression of aLEAgene in rice improves drought resistance under the field conditions[J].Theoretical and Applied Genetics,2007,115(1):35-46.
[10]GANGULY M,DATTA K,ROYCHOUDHURY A,et al.Overexpression ofRab16Agene in indica rice variety for generating enhanced salt tolerance[J].Plant Signaling & Behavior,2012,7(4):502-509.
[11]MUNDY J,CHUA N H.Abscisic acid and water-stress induce the expression of a novel rice gene[J].The EMBO Journal,1988,7(8):2279.
[12]BATEMAN A,COGGILL P,FINN R D.DUFs:families in search of function[J].Acta Crystallographica Section F:Structural Biology and Crystallization Communications,2010,66(10):1148-1152.
[13]黄骥,王建飞,张红生.植物C2H2 型锌指蛋白的结构与功能[J].遗传,2004,26(3):414-418.
[14]黄骥,张红生,曹雅君,等.一个新的水稻C2H2 型锌指蛋白cDNA的克隆与序列分析[J].南京农业大学学报,2002,25(2):110-112.
Cloning and Functional Analysis of SIDP301 Gene in Oryza sativa
LUO Maochun1,CHEN Yanfei2,LUO Chengke3,CHEN Liang2*
(1.College of Life Sciences,Longyan University,Longyan 364012,China;2.Xiamen Key Laboratory for Plant Genetics,School of Life Sciences,Xiamen University,Xiamen 361102,China;3.Institute of Environmental Engineering,Ningxia University,Yinchuan 750021,China)
Rice is an important food crop,and it is also a model plant for the study of monocotyledon.It is of important theoretical and practical significance to clone the resistance genes in rice.SIDP301 gene is cloned from rice,which encodes a protein containing a DUF1644 conservative domain and zinc finger domain.Quantitative RT-PCR (qRT-PCR) data showed thatSIDP301 was expressed in all tissues and organs of rice and with higher level in roots and leaves.Its expression was induced by stresses including salt,heat and jasmonate.The salt tolerance ofSIDP301-overexpressing transgenic plants had no significant difference compared to the wild-type plants.However,SIDP301-suppressing transgenic plants exhibited hyposensitivity to salt stress compared to the wild-type plants.Through expression profiling analysis using qRT-PCR,all of the examined stress-responsive genes (eg.P5CS,DREB2A,Rab16aandLea3-1) were found to be up-regulated inSIDP301-overexpressing transgenic plants compared to the wild-type plants under salt stress,but the levels of gene expression had no significant difference in theSIDP301-suppressing transgenic plants compared to the wild-type plants.These results indicate thatSIDP301 is a stress-related gene,and the suppression of its expression was able to decrease the resistance of rice.
Oryzasativa;stress tolerance;SIDP301 gene
10.6043/j.issn.0438-0479.201604105农业生产专题
2016-04-13录用日期:2016-06-17
国家重大科技专项(2014ZX08001-008);国家自然科学基金(31560297)
chenlg@xmu.edu.cn
罗茂春,陈艳菲,罗成科,等.水稻SIDP301基因的克隆与功能分析[J].厦门大学学报(自然科学版),2016,55(5):672-678.
LUO M C,CHEN Y F,LUO C K,et al.Cloning and functional analysis ofSIDP301 gene inoryzasativa[J].Journal of Xiamen University(Natural Science),2016,55(5):672-678.(in Chinese)
Q 356.1
A
0438-0479(2016)05-0672-07
