我国水稻分子育种研究进展
2016-10-18朱义旺林雅容
朱义旺,林雅容,陈 亮
(1.厦门市植物遗传重点实验室,厦门大学生命科学学院,福建厦门361102;2.福建省农业科学院生物技术研究所,福建省农业遗传工程重点实验室,福建福州350003)

我国水稻分子育种研究进展
朱义旺1,2,林雅容1,2,陈亮1*
(1.厦门市植物遗传重点实验室,厦门大学生命科学学院,福建厦门361102;2.福建省农业科学院生物技术研究所,福建省农业遗传工程重点实验室,福建福州350003)
分子标记辅助选择育种和转基因育种是水稻分子育种的主要内容,同时基因编辑技术的发展为水稻分子育种注入新的活力.从产量、品质、抗逆等方面阐述了水稻分子育种的生物学基础,综述了我国近几年水稻分子育种研究成果以及基因组编辑技术在水稻分子育种上的应用进展.
水稻;分子育种;转基因;基因组编辑技术
水稻杂交育种为保障我国的粮食安全作出了重要的贡献,但是随着时代进步以及日愈复杂的环境变化,其发展潜力难于高效满足日愈多样化的市场需求.水稻分子育种借助分子生物学与经典遗传学的理论基础,以分子标记技术、转基因技术、生物信息学手段进行新型的分子水平育种,克服了水稻常规育种周期长、效率低的缺点,已成为现代水稻育种发展的主要方向,是我国粮食安全的重要技术保障.此外,近几年基因编辑技术的飞速发展为水稻分子育种工作展示了广阔的前景.以下主要概述近几年水稻功能基因研究成果和水稻分子育种的研究进展,并展望基因编辑技术应用于水稻分子育种的发展潜力.
1 水稻分子育种的生物学基础
水稻种质资源中优势等位基因的鉴定和利用是水稻分子育种的生物学基础.大量突变体库、基因全长cDNA文库、高通量高精度测序等一批水稻功能基因组研究平台的建立,以及插入标签、基因表达信息、图位克隆等基因克隆体系的日益完善,实现了一大批控制水稻产量、品质、抗逆等相关基因的克隆,并且大部分在农业生产中表现出较为良好的应用前景,为水稻品种改良储备了重要的基因资源.
1.1与产量相关的重要基因
产量性状是复杂的数量性状,水稻产量由单位面积有效穗数、每穗粒数和粒重3个因素构成,其中粒重主要由粒长、粒宽、粒厚和籽粒充实度4个因素共同控制.此外,株型、穗型等因素也会影响水稻单位面积产量.近10年来,我国科研工作者已经克隆了相当一部分影响水稻产量的重要基因(表1),其中包括GW2[1]、GW5[2]、GW8[3]、GS5[4]等粒型主效基因及Ghd7[5]、DTH8[6]等同时影响水稻光周期和产量性状的一因多效基因.另外,控制水稻穗型的主效基因DEP1突变能促进细胞分裂,从而通过增加穗枝梗数和每穗粒数来促进水稻增产[7].而直立型密穗基因DEP2除了调控水稻穗型,还具有控制种子大小的功能,突变体dep2表现为直立穗、小圆粒种的表型[8].氮高效基因NRT1.1B编码一个硝酸盐转运蛋白[9],在粳稻和籼稻中存在一个碱基的差异,通过对比发现籼型NRT1.1B具有更高的硝酸盐吸收及转运活性,且含有籼型NRT1.1B的近等基因系分蘖数目以及产量均有显著增加.最近,储成才科研团队和福建农业科学院赵明富研究组从水稻大粒材料RW11中克隆了一个控制水稻粒长的显性基因GL2,在不影响相关重要产量性状的基础上增大粒型,从而使单株产量增加16.6%[10].值得注意的是,另有一篇关于该基因的研究论文也同期发表在《Nature Genetics》上,从不同角度对该基因的分子机制展开探讨,共同说明该基因对水稻产量性状的遗传改良具有良好的应用前景[11].
表1 2008—2016年部分已克隆的水稻产量性状相关基因
Tab.1 Part of rice yield-related genes cloned from 2008 to 2016

基因名称编码蛋白控制性状生物学功能参考文献GW5核定位蛋白粒宽、粒重GW5功能缺失时将无法转移泛素至靶蛋白上,未降的解靶蛋白进一步激活颖花外壳细胞的分裂,增加谷壳的宽度及粒重[2]GW8含SBP结构域的转录因子粒型、品质通过直接结合抑制GW7启动子,下调它的表达水平[3]GS5丝氨酸羧肽酶粒宽、充实度、千粒重GS5启动子区域的两个关键单核苷酸多态性(SNPs)造成水稻幼穗中GS5的差异表达,决定了籽粒大小的差异[4]Ghd7含CCT核蛋白穗粒数、株高、抽穗期受phyA、phyB、phyC诱导增强表达,从而推迟抽穗、增加株高和每穗粒数[5]DTH8CCAAT盒结合蛋白穗粒数、株高、抽穗期长日照条件下,Ghd8通过调节Ehd1、RFT1和Hd3a延迟水稻开花,但短日照条件下并不抑制这些基因促进水稻开花[6]DEP1三聚体G蛋白的γ亚基穗型、穗粒数、粒型突变的DEP1能引起稻穗变短、直立、着粒密集,以及氮不敏感型营养生长,从而促进水稻增产15%~20%[7]DEP2植物特有的定位于内质网的蛋白穗型、粒型调控水稻穗型,并参与控制种子大小[8]NRT1.1B硝酸盐转运蛋白分蘖数目、氮高效利用籼稻NRT1.1B变异通过提高根向茎的氮运输能力以及上调硝酸盐应答相关基因的表达来促进硝酸盐利用[9]GL2GRF转录因子粒长、粒宽、粒重与转录共激活子OsGRFs互作,调控细胞伸长和细胞分裂,影响水稻粒型和粒重;另外受OsmiR396识别剪切,当它的识别序列突变后,OsmiR396失去对其剪切功能,产生大粒表型[10-11]GS3含4个结构域的跨膜蛋白粒重和粒长的主效基因一个控制籽粒大小的主效数量性状基因座(QTL),在调节籽粒和器官大小中发挥负调节子的功能.[12]IPA1类Squamosa启动子结合蛋白株高、分蘖、穗粒数受microRNA156的调控,当OsSPL14特定位点突变后,水稻分蘖减少,穗粒数和千粒重增加,同时茎秆变得粗壮,抗倒伏能力增强,进而产量提高[13]OsPPKL1,2,3含有Kelch重复域的蛋白磷酸酶粒长OsPPKL1突变体使水稻粒形变短,OsPPKL2和OsPPKL3是该基因的同源基因,在水稻粒长调控中分别发挥正、负调节子的作用[14]OsMKK4丝裂原活化蛋白激酶穗型、粒型、株高影响油菜素内酯(BR)应答以及BR相关基因表达,在种子生长中可能作为MAPK通路和BR间的连接因子[15]TGW6IAA-葡萄糖水解酶粒重通过IAA直接控制胚乳的长度,还间接参与源到库的碳水化合物的运输[16]Bg1生长素特异诱导的未知功能蛋白粒型生长素响应和转运的正调控因子,是植物特异的控制器官大小的调节因子[17]Bg2CYP78A13蛋白粒长、粒宽、粒厚、千粒重、胚的大小调控水稻胚发育、茎顶端分生组织维持和籽粒产量[18]FUWA含NHL结构域的蛋白株高、分蘖、穗粒数、粒型、千粒重在禾本科作物中进化保守,通过限制细胞周期过程,调控茎杆和小穗的发育[19]GLW7SBP型转录因子粒长、粒重可直接结合于SRS5启动子,通过延伸细胞长度增加粒长以及千粒重[20]
1.2与品质相关的重要基因
水稻品质性状的遗传研究与育种实践是我国水稻科学研究的薄弱环节,从而造成优质稻米品种较少、国际竞争力低的现状,因此,提高我国稻米食味品质是现阶段水稻科研工作者的研究热点.近10年来,许多与水稻品质相关的重要基因被陆续克隆(表2).较早研究的与水稻品质相关的基因是胚乳中淀粉合成相关基因,包括蔗糖合成酶、腺苷二磷酸葡萄糖(ADPG)焦磷酸化酶、淀粉分支酶和淀粉去分支酶等,这些基因及其等位基因的组合直接影响水稻胚乳直链淀粉的含量,从而影响稻米的食味品质.水稻香味是水稻品质的重要评价标准之一,香味基因OsBADH2的突变能够导致香味物质2-乙酰基-1-吡咯啉不断积累,形成具有香味的水稻叶片和籽粒[21].2014年华中农业大学的何予卿教授联合其他实验室相继克隆出2个稻米品质基因Chalk5[22]和OsAAP6[23],分别通过正调控水稻籽粒垩白和籽粒蛋白含量而影响稻米的营养品质和蒸煮食味品质.OsVPE1[24]是一个参与水稻籽粒蛋白积累的基因,在水稻谷蛋白的合成和成熟中发挥关键作用,为低蛋白水稻品种选育提供材料和分子育种的生物学基础.水稻籽粒的长宽比也是影响水稻品质的重要因素,GW8编码一个包含SBP结构域的转录因子,可通过调控水稻粒宽同时影响水稻品质和产量[3].2015年傅向东课题组[25]和李家洋课题组[26]在《Nature Genetics》上同期发表了GW8的下游调控基因GL7的相关研究论文,研究表明GL7能改变籽粒长度并改善稻米外观品质,GW8通过结合GL7的启动子抑制该基因的表达,从而影响细胞纵向伸长.此外,控制贮藏蛋白运输的主要运输工具编码基因GPA3[27]和籽粒灌浆充实度基因GIF1[28]等也对水稻品质具有较大影响.
表2 2008—2016年部分已克隆的水稻品质相关基因
Tab.2 Part of rice quality-related genes cloned from 2008 to 2016

基因位点编码蛋白控制性状生物学功能参考文献OsBADH2甜菜碱醛脱氢酶香味基因发生功能丧失型突变后不能催化4-氨基丁醛的氧化而导致4-氨基丁醛积累,从而促进了香味物质2-AP的合成[21]Chalk5液泡膜质子转运焦磷酸酶籽粒垩白、精密率高表达可能干扰了发育中种子的内膜转运系统pH稳态,在胚乳储存物质中形成了气体空间,导致了籽粒垩白的形成[22]OsAAP6氨基酸通透酶籽粒蛋白含量促进水稻根对氨基酸的吸收和转运,高表达水平与高籽粒蛋白含量呈现正相关[23]OsVPE1液泡加工酶谷蛋白的成熟将谷蛋白前体加工成酸性和碱性亚基以形成正确的PSV(蛋白贮藏液泡)结构和分隔储藏蛋白,在谷蛋白的成熟中发挥关键作用[24]GW7拟南芥LONGIFOLIA同源蛋白粒长、粒宽表达量上调能增加谷粒的纵向细胞分裂并减少横向细胞分裂,导致谷粒变得细长[25-26]GPA3后高尔基体囊泡运输调控因子谷蛋白前体通过VPS9a与Rab5a形成一个调控复合体,协同调控水稻中DVs介导的后高尔基体运输[27]GIF1细胞壁转化酵素淀粉合成负责控制蔗糖转化酶的活性,使蔗糖酶位于细胞壁上,把蔗糖转化成用于制造淀粉的物质[28]OsVIT1,2泡膜转运蛋白源和库器官间Fe/Zn的转移可能发挥跨膜转运Fe2+、Zn2+和Mn2+至液泡的功能[29]FLO6参与淀粉合成和复合颗粒形成的因子籽粒淀粉、蛋白和脂类含量该基因产物的两端分别与淀粉和ISA1结合,在淀粉合成中,起到桥梁二者的作用[30]
1.3与抗逆相关的重要基因
在长期的进化过程中,植物自身形成了一套完善的防御机制,以应对外界生物与非生物胁迫.生物胁迫主要包括稻瘟病、白叶枯病和条纹叶枯病等病害以及螟虫、褐飞虱等水稻生产中的主要虫害.首个水稻抗条纹叶枯病基因STV11由中国农科院万建民团队成功克隆并于2014年发表在《Nature Communications》上,该基因赋予植物对RSV(rice stripe virus)持久的抗性[31].Xa13是由我国科学家分离克隆的白叶枯主效基因,该基因编码的细胞膜蛋白有助于病原侵染,该基因的突变增强了对稻瘟病的抗性[32].据国家水稻数据中心统计,截至2015年3月,经报道的水稻稻瘟病病抗性基因共69个位点,84个主效基因[33],其中24个基因已被成功克隆,由我国科学家克隆的抗性谱较宽的主效基因Pi9[34]和Pi-d2[35]表现出很好的应用价值.同时我国在水稻抗褐飞虱方面也鉴定了大量的主效基因,其中Bph3是由3个编码质膜凝集素受体激酶的基因组成的基因簇,含有该基因簇的水稻品种能够显著增强水稻对褐飞虱和白背飞虱广谱持久的抗性[36].这些抗性基因的获得为分子标记辅助育种选育抗病水稻品种奠定了理论基础.
表3 2008—2016年部分已克隆的水稻抗非生物胁迫相关基因
Tab.3 Part of abiotic stress related genes in rice cloned from 2008 to 2016

基因位点表达蛋白胁迫应答生物学功能参考文献OsSIK1蛋白激酶干旱和盐胁迫应答通过激活抗氧化系统影响叶表皮远轴和近轴的气孔密度[37]DCA1含CHY锌指结构域和环-H2转录因子干旱和盐胁迫应答可能与DST蛋白形成异源四聚体,正向调控气孔孔径大小和气孔O2含量,最终影响植株的胁迫耐受性[38]DSM1有丝分裂原活化蛋白激酶激酶激酶干旱胁迫应答作为水稻响应干旱胁迫的早期信号传导组分,通过调节过氧化物酶基因的表达控制活性氧的清除,从而调节水稻的抗旱性[39]OsDIS1SINA型E3泛素连接酶干旱胁迫反应在转录水平上通过调节一系列逆境相关基因的表达,翻译后修饰水平上通过和OsNek6互作调控水稻的干旱胁迫响应过程[40]OsTRxh1h类硫氧还蛋白盐胁迫反应调节质外体氧化还原状态,影响植物的发育和对胁迫的应答[41]OsbZIP46ABRE结合蛋白干旱和热胁迫通过对含ABRE元件基因的直接调控,实现对ABA、干旱和热胁迫应答[42]OsPIN3a生长素输出载体干旱胁迫应答参与生长素的极性运输来实现水稻的干旱胁迫应答调控[43]OsTT126S蛋白酶体的α2亚基高温抗性编码的蛋白使细胞中的蛋白酶体在高温下对泛素化底物的降解速率更快,从而加快降解高温下积累的有毒变性蛋白来保护植物细胞.[44]OsSIK2S结构域受体类激酶干旱和盐胁迫应答提供非生物胁迫抗性并延缓黑暗诱导的叶片衰老,整合胁迫信号于发育过程从而使植物在不利环境条件下进行适应性生长[45]COLD1G蛋白信号调节因子耐寒性能与RGA1互作以感知低温,激活Ca2+通道,并增强G蛋白GTP酶活性,增强水稻的耐寒性[46]OsWRKY13WRKY转录因子干旱胁迫应答通过与目标基因启动子顺式作用元件的特定位点和特异序列结合,直接抑制SNAC1和WRKY45-1的表达,负调控抗旱性[47]OsETOL1乙烯过表达同源蛋白干旱和涝胁迫与OsACS2互作,通过调节乙烯产量和能量代谢在水稻干旱胁迫和涝胁迫抗性过程中发挥着独特的作用[48]TOGR1DEAD-BoxRNA解旋酶耐热性参与高温条件下正常rRNA前体的加工,是细胞核仁SSU复合体的伴侣蛋白,对高温下的细胞增殖十分重要,调控水稻耐热生长[49]
植物除受到虫害、病害和杂草等生物胁迫外,还受到不利的气候、土壤、水体等环境条件的非生物胁迫.特别是在全球环境逐渐恶化,干旱、高低温胁迫、盐胁迫等问题日趋严重的情况下,研究水稻在不同逆境中的生理机制及应用是现阶段的重要课题.近年来,我国克隆了不少对逆境有不同程度抗性的基因(表3).OsTT1是中科院上海生科院研究所林鸿宣团队克隆的一个水稻抗高温基因,其编码一个26S蛋白酶体亚基,可以在高温下有效降解水稻细胞中积累的有毒变性蛋白[44].在2016年2月,薛勇彪课题组和程祝宽课题组合作,也在水稻中成功克隆了一个新的耐热基因TOGR1,该基因编码的蛋白可以高温下对错误折叠的pre-rRNA前体进行正确构象的解旋[49].此外,DST是林鸿宣课题组于2009年克隆的一个新型锌指转录因子基因,对水稻的耐旱和耐盐性具有负调节作用[50];2015年该课题组进一步报道了DST的一个转录共激活因子DCA1,当过量表达DCA1基因时,可以增加气孔开度来介导植株的抗旱耐盐[38].这些研究结果为水稻抗逆机理的深入研究提供新线索,并且为作物抗逆性的分子育种改良提供了理论基础.
2 水稻分子标记辅助选择育种
合理的标记和鉴定是加快水稻育种进程的重要步骤.生物的遗传标记按其运用先后顺序分别是形态标记、生化标记和DNA分子标记.与前两者相比,分子标记应用于水稻育种的辅助选择具有特异性高、使用方便、成本低、步骤简单、周期短且不受基因表达和环境条件影响的优势,已为大多数研究者广泛使用.
2.1在产量改良上的运用
产量性状为多基因或少数几个主效基因控制的数量性状,其表型易受到环境的影响,通过分子标记辅助选择(MAS)培育高产水稻新品种方面取得了一定的进展.杨益善等[51]利用MAS和田间选择相结合的方法,将野生稻的两个高产QTL导入中熟晚稻恢复系测64-7,育成了籼型晚稻新恢复系远恢611,在后期的不同杂交组合中显示了超高产潜力.2008年两系杂交稻新组合Y两优7号,被湖南省农业厅认定为超级杂交中稻组合,该组合的恢复系R163也是以优良恢复系9311 为受体和轮回亲本,利用紧密连锁的分子标记转入了野生稻的两个高产QTL得到的[52].
2.2在品质改良上的运用
明恢63是一个直链淀粉含量适中的籼型强优势恢复系,但存在糊化温度高、胶稠度较差及心白率大的问题.王岩等[53]把中国香稻的alK和fgr等位基因片段导入明恢63,改良品系的外观品质、蒸煮食味品质得到了明显的改善.蔡治君等[54]以香型巨胚粳型水稻的中间材料和黑色非香正常胚糯性水稻品系“上农黑糯”进行杂交,结合分子标记辅助常规育种,首次成功选育出具有保健功能、香味性状和粳型性状集中于一体的保健黑色香型巨胚粳稻. 庄杰云等[55]利用分子标记辅助育种选育出携带有利等位基因wx的恢复系中恢161,与不育系中9A配组育成优质高产的杂交稻新组合中优161.朱速松等[56]利用珍汕97B(高直链淀粉含量)与优质保持系贵9B(中直链淀粉含量)杂交,在BC1F1和BC5F1用PCR-AccⅠ分子标记对控制中等直链淀粉含量的基因型进行辅助选择,选育出了不育性彻底、直链淀粉含量中等、综合农艺性状优良的三系籼型不育系H22A.
2.3在水稻抗病虫的运用
借助MAS将抗逆相关基因转移或聚合到特定水稻品种,已获得了部分单个抗性性状显著提高的新材料.姚姝等[57]以品种关东194为供体,通过杂交、回交结合分子标记,将供体材料条纹叶枯病抗性基因Stv-bi导入宁恢8号,通过MAS并综合农艺性状选择,育成抗性明显提高的宁恢8号改良系.为了改良杂交中稻组合Q优6号的稻瘟病抗性,闫成业等[58]将具抗稻瘟病亲本材料75-1-127的广谱抗性基因Pi9转入到Q优6号的父本R005中,育成了2个携带Pi9基因的株系,并与Q优6号的母本Q2A配制了组合,经鉴定新组合在主要农艺性状、产量、稻米品质方面与R005相似,但稻瘟病抗性明显提高.除此之外,多个抗性基因聚合的改良品种,也是提高抗性、拓宽抗谱、延长抗性寿命的重要育种手段.杨子贤等[59]利用MAS改良93-11恢复系对白叶枯病和螟虫的抗性取得了良好的效果,在回交的后代家系中筛选得到了抗白叶枯病的Xa21基因和Bt基因.潘晓飚等[60]将三黄占2号的抗稻瘟病主基因Pi-GD-1(t)、Pi-GD-2(t) 和主效QTLGLP8-6(t)及抗白叶枯病基因Xa23导入到明恢86等骨干中籼恢复系,获得5个带有抗稻瘟病兼抗白叶枯病的双基因或多基因聚合改良系,进一步实验表明,部分改良系和与不育系Ⅱ-32A配制的测交种对恢复系稻瘟病以及白叶枯病改良的效果明显.
3 水稻转基因育种
植物转基因育种是利用基因工程的手段,将功能清晰的外源基因导入植物基因组,通过直接表达外源基因,或调控内源基因的表达,使植物获得新的性状的一种品种改良技术.该技术相对于常规水稻育种来说,既省时又能够有效地达到既定目标,大幅度提高了育种能力.自1988年首次获得可育的转基因水稻以来,我国培育了大量高质、抗病、抗虫、抗除草剂、抗旱及耐盐等自主产权的环境友好型水稻新品种,在水稻产量的可持续性、品质的多样性及环境的适应性方面展现出巨大发展潜力.
3.1水稻转基因育种与高产高质
研究表明,籽粒中淀粉合成过程直接影响水稻的产量和品质.利用基因工程的手段调控水稻淀粉合成、改变稻米中的淀粉含量和结构、改善稻米品质、提高水稻产量成为重要的研究课题.林鸿生等[61]利用大肠杆菌中编码ADPG焦磷酸化酶的基因glgC-TM,将其导入水稻,并获得了千粒重得到增加的转基因植株.胡昌泉等[62]采用农杆菌介导法获得了转可溶性淀粉合成酶基因SSS和淀粉分支酶基因SBE的转基因恢复系明恢86,表型鉴定表明稻谷直链淀粉含量大幅度降低.另外,从水稻蛋白质和微量元素着手,Zheng等[63]将菜豆种子蛋白质基因导入水稻中表达,使得转基因水稻种子总蛋白质含量与赖氨酸含量都有所提高.叶红霞等[64]将豌豆铁蛋白基因转入“秀水11”水稻品种中,获得富含铁元素且其他重要农艺性状、食味品质等均无明显差异的转基因种质材料.另外,类似富含β-胡萝卜素的金色稻米等具有特殊营养品质的保健水稻新品种也在不断的研究和培育之中[65].
3.2水稻转基因育种与抗虫抗病
病虫害时刻伴随着水稻的整个生产过程中,使用的化学药剂不仅成本高,而且污染严重,利用转基因手段培育抗病虫害水稻已有长足发展.抗虫转基因水稻所用的外源基因主要有苏云金芽孢杆菌基因、昆虫蛋白酶抑制剂基因、外源凝集素基因、几丁质酶基因、营养杀虫蛋白基因、昆虫激素基因等[66],其中苏云金芽孢杆菌基因能有效控制水稻鳞翅目昆虫危害成为当前应用最为广泛的杀虫基因.鉴于转基因作物安全评价上的考虑,水稻育种工作者开发了特异性启动子介导的外源蛋白特异性表达,如Ye等[67]利用绿色组织特异性表达的rbcS基因启动子来驱动cry1C基因表达,获得了高效抗虫且Bt蛋白仅在绿色组织中高效表达而在水稻胚乳中基本不表达的转基因株系.另外,科研工作者还成功地将多个抗虫基因同时导入水稻培育多价抗虫水稻品种,也达到了可观的效果[68].目前,水稻病害主要包括病毒性病害、真菌性病害和细菌性病害3个方面,许多重要的抗病基因被分离克隆,并在水稻抗病转基因研究中取得了显著的成绩.Wang等[69]分离出一个对多数生理小种具有高抗表现的Pib基因,并利用该基因转化感病品种日本晴,得到具有抗性的生理小种003新材料.吴家道等[70]用基因枪转基因技术将高抗白叶枯病的Xa21基因导入恢复系(明恢63)和保持系(皖B)中,二者杂交组合 F1既抗白叶枯病又有较大的增产潜力.
3.3水稻转基因育种与生态友好
伴随着我国工业化和城市化的推进,产生了气候变暖、土地盐碱化和沙漠化、极端气候事件频发等一系列严峻的生态环境问题,使粮食安全问题日显突出,因而如何保证水稻产量的可持续性和稳定性,提高水稻环境耐受性,减小水稻生产对环境的影响,是应对气候环境变化的重要课题.过去20年,分子生物学的进展挖掘了一系列抗旱、耐淹、耐盐碱、耐寒等逆境耐受相关基因,也创制了一大批耐盐抗逆水稻新品种[71-74].2015年,福建省农科院联合瑞典农业大学创制了一种高产量低甲烷排放的环境友好型转基因水稻,该成果发布表在《Nature》上,通过转基因将大麦中的一个疑似控制淀粉合成与分配的转录因子基因SUSIBA2过表达在水稻日本晴里,大田实验证明转基因水稻基本不仅极大降低甲烷排放而且淀粉合成量增加,水稻产量更高[75].
4 水稻基因编辑育种
近几年,基因组编辑技术的高速发展为水稻基因功能研究和遗传育种改良提供了一种高效的辅助工具.它是利用位点特异性核酸酶在植物基因组DNA序列上造成双链断,激发细胞自身同源重组和非同源末端接合的修复机制,从而完成对植物基因组的靶向修饰.该技术不仅可以定点修饰作物自身的单个基因来获取新的性状,还可以同时编辑多个基因,实现多基因的转录调控、表观遗传调控等衍生技术.
4.1单基因修饰
基因编辑技术是人们开启认识基因功能的新钥匙,自TALENs技术形成之后,便广泛应用于包括水稻在内的多种生物中.Li等[76]利用TALENs技术靶向修饰了水稻蔗糖转运蛋白基因OsSWEET14的启动子序列,降低了水稻白叶枯病原菌分泌的效应蛋白与其结合的能力,从而提高水稻白叶枯病抗性.Chen等[77]利用TALENs技术定向敲除了水稻的52个基因,建立了一个大规模的 TALENs突变体平台.研究者通过运用Golden Gate方法进行TALENs 组装,构建植物表达载体,在水稻原生质体中进行TALENs活性检测,转化水稻,筛选转基因植株,最终获得突变体,突变效率达30%以上.Shan等[78]采用TALENs技术对水稻和短柄草中共12个位点进行靶向修饰,突变频率介于3.8%~100%之间,获得的突变类型主要集中在间隔序列上1~20个碱基的缺失.可见,利用TALENs技术定点突变不利基因,实现目标性状的精准改良,对水稻分子育种进程起到了强力的推进作用.
CRISPR/Cas9是继TALENs之后另一新兴的基因组定点改造工具,由于该系统简单易行、成本更低、转化效率更高,因此在作物的精准遗传改良上已成为最为广泛使用的基因组编辑手段.Shan等[79]利用水稻偏爱密码子优化Cas9核酸酶基因,并采用水稻小核RNA的U3启动子转录sgRNA,定点敲除水稻PDS基因.同年,Zhang等[80]和Ma等[81]分别对水稻ROC5和Waxy基因进行靶向修饰,获得的突变体则用于水稻卷叶育种及糯性育种的研究中.Zhang等[80]利用CRISPR/Cas9构建的11个水稻基因靶点,检测都具有活性,最高突变效率达66.7%,其中部分出现纯合突变和双等位基因突变个体.瞿礼嘉课题组[82]定点突变水稻叶绿素合成基因CAO1和控制分蘖夹角的基因LAZY1,T1代纯合突变体中则获得了叶绿素含量降低和分蘖夹角增大的相应表型.然而以上所运用的Ⅱ型CRISPR系统中Cas9蛋白只能特异识别NGG的PAM序列,很大程度上限制了sgRNA的选择范围.为突破这一限制,Hu等[83]定点突变Cas9蛋白,获得2种PAM识别序列为NGA和NGCG的Cas9突变蛋白,并通过水稻转基因实验证明,都能实现对基因组的有效编辑.该突破将水稻基因组序列中能够用于CRISPR/Cas9的可编辑范围拓展到现有的2倍以上,为水稻更广泛的基因组编辑提供新的可选工具.
表4 截止2016年3月已发表的水稻定点编辑基因
Tab.4 The genes applied to target edit technologies in rice that have been published until March,2016
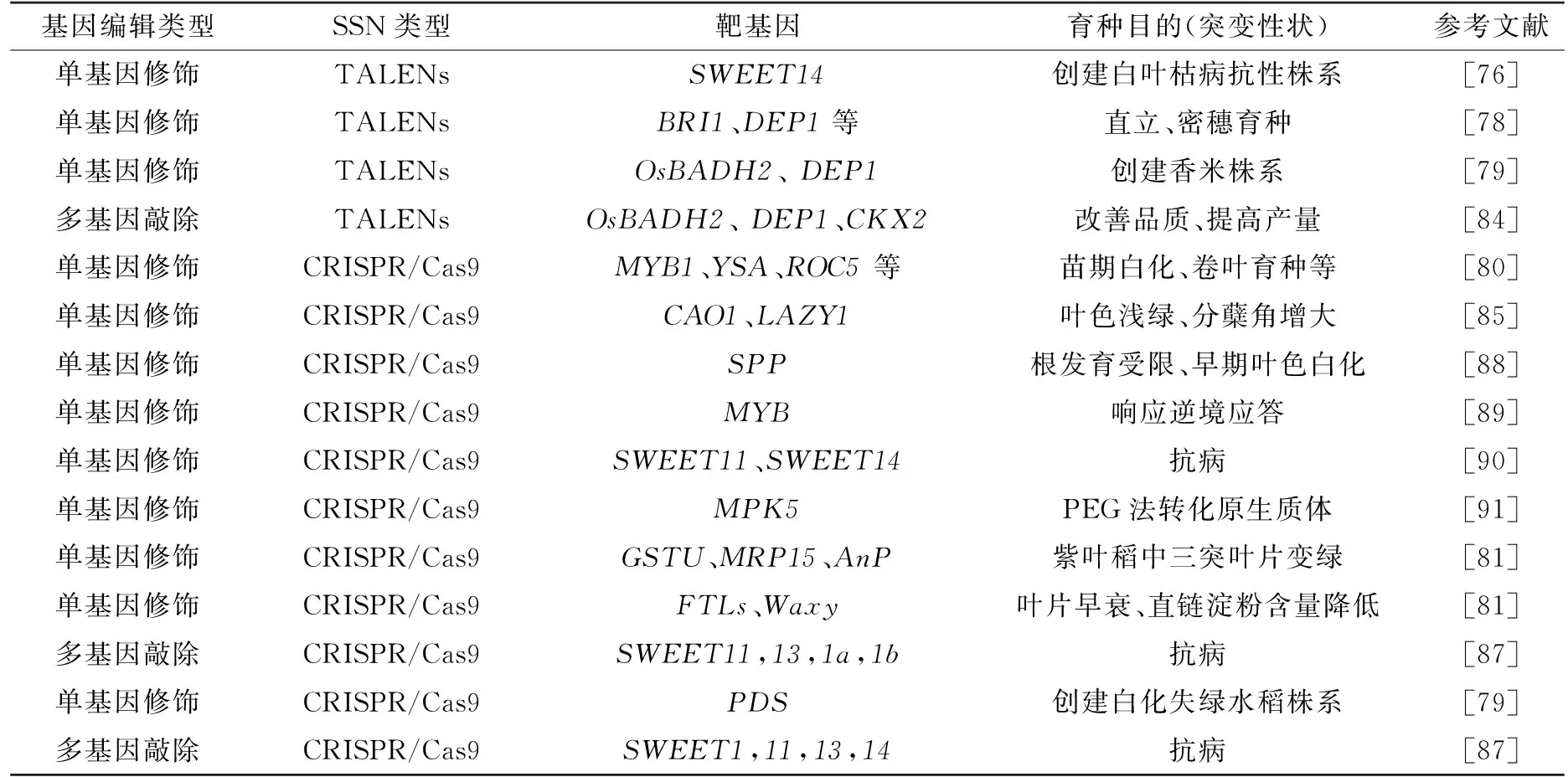
基因编辑类型SSN类型靶基因育种目的(突变性状)参考文献单基因修饰TALENsSWEET14创建白叶枯病抗性株系[76]单基因修饰TALENsBRI1、DEP1等直立、密穗育种[78]单基因修饰TALENsOsBADH2、DEP1创建香米株系[79]多基因敲除TALENsOsBADH2、DEP1、CKX2改善品质、提高产量[84]单基因修饰CRISPR/Cas9MYB1、YSA、ROC5等苗期白化、卷叶育种等[80]单基因修饰CRISPR/Cas9CAO1、LAZY1叶色浅绿、分蘖角增大[85]单基因修饰CRISPR/Cas9SPP根发育受限、早期叶色白化[88]单基因修饰CRISPR/Cas9MYB响应逆境应答[89]单基因修饰CRISPR/Cas9SWEET11、SWEET14抗病[90]单基因修饰CRISPR/Cas9MPK5PEG法转化原生质体[91]单基因修饰CRISPR/Cas9GSTU、MRP15、AnP紫叶稻中三突叶片变绿[81]单基因修饰CRISPR/Cas9FTLs、Waxy叶片早衰、直链淀粉含量降低[81]多基因敲除CRISPR/Cas9SWEET11,13,1a,1b抗病[87]单基因修饰CRISPR/Cas9PDS创建白化失绿水稻株系[79]多基因敲除CRISPR/Cas9SWEET1,11,13,14抗病[87]
4.2多基因编辑
利用多基因敲除技术研究复杂性状或数量性状,能够在较短时间获得多基因同步敲除突变体,加快研究进程.将多个序列特异性核苷酸(SSNs)同时导入细胞便可以实现多基因的同步编辑.高彩霞课题组[84]通过基因枪将水稻香味基因OsBADH2、穗粒数相关基因OsCKX2以及直立穗基因OsDEP1的TALENs质粒同时轰击水稻愈伤,分别获得9.7%,25.6%和9.2%的单基因突变率,并且鉴定出1.9%的植株同时包含有3个靶基因突变.同TALENs技术一样,CRISPR/Cas9系统也可以实现多位点靶向修饰,而且更有优势,它仅需单分子Cas9蛋白连接几个位点特异的gRNA便能实现.Xie等[85]利用多个内源转运RNA (transfer RNA,tRNA)与sgRNA串联组成的加工系统实现了CRISPR/Cas9的多基因编辑效力,这一组装系统在水稻中获得了多达8个位点的同时突变,并且个别位点效率高达100%.可见,TALENs和CRISPR/Cas9技术不仅可以对单个目的基因进行定点编辑,而且还能实现多个基因的靶向修饰,有效地解决了植物获得稳定、高效、精确修饰突变材料的难题.
借助于TALEN技术,Christian等[86]和Shan等[78]分别在拟南芥和水稻中实现了4.4 kb和1.3 kb 基因片段删除.由于CRISPR/Cas9系统构建简单,因此在多基因编辑和大片段缺失领域也更具有优势.Zhou等[87]构建了一套高效简便、可同时进行多重靶标的Cas9/sgRNA载体系统,靶向修饰水稻中4个糖输出转运子基因,并在T0代转基因植物中提高了87%~100%的糖输出效率;另外,利用该编辑系统同时还诱导了水稻基因组染色体大片段缺失,缺失长度约为115~245 kb(包含了2~3个不同的基因簇),且该大片段缺失在多代系中具有可遗传性.进一步表明SSNs也能有效删除染色体大片段,对于研究非编码RNA、基因调控序列和冗余基因功能将具有重要的作用.
5 展 望
随着日愈复杂的环境变化以及日愈多样化的人类需求,我国的水稻育种重点也不仅限于产量育种,新时期新形势下,科研工作者也侧重于水稻品质多样性、环境高适应及低资源投入的新理念育种,包括谷物中微量元素强化,耐贫瘠和抗胁迫水稻品种的开发以及水稻的生态友好可持续生产等,这些为水稻分子育种提出了更高的要求.因此,不仅仅需要持续深入系统地了解水稻重要农艺性状及杂种优势相关的生长发育分子机制,还要完善现有分子育种相关的种质资源信息系统,结合分子标记辅助选育与水稻分子设计,培育具有杂种优势与理想株型的高产、优质、耐逆、抗病的水稻新品种.近几年,以TALENs和CRISPR/Cas9系统为代表的基因组定点编辑技术迅速发展,已成功运用于水稻基因的定点编辑.未来基因定点编辑以及其衍生技术,结合水稻转基因技术及分子标记辅助,可以加快水稻功能基因组学以及分子育种的研究步伐,为进一步实现水稻从传统育种向高效、精确、定向的水稻分子设计育种注入新的活力.
[1]YAN S,ZOU G H,LI S,et al.Seed size is determined by the combinations of the genes controlling different seed characteristics in rice[J].Theoretical and Applied Genetics,2011,123(7):1173-1181.
[2]WENG J F,GU S H,WAN X Y,et al.Isolation and initial characterization ofGW5,a major QTL associated with rice grain width and weight[J].Cell Research,2008,18(12):1199-1209.
[3]WANG S K,WU K,YUAN Q B,et al.Control of grain size,shape and quality byOsSPL16 in rice[J].Nature Genetics,2012,44(8):950-954.
[4]LI Y B,FAN C C,XING Y Z,et al.Natural variation inGS5 plays an important role in regulating grain size and yield in rice[J].Nature Genetics,2011,43(12):1266-1269.
[5]XUE W Y,XING Y Z,WENG X Y,et al.Natural variation inGhd7 is an important regulator of heading date and yield potential in rice[J].Nature Genetics,2008,40(6):761-767.
[6]WEI X J,XU J F,GUO H G,et al.DTH8 suppresses flowering in rice,influencing plant height and yield potential simultaneously[J].Plant Physiology,2010,153(4):1747-1758.
[7]HUANG X Z,QIAN Q,LIU Z B,et al.Natural variation at the DEP1 locus enhances grain yield in rice[J].Nature Genetics,2009,41(4):494-497.
[8]LI F,LIU W B,TANG J Y,et al.Rice DENSE AND ERECT PANICLE 2 is essential for determining panicle outgrowth and elongation[J].Cell Research,2010,20(7):838-849.
[9]HU B,WANG W,OU S J,et al.Variation inNRT1.1Bcontributes to nitrate-use divergence between rice subspecies[J].Nature Genetics,2015,47(7):834-838.
[10]CHE R H,TONG H G,SHI B H,et al.Control of grain size and rice yield by GL2-mediated brassinosteroid responses[J].Nature Plants,2015,2(1):15195.
[11]DUAN P G,NI S,WANG J M,et al.Regulation ofOsGRF4 byOsmiR396 controls grain size and yield in rice[J].Nature Plants,2015,2(1):15203.
[12]FAN C C,XING Y Z,MAO H L,et al.GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J].Theoretical and Applied Genetics,2006,112(6):1164-1171.
[13]JIAO Y Q,WANG Y H,XUE D V,et al.Regulation ofOsSPL14 byOsmiR156 defines ideal plant architecture in rice[J].Nature Genetics,2010,42(6):541-544.
[14]ZHANG X J,WANG J F,HUANG J,et al.Rare allele ofOsPPKL1 associated with grain length causes extra-large grain and a significant yield increase in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(52):21534-21539.
[15]DUAN P G,RAO Y C,ZENG D L,et al.SMALLGRAIN1,which encodes a mitogen-activated protein kinase kinase 4,influences grain size in rice[J].The Plant Journal,2014,77(4):547-557.
[16]ISHIMARU K,HIROTSU N,MADOKA Y,et al.Loss of function of the IAA-glucose hydrolase geneTGW6 enhances rice grain weight and increases yield[J].Nature Genetics,2013,45(6):707-711.
[17]LIU L C,TONG H G,XIAO Y H,et al.Activation of big grain1 significantly improves grain size by regulating auxin transport in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(35):11102-11107.
[18]YANG W B,GAO M J,YIN X,et al.Control of rice embryo development,shoot apical meristem maintenance,and grain yield by a novel cytochrome P450[J].Molecular Plant,2013,6(6):1945-1960.
[19]CHEN J,GAO H,ZHENG X M,et al.An evolutionarily conserved gene,FUWA,plays a role in determining pa-nicle architecture,grain shape and grain weight in rice[J].The Plant Journal,2015,83(3):427-438.
[20]SI L,CHEN J,HUANG X,et al.OsSPL13 controls grain size in cultivated rice[J].Nature Genetics,2016,48(4):447-456.
[21]CHEN S H,YANG Y,SHI W W,et al.Badh2,encoding betaine aldehyde dehydrogenase,inhibits the biosynthesis of 2-acetyl-1-pyrroline,a major component in rice fragrance[J].The Plant Cell,2008,20(7):1850-1861.
[22]LI Y,FAN C,XING Y,et al.Chalk5 encodes a vacuolar H+-translocating pyrophosphatase influencing grain chalkiness in rice[J].Nature Genetics,2014,46(4):398-404.
[23]PENG B,KONG H,LI Y,et al.OsAAP6 functions as an important regulator of grain protein content and nutritional quality in rice[J].Nature Communications,2014,5(1):4847.
[24]WANNG Y H,ZHU S S,LIU S J,et al.The vacuolar processing enzymeOsVPE1 is required for efficient glutelin processing in rice[J].The Plant Journal,2009,58(4):606-617.
[25]WANG S K,LI S,LIU Q,et al.TheOsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality[J].Nature Genetics,2015,47(8):949-954.
[26]WANG Y X,XIONG G S,HU J,et al.Copy number va-riation at theGL7 locus contributes to grain size diversity in rice[J].Nature Genetics,2015,47(8):944-948.
[27]REN Y L,WANG Y H,LIU F,et al.GLUTELINPRECURSORACCUMULATION3 encodes a regulator of post-golgi vesicular traffic essential for vacuolar protein sorting in rice endosperm[J].The Plant Cell,2014,26(1):410-425.
[28]WANG E T,XU X,ZHANG L,et al.Duplication and independent selection of cell-wall invertase genesGIF1 andOsCIN1 during rice evolution and domestication[J].BMC Evolutionary Biology,2010,10(1):108.
[29]ZANG H Y,XU Y H,YI H Y,et al.Vacuolar membrane transportersOsVIT1 andOsVIT2 modulate iron translocation between flag leaves and seeds in rice[J].The Plant Journal,2012,72(3):400-410.
[30]PENG C,WANG Y H,LIU F,et al.FLOURYENDOSPERM6 encodes a CBM48 domain-containing protein involved in compound granule formation and starch synthesis in rice endosperm[J].The Plant Journal,2014,77(6):917-930.
[31]WANG Q,LIU Y Q,HE J,et al.STV11 encodes a sulphotransferase and confers durable resistance to rice stripe virus[J].Nature Communications,2014(5):4768.
[32]YUAN M,CHU Z,LI X,et al.The bacterial pathogen xanthomonas oryzae overcomes rice defenses by regulating host copper redistribution[J].The Plant Cell,2010,22(9):3164-3176.
[33]国家水稻数据中心.稻瘟病主效抗性基因列表[DB/OL].[2012-06-20].http:∥www.ricedata.cn/gene/gene_pi.htm.
[34]QU S,LIU G,ZHOU B,et al.The broad-spectrum blast resistance genePi9 encodes a nucleotide-binding site-leucine rich repeat protein and is a member of a multigene family in rice[J].Genetics,2006,172(3):1901-1914.
[35]CHEN X,SHANG J,CHEN D,et al.A B-lectin receptor kinase gene conferring rice blast resistance[J].The Plant Journal,2006,46(5):794-804.
[36]LIU Y Q,WU H,CHEN H,et al.A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice[J].Nature Biotechnology,2015,33(3):301-305.
[37]OUYANG S Q,LUNY F,LIU P,et al.Receptor-like kinaseOsSIK1 improves drought and salt stress tolerance in rice (Oryzasativa) plants[J].The Plant Journal,2010,62(2):316-329.
[38]CUI L G,SHAN J X,SHI M,et al.DCA1 acts as a transcriptional co-activator ofDSTand contributes to drought and salt tolerance in rice[J].PLoS Genetics,2015,11(10):e1005617.
[39]NING J,LIX H,HICKS L M,et al.A raf-like MAPKKK geneDSM1 mediates drought resistance through ROS scavenging in rice[J].Plant Physiology,2010,152(2):876-890.
[40]NING Y S,JANTASURIYARAT C,ZHAO Q Z,et al.The SINA E3 ligaseOsDIS1 negatively regulates drought response in rice[J].Plant Physiology,2011,157(1):242-255.
[41]ZHANG C J,ZHAO B C,GE W N,et al.An apoplastic h-type thioredoxin is involved in the stress response through regulation of the apoplastic reactive oxygen species in rice[J].Plant Physiology,2011,157(4):1884-1899.
[42]TANG N,ZHANG H,LI X H,et al.Constitutive activation of transcription factorOsbZIP46 improves drought tolerance in rice[J].Plant Physiology,2012,158(4):1755-1768.
[43]ZHANG Q,LI J J,ZHANG W J,et al.The putative auxin efflux carrierOsPIN3tis involved in the drought stress response and drought tolerance[J].The Plant Journal,2012,72(5):805-816.
[44]LI X M,CHAO D Y,WU Y A,et al.Natural alleles of a proteasomeα2 subunit gene contribute to thermotolerance and adaptation of African rice[J].Nature Genetics,2015,47(7):827-33.
[45]CHEN L J,WURIYANGHAN H,ZHANG Y Q,et al.An s-domain receptor-like kinase,OsSIK2,confers abiotic stress tolerance and delays dark-induced leaf senescence in rice[J].Plant Physiology,2013,163(4):1752-1765.
[46]MA Y,DAI X Y,XU Y Y,et al.COLD1 confers chilling tolerance in rice[J].Cell,2015,160(6):1209-1221.
[47]CHENG H T,LIU H B,DENG Y,et al.TheWRKY45-2WRKY13WRKY42 transcriptional regulatory cascade is required for rice resistance to fungal pathogen[J].Plant Physiology,2015,167(3):1087-1099.
[48]DU H,WU N,CUI F,et al.A homolog of ethylene overproducer,OsETOL1,differentially modulates drought and submergence tolerance in rice[J].The Plant Journal,2014,78(5):834-849.
[49]WANG D,QIN B X,LI X,et al.Nucleolar dead-box RNA helicaseTOGR1 regulates thermotolerant growth as a pre-rRNA chaperone in rice[J].PLoS Genetics,2016,12(2):e1005844.
[50]HUANG X Y,CHAO D Y,GAO J P,et al.A previously unknown zinc finger protein,DST,regulates drought and salt tolerance in rice via stomatal aperture control[J].Genes & Development,2009,23 (15):1805-1817.
[51]杨益善,邓启云,陈立云,等.野生稻高产QTL导入晚稻恢复系的增产效果[J].分子植物育种,2006,4(1):59-64.
[52]吴俊,庄文,熊跃东,等.导入野生稻增产QTL 育成优质高产杂交稻新组合Y 两优7号[J].杂交水稻,2010,25(4):20-22.
[53]王岩,付新民,高冠军,等.分子标记辅助选择改良优质水稻恢复系明恢63的稻米品质[J].分子植物育种,2009,7(4):661-665.
[54]蔡治君,黄菊,王英存.等.分子标记辅助育种选育黑色香型巨胚水稻[J].分子植物育种,2014,12(6):1112-1118.
[55]庄杰云,朱玉君,屠国庆,等.多基因聚合育成优质高产杂交稻新组合中优161[J].杂交水稻,2010,25(5):12-14.
[56]朱速松,施文娟,张玉珊,等.利用分子标记辅助选择选育中等直链淀粉含量的籼型三系不育系H22A[J].杂交水稻,2010,25(1):9-12.
[57]姚姝,陈涛,张亚东,等.分子标记辅助选择改良宁恢8号的条纹叶枯病抗性[J].中国水稻科学,2014,28(1):85-91.
[58]闫成业,马马渡·刚德卡,蒋胜理,等.分子标记辅助选择改良杂交水稻Q优6号的稻瘟病抗性[J].杂交水稻,2014,29(1):56-61.
[59]杨子贤,姜恭好,徐才国,等.利用分子标记辅助选择改良93-11恢复系对白叶枯病和螟虫抗性[J].分子植物育种,2004,2(4):473-480.
[60]潘晓飚,陈凯,张强,等.分子标记辅助选育水稻抗白叶枯病和稻瘟病多基因聚合恢复系[J].作物学报,2013,39(9):1582-1593.
[61]林鸿生,华志华,李娜,等.农杆菌介导glgC-TM基因转化水稻研究[J].中国水稻科学,2002,16(2):129-133.
[62]胡昌泉,徐军望,苏军,等.农杆菌介导法获得转可溶性淀粉合成酶基因籼稻[J].福建农业学报,2003,18(2):65-68.
[63]ZHENG Z,KAZUHIKO S,KUNIDUKE T,et al.The bean seed storage protein B_Phaseolin is synfheized,processed,and accumulated in the vacuolar type-Ⅱprotein bodies of transgenic rice endosperm[J].Plant Physiology,1995,109(3):777-786.
[64]叶红霞,郭泽建,舒庆尧,等.两份转Fer基因富铁水稻特异种质应用价值的初步评价[J].中国水稻科学,2007,21(3):270-274.
[65]YE X D,SALIMA B,KLOTI A,et al.Engineering the provitamin A(beta_carotene) biosynthetic parth way into (carotenoid_free) rice endosperm[J].Science,2000,287(4):303-305.
[66]王锋.转基因水稻育种研究的现状、问题及其发展策略[J].福建农业学报,2000,15(S1):141-144.
[67]YE R,HUANG H,ZHOU Y,et al.Development of insect resistant transgenic rice with cry1C free endosperm[J].Pest Management Science,2009,65(9):1015-1020.
[68]李聪,张启军,刘少奎,等.sbk和sck双价抗虫转基因水稻的育成和鉴定[J].中国水稻科学,2011,25(6):599-604.
[69]WANG Z X,YANO M,YAMANOUCHI U,et al.ThePibgene for rice blast resistance belongs to the nucleotide binding and leucine-rich repeat class of plant disease resistance genes[J].The Plant Journal,1999,19(1):55-64.
[70]吴家道,杨剑波,许传万,等.水稻抗白叶枯病基因Xa21转基因水稻及其杂交稻研究[J].作物学报,2001,27(1):29-34.
[71]XU D,DUAN X,WANG B,et al.Expression of a late embryo-genesis abundant protein gene,HVA1,from barley confers tolerance to water deficit and salt stress in transgenic rice[J].Plant Physiol,1996,110(1):249-257.
[72]孙国凤.在拟南芥和水稻中导入甜菜碱生物合成系统基因已确认其耐碱性[J].生物技术通报,1997(6):40-41.
[73]郭岩,张莉,肖岗,等.甜菜碱醛脱氢酶基因在水稻中的表达及转基因植株的耐盐性研究[J].中国科学(C辑),1997,27(2):151-155.
[74]YOKOI S,HIGASHI S I,KISHITANI S,et al.Introduction of the cDNA for Arabidopsis glycerol-3-phosphate acyltransferase(GPAT) confers unsaturation of fatty acids and chilling tolerance of photosynthesis on rice[J].Mol Breed,1998,4(3):269-275.
[75]SU J,HU C Q,YAN X,et al.Expression of barleySUSIBA2 transcription factor yields high-starch low-methane rice[J].Nature,2015,523:602-606.
[76]LI T,LIU B,SPALDING M H,et al.High-efficiency TALEN-based gene editing produces disease-resistant rice[J].Nature Biotechnology,2012,30(5):390-392.
[77]CHEN K,SHAN Q,GAO C.An effcient TALEN mutagenesis system in rice[J].Methods,2014,69(1):2-8.
[78]SHAN Q W,WANG Y P,CHEN K L,et al.Rapid and efficient gene modification in rice andBrachypodiumusing TALENs[J].Molecular Plant,2013,6(4):1365-1368.
[79]SHAN Q W,WANG Y P,LI J,et al.Targeted genome modification of crop plants using a CRISPR-Cas system[J].Nature Biotechnology,2013,31(8):686-688.
[80]ZHANG H,ZHANG J S,ZHU J K,et al.The CRISPR/Cas9 system produces specific and homozygous targeted gene editing in rice in one generation[J].Plant Biotechnology,2014,12(6):797-807.
[81]MA X L,ZHANG Q Y,ZHU Q L,et al.A robust CRISPR/Cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants[J].Molecular Plant,2015,8(8):1274-1284.
[82]MIAO J,GUO D,ZHANG J,et al.Targeted mutagenesis in rice using CRISPR-Cas system[J].Cell Research,2013,23(10):1233-1236.
[83]HU X,WANG C,FU Y,et al.Expanding the range of CRISPR/Cas9 genome editing in rice[J].Molecular Plant,2016,9(6):943-945.
[84]SHAN Q,ZHANG Y,CHEN K,et al.Creation of fragrant rice by targeted knockout of theOsBADH2 gene using TALEN technology[J].Plant Biotechnology,2015,13(6):791-800.
[85]XIE K B,MINKENBERG B,YANG Y N.Boosting CRISPR/ Cas9 multiplex editing capability with the endogenous tRNA-processing system[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(11):3570-3575.
[86]CHRISTIAN M,QI Y P,ZHANG Y,et al.Targeted mutagenesis ofArabidopsisthalianausing engineered TAL effector nucleases (TALENs)[J].G3:Genes Genomes Genetics,2013,3(10):1697-1705.
[87]ZHOU H B,LIU B,WEEKS D P,et al.Large chromosomal deletions and heritable small genetic changes induced by CRISPR/Cas9 in rice[J].Nucleic Acids Research,2014,42(17):10903-10914.
[88]FENG Z Y,ZHANG B T,DING W N,et al.Efficient genome editing in plants using a CRISPR/Cas system[J].Cell Research,2013,23(10):1229-1232.
[89]MAO Y F,ZHANG H,XU N F,et al.Application of the CRISPR-Cas system for efficient genome engineering in plants[J].Molecular Plant,2013,6(6):2008-2011.
[90]JIANG W Z,ZHOU H B,BI H H,et al.Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification in Arabidopsis,tobacco,sorghum and rice[J].Nucleic Acids Research,2013,41(20):e188.
[91]XIE K B,YANG Y N.RNA-guided genome editing in plants using a CRISPR-Cas system[J].Molecular Plant,2013,6(6):1975-1983.
Research Progress of Rice Molecular Breeding in China
ZHU Yiwang1,2,LIN Yarong1,2,CHEN Liang1*
(1.Xiamen Key Laboratory for Plant Genetics,School of Life Sciences,Xiamen University,Xiamen 361102,China;2.Fujian Key Laboratory of Genetic Engineering for Agriculture,Biotechnology Research Institute, Fujian Academy of Agricultural Sciences,Fuzhou 350003,China)
The molecular marker-assisted selection and transgenic breeding consist of the main content of rice molecular breeding,and the development of genome editing technologies offers a new way to rice breeding in recent years.In this review,we described the biological basis of rice molecular breeding in terms of yield,quality,stress tolerance,etc.Furthermore,some research achievements as well as the progress of genome editing technologies applied to rice molecular breeding were summarized.
rice;molecular breeding;transgenic;genome editing technologies
10.6043/j.issn.0438-0479.201604103农业生产专题
2016-04-08录用日期:2016-06-15
国家自然科学基金(31560297);福建省科技重大专项(2015NZ002-3)
chenlg@xmu.edu.cn
朱义旺,林雅容,陈亮.我国水稻分子育种研究进展[J].厦门大学学报(自然科学版),2016,55(5):661-671.
ZHU Y W,LIN Y R,CHEN L.Research progress of rice molecular breeding in China[J].Journal of Xiamen University(Natural Science),2016,55(5):661-671.(in Chinese)
Q 37
A
0438-0479(2016)05-0661-11
