39例成人急性乙型肝炎患者血清HBV基因变异检测及其临床意义探讨*
2016-10-17杜晓菲马丽娜柳雅立魏飞力吴云陈新月
杜晓菲,马丽娜,柳雅立,魏飞力,吴云,陈新月
39例成人急性乙型肝炎患者血清HBV基因变异检测及其临床意义探讨*
杜晓菲,马丽娜,柳雅立,魏飞力,吴云,陈新月
目的了解成人急性乙型肝炎患者流行的病毒基因型及基因变异情况。方法在2010年12月~2014年1月北京佑安医院收治39例急性乙型肝炎患者,采用直接基因测序法和平行等位基因特异性检测技术检测HBV基因型、P区、S区、前C区(PreC)和基本核心启动子(BCP)区序列。结果在39例患者中,成功测序35例。35例急性乙型肝炎患者感染HBV B基因型12例(36.4%),C基因型21例(57.6%,D基因型2例(6.0%);通过直接测序法和PASS法均检测到同1例患者存在A181S耐药变异,变异病毒占准种池比例达100%;直接测序法检测到1例患者存在S区S132F和W172C变异;1例患者存在PreC/BCP区G1896A和T1758C变异。结论急性乙型肝炎患者感染病毒基因型与文献报道的慢性乙型肝炎患者感染病毒基因型分布一致,以C型和B型为主,存在P区、S区和PreC/BCP区变异可能,未见不同病毒株感染引起转归的不同。
急性乙型肝炎;基因型;变异
已有关于耐药变异病毒引起急性乙型肝炎(Acute hepatitis B,AHB)[1~4]、抗病毒药物相关的疫苗逃避变异病毒(Antiviral drug-associated potential vaccine escape mutant,ADAP-VEMS)感染者再次接种乙肝疫苗而产生HBsAb成功的报道[5,6]。本文对我院收治的明确诊断为AHB患者进行HBV S区、P区、前C区(PreC)和基本核心启动子(Basal core promoter,BCP)区基因序列测定,了解有无变异病毒,观察患者临床特点及转归情况。
1 资料与方法
1.1研究对象2010年12月至2014年1月北京佑安医院国际医疗部收治的AHB患者39例,AHB诊断参照2000年中华医学会传染病与寄生虫病学分会和肝病学分会联合修订的《病毒性肝炎防治方案》的标准[7],同时本研究将其定义为:既往无乙型肝炎病毒感染史(发病前半年内体检HBsAg阴性),无乙型肝炎家族史,临床表现具有急性肝炎的症状和体征,实验室检查血清转氨酶明显升高,或伴有胆红素升高,病原学检测血清HBsAg、HBeAg、HBV DNA、抗-HBc IgM阳性。排除其他嗜肝病毒、巨细胞病毒、EB病毒感染及酒精性、自身免疫性肝病等原因引起的急慢性肝损害。本研究经我院医学伦理委员会同意,受试者签署知情同意书。
1.2血清HBV DNA检测和基因测序使用QIAamp DNA Blood mini Kits(美国Qiagen公司,货号为51106)提取血清HBV DNA,采用ntPCR技术扩增目的基因,采用双脱氧终止法对ntPCR产物进行直接测序。HBV P区序列测定使用引物1:54-75 CTCGTGGTGGACTTCTCTC;引物2:1267-1287 GC AAAGCCCAAAAGACCCAC;引物3:253-271 TTCC TGCTGGTGGCTCCAgTTC;引物4:1000-1019 TGCT AGGAGTTCCGCAGTATG;PreC/BCP区测序使用引物1:1604-1623 TCGCATGGAGACCACCGTGA;引物2:2060-2076 ATAGCTTGCCTGAGTGC;引物3:1653-1672 CATAAGAGGACTCTTGGACT;引物4:1957-1974 GGAAAGAAGTCAGAAGGC。PCR产物经琼脂糖凝胶电泳鉴定,应用ABI 3730XL测序仪进行双向序列测定。应用ContigExpress和Bioedit软件,对测序结果进行拼接和校正。将结果提呈至斯坦福大学耐药分析网页(http://hivdb.stanford. edu/HBV/HBVseq),参照其version 0.8耐药基因库进行虚拟表型分析,对不同位点的核苷(酸)耐药变异进行判定。
1.3平行等位基因特异性序列检测(Parallel allelespecific sequencing assay,PASS)PCR扩增引物和测序引物由美国Integrated HBV DNA Technologies(IDT)公司合成。应用蛋白酶K-苯酚抽提法提取血清HBV DNA。采用PASS法检测HBV耐药位点。PASS技术是应用聚合酶技术分析病毒基因组。首先扩增一段HBV P区1.1 kb基因片段,包含了主要耐药位点,一个丙烯酰化的引物可通过共价结合作用固定在聚丙烯酰胺凝胶上,因此在进行胶内PCR时,扩增的产物仅能积聚到单个HBV DNA模板附近。在扩增后,游离的DNA链可通过变性洗涤,固相的HBV DNA链与序列互补的引物杂交,而引物的3'端直接位于产生耐药的单核苷酸突变位点的上游。在不同荧光素标记的单核苷酸存在的情况下,引物进行单核苷酸延伸,可带上不同颜色荧光标记的碱基。然后,通过微距阵扫描成像区分出颜色不同的野生型和突变型,同一块凝胶循序性地用不同的引物对耐药位点进行检测。本次研究检测15个主要的耐药位点,分别为L80V、L80I、L180M、V173L、A181T、A181V、A181S、T184G1、T184G2、M2 04V、M204I、A194T、S202I、N236T、M250V。
1.4统计方法应用SPSS21.0软件(IBMInc,Chicago,IL)对数据进行统计处理。连续变量检测前进行正态性检验,将非正态性资料转换成正态后再检验。对符合正态分布的计量资料以(±s)表示,对偏态分布的计量资料以中位数(四分位数间距)表示。两组间连续变量的比较采用t检验和秩和检验。计数资料采用Chi-square检测。显著性标准为P值小于0.05。
2 结果
2.1一般情况39例AHB患者均为汉族,男性25例,女性14例;平均年龄为37.6±12.9岁(18~66岁)。13例为性接触传播,2例有看牙医经历,其余24例患者感染途径不明。患者入院时谷丙转氨酶为(1655.7±451)U/L,总胆红素(146.8±74.1)μmol/L,血清HBV标志物转换时间如表1(以患者出现明显的临床症状的时间为疾病起点)。
2.2感染HBV基因分型情况对39例患者入院时留取血清,进行HBV基因测序,其中35例成功完成扩增测序。根据S区核苷酸序列异源性是否≥4%,判断基因型,结果B基因型为36.4%(12/35),C基因型为57.6%(21/35),D基因型为6.0%(2/35)。
2.3P区基因变异与病情经PCR扩增直接测序法检测,在35例AHB患者中,有1例(2.9%)患者感染的HBV存在基因耐药变异,即为rtA181S位变异(图1),其感染HBV为B基因型,该患者男性38岁,临床诊断符合急性无黄疸型肝炎,发病1周入院。入院后,血清ALT峰值为1784.6 U/L,TBIL20.4μmol/L,HBV DNA 5.71×104IU/ml,HBsAg 4647 IU/ml。随着肝功能指标好转,相继出现血清HBV DNA消失,HBeAg/HBeAb血清学转换和HBsAg/HBsAb血清学转换。病程7周,临床痊愈。该患者性伴侣为慢性乙型肝炎患者,已服用阿德福韦酯治疗2年,但处于病毒学突破状态(初始治疗时血清HBV DNA为2.3×107IU/ml,治疗24周时血清HBV DNA降至5.63×102IU/ml,但在3月前复查升至4.8×105IU/ml)。进一步采用PASS法复查并观察该AHB患者感染的HBV rt A181S变异病毒在准种池中所占比例,结果仅发现RT A181S变异,未见其他RT区变异,与直接测序检测结果一致,变异病毒株在准种池中占100%(图2)。

表1 39例AHB患者血清HBV标记物转换时间(w)
图1 P区变异患者RT区基因序列可见A181S变异

图2 P区变异复检血清HBV DNA经PASS进行不同耐药位点检测,该图为A181位点检测结果,图中红色斑点为变异病毒株,绿色斑点为野毒株,可见该位点无野毒株,均为变异株
2.4S区测序情况在35例AHB患者中,检测到1例患者感染的HBV存在S区基因变异,变异位点为I110L、S132F和W172C(图3)。该患者与前述存在P区变异者为同一患者。
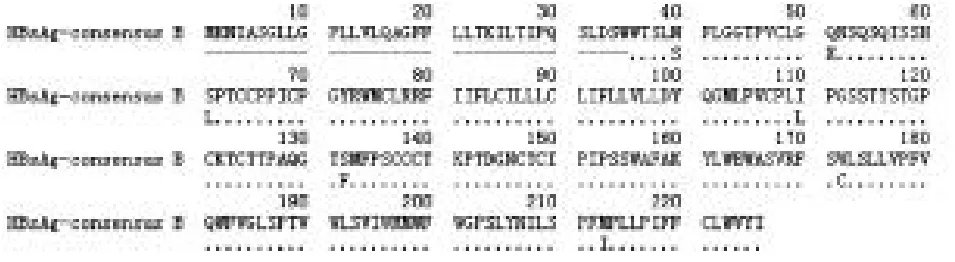
图3 S区变异患者基因序列可见I110L、S132F和W172C变异
2.5PreC/BCP区测序情况在35例AHB患者中,检测到1例患者感染的HBV同时存在前C区 G1896A和BCP区T1758C变异。该患者男性47岁,感染途径不明。发病第5天入院,入院时血清HBeAg阴性。ALT峰值为4863.4 U/L,TBIL为169 μmol/L,HBV DNA为9.8×103IU/ml,病毒基因型为C型。起病8周后肝功能恢复正常,第6周血清HBsAg转阴,第11周HBV DNA检测不到,病程11周。
3 讨论
有文献报道AHB患者HBV基因型可能因传播途径不同而不同。在日本,通常以B型和C型为主,但近年A基因型比例在明显上升,并认为与性传播途径感染有关[8-12]。本组在有明确传播途径的患者也以性传播为主,但感染病毒基因型无特殊,与其他中心的研究报道一致[13-15],提示性传播为AHB的主要感染途径。近年先后有在AHB患者中检测到耐药变异病毒株的报道[3,16-18],其检出率约占2%~7%,但未报道耐药变异株在准种池中所占比例,也极少涉及耐药变异病毒感染患者的感染途径及转归的追踪。虽然目前现有资料提示耐药变异病毒在急性HBV感染中的比例不高,但作为新的、初始即耐药的传染源在流行病学上可能具有重要的意义。181位点作为一个共享的耐药位点,一旦出现耐药变异,将引起ADV、LAM、LDT的原发性耐药,并降低TDF的敏感性。
我们发现1例患者感染的HBV同时存在S区S132F和W172C变异。S132F变异位于α决定簇第一环内(124~137AA),可能导致HBsAg与相应抗体的结合力明显下降[19],但该患者预后好,提示S132F变异非主要影响抗体结合力的位点,也可能变异毒株为非优势株而被自然淘汰。S区α决定簇变异株主要传播途径主要经母婴垂直传播,罕见水平传播,对于该患者感染的S132F变异株是否为水平传播引起,需追踪其性伴侣感染的HBV基因序列,以进一步明确。考虑S区W172C变异为rtA181S突变导致的,使得HBsAg截短。近年体外细胞和动物实验结果证实HBsAg截短变异有潜在的致癌作用,但至今尚无明确的临床研究证实抗病毒治疗耐药相关突变与致癌性有关。长期抗病毒治疗引起的病毒突变,特别是引起前S与S区突变的潜在致癌性值得进一步研究。目前关于ADAP-VEMS感染疫苗免疫人群病例报道较少[6],尚不清楚免疫预防接种和抗病毒治疗两者联合是否会加速ADAP-VEMs在人群中的传播。在临床上,有必要进行ADAP-VEMs监测,因为无论是乙肝免疫球蛋白或是主动免疫均不能阻止ADAP-VEMs的母婴传播。一旦婴儿被传播,后续治疗将更复杂。
在本研究中另检测到1例患者感染的HBV同时存在PreC区G1896A和BCP区T1758C变异。大量研究表明HBV PreC/BCP区变异或联合变异可造成HBeAg表达下降或停止,但HBV仍然能复制和传播。该患者入院时HBeAg即为阴性,结合其病毒测序发现存在PreC/BCP变异,推测可能其感染的病毒即为变异病毒。PreC/BCP变异的意义未完全明确,研究提示HBeAg阴性和PreC区(G1896A、G1899A)变异可能与重型乙型肝炎和暴发性乙型肝炎(FHB)的发生有关[20]。
本组39例AHB患者临床特征及基线无治疗干预的血清病毒基因测序结果提示P区、S区、PreC/BCP区变异病毒均可造成传播,最终临床转归好。但因病例数少,尚不能确定其慢性化或重症化比率。
[1]GBD 2013 Mortality and Causes of Death Collaborators.Global,regional,andnationalage-sexspecificall-causeand cause-specific mortality for 240 causes of death,1990-2013:a systematic analysis for the Global Burdenof Disease Study 2013.Lancet,2015,385:117-171.
[2]Trepo C,Chan HL,Lok A.Hepatitis B virus infection.Lancet,2014,384:2053-2063.
[3]Xu Z,Liu Y,Xu T,et al.Acute hepatitis B infection associated with drug-resistant hepatitis B virus.J Clin Virol,2010,48:270-274.
[4]Liu Y,Zhong Y,Zou Z,et al.Features and clinical implications of hepatitis B virus genotypes and mutations inbasal core promoter/precore region in 507 Chinese patients with acute and chronic hepatitis B.J Clin Virol,2010,47:243-247.
[5]赵琳,黄玲,王晶慧.240例初治乙型肝炎患者的流行病学特征.肝脏,2011,16:442-445.
[6]Thibault V,Aubron-Olivier C,Agut H,et al.Primary infection with a lamivudine-resistant hepatitis B virus.Aids,2002,16:131-133.
[7]中华医学会传染病与寄生虫病学分会、肝病学分会联合修订.病毒性肝炎防治方案.中华肝脏病杂志,2000,8:5-10.
[8]Ozasa A,Tanaka Y,Orito E,et al.Influence of genotypes and precore mutations on fulminant or chronic outcome of acute hepatitis B virus infection.Hepatology,2006,44:326-334.
[9]Matsuura K,Tanaka Y,Hige S,et al.Distribution of hepatitis B virus genotypes among patients with chronic infection in Japan shifting toward an increase of genotype A.J Clin Microbiol,2009,47:1476-1483.
[10]Yotsuyanagi H,Ito K,Yamada N,et al.High levels of hepatitis B virus after the onset of disease lead to chronic infection in patientswithacutehepatitisB.ClinInfectDis,2013,57:935-942.
[11]Yano K,Tamada Y,Yatsuhashi H,et al.Dynamic epidemiology of acute viral hepatitis in Japan.Intervirology,2010,53:70-75.
[12]Ito K,Yotsuyanagi H,Yatsuhashi H,et al.Risk factors for long term persistence of serum hepatitis B surface antigen following acute hepatitis B virus infection in Japanese adults.Hepatology,2014,59:89-97.
[13]Li HM,Wang JQ,Wang R,et al.Hepatitis B virus genotypes and genome characteristics in China.World J Gastroenterol,2015,21(21):6684-6697.
[14]Chattopadhyay S,Das BC,Hussain Z,et al.Hepatitis B virus genotypes in acute and fulminant hepatitis patients from north Indiausingtwodifferentmoleculargenotypingapproaches. Hepatol Res,2006,35:79-82.
[15]Suzuki Y,Kobayashi M,Ikeda K,et al.Persistence of acute infection with hepatitis B virus genotype A and treatment in Japan.JMed Virol,2005,76:33-39.
[16]Hayashi K,Katano Y,Ishigami M,et al.Prevalence and clinical characterization of patients with acute hepatitis B induced by lamivudine resistant strains.J Gastroenterol Hepatol,2010,25:745-749.
[17]Baxa DM,Thekdi AD,Golembieski A,et al.Evaluation of anti-HBVdrugresistantmutationsamongpatientswithacute symptomatic hepatitis B in the United States.J Hepatol,2013,58:212-216.
[18]Morando F,Rosi S,Fasolato S,et al.Severe acute hepatitis B inatreatmentnaivepatientwithantiviraldrugresistant mutationsinthepolymerasegene.JMedVirol,2013,85:210-213.
[19]Clements CJ,Coghlan B,Creati M,et al.Global control of hepatitisBvirus:does treatment-inducedantigenic changeaffect immunization.Bull World Health Organ,2010,88:66-73.
[20]Sainokami S,Abe K,Sato A,et al.Initial load of hepatitis B virus(HBV),itschangingprofile,andprecore/corepromoter mutations correlate with the severity and outcome of acute HBV infection.J Gastroenterol,2007,42:241-249.
(收稿:2016-04-15)
(本文编辑:陈从新)
Hepatitis B viral genotypes and gene mutations in 39 adult patients with acute hepatitis B
Du Xiaofei,Ma Lina,Liu Yali et al.
Department of International Medical Service,You'an Hospital,Capital Medical University,Beijing 100069,China
ObjectiveTo investigate the prevalent viral genotypes and possible gene mutation in adults with acute hepatitis B(AHB).MethodsSerum samples of 39 patients with AHB admitted in our hospital were collected between December 2012 and January 2014.Viral genotypes and sequences of P region,S region,Pre C region and basic core promoter(BCP)were detected by direct sequencing and parallel allele specific sequencing(PASS).Results35 out of 39 patients with AHB were sequenced successfully.Genotype distribution in these 35 cases was as follows.Genotype B accounted for 36.4%(12/35),genotype C for 57.6%(21/35),and genotype D for 6.0%(2/35);A181S drug resistance mutation was found in one patient by both sequencing methods,while S132F and W172C mutations in S region as well as G1896A andT1758C mutations in PreC/BCP regions were noticed by direct sequencing in two different cases,respectively.ConclusionsViral genotype distribution of common genotype C and B in patients with AHB is not different in patients with CHB.Patients infected with P region,S region or PreC/BCP region mutants might have similar prognosis as patients infected with wild HBV.
Acute hepatitis B;Genotype;Mutation
10.3969/j.issn.1672-5069.2016.05.004
“十二五”国家科技重大专项(编号:2013ZX1002002-006);首都临床特色应用研究与成果推广项目(编号:Z151100004015181);北京市卫生和计划生育委员会科技成果和适宜技术推广项目(标号:TG-2015-020)
100069北京市首都医科大学附属北京佑安医院国际医疗部
杜晓菲,女,36岁,硕士研究生,主治医师。主要从事肝病诊疗工作。E-mail:dxiaofei80@sina.com
陈新月,E-mail:chenxydoc@163.com
