抗丙型肝炎病毒治疗过程中甲状腺功能异常与病毒学应答关系研究*
2016-10-17朱芳颜学兵王家猛周付成费媛媛
朱芳,颜学兵,王家猛,周付成,费媛媛
抗丙型肝炎病毒治疗过程中甲状腺功能异常与病毒学应答关系研究*
朱芳,颜学兵,王家猛,周付成,费媛媛
目的探讨聚乙二醇干扰素(Peg-IFN)联合利巴韦林(RBV)治疗慢性丙型肝炎患者发生甲状腺功能异常的转归及其对抗病毒疗效的影响。方法204例(HCV基因1b型感染173例,2a型9例,3b型2例,未分型20例)慢性丙型肝炎患者应用Peg-IFN联合RBV抗病毒治疗。对于基因1型和未分型者治疗48 w,对于基因2型和3型治疗24 w。采用化学发光免疫分析法检测血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、超敏促甲状腺激素(sTSH);采用间接免疫荧光法检测血清抗甲状腺球蛋白抗体(Tg-Ab)、抗甲状腺过氧化物酶抗体(TPOAb)、抗促甲状腺激素受体抗体(TRAb)、抗甲状腺微粒体抗体。结果在治疗过程中,发生甲状腺功能异常43例(19.0%),其中甲状腺功能减退症7例(16.3%),亚临床甲状腺功能减退症17例(39.5%),甲状腺功能亢进症11例(25.6%),亚临床甲状腺功能亢进症8例(18.6%);甲状腺功能异常集中发生于治疗后24~36 w;在观察结束时,37例甲状腺功能异常患者自发或者经药物治疗后甲状腺功能恢复正常,6例患者仍需要密切监测甲状腺功能或服用抗甲状腺药物;43例甲状腺功能异常与161例无甲状腺功能异常患者RVR、EVR、ETVR、SVR、治疗结束后96 w病毒学应答率差异均无统计学意义(P>0.05)。结论Peg-IFN联合RBV治疗慢性丙型肝炎患者诱发甲状腺功能异常的发生率为19.0%,大部分是可逆的,甲状腺功能异常不影响抗病毒疗效。
慢性丙型肝炎;聚乙二醇干扰素;甲状腺功能;病毒学应答
甲状腺功能异常(thyroid dysfunction,TD)是聚乙二醇干扰素(pegylated interferon,Peg-IFN)联合利巴韦林(ribavirin,RBV)治疗(PR方案)较常见的内分泌系统不良反应[1~3]。本文分析了204例应用PR方案治疗的慢性丙型肝炎(CHC)患者甲状腺功能监测结果,以探讨出现TD患者的临床特征、对病毒学应答和转归的影响,现将结果报道如下。
1 资料与方法
1.1一般资料2013年1月~2014年1月宿迁市钟吾医院收治的CHC患者204例,女性93例,男性111例;年龄3~79岁,平均年龄(42.2±19.6)岁。诊断符合2015年中华医学会制定的《丙型肝炎防治指南》[1],其中HCV基因1b型感染173例,2a型9例,3b型2例,未分型20例。入院前6个月内未接受过抗病毒药物或免疫调节剂治疗,排除HBV、HCV、HIV混合感染,既往无精神疾病或严重心肺疾病。
1.2治疗方法204例患者均采用PR方案治疗,即给予Peg IFNα-2a(派罗欣,上海罗氏制药有限公司)180 μg(儿童104 μg/m2体表面积)或Peg IFNα-2b(佩乐能,美国先灵葆雅公司)1~1.5 μg· kg-1皮下注射,1次/w,RBV(江西汇仁药业有限公司)15 mg.kg-1·d-1口服。对于基因1型和未分型者治疗48 w,对于基因2、3型治疗24 w。
1.3检测方法采用化学发光免疫分析法检测血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、超敏促甲状腺激素(sTSH);采用间接免疫荧光法检测血清抗甲状腺球蛋白抗体(Tg-Ab)、抗甲状腺过氧化物酶抗体(TPOAb)、抗促甲状腺激素受体抗体(TRAb)、抗甲状腺微粒体抗体(TMAb,罗氏E601发光仪及其配套试剂盒);采用荧光定量PCR法检测血清HCV RNA(ABI7500实时荧光定量PCR仪及湖南圣湘生物科技有限公司试剂盒或COBAS AmpliPrep/COBAS TagMan分析仪及其配套试剂盒)。甲状腺功能亢进症的诊断标准:sTSH<0.35 mIU/L,FT3>10.43 pmol/L和(或)FT4>21.1 pmol/L;甲状腺功能减退症的诊断标准:sTSH>4.95 mIU/L,FT3<3.67 pmol/L和(或)FT4<7.46 pmol/L;亚临床甲状腺功能亢进症的诊断标准:sTSH<0.35 mIU/L,FT3和FT4正常;亚临床甲状腺功能减退症的诊断标准:sTSH>4.95 mIU/L,FT3和FT4正常。TD诊断符合《中国甲状腺疾病诊疗指南》[4,5]。将Tg-Ab、TPOAb、TRAb、TMAb中任一或多个阳性定义为抗甲状腺自身抗体阳性。
1.4统计学处理应用SPSS 13.0软件进行统计学分析,计量资料以±s表示,采用t检验,计数资料的比较采用x2检验或校正x2检验,P<0.05为差异有统计学意义。
2 结果
2.1甲状腺功能正常与异常患者入组时一般资料比较见表1。
2.2PR治疗后发生TD类型和发生时间204例患者在治疗过程中,发生TD43例(19.0%),TD患者中检出抗甲状腺自身抗体阳性者23例(53.5%),考虑自身免疫性甲状腺炎;在19例甲状腺功能亢进和亚临床甲状腺功能亢进患者中,6例在1~3月后转为甲状腺功能减退,抗甲状腺自身抗体阴性,考虑破坏性甲状腺炎。TD发生时间见表2。
表1 两组患者一般资料(n,±s)比较
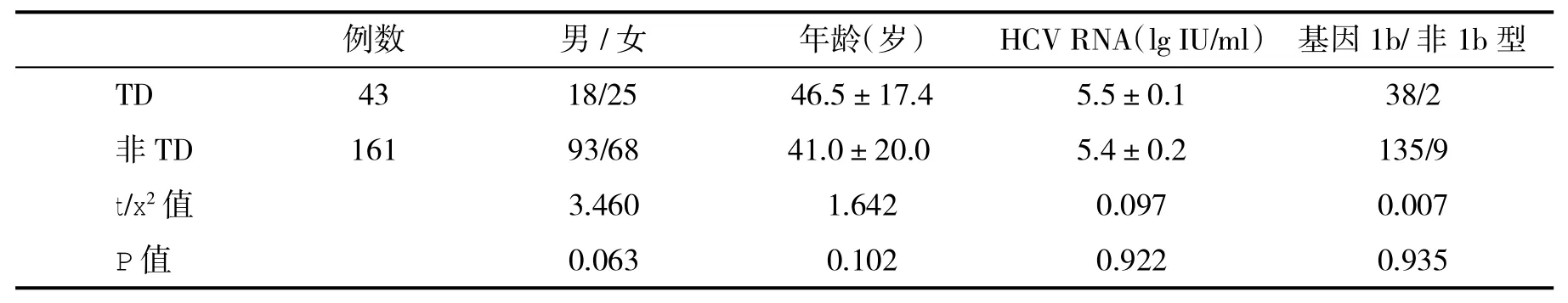
表1 两组患者一般资料(n,±s)比较
例数男/女年龄(岁)HCV RNA(lg IU/ml)基因1b/非1b型TD4318/2546.5±17.45.5±0.138/2非TD16193/6841.0±20.05.4±0.2135/9 t/x2值3.4601.6420.0970.007 P值0.0630.1020.9220.935

表2 不同甲状腺功能异常患者血清抗体阳性率(%)和疾病发生时间比较
2.3TD的处理及转归对43例TD患者,无论抗甲状腺自身抗体是否阳性,均未降低Peg-IFN剂量。25例亚临床TD患者和4例无症状甲状腺功能亢进症患者未予以甲状腺药物治疗,平均持续3月后25例患者甲状腺功能恢复正常;2例亚临床甲状腺功能亢进症和2例甲状腺功能亢进症患者于2~3个月后转为甲状腺功能减退症,其余7例甲状腺功能亢进症患者,因有不同程度的心悸、乏力、易怒等症状,予以丙硫氧嘧啶治疗,2例于1月后转为甲状腺功能减退症;1例于24 w出现甲状腺功能亢进,于治疗32 w出现严重的室性心律失常(频发室性早搏、室性二联律、三联律)而立即停止干扰素治疗,同时加用心得安控制心率,1月后患者症状消失,心电图恢复正常;1例于治疗41 w(24 w出现甲状腺功能亢进)出现明显的精神症状而停止抗病毒治疗。共计13例甲状腺功能减退症患者予以左甲状腺素片替代治疗,治疗过程中始终维持甲状腺功能正常,未出现显著不良反应及并发症。除2例提前终止治疗外均完成规定疗程。治疗结束96 w时,12例患者停用甲状腺药物后甲状腺功能持续正常>6月,视为甲状腺功能复常,6例(4例甲状腺功能减退症、2例甲状腺功能亢进症)进展为持续性TD,均检测出高滴度的抗甲状腺自身抗体。本组TD复常率为86.1%。TD组初检甲状腺激素水平异常时与结束后96 w,血清Tg-Ab、TRAb、TMAb阳性率比较,差异无统计学意义(P均>0.05),而TpoAb阳性率则明显不同(P=0.014)。治疗结束后96 w,TD与非TD患者各类抗体阳性率均存在显著性差异(P均<0.05,表3)。
2.4TD的发生对病毒学应答的影响两组患者RVR、EVR、ETVR、SVR、治疗结束后96 w病毒学应答率差异均无统计学意义(P均>0.05,表4)。

表3 两组抗甲状腺自身抗体阳性率(%)比较

表4 两组病毒学应答率[例(%)]的比较
3 讨论
PR方案抗病毒治疗CHC患者可能与甲状腺疾病密切相关。目前,对Peg-IFN抗病毒治疗引起TD发生已形成共识,但国内外的研究[6,7]对TD发生率及对患者病情转归的影响仍有较大的争议。
本组TD发生率为19.0%,以甲状腺功能减退症为主,占55.8%,低于Hwang et al[7]的研究,而与国内近期的报道[8,9]相似。周红霞等[8]发现78例CHC患者在抗病毒治疗过程中TD发生于IFN治疗后31~60 d,而王晗等[9]在432例CHC患者中发现86.6%TD于治疗后6个月内诱发。我们的资料显示TD可发生于Peg-IFN治疗的任何阶段,但主要集中出现在治疗后24~36 w,累计发生率分别为39.5%和62.8%,与Prummel et al[10]的研究一致。
在2005年,Moncoucy et al[11]在法国22l例初始甲状腺功能正常的CHC患者,发现Peg-IFN联合RBV治疗与Peg-IFN单独治疗相比并没有增加甲状腺疾病发生的风险。因此认为,Peg-IFN是引起甲状腺疾病的原因。方敏等[12]认为凡是药物可以控制的TD均可继续使用Peg-IFN,不必减量或停用。其它研究也得出相似的结论[13]。本研究也有同样发现,所有TD患者Peg-IFN均未减量,在调节甲状腺药物应用及密切监测甲状腺功能的情况下可顺利完成抗病毒疗程。大部分患者甲状腺功能自行恢复。在监测过程中,仅2例甲状腺功能亢进症患者因其它严重并发症而停止治疗。因此我们建议,对于亚临床甲状腺功能异常患者,可继续Peg-IFN治疗,但应缩短甲状腺功能的监测时间;对于甲状腺功能减退症患者,给予左甲状腺素替代治疗后不需减量或停用Peg-IFN;对于甲状腺功能亢进症患者,有条件者应行吸碘率测定,及早判断是否为破坏性甲状腺炎,否则应推迟或以小剂量的丙硫氧嘧啶治疗,避免诱导甲减,并及时调整抗甲状腺药物剂量。治疗过程中若发生与Peg-IFN相关的其它严重不良反应(如本研究中出现的严重精神症状、频发的室性及室上性心律失常以及严重的急性过敏反应、肝功能失代偿、心肺功能不全等)要立即停止抗病毒治疗。
对于TD的长期可逆性仍然存在争议。有些报道显示所有的患者均呈现可逆性,另外一些在随访结束时仅部分可逆[14,15],但这些研究的随访多在1年以内。Doi[16]在日本439例CHC患者中,发现17例(3.9%)发生了TD,随访4~10年后,仍有9例患者病情持续。Carella[17]观察114例治疗前无甲状腺疾病证据的CHC患者,发现在Peg-IFN治疗结束后高水平的抗甲状腺自身抗体与患慢性甲状腺自身免疫性疾病危险性相关。治疗结束时TgAb和TPOAb共同存在是出现TD的预测因素。由于部分患者可出现慢性甲状腺炎,所以干扰素治疗相关的甲状腺自身免疫性疾病并不一定是完全可逆的。
有报道称,在IFN治疗过程中TD是获得较好疗效的预测因子[7,18],而本研究发现丙型肝炎患者在接受PR方案治疗后出现TD不影响抗病毒疗效,与多数文献报道符合[13,14,19,20]。
[1]中华医学会肝病学分会,中华医学会感染病学分会.丙型肝炎防治指南(2015更新版).中华肝脏病杂志,2015,23(12):906-923.
[2]Tomer Y,Blackard JT,Akeno N.Interferon alpha treatment and thyroid dysfunction.Endocrinol Metab Clin North Am,2007,6(4):105l-1066.
[3]Mandac JC,Chaudhry S,Sherman KE,et a1.The clinical and physiological spectrum of interferon-alpha induced thyroiditis:toward a new classification.Hepatology,2006,43(4):661-672.
[4]中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组.甲状腺疾病诊治指南-甲状腺功能减退症.中华内科杂志,2007,46(11):967-971.
[5]中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组.中国甲状腺疾病诊治指南-甲状腺功能亢进症.中华内科杂志,2007,46(10):876-882.
[6]OrságováI,RoZnovskyL,PetrousováL,etal.Thyroid dysfunction during interferon alpha therapy for chronic hepatitis B and C-twenty years of exper ience.Klin Mikrobiol Infekc Lek,2014,20(3):92-97.
[7]Hwang Y,Kim W,Kwon SY,et al.Incidence of and risk factors for thyroid dysfunction during peginterferon α and ribavirin treatment in patients with chronic hepatitis C.Korean J Intern Med,2015,30(6):792-800.
[8]周红霞,赵斗贵,姜树勤,等.干扰素联合利巴韦林治疗慢性丙型肝炎致甲状腺功能异常临床分析.中国肝脏病杂志(电子版),2014,6(1):71-74.
[9]王晗,谢娜,徐军,等.慢性丙型肝炎患者干扰素-α治疗后诱发甲状腺功能异常观察.解放军医学院学报,2015,12(11):1089-1092.
[10]PrummelMF,LaurbergP.Interferon-alphaandautoimmune thyroiddisease.Thyroid,2003,13(6):547-551.
[11]Moncoucy X,Leymarie F,Delemer B,et a1.Risk factors and long-term course of thyroid dysfunction during antiviral treatments in 221 patients with chronic hepatitis C.Gastroenterol Clin Biol,2005,29(4):339-345.
[12]方敏,邱国华,路遥,等.聚乙二醇化干扰素α-2a联合利巴韦林治疗慢性丙型肝炎合并甲状腺功能紊乱一例.中华实验和临床感染病杂志(电子版),2013,10(5):739-740.
[13]滕志兰,巩维进,张树青,等.聚乙二醇干扰素α-2a联合利巴韦林治疗慢性丙型肝炎合并慢性淋巴细胞性甲状腺炎的临床观察.中华肝脏病杂志,2013,21(2):101-104.
[14]TranHA,JonesTL,JannaEA,etal.Thenaturehistoryof interferon-alphainducedthyroiditisinchronichepatitisC patients;a long term study.Thyroid Res,2011,4(1):2.
[15]Vasiliadis T,Anaqnostis P,Nalmpantidis G,et al.Thyroid dysfunction and long-term outcome during and after interferon-alpha therapy in patients with chronic hepatitis C.Ann Acad Med Sinqapore,2011,40(9):394-400.
[16]Doi F,Kakizaki S,Takagi H,et al.Long-term outcome of interferon-alpha-induced autoimmune thyroid disorders in chronic hepatitis C.Liver Int,2005,25(2):242-246.
[17]Carella C,Mazziotti G,Morisco F,et al.Long-term outcome of interferon-alpha-inducedthyroidautoimmunityandprognostic influenceofthyroidautoantibodypatternattheendof treatment.J Clin Endocrinol Metab,2001,86(5):1925-1929.
[18]TranHA,JonesTL,GibsonR,etal.Thyroiddiseaseisa favorableprognosticfactorinachievingsustainedvirologic response in chronic hepatitis C undergoing combination therapy:A nested case control study.BMC Endo Diso,2011,11:10.
[19]马会乐,郭章林,邱国华,等.聚乙二醇化干扰素-α2a治疗慢性丙型肝炎并发甲状腺疾病患者的临床疗效观察.中国肝脏病杂志(电子版),2013,5(2):39-42.
[20]BarutS,GunalO,ErkorkmazU,etal.Thyroiddysfunctionin Turkish patients with chronic hepatitis C receiving peginterferon plus ribavirin in the period of 2005-2010.Braz J Infect Dis,2012,16(5):448-451.
(收稿:2016-04-12)
(本文编辑:陈从新)
Prevalence of thyroid dysfunction and its impact on virologic response in patientswithhepatitis Creceiving pegylated interferon-α and ribavirin
Zhu Fang,Yan Xuebing,Wang Jiameng,et al.
Department of Infectious Diseases,Xuzhou Medical College,Xuzhou 221002,Jiangsu Province,China
ObjectiveTo explore the prevalence of thyroid dysfunction in patients with chronic hepatitis C during pegylated interferon(Peg-IFN)combined with ribavirin(RVB)therapy and its impact on antiviral efficacy. Methods204 patients(HCV 1b infection in 173,2a in 9,3b in 2,and undefined in 20)with chronic hepatitis C who had normal thyroid function at the beginning of the study received the treatment of Peg-IFN combined with RBV.The regimen lasted for 48 weeks for patients with HCV 1 and undefined genotypes,and for 24 weeks for patients with genotype 2 and 3.Serum FT3,FT4,sTSH,Tg-Ab,TPOAb andTRAb were detected. ResultsThyroid dysfunction occurred in 43 patients(19.0%)during the PEG-IFN/RBV treatment,among whom 16.3%presentedwithhypothyroidism,39.5%withsubclinicalhypothyroidism,25.6%withhyperthyroidism,and 18.6%with subclinical hyperthyroidism.Thyroid dysfunction mainly occurred at 24 to 36 week treatment.At the end of observation,37 patients with thyroid dysfunction recovered spontaneously or after medical intervention,however,six patients with high serum titer of thyroid autoantibodies still needed close monitoring of thyroid function and sustained administration of anti-thyroid agents.Therewerenosignificantdifferencesas respect to RVR,EVR,ETVR andSVR between43 patients with thyroid dysfunction and 161 with normal thyroidfunction(P>0.05).ConclusionThyroid dysfunction occurs in patients with chronic hepatitis C duringPeg-IFN/RBVtreatment.Thethyroid dysfunctions are reversible,and do not influence the antiviral efficacy.
HepatitisC;Thyroidfunction;Pegylated interferon;Virologic response
10.3969/j.issn.1672-5069.2016.05.008
国家自然科学基金项目(编号:81371867);江苏省医学科技专项/新型临床诊疗技术攻关项目(编号:BL2014033);江苏省“科教兴卫”医学重点人才培养基金项目(编号:RC2011117);江苏省“六大人才高峰”项目(编号:2011-WS-068)
221002江苏省徐州市徐州医科大学/宿迁市第一人民医院感染病科(朱芳,费媛媛);徐州医科大学附属医院感染性疾病科(颜学兵);宿迁市钟吾医院感染病科(王家猛,周付成)
朱芳,女,29岁,硕士研究生,主治医师。E-mail:zhu606fang@126.com
颜学兵,E-mail:yxbxuzhou@126.com
