水杨酸法测定蔬菜水果中过氧化氢酶活性
2016-10-17樊航宏薛瑾瑾李志英任光明
樊航宏,薛瑾瑾,李志英,任光明
(忻州师范学院化学系,山西忻州034000)
水杨酸法测定蔬菜水果中过氧化氢酶活性
樊航宏,薛瑾瑾,李志英,任光明
(忻州师范学院化学系,山西忻州034000)
建立一种测定蔬菜水果中过氧化氢酶活性的新方法.在过氧化氢中加入过氧化氢酶分解部分过氧化氢,剩余的过氧化氢在酸性条件下与二价铁离子反应,产生的羟自由基与水杨酸反应生成紫色物质,该紫色物质最大吸收波长为510 nm,通过测定该物质含量来计算过氧化氢酶活性.结果表明:最佳反应条件为1mL pH=1的硫酸、4 mL硫酸亚铁溶液(1×10-3mol/L)、1mL过氧化氢溶液(0.003%)、2 mL水杨酸溶液(1×10-2mol/L),在40℃下反应10 min为最佳反应条件.测定的五种蔬菜水果中过氧化氢酶活性:土豆的过氧化氢酶的活性为4.96(μg/min);黄瓜的过氧化氢酶的活性为1.05(μg/min).
过氧化氢酶活性;过氧化氢;硫酸亚铁;水杨酸
过氧化氢酶(又称触酶),是一类广泛存在于动物、植物和微生物体内的末端氧化酶,其生物学功能是催化细胞内过氧化氢分解为H2O与O2,阻抑H2O2生成有害的·OH[1].其测定方法主要有碘量法[1]、紫外吸收法[2]、荧光分析法[3]、化学发光法[4]、极谱氧电极法[5]、简易气量测定法[6]等,基于过氧化氢易分解,所以直接检测过氧化氢来表示过氧化氢酶活性的测定方法准确度不高.
研究发现Fe2+在酸性条件下与过氧化氢反应会产生羟自由基(·OH),其反应式为:Fe2++H2O2→Fe3++ OH-+·OH,水杨酸与羟自由基反应的紫色产物在波长510 nm下有最大吸收峰[7-9],通过测定双氧水的减少量计算过氧化氢酶反应的过氧化氢量,从而建立检测过氧化氢酶活性的新方法.在强酸条件测定羟自由基,可同时终止酶解过氧化氢的反应,该方法快速、简单、环保,可用于学生基础实验和食品中过氧化氢酶的快速检测.
1 材料与方法
1.1仪器与试剂
新鲜的土豆、黄瓜、生菜、苹果、梨,均购于本地华美超市.双氧水30%(天津市永大化学试剂有限公司)、硫酸亚铁(天津市风船化学试剂科技有限公司)、水杨酸(天津市风船化学试剂科技有限公司)、石英砂.本实验所用试剂均为分析纯,水为二次蒸馏水.水样来自实验室自来水.
UV-2550紫外可见光谱仪(岛津公司,苏州),数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司).
1.2实验方法
1.2.1过氧化氢的标准曲线
取6支10 mL比色管,分别向其中加入0,0.2,0.4,0.6,0.8,1 mL过氧化氢溶液(0.003%),再向各管内加入1mL pH=1的硫酸、4 mL硫酸亚铁溶液(1× 10-3mol/L)、2 mL水杨酸溶液(1×10-2mol/L),用蒸馏水定容到刻度线,混匀.在40℃水浴锅内保温10分钟后,在波长510 nm下测定吸光值,记为A.以过氧化氢的质量为横坐标,吸光度为纵坐标绘制工作曲线.
1.2.2酶液的提取
称取新鲜被测植物组织0.5 g,置于研钵中,加入少量石英砂和2~3 mL蒸馏水,充分研磨成匀浆后,转入25 mL容量瓶内,并用蒸馏水冲洗数次研钵,合并冲洗液,并定容到刻度线,混匀后放置在5℃冰箱内静置10分钟.在4000 r/min下离心15分钟,上清液即为过氧化氢酶粗提液,于5℃冰箱内保存备用[10].
1.2.3酶活性测定
取4支10 mL比色管,分别加入1 mL过氧化氢酶粗提液液,在25℃水浴锅内预热10分钟后,逐管加入1mL过氧化氢溶液(0.003%),在25℃下保温.每隔1分钟取出一支比色管,迅速加入1mL pH=1的硫酸,终止反应.再向管内加入4 mL硫酸亚铁溶液和2 mL水杨酸溶液,用蒸馏水定容到10 mL,混匀,放在40℃水浴锅内保温10分钟.然后在波长510 nm下测定吸光值,记为As1、As2、As3、As4,对照组不加过氧化氢的其余组分溶液,每隔1 min测其吸光度,共测3次,取平均值记为Ab,并计算ΔA(ΔA=As-Ab).
1.2.4酶活性的计算方法
土豆过氧化氢酶的活性计算方法[11]:
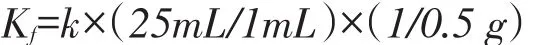
其中,Kf为过氧化氢酶活性值μg/min;k为ln(X0/X)—t图中直线的斜率,表示植物组织中过氧化氢酶分解过氧化氢的速率;25 mL为植物过氧化氢酶粗提液总体积,1 mL为反应液中酶液的加入量,0.5 g为称取植物组织的质量.
1.3统计分析
实验数据用origin 8.0软件处理,并用SPSS 17.0软件包进行差异显著性分析(P<0.05).
2 结果与讨论
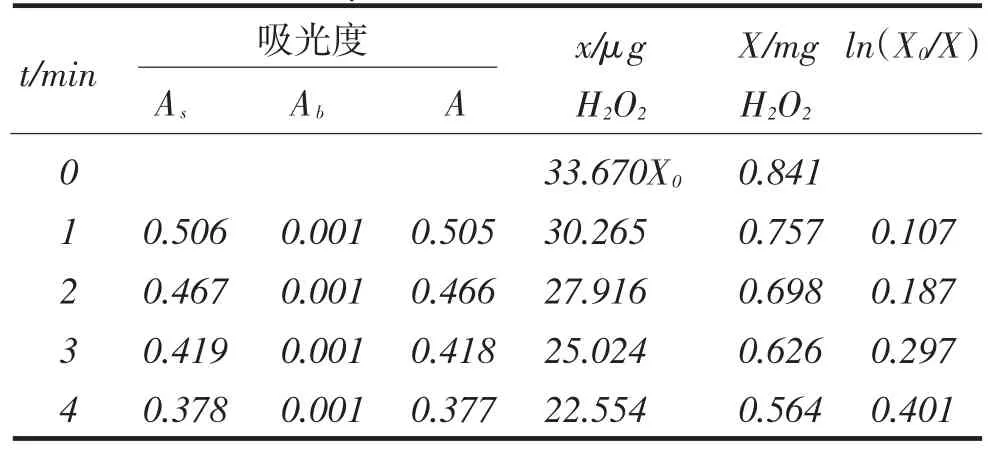
表1 与k值相关的实验数据Tab.1The experimental data related to k value
2.1线性关系的考察
按1.2.1标准曲线的方法,求得回归方程和相关系数分别为:y=0.0166x+0.0036,R2=0.9992,过氧化氢浓度在0~33.670 μg范围内呈良好的线性关系.
2.2硫酸亚铁浓度双氧水检测的影响
取7支10 mL比色管,按1.2.3的实验方法,保持其它条件不变(1 mL过氧化氢溶液、2 mL水杨酸溶液、pH=1的硫酸1 mL、反应时间为10 min、反应温度为40℃),只改变硫酸亚铁溶液为2、2.5、3、3.5、4、4.5、5、5.5 mL,考察硫酸亚铁浓度双氧水检测的影响,见图1.

图1 硫酸亚铁浓度对双氧水检测的影响Fig.1Effect of ferrous sulfate concentration on the detection of hydrogen peroxide
结果表明,在测定羟自由基时,硫酸亚铁的最佳加入量为4 mL.
2.3水杨酸浓度对双氧水检测的影响
取6支10 mL比色管,按1.2.3的实验方法,保持其它条件不变(1 mL过氧化氢溶液、4 mL硫酸亚铁溶液、pH=1的硫酸1 mL、反应时间为10分钟、反应温度为40℃)只改变水杨酸溶液的体积为0.5、1、1.5、2、2.5、3 mL,考查水杨酸浓度对双氧水检测的影响,结果如图2.
结果表明,在测定羟自由基时,水杨酸溶液的最佳加入量为2 mL.
2.4pH对双氧水检测的影响
取6支10 mL比色管,按1.2.3的实验方法,保持其它条件不变(1 mL过氧化氢溶液、4 mL硫酸亚铁溶液、2 mL水杨酸溶液、反应时间为10分钟、反应温度为40℃)只改变硫酸溶液的pH=1,2,3,4,5,6各1 mL考查pH对双氧水检测的影响,结果如图3.

图2 水杨酸浓度对双氧水检测的影响Fig.2Effect of salicylic acid concentration on the detection of hydrogen peroxide
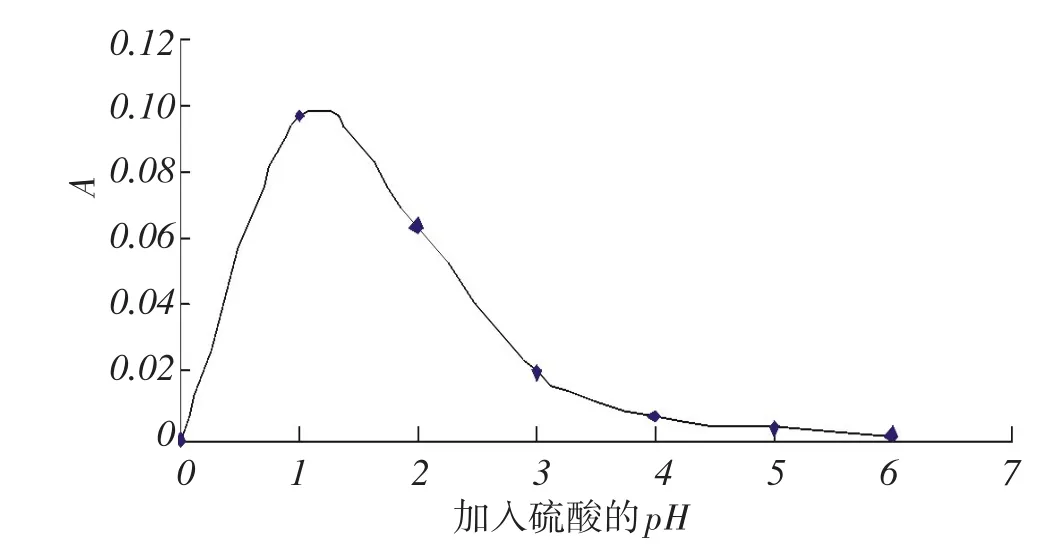
图3 pH对双氧水检测的影响Fig.3Effect of pH on the detection of hydrogen peroxide
结果表明,在测定双氧水时,加入pH=1的硫酸1 mL效果最佳,用pH计测定,pH位1.2,pH=1.0可以终止过氧化氢和过氧化氢酶的方法,本试验选择pH=1.2的硫酸溶液1 mL.
2.5时间对双氧水检测的影响
取6支10 mL比色管,按1.2.3的实验方法,保持其它条件不变(1 mL过氧化氢溶液、4 mL硫酸亚铁溶液、2 mL水杨酸溶液、反应温度为40℃)只改变反应时间为2、4、6、8、10、12、15 min,考查反应时间对双氧水检测的影响,结果如图4.结果表明,在测定双氧水时,最佳反应时间为10分钟.
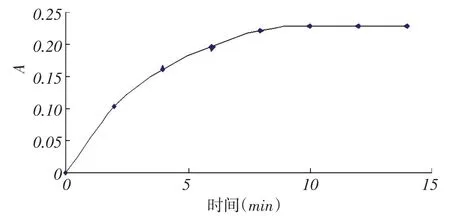
图4 时间对双氧水检测的影响Fig.4Effect of time on the detection of hydrogen peroxide
2.6温度对双氧水检测的影响
取6支10 mL比色管,按1.2.3的实验方法,保持其它条件不变(1 mL过氧化氢溶液、4 mL硫酸亚铁溶液、2 mL水杨酸溶液、反应时间为10分钟)只改变反应温度20℃、30℃、40℃、50℃、60℃、70℃.考查温度对双氧水检测的影响,结果如图5.
结果表明,在测定双氧水时,最佳反应温度为40℃.

图5 温度对双氧水检测的影响Fig.5Effect of temperature on the detection of hydrogen peroxide
2.7酶活性的测定
分别取处理后的样品土豆、黄瓜、生菜、苹果、梨0.5g,按1.2.1的方法提取,加入过氧化氢X0为33.670 μg,按1.2.3的实验方法测定△A,计算ln(X0/X),以时间t为横坐标,ln(X0/X)为纵坐标作图求的回归方程,根据1.2.4的试验方法计算反应速率k和过氧化氢酶酶活K,实验数据见表2.

表2 样品酶活的测定Tab.2The determination of enzyme activity of sample(μg/min)
用紫外分光光度法[2]直接测定土豆、黄瓜、生菜、苹果、梨五种蔬菜水果的过氧化氢酶活性,所得数据分别为4.87±3.5、1.02±3.2、4.21±0.8、1.45±1.5、2.40± 6.7 μg/min,统计分析表明,过氧化氢酶活没有显著性差异,新方法适用于蔬菜水果中过氧化氢酶活的测定.
3 结论
利用水杨酸法测定不同植物中过氧化氢酶活性的新方法,加入硫酸既可以终止过氧化氢酶分解过氧化氢,又满足水杨酸法测定过氧化氢的反应条件,同时简化了反应体系.对五种植物组织中过氧化氢酶进行测定,结果与紫外吸收光谱法比较,无显著性差异,但本法重现性好,检出线低,选择性好,适合于蔬菜水果中过氧化氢酶活的测定.
[1]郎杰朱,银硕.大米过氧化氢酶活性的2种测定方法比较[J].中国粮油学报,2014,29(2):89-93.
[2]杨兰芳,庞静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009,20:364-365.
[3]高吉刚,田玉新,邵光库,等.草莓和肥桃中过氧化氢酶活性的荧光法测定[J].山东农业大学学报,2006,37(4):573-576.
[4]方玲,孙才云,唐云明.大豆过氧化氢酶的分离纯化及性质研究[J].食品科学,2015,36(1):140-145.
[5]薛颖,刘平,刘泰然,等.酶-氧电极测定固体食品中H2O2方法的研究[J].卫生研究,2006,35(3):313-315.
[6]潘建国,王开发,郑尧隆,等.用Warburg法测定蜂花粉中过氧化氢酶活性[J].植物学通报,2008,18(4):505-508.
[7]李志英,李国平,马莉.微波-β-环糊精协同提取茶叶中茶多酚及抗氧化性的研究[J].食品工业科技,2012,33(8): 201-203.
[8]刘红,胡咸俊,王维,等.热带植物花卉的抗氧化性研究[J].海南师范学院学报,2007,20(4):339-341.
[9]刘红.三种调味液对即食鱼品的抗氧化作用[J].海南师范学院学报,2001,13(1):70-73.
[10]Liu J R,Ye Y L,Lin T Y,et al.Effect of floral sourceson the antioxidant,antimicrobial,and anti-inflammatoryactivi⁃ties of honeys in Taiwan[J].Food Chemistry,2013,139(4): 938-943.
[11]杜冰,王萌,程妮,等.一种测定蜂蜜中过氧化氢酶活性的改进方法[J].食品与发酵工业,2013,39(11):227-230.
责任编辑:刘红
Determining the Activity of Catalase in Vegetable and Fruit by Using the Salicylic Acid Method
FAN Hanghong,XUE Jinjin,LI Zhiying,REN Guangming
(Department of Chemistry,Xinzhou Normal University,Xinzhou 034000,China)
A new method for determining the activity of catalase was established.Catalase can promote the decomposition of hydrogen peroxide,and in acidic conditions,the unreacted hydrogen peroxide can react with ferrous iron and generate the hydroxyl radicals,which can react with salicylic acid and produce the purple material,and the maximum absorption wave⁃length of the purple material is 510 nm.Further,the activity of catalase was calculated by determining the content of the pur⁃ple material.The result of the experiments is that:with the 1mL sulfate(pH=1),4mL solution of sulfate ferrous(1×10-3mol/ L),1 mL of solution of hydrogen peroxide(0.003%),2 mL of solution of salicylic acid(1×10-2mol/L),at 40℃and reaction of 10 minutes are the optimum reaction conditions.Five kinds of plant tissues were determined,and the results showed that the potato catalase activity was the highest(4.96μg/min)and the cucumber catalase activity was the lowest(1.05 μg/min).
Catalase activity;hydrogen peroxide;ferrous sulphate;salicylic acids
TS 202.1
A
1674-4942(2016)01-0061-04
2015-09-17
山西省物理化学重点扶持学科项目(20141010);忻州师范学院大学生科技创新项目(2015885)
