手性离子液体修饰纳米金粒子用于酪氨酸对映体的手性识别
2016-10-16陈毅挺李艳霞刘四杰
黄 露, 陈毅挺, 李艳霞, 刘四杰
(闽江学院化学与化学工程系,福建福州 350108)
由于手性物质的两个对映体通常具有不同的生物活性,手性分析引起了人们越来越多的关注。当前,用于手性识别或拆分的方法,主要包括液相色谱、气相色谱、毛细管电泳、电化学等。然而,上述方法大多耗时、成本高,不能用于食品安全、环境等领域的实时、实地检测。因此,开发新的快速、高效、灵敏的手性识别方法对于药学、农学、环境和食品等科学领域研究都具有十分重要的意义。
金纳米粒子,由于其稳定性好、合成方法简单、消光系数高、表面等离子共振强等,其在手性识别和拆分领域的研究越来越多。例如,金纳米粒子制备的手性固定相被用于液相色谱[1,2]、毛细管电泳[3]和微流控芯片[4,5]手性拆分药物对映体;β- 环糊精修饰的金纳米粒子作为假固定相或是涂层固定相被用于毛细管电泳手性拆分药物对映体[6,7];N-乙酰-L-半胱氨酸[8]、半胱氨酸[9 - 11]修饰的金纳米粒子被用于手性化合物的光度手性识别;金纳米粒子修饰在电极表明上可用于手性化合物的电化学手性识别[12 - 15]。
对于手性识别,关键在于构建手性纳米材料。而创建手性最普遍和有效的方法就是将手性分子修饰到纳米材料表面。本文将手性离子液体1-乙基-3-甲基咪唑L-酒石酸盐(EMIML-Tar)作为修饰剂,氯金酸为原料,硼氢化钠为还原剂,采用化学还原法合成了金纳米粒子。并以酪氨酸(Tyr)对映体作为对象,研究了酪氨酸对映体与金纳米粒子相互作用后的光谱行为,建立了一种手性识别Tyr对映体的新方法。
1 实验部分
1.1 主要仪器和试剂
UV2450紫外-可见分光光度计(岛津仪器苏州有限公司);TECNAI G2F20场发射透射电子显微镜(美国,FEI公司);iS5红外光谱仪(美国,尼高力公司);pHS-3C台式pH计(上海仪电科学仪器股份有限公司);HX50照相机(索尼)。
D -Tyr和L-Tyr(纯度99%,上海源叶生物科技有限公司);1-乙基-3-甲基咪唑L-酒石酸盐(EMIML-Tar)(纯度99%,上海成捷化学有限公司);硼氢化钠、氯金酸(分析纯,国药集团化学试剂有限公司);其他试剂均为分析纯。
1.2 手性离子液体修饰金纳米粒子的制备
将配制好1%氯金酸、1.0×10-3mol/L EMIML-Tar母液,放于冰箱中冷藏待用。采用化学还原方法合成纳米金。首先移取0.4 mL 1%氯金酸于250 mL的烧杯中,然后加入99.4 mL的纯净水,接着加入0.1 mL 1.0×10-3mol/L EMIML-Tar,室温下磁力搅拌20 min,加入新鲜冰水配制的0.3 mol/L硼氢化钠0.1 mL,从而得到EMIML-Tar修饰的金纳米粒子(EMIML-Tar-AuNPs)。从红外光谱图(图略)可见,修饰后的金纳米粒子在1 625 cm-1处出现C=C特征吸收峰,1 542 cm-1处出现C=N特征吸收峰,说明EMIML-Tar已被修饰到金纳米粒子上。
1.3 D -Tyr和L-Tyr的手性识别
分别配制浓度为2.5、6.25、12.5、18.8、25.0、62.5、125、188、250 μmol/L的D -Tyr和L-Tyr溶液。依次取0.5 mL配制好的上述溶液加到1.5 mL EMIML-Tar-AuNPs胶体中,放置10 min后,通过紫外-可见分光光度计研究各组胶体最大吸收波长变化,结合胶体颜色实现对D -Tyr和L-Tyr的选择性手性识别。
2 结果与讨论
2.1 EMIML-Tar-AuNPs表征
图1A为EMIML-Tar-AuNPs的透射电镜(TEM)图。从图中可以看出,EMIML-Tar-AuNPs呈较规则的球形,分散均匀。图1B给出了随机选取100个EMIML-Tar-AuNPs的粒径分布图。从图中可以看出,EMIML-Tar-AuNPs的粒径主要集中在5.5~7.5 nm之间,平均粒径约为6.5 nm。
2.2 紫外-可见吸收光谱分析
将1.25 mmol/L D -Tyr和L-Tyr加入到EMIML-Tar-AuNPs胶体中,观察胶体颜色并进行紫外可见分光光度分析(图2)。从图中可以看出,EMIML-Tar-AuNPs胶体中加入D -Tyr后,胶体颜色几乎没有变化,而加入L-Tyr后,胶体颜色从初始的红色转变成蓝紫色。同时,通过紫外可见分光光谱可以看到,L-Tyr的加入使得纳米金胶体的波峰发生明显展宽及红移,而加入D -Tyr时,波峰红移和展宽现象不明显。这说明了EMIML-Tar-AuNPs对D -Tyr和L-Tyr的响应具有明显的不同。
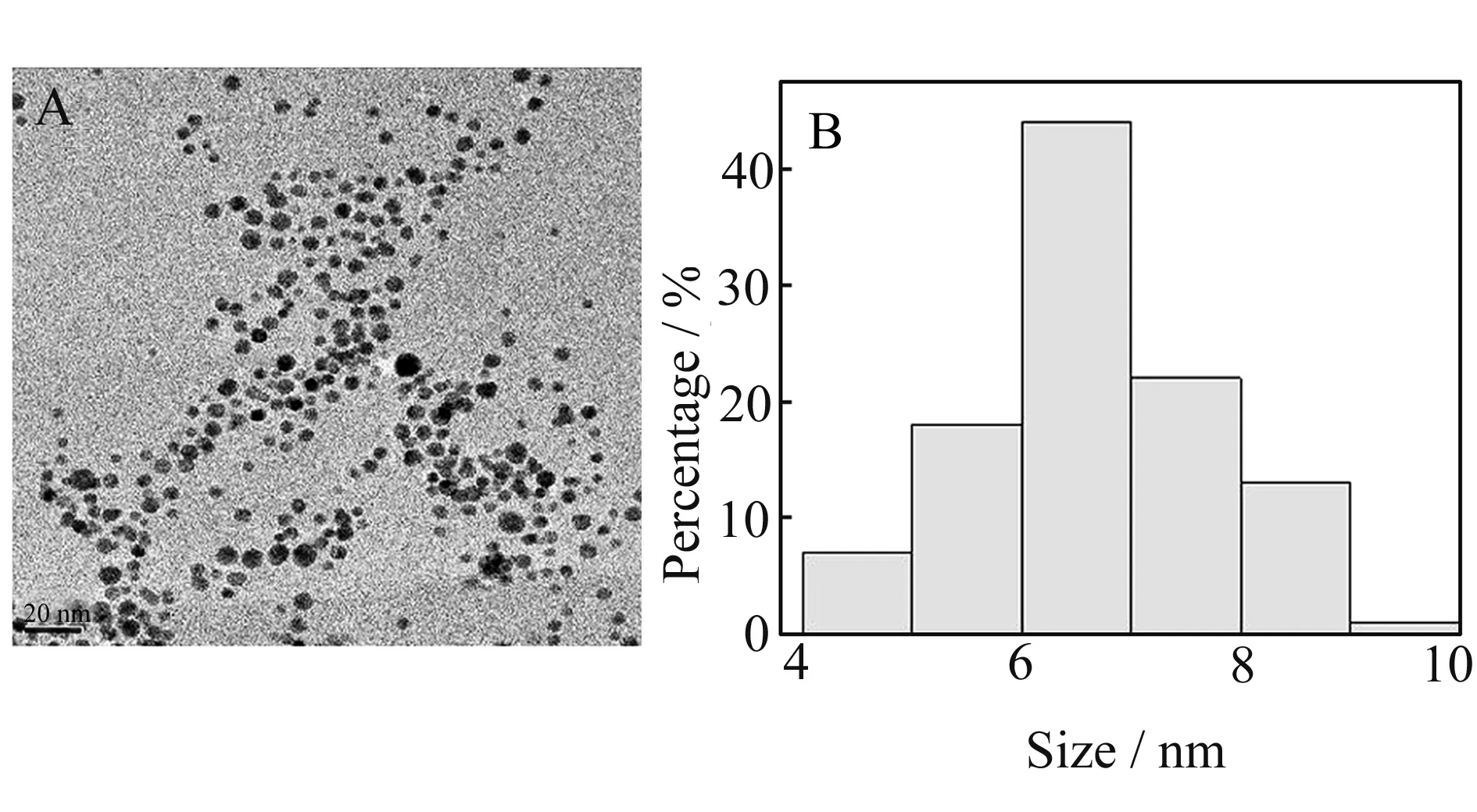
图1 EMIML-Tar-AuNPs的TEM图(A)和粒径分布图(B)Fig.1 The TEM image(A) and size distribution(B) of EMIML-Tar-AuNPs
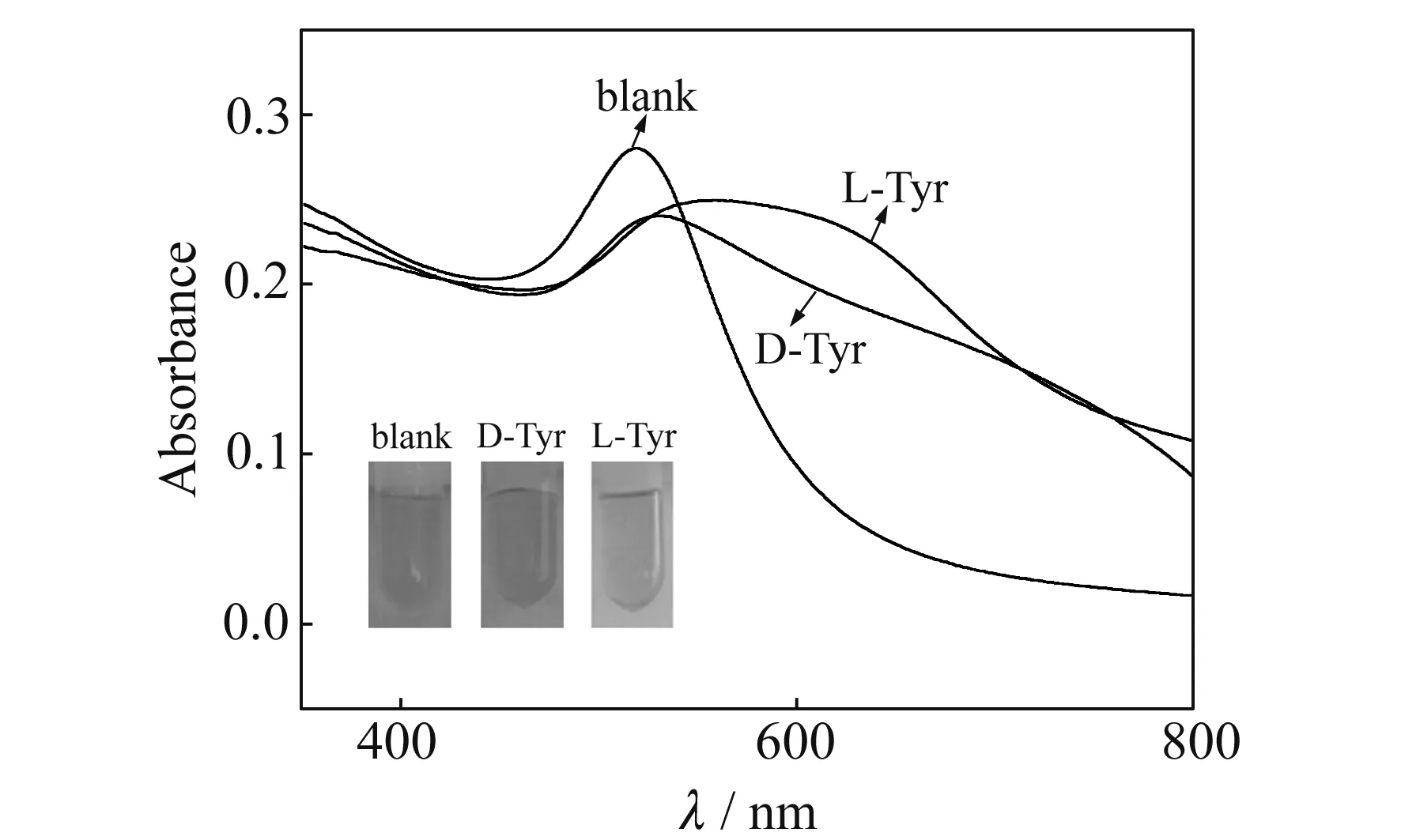
图2 添加D -Tyr或L-Tyr的EMIML-Tar-AuNPs的颜色图及紫外可见光谱图Fig.2 Photographs and UV-Vis spectra of EMIML-Tar-AuNPs in the presence of D -Tyr or L-Tyr experimental conditions:1.5 mL EMIML-Tar-AuNPs added with 0.5 mL 1.25 mmol/L D -Tyr or L-Tyr.
图3A和3B分别给出了不同浓度的D -Tyr和L-Tyr与EMIML-Tar-AuNPs相互作用后的紫外-可见光谱图。从图中可以看出,加入D -Tyr后,胶体紫外-可见光谱图在520 nm附近会出现最大吸收峰,峰值吸光度在0.2上下波动,波峰较窄,且没有展宽的趋势;与加入D -Tyr相比,加入同浓度的L-Tyr之后,胶体的最大吸收峰值变化不大,但是它的峰宽较宽,光谱图扩展趋势明显。
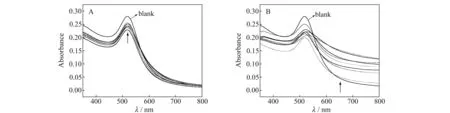
图3 不同浓度D -Tyr(A)和L-Tyr(B)与EMIML-Tar-AuNPs混合后的紫外-可见光谱图Fig.3 UV-Vis spectra of EMIML-Tar-AuNPs mixed with D -Tyr and L-Tyr of different concentrations experimental conditions:2.5,6.25,12.5,18.8,25,62.5,125,188,250 μmol/L.
由于EMIML-Tar-AuNPs胶体的最大吸收峰在520 nm,而加入D -Tyr和L-Tyr后,胶体的紫外光谱图在650 nm处呈现出明显差异性,因而实验用650 nm和520 nm的吸光度比值来衡量EMIML-Tar-AuNPs的性能。从图4中可以看出,加入L-Tyr的胶体在650 nm和520 nm处的吸光度比值明显高于加入同浓度D -Tyr的胶体。另外,随着L-Tyr浓度的增大,A650/A520首先小幅度减小,到18.8 μmol/L后,A650/A520开始大幅度增加;而D -Tyr各浓度的A650/A520数值变化不大。该结果进一步证实了利用EMIML-Tar-AuNPs能够对D -Tyr和L-Tyr进行手性识别。
另外,浓度在15~150 μmol/L和150~1 500 μmol/L范围内,其浓度对数值与A650/A520比值存在线性关系,其线性方程分别为:A650/A520=0.1919lgc+1.2941(R2=0.9924),A650/A520=0.6433lgc+3.051(R2=0.9964)。
2.3 TEM分析
图5给出了EMIML-Tar-AuNPs胶体中加入D -Tyr和L-Tyr后的TEM图。由图5A和图1A对比可知,加入D -Tyr后,TEM图无较大变化,纳米金粒子分散情况好,无团聚;而图5B中,纳米金粒子间相互靠拢,出现较大颗粒,有团聚现象。这表明L-Tyr可使纳米金粒子发生团聚。
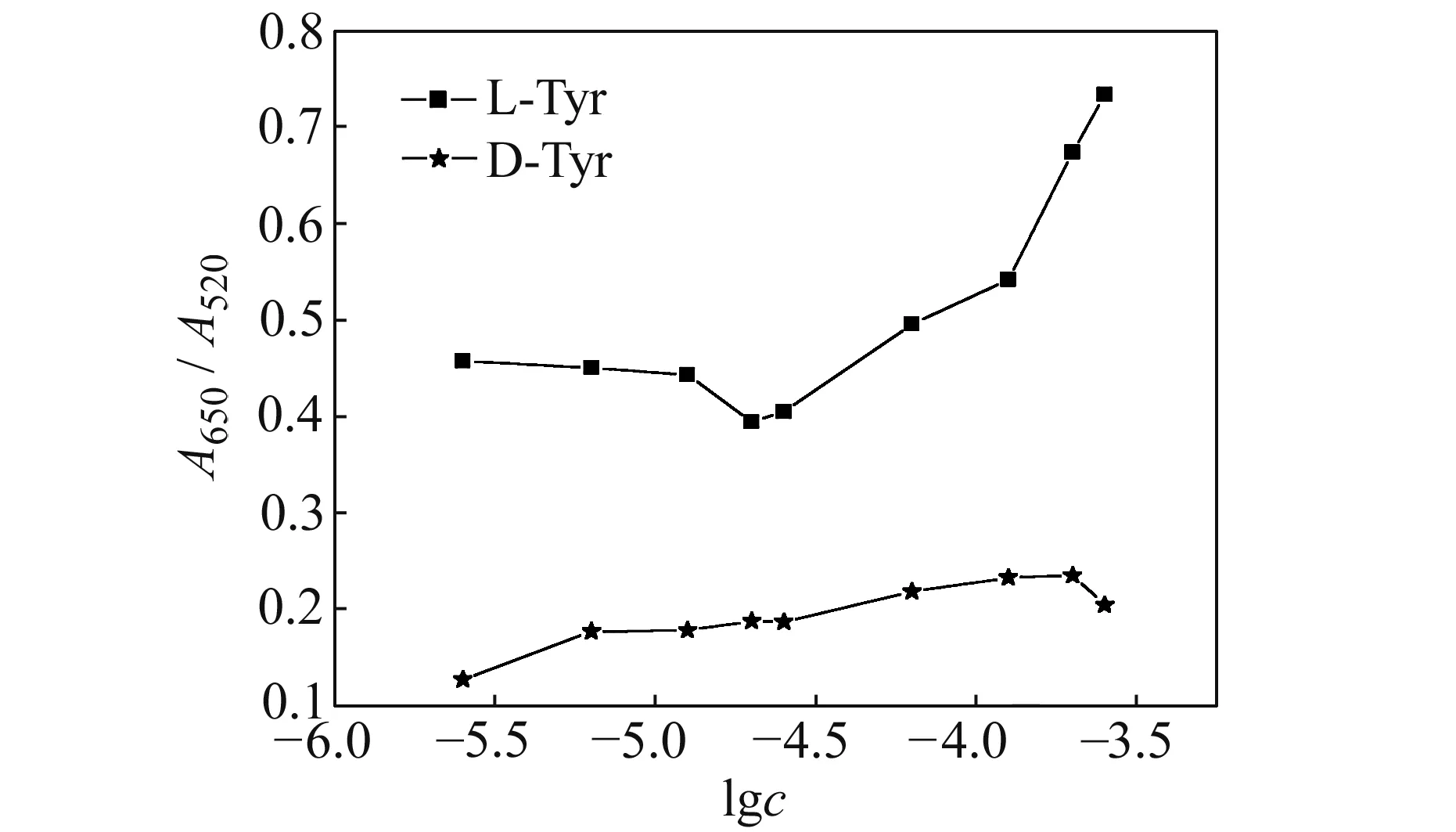
图4 A650/A520与2.5~250 μmol/L D -Tyr和L-Tyr的浓度对数图Fig.4 The plot of A650/A520 versus logarithm of D -Tyr and L-Tyr concentration over the range of 2.5 to 250 μmol/L
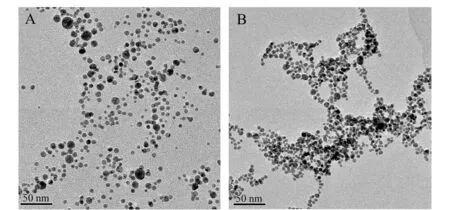
图5 经过D -Tyr(A)和L-Tyr(B)处理后的EMIML-Tar-AuNPs的TEM图Fig.5 TEM images of EMIML-Tar-AuNPs after treatment with D -Tyr(A) and L-Tyr(B) experimental conditions as shown in Fig.3.
综上所述,金胶体的颜色变化主要是L-Tyr引发的纳米粒子间的团聚所造成(从TEM图中可以得到证实)。本实验的手性选择性主要依赖于EMIML-Tar-AuNPs与L-Tyr在分子水平上发生的化学相互作用。在简单的双分子体系中,三点接触模型是手性识别当中最常用到的。因此,参照三点接触模型提出了EMIML-Tar-AuNPs与L-Tyr可能的相互作用模式:L-Tyr通过羧基、氨基和羟基与EMIML-Tar发生静电和氢键相互作用,从而导致金纳米粒子的团聚。手性选择性可能是由于L-Tyr的结构比D -Tyr的结构更易于与EMIML-Tar发生相互作用造成的。
3 结论
本文利用EMIML-Tar修饰的纳米金溶液对D-和L-酪氨酸进行手性识别。实验对合成纳米金条件进行了优化,并在最佳条件下,对系列浓度D-和L-酪氨酸标准溶液,以及混合D-和L-酪氨酸溶液进行紫外-可见分光光度分析。实验结果表明,EMIML-Tar修饰的纳米金溶液可以较好地对D-和L-酪氨酸进行手性识别,该方法灵敏度高、测定时间短,有望用于其他药物对映体的手性识别。
