呋喃妥因分子印迹电化学传感器的制备及应用
2016-10-16谭学才杨素平黄翠玉吴佳雯李晓宇李鹏飞余会成李小燕雷福厚
胡 琪, 谭学才, 杨素平, 黄翠玉, 吴佳雯, 李晓宇, 李鹏飞, 余会成, 李小燕, 雷福厚
(广西民族大学化学化工学院,广西林产化学与工程重点实验室,广西高校食品安全与药物分析化学重点实验室,广西南宁 530008)
呋喃妥因(Nitrofurantoin,NTF)是抗菌类药物,广泛应用于尿道细菌感染。目前,检测NTF的主要方法有分光光度法[1,2],原子吸收法[3]、高效液相色谱法[4 - 6]、极谱法[7]、光纤传感器[8]和电化学伏安法[9]等。电化学检测与分子印迹技术[10,11]结合能很好的解决灵敏度、选择性的问题。本文利用自制的马来松香丙烯酸乙二醇酯(EGMRA)为交联剂,以甲基丙烯酸为功能单体,NTF为模板分子,制备分子印迹聚合膜,采用差分脉冲伏安(DPV)法测定,实现了对NTF肠溶片样品中NTF的检测。
1 实验部分
1.1 仪器与试剂
CHI760D电化学工作站(上海辰华仪器公司),三电极系统:玻碳电极(GCE,Φ=3.0 mm)、印迹或非印迹电极为工作电极,饱和Ag/AgCl电极为参比电极,铂柱电极为对电极;DZF-6021型真空干燥箱(上海精宏实验设备有限公司)。
NTF(分析纯,中国药品生物制品检定所);呋喃西林(分析纯,中国药品生物制品检定所);盐酸氨基脲、呋喃它酮、呋喃唑酮均为分析纯,购买于阿拉丁试剂公司;甲基丙烯酸(分析纯,Sigma公司);马来松香丙烯酸乙二醇酯(EGMRA,自制),其余试剂均为分析纯。实验用水为二次蒸馏水。
1.2 印迹及非印迹电极的制备
在25 mL烧杯中加入适量9∶1的N,N-二甲基甲酰胺(DMF)和无水乙醇,称取0.1 mmol NTF模板分子,然后依次加入0.4 mmol的甲基丙烯酸、0.8 mmol EGMRA和0.0072 g偶氮二异丁腈(每加入一种试剂均超声溶解5 min)。取2 μL NTF溶液滴涂于预处理好的裸电极表面,将该电极放入60 ℃真空干燥箱内反应4 h。将热引发聚合后的电极置于DMF-甲醇-乙酸(8∶1∶1,V/V)溶液中洗脱,直至洗脱之后的印迹电极峰电流不变,将印迹电极(MIP)保存于水中待用。非印迹电极(NIP)的制作除不加模板分子外,其余步骤同上。
1.3 检测方法
采用循环伏安(CV)法、差分脉冲伏安(DPV)法、交流阻抗(EIS)法对印记电极进行表征。测定溶液为5.0×10-3mol/L K3[Fe(CN)6]-0.10 mol/L KCl(pH=4.0),实验所用溶液均需通氮气除氧处理。
2 结果与讨论
2.1 实验条件的优化
2.1.1模板去除溶剂及洗脱时间的选择分别考察了体积比为3∶7、4∶6、5∶5的DMF-水溶液,体积比为5∶4∶1的DMF-乙酸-水溶液,体积比为1∶9、2∶8的乙酸-甲醇溶液,体积比为8∶1∶1的DMF-乙酸-甲醇溶液。结果发现,体积比为8∶1∶1的DMF-乙酸-甲醇溶液可快速有效地去除模板分子。实验选择10 mL体积比为8∶1∶1的DMF-乙酸-甲醇溶液为去除模板的洗脱剂。对印迹电极进行磁力搅拌洗脱,结果发现,随洗脱时间不断增加,NTF溶出而留下的“空穴”就越多,探针峰电流就越大。当洗脱50 s后,K3[Fe(CN)6]峰电流变化并不显著,表明聚合膜中的NTF已全部溶出。故选择50 s为最佳的洗脱时间。
2.1.2支持电解质pH的选择在0.10 mol/L KCl溶液中加入不同体积的0.10 mol/L HCl或0.10 mol/L NaOH溶液调节其pH值分别为4.0、5.0、6.0、7.0、8.0和9.0。实验结果表明,碱性太强会破坏印迹膜的稳定性导致模板分子的识别能力下降。实验结果发现,当溶液的pH值为4.0时,峰形较为理想,而且响应电流最大。因此选择测试底液的pH值为4.0。
2.1.3孵化时间的选择实验结果表明,随着孵化时间从5 s逐渐增加到60 s时,印迹传感器对探针分子的氧化峰电流不断地降低。这表明随着孵化时间的增加,模板分子与印迹膜中的“空穴”能重新结合,导致洗脱之后的印迹电极表面的“空穴”被封闭。当孵化时间超过60 s时,峰电流变化趋于平衡,说明NTF分子在印迹膜中的识别能力已经饱和,故选用60 s为最佳孵化时间。
2.2 分子印迹膜电化学表征
2.2.1不同电极的循环伏安图和差分脉冲伏安图图1是裸GCE(a)、去除模板分子后的印迹电极(b)、加入1.5×10-6mol/L NTF与印迹电极作用后(c)、加入2.0×10-6mol/L NTF与印迹电极作用后(d)、非印迹电极(e)的CV图及DPV图。由图可知,探针分子在裸GCE上有较大的峰电流;去除模板分子后,印迹电极表面形成了印迹“空穴”,使电化学传感器上出现了小于裸GCE上的峰电流;然而加入不同浓度的NTF与印迹电极作用后,NTF会进入空穴中,从而阻碍探针分子的电子传递速率,高浓度的NTF扩散能快速结合从而阻碍就更大;而在洗脱之后的非印迹电极的表面不会出现印迹空穴,因而洗脱之后的非印迹电化学传感器上基本上没有峰电流出现。
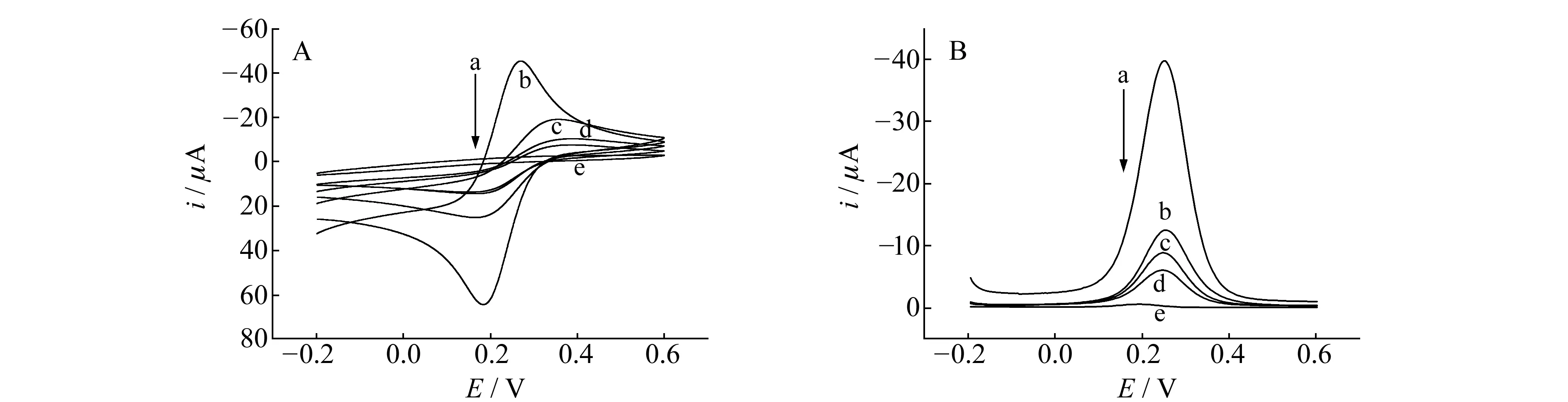
图1 不同电极在5.0×10-3 mol/L [Fe(CN)6]-3/-4(含0.1 mol/L KCl,pH=4.0)中循环伏安图(A)及差分脉冲伏安图(B)Fig.1 Cyclic voltammograms (A) and different pulse voltammograms (B) of different modified electrodes in 5.0×10-3 mol/L [Fe(CN)6]-3/-4 solution containing 0.1 mol/L KCl(pH=4.0)the bare GCE(a),after removal of the NTF(b),after interaction with 1.5×10-6 mol/L NTF(c),after interaction with 2.0×10-6 mol/L NTF(d) and nMIPs-electrode(e).
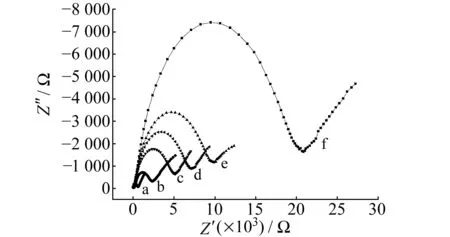
图2 不同电极的交流阻抗图Fig.2 Electrochemical impedance spectroscopy of different modified electrodes the bare GCE(a),after removal of the NTF(b),after interaction with 5.0×10-6 mol/L NTF(c),after interaction with 8.0×10-6 mol/L NTF(d),after interaction with 5.0×10-5 mol/L NTF(e) and nMIPs-electrode(f).
2.2.2不同电极的交流阻抗图图2是不同电极的交流阻抗(EIS)图。从图中可以看到,裸GCE的EIS半圆直径非常小,表明对探针分子有很小的电子转移阻抗;印迹电极去除模板分子后,会形成了“空穴”但其非孔穴部分会覆盖电极表面,从而使电极的阻抗值有所增大;在印迹电极测试时候,加入不同浓度的NTF,NTF模板分子会和印迹膜孔穴发生识别,从而封闭印迹“空穴”,高浓度的模板分子能快速和印迹膜发生结合,因而使电极的阻抗值出现不同的情况;洗脱之后的非印迹电极的阻抗变化表明,洗脱之后的非印迹电极表面不能形成印迹孔穴,从而使电化学传感器的阻抗值最大。这与图1中的CV图十分吻合。
2.2.3传感器的响应特征实验结果表明(图3),在8.0×10-8~5.0×10-6mol/L浓度范围内,[Fe(CN)6]3-/4-氧化峰电流与NTF的浓度呈良好的线性关系,其线性回归方程为:ip(μA)=10.209-0.0186c(10-8mol/L),相关系数为0.9939,检出限为6.5×10-8mol/L。该传感器具有更高的灵敏度,且制作简便价格低廉。
2.2.4传感器的选择性实验考察了印迹和非印迹传感器的选择性。由图4可知,NTF在印迹电极上的响应电流(△i)最大,对NTF分子有较好的识别的能力。而非印迹电极在NTF及其类似物中响应电流(△i)均非常小且差别不大,表明非印迹膜电极不具备特异性识别能力。
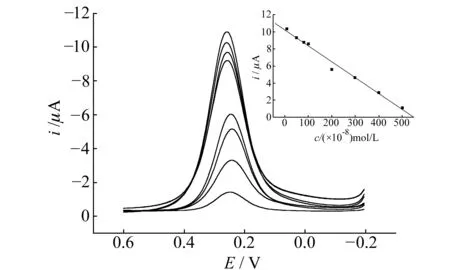
图3 不同浓度NTF的差分脉冲伏安图(内插图为峰电流与NTF浓度的校正曲线)Fig.3 Different pulse voltammograms of different NTF concentration;Inset shows the linear relation between peak current and the concentration of NTF NTF concentrations are 8.0×10-8,5.0×10-7,8.0×10-6,1.0×10-6,2.0×10-6,3.0×104,4.0×10-6 and 5.0×10-6 mol/L(from up to low),respectively.
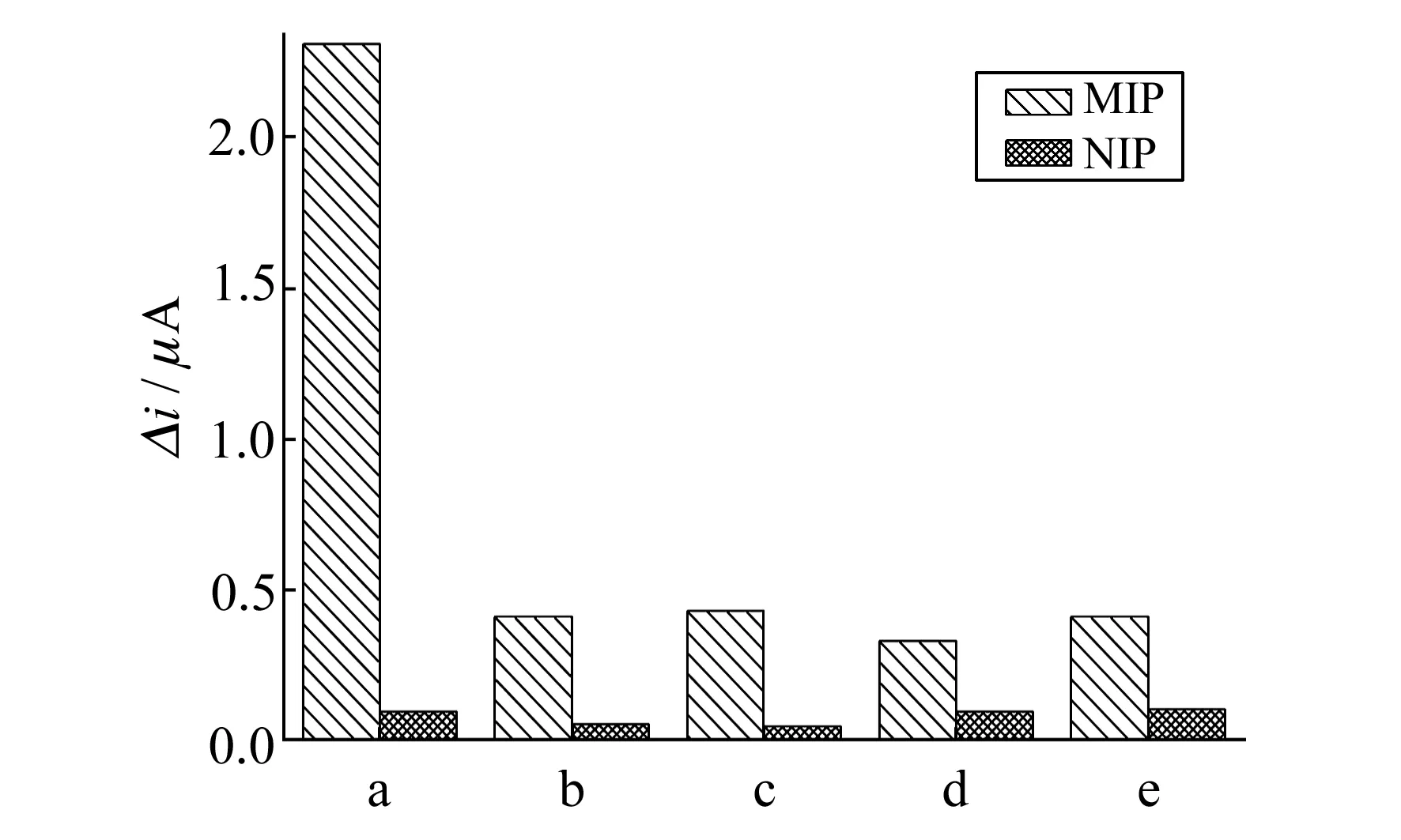
图4 印迹膜电极和非印迹膜电极对不同物质的选择性响应Fig.4 The selective response of the MIP and NIP electrochemical sensors to NTF(a),furaltadone(b),furazolidone(c),furacilinum(d),semicarbazide hydrochloride(e) with the same concentration of 1.0×10-6 mol/L
2.2.5传感器的重现性和稳定性用同一根电极对1.0×10-8mol/L的NTF溶液平行测定20次,其相对标准偏差为1.9%,说明该传感器的重现性较好。将使用过的电极用洗脱液重新洗涤,然后将其保存于水中,47 d后进行测试,其响应电流下降了3.3%,说明了该传感器的稳定性良好。
2.3 实际样品分析
取NTF药片3片(山西汾河制药,标示含量50 mg/tablet),称量之后研细。准确称取药粉0.0196 g(约含有NTF 10 mg),加DMF溶解并定容于25 mL容量瓶中。采用标准加入法进行药品含量以及回收率测定。其测定结果见表1,回收率在96.6%~101.6%之间。
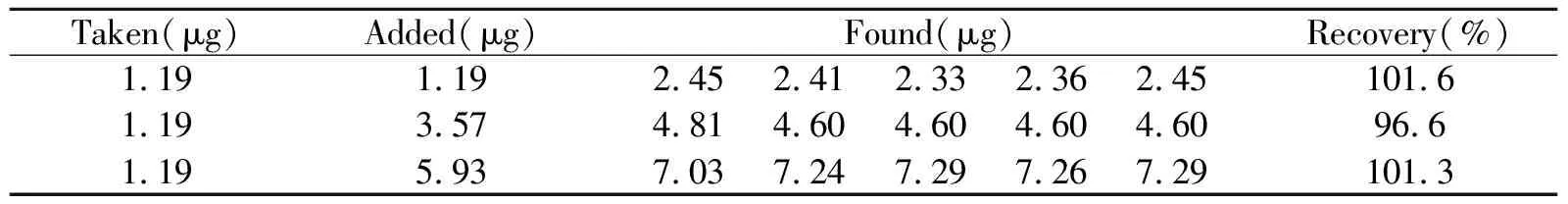
表1 回收率测定
3 结论
本文制备的NTF分子印迹传感器具有良好的选择性,快速结合模板分子能力和稳定性,制作方法简便易行,应用于肠溶片中的回收率检测,获得了较好的结果。
