基于量子点标记的适配体技术在分析检测中的研究进展
2016-10-16李梦华褚先锋豆小文杨美华孔维军欧阳臻
李梦华, 褚先锋, 豆小文, 杨美华*, 孔维军, 欧阳臻
(1.江苏大学药学院,江苏镇江 212013;2.中国医学科学院,中国协和医科大学,药用植物研究所 北京 100193)
1 前言
量子点(Quantum Dots,QDs),又称半导体纳米粒子(Semi-conductor Nanoparticles),是由Ⅱ-Ⅵ族元素或Ⅲ-Ⅴ族元素组成,且三个维度尺寸都小于100 nm的纳米微晶体。由于其直径小于或接近激子波尔半径而表现出独特的物理性质,如量子尺寸效应、表面效应、宏观量子隧道效应等。自Alivisatos小组[1]和Nie小组[2]解决了量子点生物相容性的难题以来,量子点以颜色丰富、光化学性质稳定、抗漂白能力强等优势备受关注,并逐步应用于重金属[3,4]、真菌毒素[5]、农药[6 - 8]及其他小分子污染物的痕量分析。
适配体(Aptamer)是经指数富集配体系统进化技术(SELEX)体外筛选而获得[9],且能与靶物质特异并紧密结合的一小段RNA或DNA单链寡核苷酸序列[10]。适配体与靶物质之间的识别、结合原理与抗体相似,有着“化学抗体”的美誉,但适配体在很多性能方面都超越了抗体,如稳定性强、易于功能化修饰与标记、设计简单及成本低等。因此,适配体被广泛应用于蛋白质研究[11]、药物分析[12,13]、病毒检测[14,15]等领域。
适配体特异性识别靶物质后,本身并不具有将识别信息转换为可检测信号的能力,而荧光物质可作为标记物与适配体相结合,将信息转换为可检测信号。传统的荧光染料在检测过程中表现出易淬灭、瞬时即逝等缺点,量子点以独特的优势[16 - 19](表1)弥补了传统荧光染料带来的不足,提高了分析检测的灵敏度,并实现了多组分的同时检测。因此,将量子点的光学特异性与适配体特异性识别技术相结合,提供了高效、简便、快速、灵敏、高通量的分析检测平台。本文介绍了量子点的合成方法及其与适配体的偶联,综述了近几年基于量子点标记的适配体技术在生物分子、病原微生物、细胞、生物毒素方面的应用,总结了该技术在应用方面存在的问题,并提出该技术面临的挑战,以期新技术在复杂基质样品检测中发挥巨大的潜力。
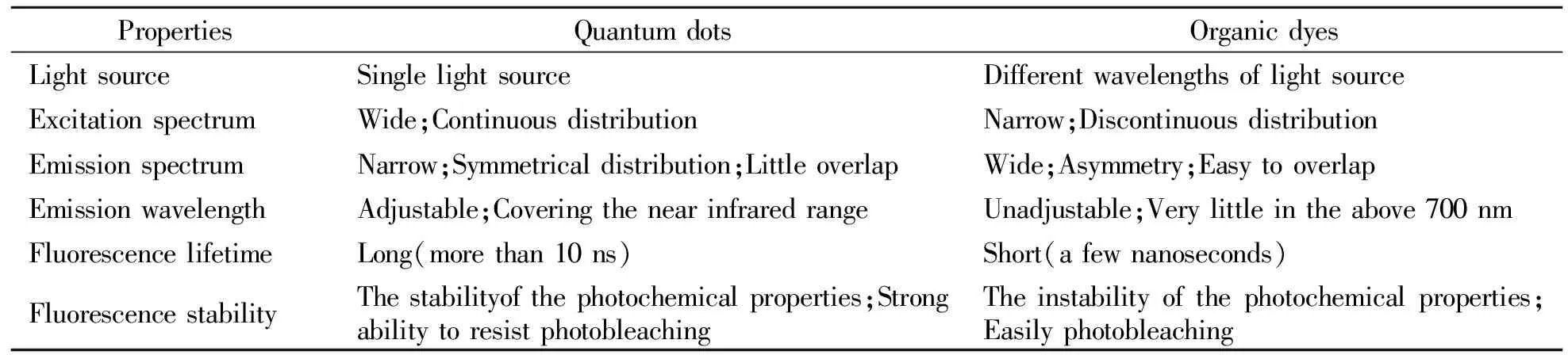
表1 量子点与有机荧光染料特性比较[16 - 19]
2 量子点的合成
目前,研究较多的量子点有Ⅱ-Ⅵ族(CdS、CdSe、CdTe、ZnSe等)和Ⅲ-Ⅴ族(CaAs、InAs等),其中Cd系量子点是最具有特色的量子点体系之一。量子点的合成方法有很多,根据合成所用溶剂的不同,一般可将量子点的合成分为有机相合成法和水相合成法。
2.1 有机相合成法
有机相合成法是基于有机物与金属化合物之间的反应而进行的。传统方法使用的前驱体,如二甲基镉(Cd(CH3)2))大多具有毒性高,危险性高,且价格昂贵等缺点。Peng 等[20]对传统有机合成方法进行了优化,以CdO作为前驱体代替Cd(CH3)2,一步合成了高荧光产率的CdS、CdTe、CdTe量子点,使量子点的合成安全化,并大大缩短了反应时间。
随着量子点合成方法的改进,价格低廉、绿色环保的试剂逐渐代替配位化合物三辛基氧化膦(Trioctylphosphine Oxide,TOPO)、三辛基膦(Trioctylphosphine,TOP)等有毒试剂。Deng等[21]采用液体石蜡和油酸分别作为溶剂和配体,合成出了高质量单分散的CdSe半导体量子点,荧光量子产率达60%。与TOPO及TOP相比,液体石蜡和橄榄油价格更低,降低了实验成本,使大规模合成CdSe量子点成为可能。
含镉量子点毒性大且造成了严重的环境污染,欧盟已禁止工业产品中Cd类重金属元素的存在,因此非镉量子点成为近年人们研究的热点。过渡金属掺杂型量子点是常见非镉量子点类型之一,与经典的Cd系量子点相比具有抗环境干扰能力强、光化学性稳定、可抑制荧光自淬灭等优点。Zhang等[22]在有机溶剂中合成Cu掺杂Zn-In-S量子点,并包裹ZnSe外壳形成Cu∶Zn-In-S/ZnS量子点。该量子点发射波长覆盖了蓝色波段到近红外波段(450~810 nm),荧光量子产率可高达85%,并且可通过配体交换转为水溶性量子点,而拓宽了应用范围。这种近红外掺杂量子点将会是以后研究的重点,有望取代某些含镉量子点。
随着荧光标记和检测技术的发展,低毒或无毒性的近红外量子点发挥巨大潜力。近年来,近红外Ⅱ区量子点成为活体成像的理想荧光探针,Zhu等[23]在有机相中合成Ag2Se量子点,其发射荧光在1 080~1 330 nm范围,荧光产率为9.58%,且量子点通过配体交换由油相转为水相仍保持3.33%的量子产率,可应用于生物成像的实际应用。Li等[24]在有机相中合成Ag2S量子点,平均粒径为5.6 nm,以聚乙二醇(PEG)包裹形成聚乙二醇化Ag2S量子点,该量子点(0.1 mg·mL-1)组织穿透深度大于1.1 cm,更利于深层组织活体成像。
有机相制备的量子点具有优良的光谱性能、尺寸均一、单分散性好、粒度可调的特点且技术比较成熟,但该类量子点不溶于水,必须对其表面进行亲水转相处理才能用于实际样品的分析检测中。
2.2 水相合成法
水相合成法具有操作简单易行,成本较低等特点,常用巯基乙酸、巯基丙酸等作为稳定剂来制备,所得量子点可直接应用于样品的分析检测[25,26]。
近年来,水溶液合成量子点的方法得到逐步改进,Hodlur等[27]研究了用性质稳定、可溶于水的二氧化硒代替了硒粉和其它有害前驱体,合成了三种CdSe量子点,量子产率最高为24%。这种合成方法符合“绿色”合成路线,但是制备的量子点表面存在大量缺陷,严重影响量子点的发光性质、荧光量子产率,因此一般在水相量子点表面包被一层无机材料壳结构形成核壳型量子点而使其表面钝化,减少激发缺陷。Wang等[28]通过微波法在水相中合成了CdTe/CdS/ZnS核-壳-壳量子点,具有良好的分散性和生物相容性,并且发射光谱可覆盖近红外区间(700~800 nm)。另外,多元近红外量子点如CuInS2[29,30]、AgInS2[31]、ZnIn2S4[32]等也逐渐应用于生物分析检测中。
水相合成法所得的量子点相对有一些不足,量子产率较低、荧光强度较弱、稳定性较差等,通常需要用水热法、微波辅助法来改善。目前,工作者已进行了大量研究使水相合成法得到快速发展,具有更大的发展潜力。
3 量子点的表面修饰及其与适配体的偶联
3.1 量子点的表面修饰
有机相中合成的量子点表面多包覆着TOPO、TOP等疏水有机配体,无法直接在水溶液环境中实现样品的检测。表面修饰是改善该类量子点生物相容性、扩大其应用范围的有效手段。常用修饰方法主要有三种:第一,表面配体交换法,利用巯基乙酸[33]、巯基丙酸[34]、半胱氨酸[35]、谷胱甘肽[36]等含水溶性基团的有机配体取代量子点表面原有配体。这些有机配体属于双功能分子,一端带有的巯基与量子点表面的金属离子发生配位作用,另一端的羧基、羟基等基团可提高量子点的水溶性且能够起到与适配体相偶联的作用。此方法相对简单,但容易导致量子点的量子产率下降及荧光减弱。第二,二氧化硅/硅氧烷包覆法[37],首先在量子点的表面包覆一层亲水性的无机物,然后修饰官能团,使量子点具有水溶性而与生物分子连接。Ma等[38]在水相中合成CdTe/CdS核壳量子点,然后利用“Stöber”法在量子点表面形成二氧化硅壳层(图1),修饰后的量子点的平均粒径小于5 nm,相比于最初的CdTe/CdS量子点展现出现更高的发光效率,同时降低了量子点毒性且改善了生物相容性。第三,两亲性聚合物法,利用聚合物的疏水侧链与量子点表面烷基链相互作用形成一层稳定的聚合膜,不仅可以进行生物分子共价连接,而且可以防止量子点受到外界环境的破坏。Speranskaya等[39]以马来酸酐两亲性聚合物修饰量子点,修饰后的量子点可保持90%的荧光且可更易于与蛋白的结合。Schmidtke等[40]合成聚酰亚胺-b-聚乙二醇(PI-b-PEG)嵌段共聚物修饰量子点,降低了细胞毒性。
3.2 量子点与适配体的偶联
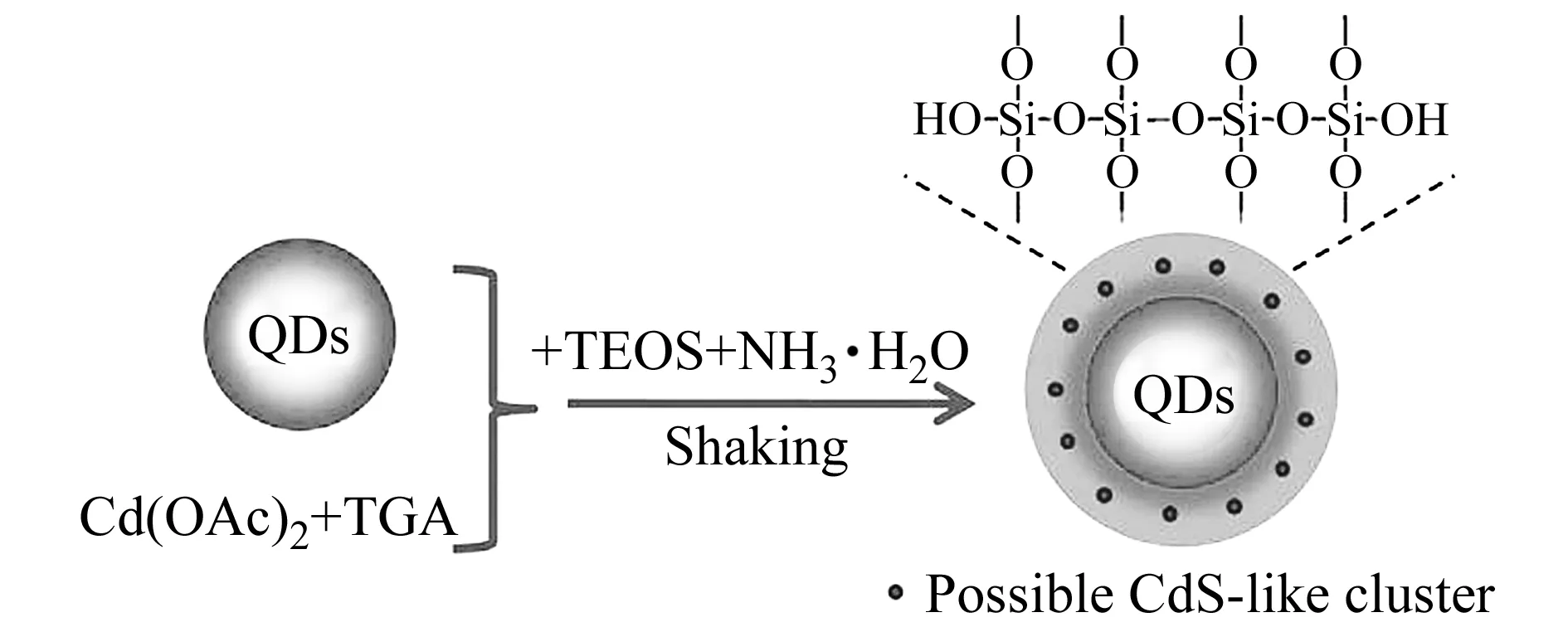
图1 二氧化硅包覆量子点的合成示意图[38]Fig.1 Schematic illustration for the synthesis of silica-coated QDs[38]
纳米材料与核酸分子的偶联方法分为共价偶联与非共价偶联。共价偶联是通过化学键合的作用将适配体连接在量子点的表面。例如,Savla等[41]在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)的催化下将标有羧基的量子点与标有氨基的适配体偶联,成功将适配体连接在量子点表面。非共价偶联是一种基于生物分子间特异性作用的生物偶联法,Zhang等[42]利用生物素与亲和素之间的特异性作用将量子点与适配体偶联形成用于小鼠肝癌细胞成像的探针,证明该方法具有很高的结合效率。
4 基于量子点标记的适配体技术在分析检测中的应用
4.1 生物分子检测
4.1.1蛋白质生物大分子蛋白质是生命活动的主要载体,也是生物功能的主要执行者。蛋白质的检测及其技术的发展对人类生命科学研究、人体健康评价等具有重大意义。蛋白质检测的最主要方法之一是标记分析法。Levy等[43]基于荧光共振能量转移(FRET)原理,首次将量子点标记的适配体传感器用于凝血酶的检测。无靶物质时,量子点与猝灭基团距离靠近,荧光被淬灭。靶物质存在时,凝血酶与适配体形成稳定结构,使带有淬灭物质的核苷酸序列脱离,量子点荧光增强,从而达到检测凝血酶的目的。

图2 基于量子点标记的适配体检测凝血酶示意图[44]Fig.2 Schematic representation of thrombin detection based on quantum dots labeled aptamer[44]
目前,蛋白质检测中研究比较多的是将量子点标记技术与荧光共振能量转移(FRET)技术结合。FRET是一种基于供体和受体之间的非辐射能量转移的能量转移方式。基于量子点标记的FRET体系中,供体-受体对需要满足的条件包括:(1)供体基团的发射光谱与受体基团的吸收光谱必须有有效重叠;(2)供体基团与受体基团之间的距离必须小于10 nm;(3)供体基团的发射光谱与受体基团的发射光谱不重叠或重叠很小。Chi等[44]建立了一种新型量子点-适配体探针检测凝血酶。将染料BOBO-3嵌入发夹结构的适配体并将其偶联到量子点上。量子点作为供体,BOBO-3为受体而组成FRET体系。当加入凝血酶时,适配体发生构象改变,由发夹构象转变为四聚体构象,使BOBO-3脱离适配体探针,从而根据BOBO-3荧光强度下降程度而对凝血酶定量分析(图2)。
另外,电致化学发光(ECL)传感器也被广泛应用于生物分子的检测。Li等[45]建立CdSe量子点标记的电化学适配体传感器(ECL-Aptamer-Sensor)检测凝血酶,荧光强度与凝血酶浓度在0~64 μg·mL-1范围内呈线性关系,相关系数为0.9986。实验证明该法检测凝血酶具有良好的特异性、稳定性和重复性。
4.1.2三磷酸腺苷(ATP) 最常见的ATP分析方法是荧光分析法和生物发光法,但由于抗体和生物发光试剂稳定性差、成本高、制备困难等缺点限制了应用范围[46],量子点标记适配体技术的发展,为ATP的检测提供了有效方法。Liu等[47]基于化学发光共振能量转移(CRET)设计了量子点-适配体传感器,通过氯化血红素/G-四链体脱氧核酶催化引起化学发光共振能量转移,从而根据QDs产生的CRET荧光信号实现对ATP的检测,检测限为10 μmol·L-1。该方法检测ATP降低了背景信号并且使多通道检测成为可能。相比于FRET,CRET不需要外来的激发光源并且以量子点作为受体,从而最大限度的降低了光漂白效应以及样品的自荧光干扰,降低了检测限,提高了灵敏度。
4.2 病原微生物检测
病原微生物是一类可引起人类和动植物各种疾病的微生物,包括细菌、病毒等[48]。这些微生物具有种类繁多、遗传变异快等特点,传统的检测方法操作复杂、检测周期长并且需要专业的操作人员。近年来,量子点标记的适配体技术以其操作简单、灵敏度高等优势在病原微生物快速检测领域脱颖而出。

图3 基于量子点标记的适配体检测细菌示意图[51]Fig.3 Schematic representation of bacteria detection based on quantum dots labeled aptamer[51]
4.2.1细菌传统检测细菌的方法步骤比较繁琐,分为以下几步:首先将标本进行培养、分纯,配制成一定浊度的细菌浓度,然后进行生化反应,最后进行细菌鉴定[49]。该方法操作复杂、漏检率较高、费时耗力且不能同时检测多种细菌。Jiang等[50]基于FRET构建了检测双歧杆菌特异性16S rDNA的新方法,以羧基修饰的量子点为供体,有机染料6-羧基罗丹明(ROX)为受体,根据量子点与ROX的荧光强度的变化来实现对双歧杆菌的检测。Duan等[51]以量子点为荧光标记物,适配体为识别元件选择性捕获目标细菌,并利用流式细胞术构建了一种特异性的、灵敏的同时检测两种食源性致病菌的方法(图3),结果显示副溶血性弧菌和沙门氏菌的检测限都为5×103cfu·mL-1,此方法为量子点标记的适配体技术在流式细胞仪上的应用开辟了道路。
4.2.2病毒目前,文献报道的病毒快速检测方法并不多。Roh等[52]用羧基修饰的量子点标记5′端为氨基的RNA核苷酸适配体作为荧光探针,在芯片上实现对目标物肝炎C病毒的 NS3的检测,检出限可达5 ng·mL-1。随后,Roh等[53]又研究了SARS病毒的检测,同样运用量子点标记适配体技术对SARS-CoV壳蛋白质进行检测。在芯片表面,量子点标记的RNA适配体可以特异性结合SARS-CoV壳蛋白,检测限最低达到0.1 pg·mL-1。此外,Tian等[54]基于量子点与碳纳米管之间形成FRET,建立量子点-单链DNA探针捕获H5N1病毒的DNA,检测限为9.39 nmol·L-1。
4.3 细胞检测与成像
量子点标记适配体的功能化探针在肿瘤细胞分析检测领域已深受研究者的青睐。在对细胞进行长期的追踪与观察中,量子点作为标记物具备较高的荧光性能,并且可以提高适配体的稳定性[55]。

图4 基于量子点标记的适配体检测癌细胞示意图[56]Fig.4 Schematic representation of cancer cells detection based on quantum dots labeled aptamer[56]
基于量子点修饰的适配体探针在肿瘤细胞检测与分析中取得了很好的效果。Lin等[56]将嵌入柔红霉素(DNR)的MUC1适配体与近红外量子点CuInS2偶联,形成DNR-MUC1-QDs偶联物作为前列腺癌细胞的识别与成像系统(图4),MUC1-QDs纳米-生物体系不但可以将DNR药物传输到靶细胞中,还可以通过量子点CuInS2的荧光强度变化来检测DNR,同时起到细胞成像的作用。其中对DNR的检测线性范围为33~88 nmol·L-1,检测限为19 nmol·L-1,研究证明了DNR-MUC1-QDs探针的高特异性和灵敏度。目前,电化学细胞传感器也成为细胞检测中的一个热点,Li等[57]基于适配体-量子点(Aptamer-QDs)构建了竞争性电化学细胞传感器,将DNA(cDNA)序列与量子点标记的适配体互补并修饰在金电极表面,靶细胞可以通过特异性识别与Aptamer-QDs结合,使Aptamer-QDs脱离电极,通过检测电极上量子点中Cd2+的浓度进而确定靶细胞的浓度。结果显示检测线性范围为1.0×102~1.0×106cells·mL-1,检测限为100 cells·mL-1。除此之外量子点-适配体探针在乳腺癌细胞(MCF-7)也被广泛应用[58],并且还有研究将其与磁性粒子结合用于肝癌细胞(HCC)的捕获与检测[59],证明了量子点-适配体可作为检测HCC的理想分子探针。
4.4 真菌毒素检测
真菌毒素包括黄曲霉毒素(AFs)、赭曲霉毒素(OTs)、伏马菌素(FBs)玉米赤霉烯酮(ZON)、脱氧雪腐镰刀菌烯醇(DON)、展青霉素(PT)等[60],目前常用检测方法主要有液相色谱、高效液相色谱、气相色谱质谱联用等方法[61]。这些方法大多需要大型仪器进行分析检测,仪器设备昂贵,对操作者要求较高,费时又耗力,不适用于实际生产中大量样品的分析检测,从而迫切需要发展简便、灵敏的快速检测方法。
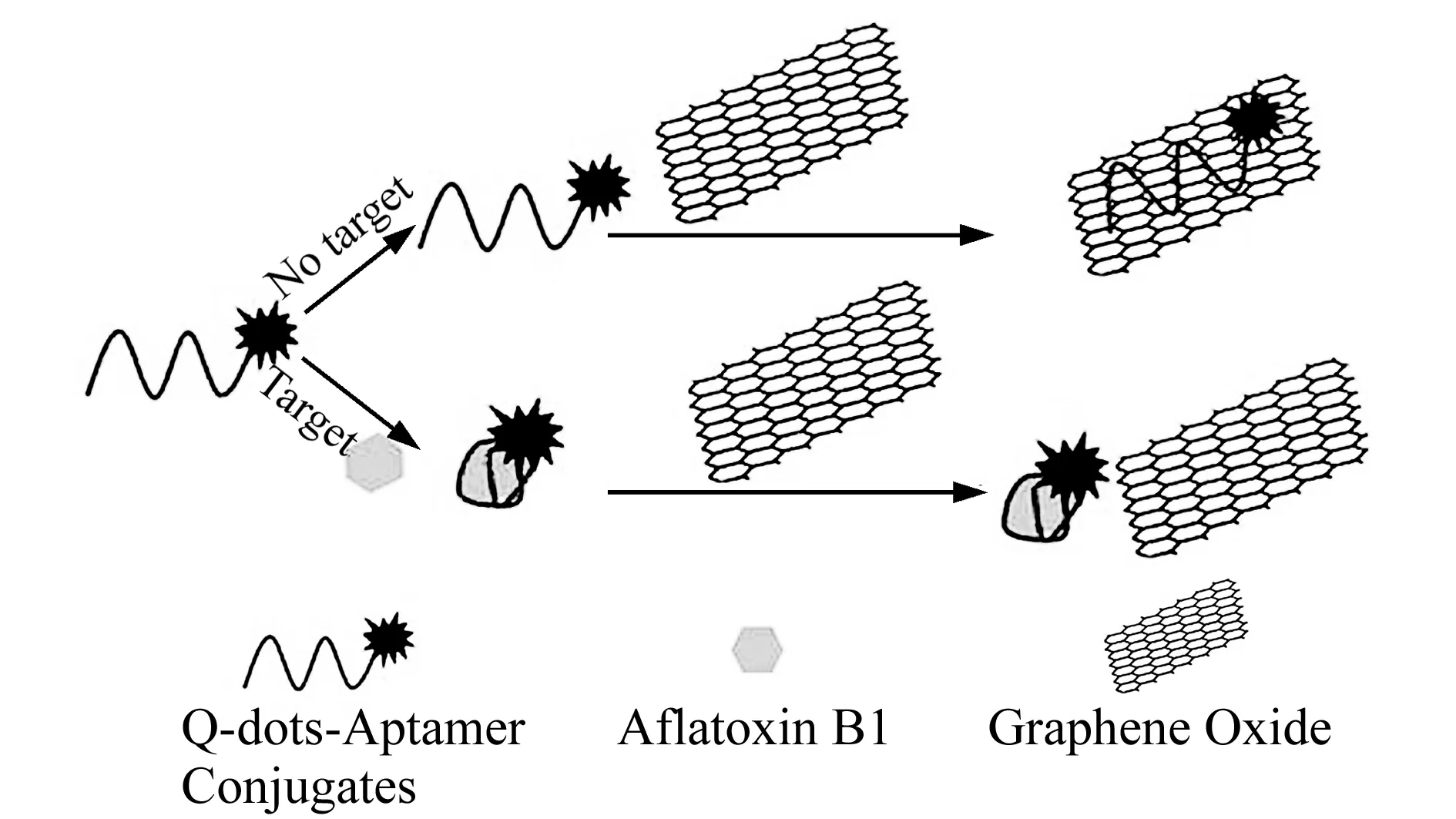
图5 基于量子点标记适配体检测AFB1[66]Fig.5 Schematic representation of AFB1 detection based on quantum dots labeled aptamer[66]
虽然,量子点以优于荧光染料的独特性质已被广泛应用于ZON[62]、黄曲霉毒素(AFB1)[63]、T-2毒素[64]等毒素的检测。但是,目前量子点-适配体技术检测真菌毒素的应用仍然很少。研究者曾报道有机染料标记适配体检测真菌毒素[65],以荧光素FAM作为标记物,单壁碳纳米管作为淬灭剂,设计了适配体传感器检测赭曲霉毒素A(OTA),检测限为24.1 nmol·L-1,线性范围为25~200 nmol·L-1。在此基础上Lu等[66]将量子点代替了荧光素作为标记物质,与适配体进行偶联,然后吸附在石墨烯表面,形成石墨烯-适配体-量子点荧光淬灭系统(图5)。根据FRET原理,在水溶液体系中AFB1的检测限低达1.0 nmol·L-1,线性范围为3.2 nmol·L-1~320 μmol·L-1。与上述荧光素标记适配体检测真菌毒素相比检测限更低,灵敏度更高。另外,Yang等[67]基于量子点的电致化学发光和核酸外切酶双重信号放大技术设计了高灵敏度适配体传感器检测OTA,其检测限低达0.64 pg·mL-1,此方法为检测毒素提供了新型化学传感技术。
5 总结与展望
近年来,基于量子点标记的适配体技术在生物毒素检测、药物传递、细胞成像及临床治疗等领域成为广大学者研究的热点,展现出特异性高、灵敏性好、操作简单、快速等优势,然而在应用中还存在一些问题:(1)生物毒性。量子点中含有的重金属等元素使其具有潜在的危害,特别是Cd系量子点。研究证明量子点的生物毒性与本身的化学组成、合成方法、应用方式及环境等因素有关[68],量子点的安全性已成为临床应用的重要问题之一。因此,使用绿色环保的方法合成毒性较低的量子点是下一步研究的方向。(2)稳定性。适配体与量子点偶联时容易发生颗粒的团聚等不稳定现象,并且偶联后,可能会产生空间位阻效应从而降低适配体的特异性和灵敏度[69]。适配体在血液或者细胞内容易被核酸酶降解,尤其是RNA更容易被水解,从而不能有效的识别检测靶物质。因此量子点-适配体探针需要更进一步研究提高稳定性。(3)适应性。目前,量子点-适配体技术集中于生物分析检测中,而在中药材等复杂基质中的应用较少。基质效应是新技术在复杂基质中应用面临的主要问题,本课题组Yang[70]等将适配体亲和柱应用于中药材中真菌毒素的富集、纯化,为新技术在中药材等复杂基质中的检测提供了前提。实现新技术在复杂基质中的分析检测也将成为今后发展的一个重要方向。
总之,基于量子点标记的适配体技术为现代分析检测提供了快速、高效、简便、灵敏的检测方法,但仍需要不断完善,不断发展,进而适用于各个领域的分析检测,同时给中药等复杂基质中有害残留物的分析检测带来新的发展契机。
