肝动脉化疗栓塞联合CT引导下射频消融术序贯治疗膈顶肝癌疗效观察*
2016-10-14扈鑫荣董军
扈鑫荣董军
肝动脉化疗栓塞联合CT引导下射频消融术序贯治疗膈顶肝癌疗效观察*
扈鑫荣①董军②
目的:评价经皮肝动脉化疗栓塞(TACE)联合CT引导下射频消融(RFA)序贯治疗膈顶部肝癌的效果。方法:选取2013年3月-2015年3月中山大学肿瘤防治中心收治的128例确诊为膈顶部肝癌的患者,均实施TACE后联合CT引导下RFA(CT-RFA),观察患者临床治疗效果。结果:128例患者经皮肝动脉造影共发现156枚病灶,均行TACE联合CT-RFA。术中并发症包括气胸8例、出血12例,给予对症处理后好转。治疗后1个月影像学复查,肿瘤完全坏死率为89.1%。结论:TACE联合CT-RFA是治疗膈顶部肝癌的有效方法,可有效灭活肿瘤。
肝癌; 膈顶部; 肝动脉化疗栓塞; 射频消融术
根据最新中国肿瘤年报统计,原发性肝癌已经成为发病率第四,死亡率第二的恶性肿瘤之一[1]。经皮肝动脉化疗栓塞(TACE)、射频消融术(RFA)及外科手术切除是目前主要治疗手段[2]。TACE不仅可以灭活大部分病灶,还可以根据碘油在病灶内部沉积,精确定位残留活性病灶,序贯联合RFA治疗可完全灭活肿瘤病灶。目前RFA治疗主要在超声导引下进行。而原发性肝癌患者多有肝硬化背景[3],大部分肝硬化结节与肝癌难以在超声下鉴别。另外受周围包绕肺组织的影响,超声无法清楚显示膈顶部的病灶,而CT可以清楚显示。因此本研究采用CT引导RFA(CT-RFA)治疗膈顶部肝癌。选取2013年3月-2015年3月中山大学肿瘤防治中心收治的128例确诊为膈顶部肝癌的患者,给予经皮TACE联合CT-RFA序贯治疗,获得较好疗效,现报告如下。
1 资料与方法
1.1一般资料 本研究共纳入患者128例,其中男86例,女42例,年龄32~74岁,中位年龄58岁,原发性肝细胞癌125例,胆管细胞癌3例。纳入标准:(1)患有乙型、丙型肝炎及肝硬化病史、血清甲胎蛋白(AFP)进行性升高及两种以上影像学典型表现,临床诊断原发性肝癌;(2)经病理组织活检证实原发性肝癌;(3)肿瘤位于膈顶部,无明显大血管、胆管浸润,无肝外转移;(4)无法手术切除或拒绝外科手术治疗患者;(5)所有患者均无TACE及RFA手术禁忌。
1.2治疗方法
1.2.1术前准备 术前完善相关血液学及影像学检查,排除手术禁忌证,明确肿瘤部位及大小,制定相应治疗计划。
1.2.2TACE 患者常规采取仰卧位,采用Seldinger穿刺法,在数字减影血管造影(DSA)导引下,经右侧股动脉进入肝总动脉。常规碘化油造影,一般注射速率4~6 mL/s,总量20 mL,具体根据肿瘤大小及门脉直径选择。根据肿瘤部位及显影情况选择性或超选择造影,观察病灶的位置、大小、数量及供血动脉。采用超乳化碘化油混合氟尿嘧啶(5-Fu)、表柔比星(EPI)及丝裂霉素(MMC)。根据瘤体大小和血供情况决定栓塞剂量。术后常规拍片观察碘化油栓塞沉积情况,必要时予以补充栓塞。1个月后复查,如果残留活性,重复1次。如果残留活性病灶,给予射频消融治疗。
1.2.3CT-RFA 采用韩国STAR MED RFA系统治疗,全程心电监护,密切关注生命体征变化。根据病灶位置选取仰卧、侧卧位或者俯卧位,术前常规CT增强扫描明确残留活性病灶位置,然后根据残余病灶的位置及大小设计进针的方向、角度及深度。体表进针点常规消毒铺巾,2%利多卡因5~10 mL局部逐层浸润麻醉,然后在CT反复扫描导引下经皮经肝逐步将17G射频消融针插入活性病灶中心位置,如果偏离设计进针方向,及时调整。当消融针放置在计划消融位置后,根据活性病灶大小及位置确定消融的功率和时间,术后即刻行CT增强扫描提示消融区呈低密度,未见强化,范围足够完全覆盖肿瘤,无气胸、腹腔出血等并发症,即可结束治疗。如果消融范围不够,应给予补充消融,保证消融效果。常规消融针道以预防针道转移及出血。术后给予止痛、止血、预防感染、对症支持等治疗。
1.3评价标准 通过术后即刻扫描,观察患者有无气胸及腹腔内出血等并发症。随访消融治疗后3周、1个月行影像学评价治疗疗效(一般采用CT或者磁共振增强扫描):完全消融为活性病灶区域为低密度,增强扫描无强化,如有强化,提示肿瘤残留活性病灶。
1.4统计学处理 采用SPSS 16.0统计学软件分析数据,计量资料以()表示,比较采用t检验,计数资料以率(%)表示,比较采用 χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1一般情况 128例患者术前经影像学证实病灶共145枚,其中单发病灶56例,病灶最长径2.2~10.3 cm,平均(5.5±1.1)cm。患者一般情况见表1。

表1 患者一般情况
2.2TACE结果 128例患者行DSA造影后共发现156枚病灶,包括术中部分常规影像学无法发现的病灶11个。其中病灶单发于肝左叶11例,位于Ⅳ段;单发于右叶32例,Ⅶ段12例,Ⅷ段20例。多发病灶85例,发现病灶113枚。经皮经肝动脉行DSA造影,早至中期可见动脉供血的结节状碘油深染区,边缘清楚,随时间延长而逐渐加深。术中均使用微导管行肝段TACE治疗,栓塞后碘油沉积好。3周后复查,82枚首次治疗后病灶内碘油密实完全充填,74枚病灶内部分碘油沉积,再次行TACE治疗后68枚病灶再次完全充填。复查可见88例存在残留,间隔3周左右行RFA治疗。
2.3RFA结果 88例存在边缘残留的患者接受CT-RFA,共消融肿瘤病灶102枚,其中>5 cm者84枚,消融时间10~30 min,平均18.9 min。102枚病灶经射频消融治疗后1个月复查,可见消融区域为低密度灶,增强扫描消融病灶内部及边缘无强化,内部可见低密度灶,同正常组织界限更加清晰(图1)。本研究156枚病灶中,其中139枚完全坏死,完全坏死率为89.1%。
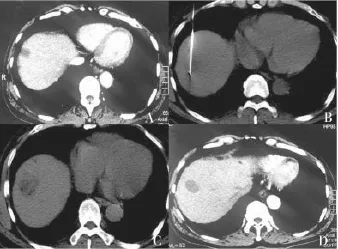
图1 CT引导下膈顶部肿瘤的RFA治疗
2.4并发症 治疗过程中出现8例气胸,经保守治疗后好转。12例患者出现肝包膜下出血,给予止血治疗后好转。术后89例出现不同程度右上腹痛和发热,经对症处理后症状明显缓解或消失。
3 讨论
射频消融(RFA)治疗是近年发展较快的肝癌根治性治疗手段之一,具有微创、操作简单、可反复治疗等优点[4-6]。目前主流肝癌治疗指南已经将其纳入,并作为小肝癌一线治疗手段进行推荐,疗效与手术切除相媲美,也是中晚期肝癌主要的治疗手段。目前影像导引方式主要有包括超声及CT,磁共振引导下的RFA目前临床应用较少[7-8]。超声具有实时成像的优势,简单方便,但是对于特殊部位的肿瘤,如膈顶及尾状叶等,显示较差,CT能够清楚显示断层解剖结构,能够重建成像,能够清楚显示特殊部位的肿瘤[9]。目前膈顶部小肝癌采用射频消融治疗研究较多,但是对于膈顶部肝癌行肝动脉化疗栓塞(TACE)治疗后RFA治疗残留病灶的研究报道较少[10-12]。
目前无法手术切除及RFA治疗的大肝癌首选TACE治疗。通过碘油栓塞肿瘤主要供血血管,使肿瘤大部分缺血坏死[13]。但因为双重供血及侧枝循环存在,一次TACE往往无法起到良好效果,对于较大病灶,需要再次栓塞治疗才能达到大部分肿瘤坏死的效果[14]。本研究选取无法手术治疗、靠近膈顶部的中等大小肝癌,经TACE治疗后大部分坏死,但仍有存留病灶的患者,采用射频消融进行补充治疗,达到了完全灭活肿瘤效果,提高了膈顶部肿瘤的治疗疗效。本研究中82枚首次治疗后病灶内碘油密实完全充填,74枚病灶内部分碘油沉积,再次行TACE治疗后68枚病灶再次完全充填。复查可见88例存在边缘残留,消融肿瘤病灶102枚。本组156枚病灶中,其中139枚完全坏死,完全坏死率为89.1%。
目前针对原发性肝癌TACE术后何时进行RFA治疗存在较大争议,部分学者认为TACE术后即刻进行RFA可以有效提高治疗疗效[15-16]。但也有学者认为先行RFA治疗,边缘残留病灶再进行TACE治疗,疗效会更好[17-18]。目前大部分学者比较认同TACE术后联合RFA治疗更加合理[19]。至于术后多久进行RFA治疗,也存在分歧。部分学者认为术后1周或者2周再给予RFA治疗,因为TACE术后,肿瘤主要供血血管栓塞,肿瘤局部相对缺血坏死,可以防止癌细胞的扩散,缩短射频治疗时间,扩大凝固坏死范围,是RFA治疗最佳时机[20]。但部分学者认为术后3~4周进行RFA治疗效果更好,TACE治疗后部分碘化油滞留病灶周围正常肝实质内,造成周围正常肝脏组织供血不足,引起肝脏功能损害,术后2周周围正常肝组织内沉积碘油尚未完全廓清,容易造成肿瘤病灶边界显示不清,容易出现遗漏或扩大消融范围,损伤周围正常肝脏组织。而且此时周围正常肝脏也相应缺血,RFA治疗可加重肝功能损伤及增加并发症风险。本组TACE治疗后3周左右复查CT显示正常肝组织中碘油基本廓清,而肿瘤病灶显示清楚,因此是RFA治疗的较好时机。68枚病灶碘油填充不完全,与瘤体比较大、多血管参与供血有关。所以,笔者认为TACE后3周左右行RFA效果较好。
本研究出现的并发症主要是气胸和出血。术者在实践活动中总结经验得出,一般位于膈顶部的肝癌,可以采用倾斜穿刺技术,与膈肌平行进针,避免反复穿刺,同时避免穿刺经过肺组织,可以有效减少气胸的发生。原发性肝癌多出现在肝硬化基础上,凝血功能较差,术中反复穿刺,可能造成肝包膜下出血,应当术前完善凝血功能检查,并嘱托患者穿刺时屏住呼吸,尽量减少反复穿刺,并尽量经过至少1 cm的正常肝组织,可以有效减少出血。另外尽量大倾斜角度进针,因为上部肝组织自身重力,也可以压迫针道,防止出血。如果需要变换射频针的方向进行多位点治疗时,应在肝被膜下调整消融针位置,并消融针道止血。在本研究中气胸和出血发病率虽然比较多见,但经上述处理后尚未见因并发症死亡病例。
综上所述,TACE联合CT-RFA序贯治疗膈顶部肝癌,可以减少RFA时热量的散失,可有效灭活肿瘤活性病灶,且并发症少。
[1] Lam V W,Ng K K,Chok K S,et al.Incomplete ablation after radiofrequency ablation of hepatocellular carcinoma:analysis of risk factors and prognostic factors[J].Ann Surg Oncol,2008,15 (3):782-790.
[2]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,16(10):929-946.
[3]周际昌.实用肿瘤内科学[M].2版.北京:人民卫生出版社,2013:45-46.
[4]唐云强,江鹏,何璐,等.三维重建联合超声引导下射频消融治疗肝癌的疗效分析[J].中华消化外科杂志,2014,13 (9):678-682.
[5]蔡磊,李晓武,夏锋,等.射频消融治疗转移性肝癌的临床疗效[J].中华消化外科杂志,2014,13(3):190-193.
[6] Ochsenbein A F,Sierro S,Odermatt B,et al.Roles of tumor localization,second signals and cross priming in cytotoxic T-cell induction[J].Nature,2001,411(6841):1058-1064.
[7] Jemal A,Bray F,Center M M,et al.Global cancer statistics[J]. Ca A Cancer Journal for Clinicians,2011,61(1):33-64.
[8]郭放,刘永叶,郑振东,等.超声引导下射频消融治疗原发性肝癌36例[J].解放军医药杂志,2014,26(4):68-70.
[9] Tombesi P,Di Vece F,Sartori S.Resection vs thermal ablation of small hepatocellular carcinoma:What’s the first choice[J].World J Radiol,2013,5(1):1-4.
[10] Metussin A,Patanwala I,Cross T J.Re:partial hepatectomy vs.transcatheter arterial chemoembolization for resectable multiple hepatocellular carcinoma beyond Milan criteria:ARCT[J].J Hepatol,2014,7(14):813-817.
[11] Dong J,Zhang L,Wang L,et al.1.0 T open-configuration magnetic resonance-guided microwave ablation of pig livers in real time[J].Scientific Reports,2015,5(3):832-836.
[12] Cucchetti A,Piscaglia F,Cescon M,et al.Cost-effectiveness of hepatic resection versus percutaneous radiofrequency ablation for early hepatocellular carcinoma[J].J Hepatol,2013,59(2) :300-307.
[13] Widmann G,Schullian P,Bale R.Radiofrequency ablation of hepatocellular carcinoma[J].Wien Med Wochenschr,2013,163 (5-6):132-136.
[14]史枢龙,宋志永.腹腔镜手术与射频消融治疗肝血管瘤的临床疗效对比分析[J].中华普外科手术学杂志(电子版),2016,10(2):165-167.
[15] Tanis E,Nordlinger B,Mauer M,et al.Local recurrence rates after radiofrequency ablation or resection of colorectal liver metastases.Analysis of the European Organisation for Research and Treatment of Cancer[J].European Journal of Cancer,2014,50(5):912-919.
[16]段浩朋,赵永福.经皮肝穿刺射频消融治疗临近肝脏大血管肝癌的安全性及疗效分析[J].河南医学研究,2016,25(4):1-3.
[17] Vogl T J,Dommermuth A,Heinle B,et al.Colorectal cancer liver metastases: long-term survival and progression-free survival after thermal ablation using magnetic resonance-guided laser-induced interstitial thermotherapy in 594 patients:analysis of prognostic factors[J].Investigative Radiology,2014,49(1):48-56.
[18] Ammori J B,Kemeny N E,Yuman Fong M D,et al.Conversion to complete resection and/or ablation using hepatic artery infusional chemotherapy in patients with unresectable liver metastases from colorectal cancer:A decade of experience at a single institution[J].Annals of Surgical Oncology,2013,20(9):2901-2907.
[19] Minami Y,Kudo M.Radiofrequency ablation of liver metastases from colorectal cancer:A literature review[J].Gut & Liver,2013,7(1):1-6.
[20]练远书,杨浩.经皮射频消融与手术切除治疗小肝癌的临床效果对比[J].临床医学研究与实践,2016,31(6):16.
Clinical Observation on Transcatheter Artery Chemoembolization Sequentially Combined with CT-guided Radiofrequency Ablation in Treatment of Liver Cancer Located in Diaphragm/
HU Xin-rong,DONG J un.//Medical Innovation of China,2016,13(26):047-051
Objective:To evaluate the effect of percutaneous transcatheter arterial chemoembolization combined with sequential CT-guided radiofrequency ablation in the treatment of liver cancer at the top of the diaphragm.Method:The 128 patients with liver cancer at diaphragm from March 2013 to March 2015 in Sun Yat-sen Cancer Center were treated by percutaneous transcatheter arterial chemoembolization (TACE) combined with CT-guided radiofrequency ablation (CT-RFA).Treatment efficacy was observed.Result:A total of 156 lesions were found in 128 patients with percutaneous hepatic arteriography and were completely treated by RFA and TACE sequentially.Intraoperative complications included pneumothorax in 8 cases and bleeding in 12 cases,and symptomatic improvement after treatment.Radiological review was performed at 1 month after treatment,complete tumor necrosis rate was 89.1%.Conclusion:TACE combined with CT-RFA is an effective method for the treatment of liver cancer at the top of the diaphragm,which can effectively inactivate the tumor.
Liver; Diaphragm top; Hepatic artery chemoembolization; Radiofrequency ablation
10.3969/j.issn.1674-4985.2016.26.013
2016-05-03) (本文编辑:蔡元元)
广东省博士启动基金(509066331033)
①广西壮族自治区南溪山医院 广西 桂林 541002
②中山大学肿瘤防治中心
董军
First-author’s address:Nanxishan Hospital of Guangxi Zhuang Autonomous Region,Guilin 541002,China
