2型糖尿病合并非酒精性脂肪肝与颈动脉粥样硬化关系的研究
2016-10-14梅歆
梅歆
2型糖尿病合并非酒精性脂肪肝与颈动脉粥样硬化关系的研究
梅歆①
目的:以颈动脉内膜中层厚度(IMT)作为动脉粥样硬化的评估指标,探讨非酒精性脂肪肝(NAFLD)和2型糖尿病(T2DM)与颈动脉病变的关系。方法:选取2013年1月-2015年6月符合纳入标准的2型糖尿病合并NAFLD患者50例作为观察组,未合并NAFLD患者50例作为对照组,共100例。采集病史(包括吸烟史、饮酒史、病程时间等),记录两组患者的身高、体质量、腰围、臀围、血压等一般资料,并计算体重指数(BMI)、测定IMT及血生化指标HbA1c、C反应蛋白(CRP),并行糖耐量试验,测定血糖及各时段胰岛素水平,计算胰岛素抵抗指数(HOMA-IR)。结果:(1)观察组HbA1c、空腹血糖(FPG)、服糖后2 h血糖(2 h PG)、空腹胰岛素(FINS)、餐后2 h胰岛素(2 h INS)及胰岛素抵抗的稳态模型评价(HOMA-IR)均高于对照组患者,差异均有统计学意义(P<0.05)。(2)观察组患者BMI、甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白(LDL-C)均高于对照组,差异均有统计学意义(P<0.05)。(3)观察组患者的左、右侧IMT、脂联素(ICAM-1)及CRP水平均高于对照组,差异均有统计学意义(P<0.05)。结论:2型糖尿病合并NAFLD患者的代谢紊乱和胰岛素抵抗更显著,该类患者更易发生动脉粥样硬化。
2型糖尿病; 非酒精性脂肪肝; 动脉粥样硬化; 代谢紊乱
First-author’s address:The People’s Hospital of Aletai,Aletai 836500,China
2型糖尿病患者发生脂肪肝的的比例很高,且大多数为非酒精性脂肪肝(non alcoholic fatty liver disease,NAFLD),合并NAFLD的患者有无特殊的生化代谢特征及预后如何尚无定论[1]。笔者设计了本临床研究,根据是否合并NAFLD,将糖尿病患者分为两组,观察对比两组患者的肝功能及糖、脂代谢水平,测定颈动脉粥样硬化斑块等相关指标,发现了一些临床特征,现报道如下。
1 资料与方法
1.1一般资料 选取2013年1月-2015年6月本科住院患者,诊断均符合2型糖尿病,随机纳入合并NAFLD患者50例作为观察组,未合并NAFLD患者50例作为对照组。观察组男38例,女12例,年龄35~88岁,平均(58.39±4.50)岁,病程3个月~55年,平均(8.29±0.29)年;对照组男36例,女14例,年龄37~89岁,平均(57.32±5.45)岁,病程3个月~53年,平均(9.12±0.33)年。两组患者的一般资料比较差异无统计学意义(P>0.05),具有可比性。所有患者均知情同意并签署知情同意书,本研究经医院伦理委员会批准。
1.2方法
1.2.1一般项目观察 采集患者病史(包括吸烟史、饮酒史、病程等),记录患者身高、体质量、腰围、臀围、血压、病程等一般资料,检测肝功能及糖、脂代谢水平,测定颈动脉粥样硬化斑块。
1.2.2仪器 标准水银血压计、身高体重测量仪、皮尺等,全自动生化分析仪、电热恒温水温箱、超低温冰箱、全自动酶标仪、离心机。
1.2.3颈动脉内膜中层厚度(IMT)测定 采用彩色多普勒超声检查仪器,探头的频率选择7.0~11.0 MHz,测定位置为双侧的颈总动脉远端1 cm位置、分叉位置与颈内动脉起始位置上部1 cm的位置,测定颈动脉IMT,将3个位置的测定数据进行计算,取平均值。
1.2.4HOMA-IR HOMA-IR的计算按照在空腹状态下,胰岛素水平×血糖水平/22.5计算而成[3]。
1.3观察指标 肝功能及糖、脂代谢水平,测定颈动脉粥样硬化斑块。测定受试者的三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、C反应蛋白(CRP);糖耐量试验,测定血糖及各时段胰岛素水平,计算胰岛素抵抗指数(HOMAIR)血红蛋白(HbA1c)水平;脂联素(ICAM-1);IMT。
1.4统计学处理 应用SPSS 12.0统计学软件进行数据处理,计量资料以()表示,比较采用t检验,计数资料以例(%)表示,比较采用 χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1两组患者血糖相关指标比较 观察组患者HbA1c、空腹血糖(FPG)、餐后2 h血糖(2 h PG),空腹胰岛素(FINS),餐后2 h胰岛素(2 h INS)及HOMA-IR均高于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者血糖相关指标比较()

表1 两组患者血糖相关指标比较()
组别 HbA1c(%) FPG(mmol/L) 2 h PG(mmol/L) FINS(pmol/L) 2 h INS(pmol/L) HOMA-IR观察组(n=50) 7.97±1.64 9.45±1.39 14.35±1.46 88.45±11.72 245.45±43.68 3.54±0.67对照组(n=50) 6.14±1.51 6.97±1.16 10.25±1.48 63.95±13.53 167.33±48.51 2.38±0.41 t值 2.59 3.51 4.17 5.48 4.61 2.46 P值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.2两组患者BMI及血生化指标比较 观察组患者BMI、TG、TC、LDL-C均高于对照组,差异均有统计学意义(P<0.05),见表2。
2.3两组患者颈动脉IMT、ICAM-1、CRP比较观察组患者左侧IMT(IMT-L)、右侧IMT(IMT-R)、ICAM-1及CRP的水平均高于对照组,差异均有统计学意义(P<0.05),见表3。
3 讨论
非酒精性脂肪肝(NAFLD)是指排除酒精以外其他因素导致的肝脏弥漫性脂肪浸润,其基本病理特征是肝细胞发生脂肪变性。流行病调查显示其发病与生活方式、糖尿病、脂代谢异常、肥胖及胰岛素抵抗有关[4],在2型糖尿病患者中发病率更高,且两者相互影响。当2型糖尿病患者合并NAFLD时,增加了心脑血管疾病的发病风险[5-7],对这一现象的原因医学界仍有争议,但大多数研究显示,动脉粥样硬化的发生是导致的心脑血管疾病的主要原因[8]。为什么2型糖尿病患者易患者动脉硬化性疾病,现临床证据不足。基于以上认识,笔者设计了本研究,通过观察对2型糖尿病合并NAFLD患者与非合并NAFLD患者生化指标的差异,来探讨其发生动脉粥样硬化的风险。
表2 两组患者BMI及血生化指标比较()

表2 两组患者BMI及血生化指标比较()
LDL-C (mmol/L)组别 BMI (kg/m2)TG (mmol/L)TC (mmol/L)观察组(n=50)26.84±1.19 2.63±0.32 4.89±0.82 3.38±0.79对照组(n=50)24.03±1.04 1.94±0.31 4.27±0.67 2.93±0.42 t值 3.72 2.78 2.39 2.23 P值 <0.05 <0.05 <0.05 <0.05
表3 两组患者颈动脉IMT、ICAM-1、CRP比较()
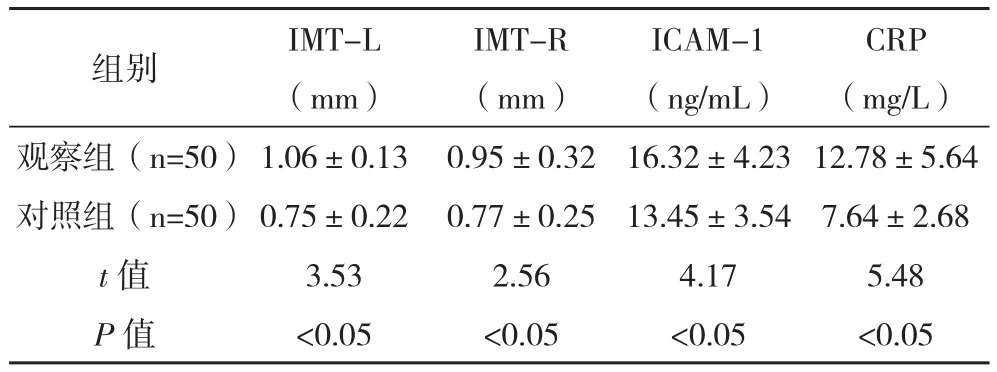
表3 两组患者颈动脉IMT、ICAM-1、CRP比较()
CRP (mg/L)观察组(n=50)1.06±0.13 0.95±0.32 16.32±4.23 12.78±5.64对照组(n=50)0.75±0.22 0.77±0.25 13.45±3.54 7.64±2.68 t值 3.53 2.56 4.17 5.48 P值 <0.05 <0.05 <0.05 <0.05组别 IMT-L (mm)IMT-R (mm)ICAM-1 (ng/mL)
动脉粥样硬化是导致心脑血管疾病主要的病理基础,它的病理特点是动脉从内膜开始,先后有多种病变合并存在,包括内膜下形成斑块、动脉层退变,还可继发斑块内出血、斑块破裂及局部血栓形成。动脉粥样硬化是多病因疾病,是多种危险因素共同作用的结果。其危险因素可分为可控的危险因素和不可控的危险因素,年龄、性别和家族史是不可控的危险因素。在本研究中两组患者在年龄和性别方面无明显差异。可控的危险因素包括血脂异常、高血压、吸烟、糖尿病和糖耐量异常、肥胖及生活方式等。本研究结果显示,两组患者在血糖相关指标上明显的差异。观察组患者的糖化血红蛋白(AbA1c)、空腹血糖(FPG)、餐后2 h血糖(2 h PG)、空腹胰岛素(FINS)、餐后2 h胰岛素(2 h INS)及胰岛素抵抗的稳态模型评价(HOMA-IR)均高于对照组患者,其差异均有统计学意义(P<0.05)。在血脂代谢指标上也有明显的差异:观察组患者甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白(LDL-C)均高于对照组,差异均有统计学意义(P<0.05)。观察组患者肥胖也更为明显,体重指数(BMI)高于对照组患者(P<0.05)。通过本研究可以看出,在2型糖尿病合并NAFLD患者中,其导致动脉粥样硬化的危险因素更为明显。
只有动脉粥样硬化的危险因素也并不一定发生动脉粥样硬化,其发病机制也有不同的学说,近年来多数学者支持“内皮损伤反应学说”,该学说认为只有在发现的动脉内膜的损伤之后,动脉粥样硬化病变才最终形成,动脉粥样硬化的形成是对内皮、内膜损伤做出的炎症-纤维增生反应。发生炎症反应的一重要指标是C反应蛋白(CRP)。在本研究中笔者也观察了两组患者的CRP水平,发现观察组患者CRP水平均高于对照组,差异有统计学意义(P<0.05)。
通过以上数据可以看出2型糖尿病合并NAFLD患者有较高的动脉粥样硬化危险因素,也具备了形成动脉粥样硬化的条件,但是否是造成了动脉粥样硬化的形成呢。因素在本研究中笔者还观察了动脉粥样硬化的指标颈动脉内膜厚度(IMT),笔者通过颈部彩色多普勒超声的方法对两组患者的IMT进行了对比观察,观察组患者的左侧IMT(IMT-L)、右侧IMT(IMT-R)均高于对照组,从而得出了合并NAFLD的患者不但具有更多的动脉粥样硬化的危险因素,在临床中也确实有更为严重的动脉粥样硬化。笔者的研究结果与国内外的研究结果基本相符,分析其原因,可能是与动脉粥样硬化与NAFLD有相似的危险因素[9-10],但NAFLD独立于传统的心血管疾病危险因素使心血管疾病的风险增加[11-14],研究显示NAFLD患者中84.6%的个体存在至少一支冠脉血管狭窄,而在非NAFLD患者中冠脉狭窄的发生率为64.1%,从而有学者认为NAFLD是与冠脉狭窄程度相关的因素[15-16]。但是观察并不一致,在探讨NAFLD与冠心病关系的研究中,结果显示应用单因素分析NAFLD与冠心病相关,但应用多因素分析则这种相关性并不存在,经随访,NAFLD 并不增加冠心病的死亡率[17-18]。但是笔者的研究结果支持NAFLD患者更易患者动脉粥样硬化。
另外,对于2型糖尿病合并NAFLD的预后主要取决于肝损伤的严重程度。有研究对5次不同的随访研究表明,257例非NAFLD患者中,平均随访3.5~11年并做肝穿检查,28%肝脏损伤有进展,59%无变化,13%肝损伤恢复或改善[19]。有些患者由脂肪变性发展到NASH,甚至为肝纤维化或肝硬化。在随访期间共26例(10.1%)死亡,其中2例(0.8%)死于与肝病有关疾病,包括1例(0.4%)为肝细胞癌。因此,有些NAFLD患者预后良好,另一些则发展成肝硬化或肝癌。单纯脂肪变性的患者一般预后良好,但NASH或更严重的肝纤维化患者预后较差。一次调查表明,仅肝活检有坏死性炎症的患者发展为肝纤维化。一次随访期平均为8.3年的调查表明,肝病相关疾病是NAFLD患者第二位常见死因,仅次于肝癌死亡。有NASH患者死于肝病者多于无NASH者,这可能与NASH患者中肝硬化比例较高有关[20]。
笔者设计了本临床研究,根据是否合并NAFLD,将糖尿病患者分为两组,观察对比两组患者的肝功能及糖、脂代谢水平,测定颈动脉粥样硬化斑块等相关指标,取得以下结论:2型糖尿病合并NAFLD患者较不合并NAFLD的2型糖尿病患者具有更加明显的代谢紊乱与胰岛素抵抗。2型糖尿病合并NAFLD患者较不合并NAFLD的2型糖尿病患者出现动脉粥样硬化的程度更甚。在影响2型糖尿病合并NAFLD患者的众多危险因素中,HOMA-IR、LDL-C、CRP、TG是其主要影响因素,胰岛素抵抗的增加、脂代谢紊乱及CRP的升高共同参与了2型糖尿病合并NAFLD患者动脉粥样硬化的发生和发展。
[1]周慧,王刚,郭丽萍.2型糖尿病患者非酒精性脂肪肝患病率的回顾性分析[J].河北医药,2010,32(5):583-584.
[2]孙广平,陈奕名,孟君.罗格列酮对非肥胖2型糖尿病合并脂肪肝的疗效观察[J].中医临床研究,2014,6(15):63-65.
[3]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[4]金慧琳.利拉鲁肽在2型糖尿病合并脂肪肝治疗中的临床观察[J].哈尔滨医药,2014,34(4):279-282.
[5]张宏伟,赵民,刘秀敏,等.非酒精性脂肪肝合并代谢综合征各组分及其聚集与心脑血管病的相关分析[J].中西医结合心脑血管病杂志,2011,9(10):1187-1188.
[6]寿芳,张召才.非酒精性脂肪肝与缺血性心血管病的相关性分析[J].心脑血管病防治,2011,11(6):468-470.
[7]李军,罗良平,张洁.城市社区中老年人群非酒精性脂肪肝与糖尿病、冠心病患病的现况[J].暨南大学学报(自然科学与医学片),2014,35(3):310-314.
[8]孙乘军.二甲双胍治疗2型糖尿病合并脂肪肝的疗效观察[J].实用心脑肺血管病杂志,2013,21(3):77-79.
[9]李杰,李钊,朱玉霞.2型糖尿病并发酒精性脂肪肝的危险因素及其与大血管病变的相关性[J].中国老年学杂志,2014,34(5):1246-1268.
[10]韩凤琴.探讨非酒精性脂肪肝合并高血压的影响因素[J].中西医结合心血管杂志,2015,3(7):56-58.
[11] Gastaldelli A,Kozakova M,Hojlund K,et al.Fatty liver is associated with insulin resistance,risk of coronary heart disease,and early atherosclerosis in a large European population[J]. Hepatology,2009,49(4):1537-1544.
[12] Sung K C,Ryan M C,Wilson A M.The severity of nonalcoholic fatty liver disease is associated with increased cardiovascular risk in a large cohort of non-obese Asian subjects[J].Atherosclerosis,2009,203(10):581-586.
[13] Yun K E,Shin C Y,Yoon Y S,et al.Elevated alanine aminotransferase levels predict mortality from cardiovascular disease and diabetes in Koreans[J].Atherosclerosis,2009,205 (11):533-537.
[14] Wong V W,Wong G L,Yip G W,et al.Coronary artery disease and cardiovascular outcomes in patients with non-alcoholic fatty liver disease[J].Gut,2011,60(2):1721-1727.
[15] Mirbagheri S A,Rashidi A,Abdi S,et al.Liver:an alarm for the heart[J].Liver International,2008,28(2):283.
[16] Alper A T,Hasdemir H,Sahin S,et al.The relationship between nonalcoholic fatty liver disease and the severity of coronary artery disease in patients with metabolic syndrome[J]. Arch Turk Soc Cardiol,2008,36(6):376-381.
[17] Feitosa M F, Reiner A P,Wojczynski M K,et al.Sexinfluenced association of nonalcoholic fatty liver disease with coronary heart disease[J].Atherosclerosis,2013,227(2):420-424.
[18] Stepanova M,Younossi Z M.Independent association between nonalcoholic fatty liver disease and cardiovascular disease in the US population[J].Clin Gastroenterol Hepatol,2012,10(6):646-650.
[19]李芳萍,张四青,王斐,等.2型糖尿病和非酒精性脂肪肝病的胰岛素抵抗研究[M].新医学,2009,40(7):429-470.
[20] Yoneda M,Mawatari H,Fujita K,et al. High sensitivity C-reactive protein is an independent clinical feature of nonalcoholic steatohepatitis (NASH) and also of the severity of fibrosis in NASH[J].J Gastroenter o,2007,42(7):573-582.
[21]章秋芳,王中英,徐建平.非酒精性脂肪性肝病与冠状动脉粥样硬化相关性及冠脉病变特点分析[J].中国中西医结合消化杂志,2016,24(2):112-115.
[22]季明,曹晶珠,邹大进.2型糖尿病合并非酒精性脂肪肝患者γ-谷氨酰转肽酶水平与颈动脉粥样硬化斑块的相关性[J].中国临床医学,2015,24(6):760-764.
Study on the Relationship between Carotid AtheroscLerosis and Type 2 Diabetes Combined with Non Alcoholic Fatty Liver Disease/
MEI Xin.//Medical Innovation of China,2016,13(26):112-115
Objective:To study the non alcoholic fatty liver (NAFLD) and type 2 diabetes mellitus (T2DM)relationship with carotid artery lesions.Method:The research objects were a total of 100 patients met the inclusion criteria of type 2 diabetes mellitus patients during January 2013 to December 2014,including patients with nonalcoholic fatty liver disease in patients with 50 cases as the observation group,and the 50 cases with non-alcoholic fatty liver disease as the control group.Collected medical history (including smoking history, drinking history,duration etc.),recorded the general data of the two groups of body height, body mass,waist circumference,hip circumference,blood pressure,course of disease,liver function test and sugar,lipid metabolism,the carotid atherosclerotic plaque was detected. The biochemical criterion were measured CRP,glycosylated hemoglobin (HbA1c) level.Blood glucose and insulin levels,insulin resistance index (HOMA-IR) calculation.The indicators were compared between the two groups.Result:(1)The HbA1c,fasting blood glucose (FPG),2 h postprandial blood glucose (2 h PG),fasting insulin (FINS),2 h postprandial insulin (2 h INS) and HOMA-IR of the observation group were significantly higher than those of the control group,had statistical differences(P<0.05). (2)The changes of BMI,serum triglyceride (TG),cholesterol (TC),low density lipoprotein (LDL-C)were significantly higher than that of the control group,the above data had statistically significant differences (P<0.05).(3)The left,right carotid intima-media thickness,adiponectin (ICAM-1) and CRP levels of the observation groups were higher than those of the control group,had statistically significant differences(P<0.05). Conclusion:Type 2 diabetes individuals with non-alcoholic fatty liver disease are remarkable in metabolic disorder and insulin resistant,and be apt to get atherosclerosis.
Type 2 diabetes mellitus; Non alcoholic fatty liver disease; Atherosclerosis; Metabolic disorder
10.3969/j.issn.1674-4985.2016.26.030
2016-01-04) (本文编辑:蔡元元)
①新疆阿勒泰地区人民医院 新疆 阿勒泰 836500
梅歆
