ELISA与FACS定量方法检测血清AQP4抗体诊断NMO的Meta分析
2016-10-14杨彬彬孙艳霞刘磊孙林代飞飞王佳伟
杨彬彬 孙艳霞 刘磊 孙林 代飞飞 王佳伟
ELISA与FACS定量方法检测血清AQP4抗体诊断NMO的Meta分析
杨彬彬孙艳霞刘磊孙林代飞飞王佳伟
目的系统评价酶联免疫吸附试验(ELISA)、流式细胞术(FACS)检测血清水通道蛋白4抗体(AQP4-IgG)对诊断视神经脊髓炎(NMO)的准确性。方法检索国内外公开发表的相关文献。根据题目、摘要、全文逐步筛选,采用质量评价工具(QUADAS)分析文献质量。采用Meta-Disc1.4与STATA 12.0软件进行Meta分析。根据Meta分析结果综合评价ELISA和FACS方法诊断NMO的准确性。结果经过严格的纳入及排除标准,最终纳入17篇文献。ELISA和FACS方法合并敏感度分别为0.63(95%CI:0.58~0.68)和0.55(95%CI:0.48~0.61),合并特异度分别为0.98(95%CI:0.97~0.98)和0.99(95%CI:0.98~0.99)。拟合受试者工作特征曲线(SROC),得到SROC曲线下面积(AUC)分别为0.9521和0.9542。结论通过ELISA和FACS方法检测AQP-4-IgG对于诊断NMO特异度高,两者都具有较高的诊断效能和准确率。但受纳入研究质量和数量限制,两种方法诊断效能的一致性尚需开展更多高质量研究予以验证。
视神经脊髓炎;水通道蛋白4;酶联免疫吸附试验;流式细胞术;Meta分析
视神经脊髓炎(neuromyelitis optica,NMO)是主要累及视神经和脊髓的中枢神经系统炎性脱髓鞘病,其临床表现与多发性硬化(multiple sclerosis,MS)有相似之处,两者的鉴别诊断存在一定困难。近年来,学者们在NMO患者血清中发现一种作用于水通道蛋白4(aquaporin 4,AQP-4)的自身抗体(NMO-IgG/AQP4-IgG),对诊断NMO具有较高的敏感性和特异性,并在NMO和MS的鉴别诊断中具有重要意义。2006年,Wingerchuk等[1]将NMO-IgG检测结果纳入NMO 3个支持诊断标准。
AQP4-IgG的检测技术也成为研究的焦点。Ruiz-Gaviria等[2]研究发现,细胞荧光免疫染色技术(cell-based fluorescent immunostaining assay,CBA)和酶联免疫吸附技术(enzyme-linked immunosorbent assay,ELISA)都具有极高的特异度,CBA的灵敏度高于ELISA,两者均可以作为临床检测AQP4-IgG的可靠技术。近年来越来越多的证据表明[3-5],AQP4-IgG含量与NMO的严重程度及疾病活动有关。定量技术更利于长期监测血清AQP4-IgG的浓度,指导治疗和评估预后。ELISA是常用的定量检测技术,目前有商品化的AQP4-IgG ELISA试剂盒;流式细胞技术(fluorescence activated cell sorter,FACS)是在CBA技术基础上建立的定量检测技术[6],两种方法都具有适用于大规模与量化检测抗体的优势,尤其是对于活动期病情监控与复发患者的治疗具有重要的意义,并且相较CBA法而言,对AQP4-IgG的结果判读更加客观化。一系列临床研究就检测NMO患者AQP4-IgG的ELISA和FACS这两种方法的诊断效能进行了评估,但结论尚不一致[7]。本研究采用Meta分析方法,对已发表的有关研究ELISA和/或FACS技术检测NMO患者血清AQP4-IgG的文献进行分析,旨在系统评价ELISA和FACS法检测血清AQP4-IgG对诊断NMO的准确性。
1 资料和方法
1.1文献检索检索PubMed(www.ncbi.nlm.
nih.gov/pubmed)、Cochrane图书馆(www.coch
ranelibrary.com)、中国知网(CNKI,www.cnki.
net)和万方数据库(www.wanfangdata.com.cn)。英文检索词:“neuromyelitis optica”和“aquaporin 4”;中文检索词:“视神经脊髓炎”和“水通道蛋白4”;检索时间范围:2004-01-01—2016-03-31;研究对象:人类。为避免漏查文献,对所纳入文献和相关综述中提供的参考文献进行二次检索。纳入标准:(1)研究类型:采用ELISA或者FACS技术检测NMO患者血清AQP4-IgG的诊断性研究;(2)NMO患者的诊断参照Wingerchuk等1999年制订[8]或2006年修订[1]的NMO诊断标准;(3)能够获取完整文献;(4)能直接或间接计算真阳性、假阳性、真阴性、假阴性值。排除标准:(1)其他方法检测NMO患者血清AQP4-IgG的文献;(2)未说明诊断NMO患者的标准;(3)缺少对照组;(4)研究对象年龄<18岁;(5)原始文献实验设计不严谨,如重复性研究、统计方法错误、样本资料不全,不能直接或间接获得四格表资料;(6)为综述、 会议论文、 信件、 评论及个案报道类文献。
1.2方法
1.2.1文献评价方法:由2名研究者采用Cochrane协作网推荐的用于诊断性Meta分析的QUADAS(quality assessment of diagnostic accuracy studies)量表[9]独立评价文献质量。根据14个条目对纳入的每个研究逐条按 “是”、“否” 和 “不清楚”进行评价:“是”为满足此条标准,“否”为不满足或未提及,部分满足或从文献中无法得到足够信息的计为“不清楚”。并交叉核对,如遇分歧,则咨询第三方协助判断。
1.2.2数据收集:数据由2名研究者采用设定的表格独立收集。每篇文献的收集信息包括第一作者、出版年份、期刊名称、研究对象、参考标准、样本量、检测方法以及每种检测方法得到的真阳性、假阳性、真阴性和假阴性例数。必要时通过邮件或电话联系原作者提供数据。
1.3Meta分析和统计学处理采用Meta Disc 1.4和STATA 12.0 软件进行分析。采用Spearman相关分析检查由阈值效应引起的异质性,采用Q检验和Inconsistency(I2)评价非阈值效应引起的异质性,若异质性检验结果为P>0.10,可认为各研究具有同质性,若P≤0.10,则认为各研究结果间存在异质性;同时,结合I2对异质性进行定量分析,若I2=0,表明没有观察到异质性,I2分别为25%、50%、75%表示异质性的低、中、高,若I2>50%则表明存在比较明显的异质性。若各研究间无统计学异质性,采用固定效应模型进行 Meta分析;反之,则采用随机效应模型进行 Meta分析。按照相应的效应模型,分别对ELISA和FACS两种检测方法计算合并的敏感度(SEN)、特异度(SPE)、阳性似然比(positive likelihood ratio,+LR)、阴性似然比(negative likelihood ratio,-LR)、诊断比值比(diagnostic odds ratio,DOR)及其相应的95%CI。绘制敏感度和特异度的森林图以及汇总受试者工作特征曲线(summary receiver operating characteristic curve,SROC),计算曲线下面积 AUC和Q*指数。分别对ELISA和FACS研究的漏斗图进行线性回归,并计算P值检测发表偏倚,并进行敏感性分析。
2 结果
2.1文献检索结果共获得相关文献1140篇,经逐层筛选后,最终纳入17个研究[3,5-6,10-23]。文献筛选流程及结果见图1。
2.2纳入研究的基本特征与质量评价纳入研究的详细信息和质量评价见表1。纳入的17篇文献中,有关ELISA检测方法的文献12篇,NMO患者共390例,对照共1350例;涉及FACS检测方法的文献7篇,NMO患者共232例,对照共805例。除文献[14]参照的是1999年Wingerchuk等制订的标准外,其余文献均参照2006年Wingerchuk等修订的诊断标准。
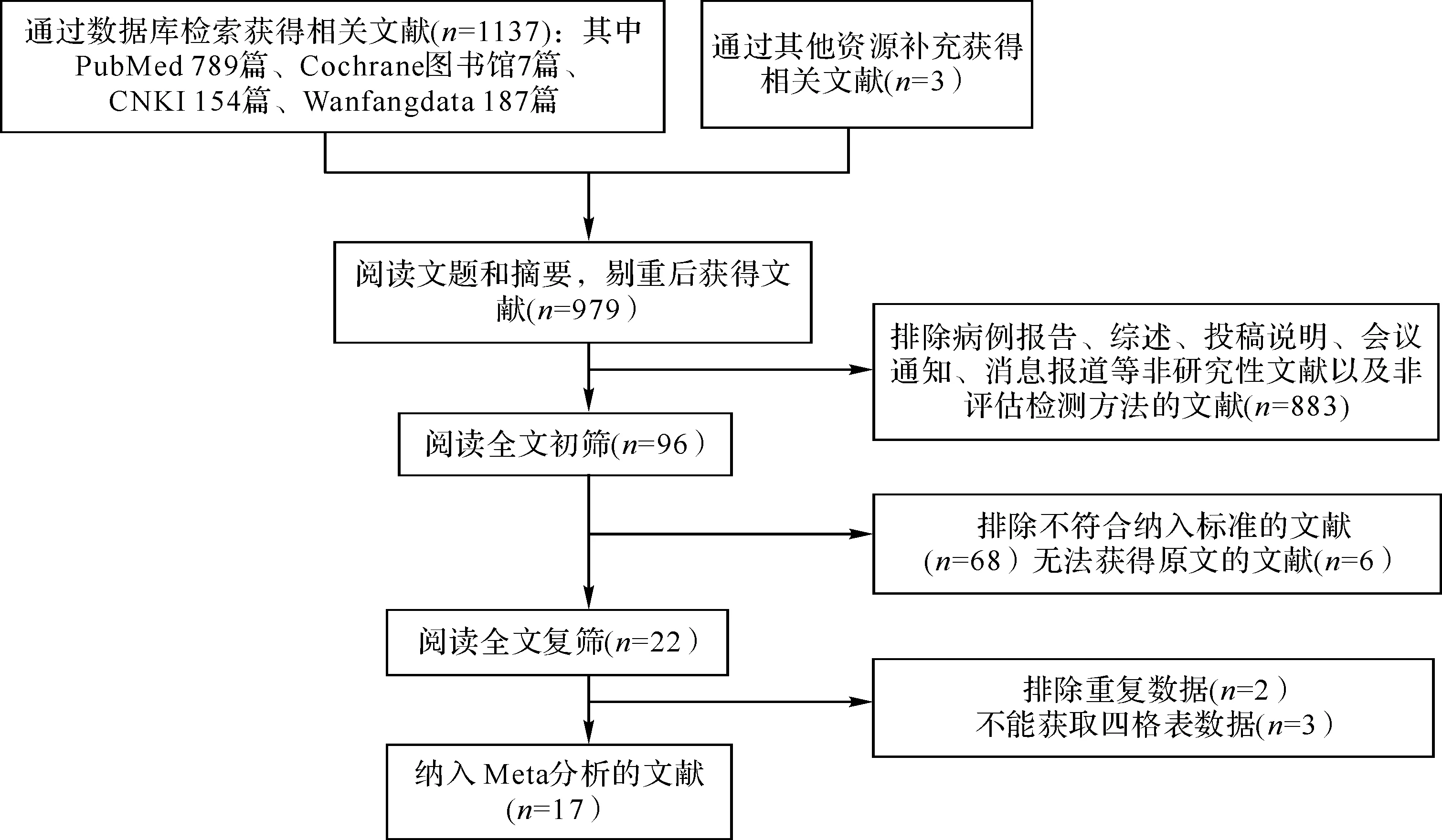
图1 文献筛选流程及结果
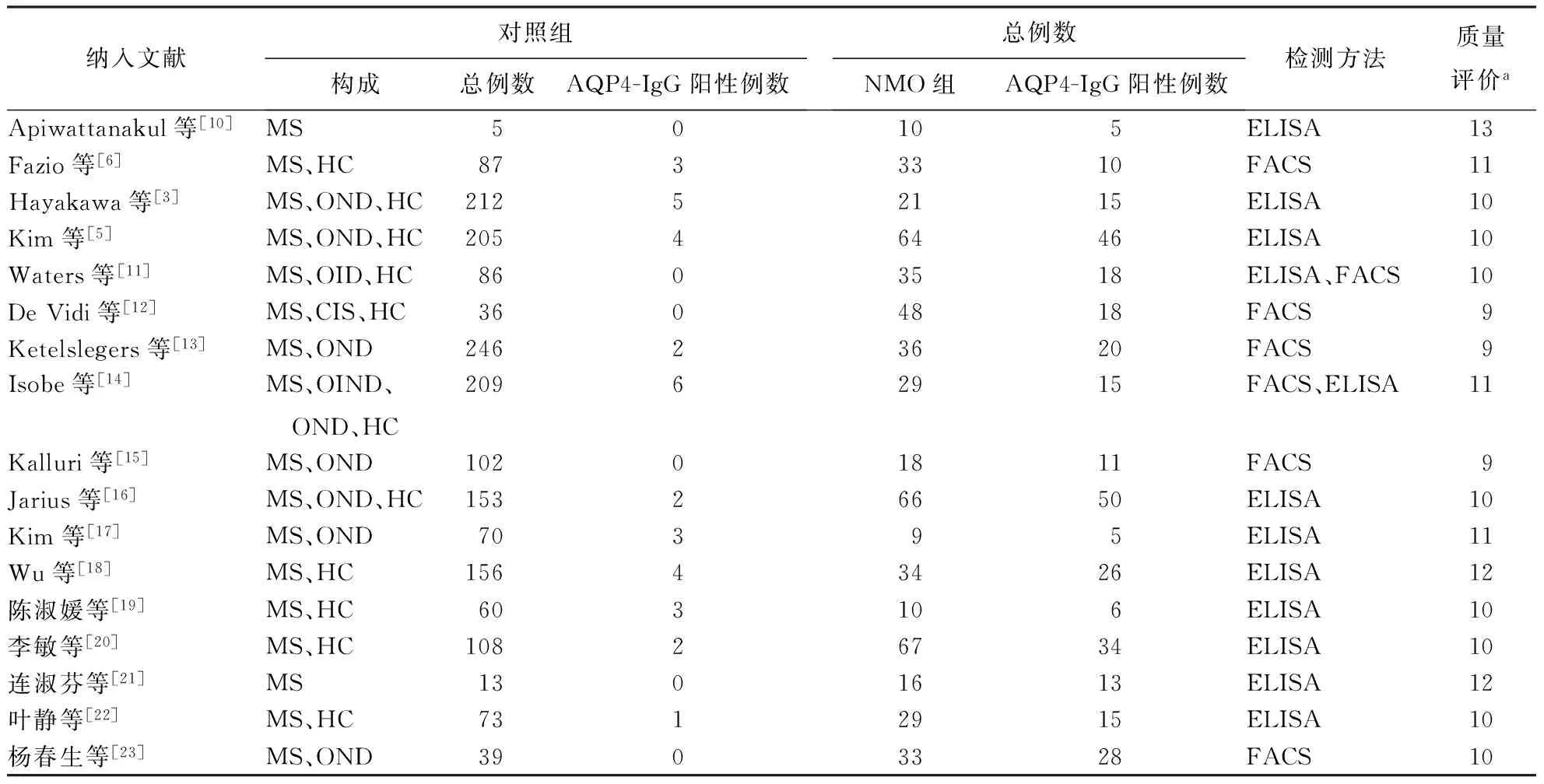
纳入文献对照组构成总例数AQP4-IgG阳性例数总例数NMO组AQP4-IgG阳性例数检测方法质量评价aApiwattanakul等[10]MS50105ELISA13Fazio等[6]MS、HC8733310FACS11Hayakawa等[3]MS、OND、HC21252115ELISA 10Kim等[5]MS、OND、HC20546446ELISA10Waters等[11]MS、OID、HC8603518ELISA、FACS10DeVidi等[12]MS、CIS、HC3604818FACS9Ketelslegers等[13]MS、OND24623620FACS9Isobe等[14]MS、OIND、 OND、HC20962915FACS、ELISA11Kalluri等[15]MS、OND10201811FACS9Jarius等[16]MS、OND、HC15326650ELISA10Kim等[17]MS、OND70395ELISA11Wu等[18]MS、HC15643426ELISA12陈淑媛等[19]MS、HC603106ELISA10李敏等[20]MS、HC10826734ELISA10连淑芬等[21]MS1301613ELISA12叶静等[22]MS、HC7312915ELISA10杨春生等[23]MS、OND3903328FACS10
注:FACS:流式细胞技术,表2~3、图3~4同;NMO:视神经脊髓炎;MS:多发性硬化;HC:健康对照;OND:其他神经系统疾病;OID:其他自身免疫性疾病;CIS:临床孤立综合征;OIND:其他炎性神经系统疾病;a表示满足QUADAS(quality assessment of diagnostic accuracy studies)量表独立评价文献质量的条目数量(总共14个条目)
2.3异质性检验
2.3.1阈值效应:ROC曲线平面图未呈“肩臂状”分布,提示不存在阈值效应。进一步计算灵敏度对数与(1-特异度)对数的Spearman相关系数,rELISA=-0.063,P=0.846;rFACS=-0.714,P=0.071,亦表明均不存在阈值效应。
2.3.2非阈值效应:ELISA法中参数敏感度、阴性似然比以及FACS法中各参数均存在非阈值效应引起的异质性,故Meta分析模型选用随机效应模型。ELISA方法中特异度、阳性似然比、诊断比值比的异质性检验P>0.1且I2<25%,故选用固定效应模型。结果见表2。
2.4Meta分析结果ELISA和FACS的合并效应量以及拟合SROC曲线得到AUC及 Q*值见表3,合并敏感度、特异度森林图、SROC 曲线见图 2~4。
2.5发表偏倚应用Deeks漏斗图法检测发表偏倚,结果显示ELISA及FACS法斜率系数差异均无统计学意义(均P>0.05),表明均不存在发表偏倚。
2.6敏感性分析分别将ELISA和FACS方法中纳入研究文献逐一剔除,重新进行 Meta 分析,结果显示,合并效应量未见明显改变,表明合并量稳定性较好。
3 讨论
NMO以其致残率高、易复发、预后差等特点严重威胁人类的健康。NMO-IgG/AQP4-IgG对NMO的早期诊断、治疗及判断预后具有至关重要的作用。Hayakawa等[3]研究发现AQP4-IgG浓度高的NMO患者症状亦较重,AQP4-IgG浓度随扩展残疾状态量表(expanded disability statusscale,EDSS)评分增高有升高趋势,免疫调节治疗后和疾病缓解期浓度降低。Kim等[5]也发现NMO患者血清AQP4-IgG含量在急性复发期显著高于缓解期,复发前期含量已经开始升高,AQP4-IgG含量与疾病活动呈正相关。AQP4-IgG含量可以监测疾病活动情况,同时结合影像学资料以及治疗情况的研究,可以分析出AQP4-IgG作为NMO生物指标的判断界值。然而,AQP4-IgG是否是预测NMO病情发展、转归的一个可靠标记物,仍然有待进一步证实。由于定量技术更利于长期客观地监测AQP4-IgG浓度,探讨与疾病严重程度的关系,而且ELISA和FACS可实现机械自动化,在费用相对低廉的前提下实现大样本量检测,因而对于临床推广该抗体检测应用有着重要的意义。
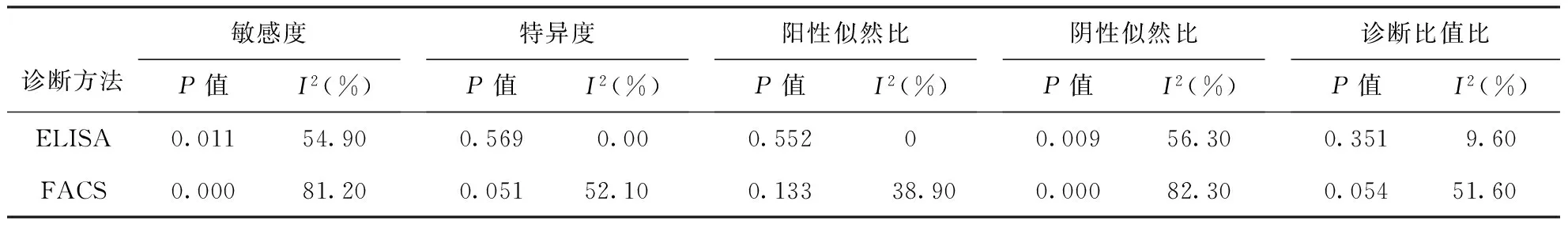
表2 ELISA和FACS两种方法各参数异质性检验结果

表3 ELISA和FACS方法参数合并统计结果
注:AUC:工作特征曲线下面积
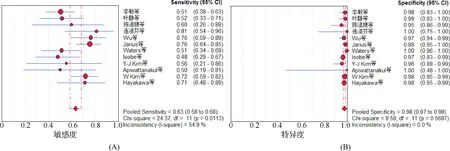
图2 ELISA敏感度(A)及特异度(B)森林图

图3 FACS敏感度(A)及特异度(B)森林图
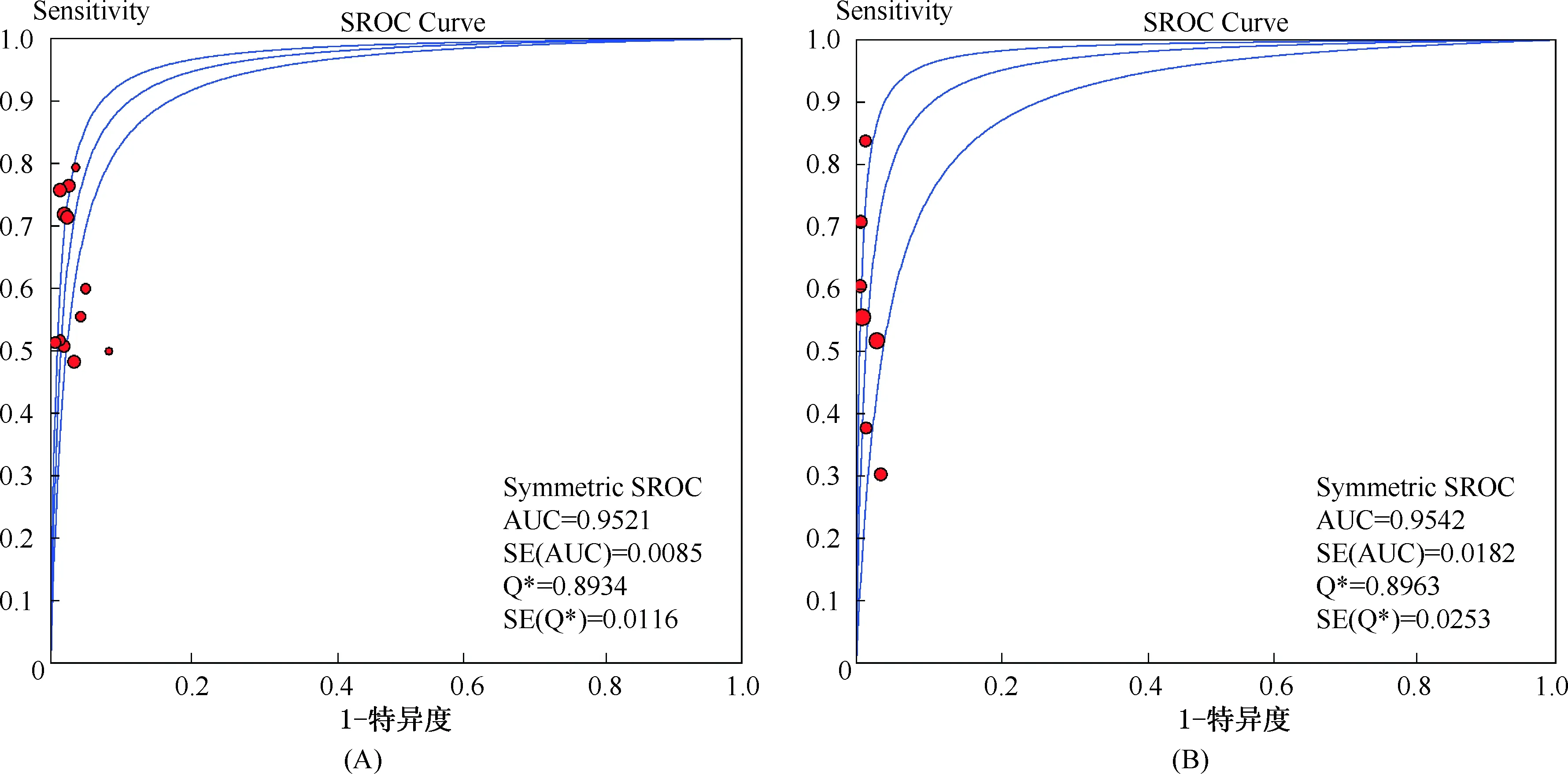
图4 ELISA(A)及FACS(B)的SROC曲线
基于上述原因,本研究对采用上述两种技术定量检测AQP4-IgG的研究文献进行了Meta分析,结果显示,ELISA和FACS检测AQP4-IgG合并特异度分别为0.98(95%CI:0.97~0.98)和0.99(95%CI:0.98~0.99),表明两种检测方法的特异度高,均可较好地避免误诊的发生。ELISA和FACS方法SROC的AUC分别为0.9521和0.9542,其对应的Q*指数分别为0.8934和0.8963。SROC曲线的AUC值是衡量某一诊断方法准确性的指标,AUC越接近1诊断效果越好,AUC>0.9时有较高的准确性。Q*值反映了ROC曲线与左上角的接近程度,可以对诊断性试验的综合能力进行判断,Q*值越大表示诊断性试验的准确率越高。综上结果表明,ELISA法和FACS法检测AQP4-IgG对于NMO的诊断都具有较高的诊断效能和准确率。同时,作者研究小组亦注意到ELISA和FACS合并敏感度分别为0.63(95%CI:0.58~0.68) 和0.55(95%CI:0.48~0.61),表明ELISA法的灵敏度较FACS法更高。分析其可能原因为:首先,由于两者纳入样本量不同所致,FACS纳入样本量低于ELISA法;其次,对于AQP4-IgG检测,两种方法的发展程度不同所致,ELISA方法较为成熟,而FACS方法尚处于研究阶段。
本研究存在一定的局限性。首先,异质性是Meta分析固有的局限性。由异质性检验结果可见,ELISA与FACS法数据均存在异质性,尤其是FACS法异质性较高,其可能原因为:(1)该Meta分析中纳入的大多数研究对象是亚洲人群,这可能会导致人口选择偏倚。(2)目前已知AQP4存在 2 种亚型,即M1和M23[24],FACS方法中纳入的文章由于采用人AQP4 cDNA质粒M1或M23进行转染,转染到人胚肾细胞(HEK293细胞)[6,11-14,23]或者人神经胶质瘤细胞系(LN18)[15],这些技术的不同也会产生异质性。(3)ELISA方法中由于使用了不同公司生产的试剂可能会导致检测偏倚。(4)由于患者可能处于不同病程期,检测时间点不同,以及可能存在药物治疗等影响因素而产生异质性。(5)采用的诊断标准不同,其中包括1999年和新修订的2006年Wingerchuk诊断标准,可能导致多重参照偏倚。受制于纳入研究的文献数量不足,本文未对引起异质性的原因进行进一步亚组分析。此外,排除诊断方法造成的假阴性,仍有少部分的NMO患者血清中检测不到AQP4-IgG[25]。这部分AQP4-IgG阴性的患者可能与AQP4-IgG阳性患者存在不同的发病机制,或者由其他抗体,如髓鞘少突胶质细胞糖蛋白抗体(MOG-IgG)介导[26]。
此外,本文Meta分析亦存在下列局限性:(1)纳入文献质量多为中等,整体质量不高,这在一定程度上影响了研究结论的可靠性。(2)仅纳入了中、英文文献,不排除语言偏倚的可能。(3)发表偏倚不容忽视,本研究通过漏斗图法未检测到发表偏倚。
综上所述,ELISA和FACS作为检测AQP4-IgG的两种定量方法,其特异度高,均具有较高的诊断效能和准确率,对NMO的诊断、鉴别诊断、指导治疗及预后评估有重要价值。但受纳入研究质量和数量限制,两种方法诊断效能的一致性尚需开展更多高质量研究予以验证。
[1]Wingerchuk DM, Lennon VA, Pittock SJ, et al. Revised diagnostic criteriafor neuromyelitis optica[J]. Neurology,2006,66(10):1485-1489.

[3]Hayakawa S, Mori M, Okuta A, et al. Neuromyelitis optica and anti-aquaporin-4 antibodies measured by an enzyme-linked immunosorbent assay[J]. J Neuroimmunol,2008,196(1-2):181-187.
[4]Jarius S,Aboul-Enein F,Waters P,et a1.Antibody to aquaporin-4 in the long-term course of neuromyelitis optica[J].Brain,2008,131(7):3072-3080.
[5]Kim W, Lee JE, Li XF, et al. Quantitative measurement of anti-aquaporin-4 antibodies by enzyme-linked immunosorbent assay using purified recombinant human aquaporin-4[J]. Mult Scler,2012,18(5):578-586.
[6]Fazio R, Malosio M, Lampasona V, et al. Antiacquaporin 4 antibodies detection by different techniques in neuromyelitis optica patients[J]. Mult Scler,2009,15(10):1153-1163.
[7]Jarius S, Wildemann B.Aquaporin-4 antibodies (NMO-IgG) as a serologicalmarker of neuromyelitis optica: a critical review of the literature[J]. Brain Pathol,2013,23(6):661-683.
[8]Wingerchuk DM, Hogancamp WF, O’Brien PC,et al. The clinical course of neuromyelitis optica (Devic′s syndrome)[J]. Neurology,1999,53 (5):1107-1114.
[9]Whiting P, Rutjes AW, Reitsma JB, 等. QUADAS的制定: 用于系统评价中评价诊断性研究质量的工具(刁骧,艾昌林译)[J]. 中国循证医学杂志,2007,7(4): 296-306.
[10]Apiwattanakul M, Asawavichienjinda T, Pulkes T, et al. Diagnostic utility of NMO/AQP4-IgG in evaluating CNS inflammatory disease in Thai patients[J]. J Neurol Sci,2012,320(1-2):118-120.
[11]Waters PJ, McKeon A, Leite MI, et al. Serologic diagnosis of NMO: a multicenter comparison ofaquaporin-4-IgG assays [J].Neurology, 2012,78 (9):665-671.
[12]De Vidi I, Boursier G, Delouche N, et al. Strategy for anti-aquaporin-4 auto-antibody identification and quantification using a new cell-based assay[J].Clin Immunol, 2011,138(3):239-246.
[13]Ketelslegers IA, Modderman PW, Vennegoor A, et al. Antibodies against aquaporin-4 in neuromyelitis optica: distinction between recurrent and monophasic patients[J]. Mult Scler,2011,17(12):1527-1530.
[14]Isobe N, Yonekawa T, Matsushita T, et al. Quantitative assays for anti-aquaporin-4 antibody with subclass analysis in neuromyelitis optica[J]. Mult Scler,2012,18(11):1541-1551.
[15]Kalluri SR, Illes Z, Srivastava R, et al. Quantification and functional characterization of antibodies to native aquaporin 4 in neuromyelitis optica[J]. Arch Neurol,2010,67(10):1201-1208.
[16]Jarius S, Franciotta D, Paul F, et al. Testing for antibodies to human aquaporin-4 by ELISA: Sensitivity, specificity, and direct comparison with immunohistochemistry[J]. J Neurol Sci,2012,320(1-2):32-37.
[17]Kim Y, Jung S, Kim Y, et al. Detection of anti-aquaporin-4 antibodies in neuromyelitis optica: Comparison of tissue-based and cell-based indirect immunofluorescence assays and ELISA[J]. J Clin Lab Anal,2012,26(3):184-189.
[18]Wu X, Liao Z, Ye J, et al. Seropositivity rates of waterchannel protein 4 antibodies compared between a cell-based immunefluorescence assay and an enzyme-linked immunosorbent assay in neuromyelitis optica patients[J]. Neural Regen,2011, 6 (32):2490-2494.
[19]陈淑媛,吴哲,付贺飞,等. 水通道蛋白4抗体对视神经脊髓炎的诊断价值[J]. 中国神经免疫学和神经病学杂志,2014,21(5):332-334.
[20]李敏,秦新月. 多种方法检测视神经脊髓炎患者血清及脑脊液中水通道蛋白4抗体的临床应用[J]. 中国实验诊断学,2015(8):1261-1263.
[21]连淑芬. 抗水通道蛋白-4抗体应用于中枢神经系统脱髓鞘疾病的鉴别诊断价值[J]. 检验医学与临床,2015(14):2051-2052.
[22]叶静,廖张元,孙慧,等. 视神经脊髓炎特异性抗体三种检测方法比较[J].中华内科杂志,2011,50(10):848-850.
[23]杨春生. 水通道蛋白-4抗体检测平台的建立及其对临床的指导意义[D]. 天津:天津医科大学,2010.
[24]Furman CS, Gorelick-Feldman DA, Davidson KG, et al.Aquaporin-4 square array assembly:opposing actions of M1 andM23 isoforms[J].Proe Natl Acad Sci USA,2003,100(100):13609-13614.
[25]Marignier R,Bernard-Valnet R,Giraudon P,et a1.Aquaporin-4 antibody-negative neuromyelitis optica:distinct assay sensitivity dependent entity[J].Neurology,2013,80(24):2194-2200.
[26]Kitley J,Woodhall M,Waters P,et a1.Myelin-oligodendrocyte glyeoprotein antibodies in adults with a neuromyelitis optica phenotype[J].Neurology,2012,79(12):1273-1277.
(本文编辑:时秋宽)
Quantitative detection of aquaporin-4 antibody in serum by ELISA and FACS in the diagnosis of neuromyelitis optica: A meta-analysis
YANGBinbin,SUNYanxia,LIULei,SUNLin,DAIFeifei,WANGJiawei*.
*Medical Research Center, Tongren Hospital, Capital Medical University; Department of Neurology, Tongren Hospital, Capital Medical University, Beijing 100730,China
Correspondingauthor:WANGJiawei,Email:wangjwcq@163.com
ObjectiveTo systematically review the diagnostic accuracy for neuromyelitis optica (NMO) depending on detection of aquaporin-4(AQP-4) antibody in serum by enzyme-linked immunosorbent assay(ELISA) and flow cytometry(FACS). MethodsA search of major digital database and hand search of
were conducted. All published studies relating to the detection of AQP-4 antibody in serum by ELISA and FACS for patients with NMO were retrieved. Two reviewers independently and stepwisely screened the literature according to the titles, abstracts and the full texts, extracted data, and methodological quality of included studies was assessed by QUADAS. Meta-analysis was then conducted using Meta-Disc 1.4 and STATA 12.0 software. The overall sensitivity and specificity of ELISA and FACS were pooled separately and compared with overall accuracy measure: summary receiver operating characteristic curve (SROC). ResultsAfter applying the inclusion and exclusion criteria, 17 studies were included in this systematic review and meta-analysis. The results of meta-analysis showed: the pooled sensitivity of ELISA was 0.63(95%CI:0.58-0.68) and FACS 0.55(95%CI:0.48-0.61), the pooled specificity of ELISA was 0.98(95%CI:0.97-0.98) and FACS 0.99 (95%CI:0.98-0.99). The AUCs for ELISA and FACS were similar (0.9521 and 0.9542, respectively). ConclusionsAQP4 detection in serum with ELISA or FACS is a useful tool for the diagnosis of patients with NMO, due to high specificity and excellent AUC results. However, due to limited quality and quantity of the included studies, more well-conducted studies are needed to verify the consistency of diagnostic efficacy between two methods.
neuromyelitis optica; aquaporin 4; ELISA; FACS; meta-analysis
3969/j.issn.1006-2963.2016.05.009
100730 首都医科大学附属北京同仁医院中心实验室(杨彬彬、孙艳霞、王佳伟),神经内科(刘磊、孙林、代飞飞、王佳伟)
王佳伟,Email:wangjwcq@163.com
R744.5+2
A
1006-2963(2016)05-0344-07
2016-05-18)
