电生理检测结果对眼肌型重症肌无力患者预后的影响
2016-10-14侯世芳刘银红许贤豪王湘
侯世芳 刘银红 许贤豪 王湘
电生理检测结果对眼肌型重症肌无力患者预后的影响
侯世芳刘银红许贤豪王湘
目的探讨电生理检测结果正常与否对单纯眼肌型重症肌无力(ocular myasthenia gravis,oMG)患者进一步向全身型发展的预测价值,并分析oMG向全身型转化的相关影响因素。方法回顾性分析2006-5—2009-5北京医院神经内科住院的76例起病至少3个月后症状仍局限在眼外肌的oMG患者的临床资料,根据住院期间的低频重复电刺激(RNS)和单纤维肌电图(SFEMG)检测结果分为电生理检测阴性组和阳性组,对患者随访5~10年,分析其住院期间的临床特征、治疗干预(胸腺切除和/或免疫抑制剂治疗)情况及预后转归情况,并对转化为全身型重症肌无力(generalized MG,gMG)患者进一步分析其转化的相关危险因素。结果76例患者中共17例(22.37%)最终转化为gMG,其中电生理阳性组转化为gMG的百分率高于电生理阴性组(33.33%比6.45%;χ2=7.638,P<0.01);转化时间:2年内6例,2~5年10例,5年后仅为1例;转化为gMG结局组中胸腺异常(胸腺增生或胸腺瘤)的百分率(94.11%比64.41%;χ2=4.312,P<0.05)及起病年龄〔(44.24±24.43)岁比(31.08±25.03)岁;t=-1.927,P<0.05〕明显高于未转化组(oMG结局组)。无论电生理阳性与否,早期治疗干预(胸腺切除和/或免疫治疗)对oMG患者向gMG转化的影响无统计学意义。结论仅有少部分的oMG患者会向全身型转化,其中电生理阳性的oMG患者更易于发生,转化时间大多在5年内。早期治疗干预(胸腺切除和/和免疫治疗)对临床转归没有明显影响。胸腺异常(胸腺增生或胸腺瘤)及起病年龄大的oMG患者易于向全身型转化。
重症肌无力;眼肌型;电生理检测
眼外肌起病是重症肌无力(myasthenia gravis,MG)患者最常见的起始症状,临床上大部分患者病情发展,很快累及其他部位骨骼肌,称为全身型MG(generalized MG,gMG);少数患者症状较长时间局限在眼外肌,称为眼肌型MG(ocular MG,oMG)[1]。近年有研究报道约50%~60%的oMG患者病程中仍会进展为gMG,且一般在起病的1~2年内[2],并认为早期胸腺切除或免疫治疗可阻止或延缓其向全身型进展[3],但并没有发现可预测其进展的确切危险因素。重复电刺激(repetitive nerve stimulation,RNS)和单纤维肌电图(single fiber electromyography,SFEMG)是MG最常用的电生理检测手段[4]。作者在长期观察中发现以上电生理检测阳性的oMG患者易于发展为全身型,推测电生理检测结果对oMG的预后可能有一定预测价值。本研究对作者医院就诊的76例oMG患者进行了5~10年随访,探讨了电生理检测结果与患者预后的关系,并分析早期治疗干预的作用以及oMG患者向全身型转化的影响因素。
1 对象和方法
1.1对象收集2006-5—2009-5作者医院住院的MG患者共368例,按照美国重症肌无力协会(MGFA)推荐的临床分型标准,将症状只局限在眼外肌、提上睑肌的患者归为oMG。本研究共纳入oMG患者106例,其中起病至少3个月后症状仍局限于眼外肌者85例。85例患者均符合oMG的诊断标准:即临床上表现为单纯眼外肌麻痹症状(单侧和/或双侧上睑下垂伴或不伴复视);症状具有晨轻暮重和活动后加重休息后减轻的特点;疲劳试验和新斯的明试验阳性;伴或不伴低频RNS和/或SFEMG检查阳性。排除标准:排除存在面肌无力(包括闭目力弱)、咀嚼无力、球麻痹、颈肌无力、四肢或躯干无力以及呼吸肌无力任一症状者;排除神经系统和眼科其他疾病。排除9例失访者,最终76例患者入组。
1.2 方法记录oMG患者的一般临床特征、实验室检查、治疗、转归及随访等结果。
1.2.1临床特征:收集患者性别构成、起病年龄、病程、胸腺切除情况、胸腺病理等资料。
1.2.2治疗干预情况:所有患者均给予溴吡斯的明治疗,对效果不理想患者进行胸腺切除和/或单纯免疫抑制剂治疗(硫唑嘌呤、环孢素或环磷酰胺),症状重者短期联合糖皮质激素治疗(泼尼松口服或甲强龙冲击治疗后逐渐减量为口服,2~3个月内减完),免疫抑制剂疗程1~2年。
1.2.3随访:对患者进行5~10年门诊或电话随访。根据随访结果,将转化为全身型的患者称为gMG结局组,症状仍局限于眼肌者称为oMG结局组,比较两组的临床特征,并分析早期治疗干预对临床转化的影响。
1.2.4肌电图检查:所有患者在住院期间均行肌电图检查,包括低频RNS和SFEMG。(1)RNS检查:使用表面电极分别在桡、腋、副和面神经上给予刺激,表面记录电极分别在肘肌、三角肌、斜方肌和口轮匝肌的肌腹上,每根神经依次给予3、5 Hz的低频超强刺激,每次刺激后肌电图仪自动记录并计算出复合肌肉动作电位(CMAP)的波幅衰减幅度,根据作者医院肌电图室的诊断标准,低频RNS波幅衰减>15%为异常。(2)SFEMG检查:将特殊的单纤维针电极插入伸指总肌,嘱患者轻抬中指,检查者微动电极找到两个或两个以上动作电位,保持针电极的位置不动使其连续稳定发放100次,肌电图机软件系统自动计算出平均连续的波间期差异(MCD)即为单个电位对的颤抖(jitter)值。如在发放过程中出现电位脱落即为阻滞(blocking),按上述方法在不同部位测定20个左右电位正确的jitter值,最后算出平均jitter值。根据作者医院肌电图室SFEMG异常的诊断标准,平均jitter值>41 μs,或有10%以上电位对jitter>55 μs或出现传导阻滞,满足以上2条中的1条即为异常[5]。根据电生理检查结果将患者分为电生理阴性组(即RNS和SFEMG检查结果均正常)和电生理阳性组(RNS和/或SFEMG检查结果异常)。对两组患者的临床特征、胸腺切除及免疫治疗情况、临床预后等情况进行比较。
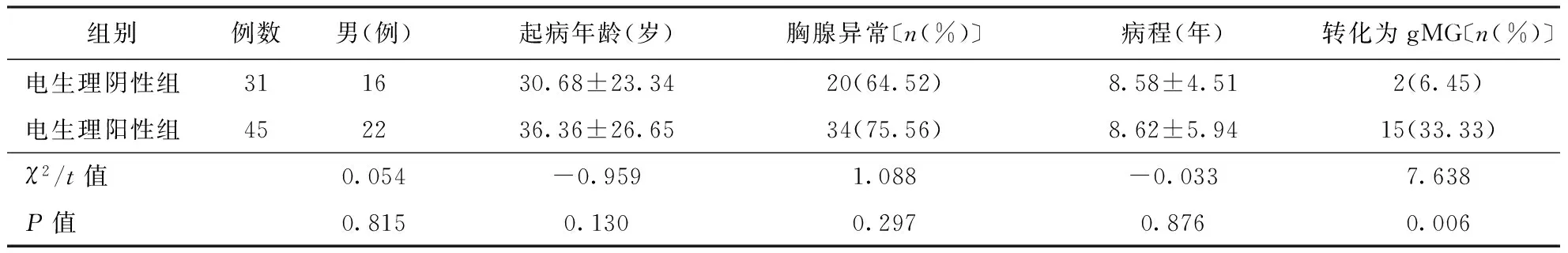
表1 两组患者临床特征及预后情况比较
注:gMG:全身型重症肌无力,表2、3同

表2 不同临床结局组临床资料比较
注:oMG:眼肌型重症肌无力,表3同
1.3统计学处理应用SPSS19.0统计软件进行分析,符合正态分布的计量资料采用均数±标准差表示,采用独立样本t检验;计数资料比较应用卡方检验或Fisher确切检验法。以P<0.05认为差异有统计学意义。
2 结果
2.1临床特征76例oMG患者中男38例,女38例;起病年龄2~87岁,平均(34.44±23.12)岁;病程2~40年,平均(8.61±5.37)年;胸腺正常者22例(28.9%),胸腺增生42例(55.3%),胸腺瘤12例(15.8%)。
2.2不同电生理结果组临床特征及预后比较76例患者中电生理阴性组31例(41.00%),阳性组45例(59.00%),两组间性别构成、起病年龄、胸腺异常比例及病程间比较差异均无统计学意义(P>0.05)。经5~10年随访,有17例患者转化为gMG(22.37%),其中电生理阳性组转化的百分率明显高于电生理阴性组(P<0.01)。结果见表1。
2.3不同临床结局组临床特征比较gMG结局组共17例,oMG结局组共59例,两组间性别构成、病程、接受治疗干预(胸腺切除和/或免疫治疗)情况差异无统计学意义;gMG结局组患者的起病年龄明显高于oMG结局组(P=0.049);胸腺异常(包括胸腺增生或胸腺瘤)百分率明显高于oMG结局组(P=0.038)。17例gMG结局组患者中,转化为gMG的时间发生于起病2年内6例(6/17),2~5年10例(10/17),大于5年1例(1/17)。结果见表2。
2.4治疗干预对患者临床转归的影响治疗干预(胸腺切除和/或免疫治疗)对电生理阳性组及阴性组的oMG患者向gMG转化的影响均未达统计学意义(均P>0.05)。结果见表3。

表3 不同治疗干预对oMG患者临床转归的影响比较
注:“-”采用Fisher精确概率法,无χ2值
3 讨论
由于MG患者受累肌群不同,其临床症状及病情轻重差异很大。Grob等[6]通过对1976例MG患者的回顾性研究发现,80%以眼部症状起病的患者会进展为全身型,其中1个月内占20%,6个月内占68%,1年内占88%。国内一项针对770例起病1个月后症状仍局限在眼外肌的oMG患者进行5年以上的随访研究发现,26%患者进展为全身型,其中2/3发生在2年内,84%发生在5年内[7]。本研究以电生理检测结果对患者分组,通过5~10年随访观察oMG患者的临床预后,结果发现,76例oMG患者中22.37%的患者进展为gMG,且电生理阳性组进展为全身型的百分率明显高于电生理阴性组,提示电生理检查结果阳性的oMG患者更易于向全身型转化。改良Osserman 和美国MGFA提出的MG临床分型中均未对眼肌型即Ⅰ型的持续时间做出界定,也没有将眼轮匝肌受累的归属问题作出具体说明。因多数MG患者眼外肌首先受累后短期即出现全身症状,既往对MG眼外肌症状持续多长时间即视为眼肌型尚无统一观点,Grob等将起病后1个月病情仍局限在眼肌者归类为Ⅰ型[6],而Sommer等[8]则认为应持续至少3个月方可认为是Ⅰ型。尽管这些观点具有主观性,但均一致认为以眼肌型起病但早期即出现全身症状者不能属于眼肌型,应为全身型。因此,本文作者亦主张对眼肌受累患者预后的判断选择起病至少3个月以上症状仍局限在眼肌。原则上单纯眼肌型应该指症状仅局限在眼外肌,即提上睑肌、四组直肌和上斜肌几组支配眼球运动的肌肉,这些肌肉均由眼球运动神经支配,其突触后膜乙酰胆碱受体的抗原性不同于其他骨骼肌,因此易于受累[9];而眼轮匝肌为面神经支配,不应属于眼外肌范畴,故单纯眼肌型不应该包括眼轮匝肌受累,提示一旦出现眼轮匝肌症状即存在面肌受累,应为轻度全身型(Ⅱa型)。目前多数研究仍将眼轮匝肌归到眼外肌,以至扩大了眼肌型范畴,将许多轻度全身型患者误视为眼肌型,这可能是导致其结果中向全身型转化率高的原因。本研究oMG入组标准中不包含伴有眼轮匝肌受累的患者,且诊断oMG时间的界定较严格,这可能是本研究发现oMG患者比例和向全身转化比例均低的原因。
目前对MG 患者的常规电生理检测手段中RNS主要检测尺神经、腋神经和面神经,SFEMG主要测定伸指总肌。目前尚难以对支配眼球运动的肌肉进行常规电生理检测[10]。多数研究认为oMG患者的电生理阳性率为50%左右[5]。本研究中oMG患者电生理阳性率为59.00%,与上述结果相仿。因电生理技术往往在临床症状出现之前即可测出MG患者神经-肌肉接头间存在的传递障碍,故oMG患者出现电生理异常即提示存在潜在的全身肌肉(面肌或四肢肌肉)的亚临床受累,将来有可能发展为临床受累。美国MGFA临床分型中对oMG的界定仅根据临床症状,没有对电生理结果做具体要求。作者医院的临床实践中是将电生理阳性的oMG患者视为轻度全身型,即Ⅱa型,仅将电生理阴性的患者归于Ⅰ型。本研究发现电生理阳性的oMG患者更易于向全身型转化,为上述观点提供了证据。由于在应用糖皮质激素治疗的早期,尤其糖皮质激素冲击治疗时,大部分患者可有不同程度的肌无力加重,从临床治疗的观点,若为Ⅰ型MG患者,可在门诊接受治疗,即使稍有加重也无生命危险,若为全身型早期的眼外肌症状者,应收住院接受糖皮质激素治疗,防止症状加重可能出现呼吸肌受累而危及生命。因此,对临床上仅表现为眼外肌受累的MG患者,鉴别其是单纯眼肌型亦或是全身型早期眼部表现显得非常重要。本研究结果提示电生理检测不仅有助于早期识别潜在全身受累的oMG患者,也有助于预测其临床预后,指导治疗方案的选择,具有较大临床意义。既往仅有少数研究评价了电生理检查对单纯眼肌受累患者预后的影响,认为RNS和SFEMG均不是oMG向全身型转化的预测因素,但SFEMG正常者症状局限于眼肌者居多[11]。但这些研究均存在病例少及随访时间短的缺点,尚不能提供可靠结论。最近韩国进行了一项大样本病例研究,对202例眼肌型患者进行了至少2年的预后分析发现,转化为全身型者共47例(23.3%),电生理异常者易于向全身型转化[12]。本研究结果与此结果相符,且随访时间更长。本研究亦发现,转化为全身型患者中,转化发生在起病2年内6例(6/17),2~5年间10例(10/17),5年后1例(1/17),进一步提示转化大多发生在5年内,5年后转化几率减小。既往多数研究发现,oMG患者向gMG转化大多在2年内,2年内未发展的患者2年后再进展的可能性小[2],这可能与oMG入组标准不严格和随访时间不够长有关。本研究经过长达5~10年的随访,结果提示对患者预后的判断要有足够时间,尤其对电生理阳性者。
对oMG患者是否需要早期免疫治疗的问题一直是近年争论的焦点,因局限于眼肌的症状不会危及生命,免疫抑制剂又存在众所周知的不良反应,治疗的结果往往弊大于利。但大多数研究仍认为早期免疫干预治疗可防止或延缓眼肌型患者向全身的进展[3]。本研究发现胸腺切除和/或免疫治疗可降低电生理异常oMG患者向gMG转化的百分率,但差异未达统计学意义,提示早期胸腺切除和/或免疫治疗只能控制近期临床症状,对疾病本身的长期预后可能帮助不大,临床可根据具体情况首先选择相对风险较小的治疗方案,病情控制不理想再行胸腺切除和/或免疫抑制剂治疗。
本研究同时发现转化为全身型患者中合并胸腺异常的百分率和起病年龄明显高于未转化组。Kupersmith等研究和国内研究也发现发病年龄与oMG的预后有关,大于50岁的患者易于进展为全身型[13,10]。提示对起病年龄大且伴电生理异常的胸腺增生oMG患者应密切随访,必要时可早期进行胸腺切除和/或免疫治疗,而胸腺瘤患者因存在潜在恶性可能应早期手术。本研究病例数相对较少,且为回顾性研究,对oMG患者早期治疗干预(胸腺切除和/或免疫治疗)能否改善长期预后尚需做进一步前瞻性随机对照研究。
[1]Jaretzki A 3rd, Barohn RJ, Ernstoff RM, et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Mvasthenia Gravis Foundation of America[J]. Ann Thoracsurg, 2000, 70(1):327-334.
[2]Kupersmith MJ, Latkany R, Homel P. Development of generalized disease a 2 years in patients with ocular myasthenia gravis[J]. Arch Neurol, 2003, 6(2):243-248.
[3]Mee J, Paine M, Byrne E, et al. Immunotherapy of ocular myasthenia gravis reduces conversion to generalized myasthenia gravis[J].Neuro Ophthalmol,2003,23(4):251-255.
[4]Srivastara A, Kalita J, Misra UK, et al.A comparative study of single-fiber electrography and repetitive nerve stimulation in consecutive patients with myasthenia gravis[J]. Electromyogr Clin Neurophysiol,2007,47(2):93-96.
[5]Plomp JJ, Morsch M, Phillips WD. Electrophysiological analysis of neuromuscular synaptic function in myasthenia gravis patients and animal models[J]. Exp Neurol, 2015,270(1):41-54.
[6]Grob D, Brenner N, Namba T, et al. Lifetime course of myasthenia gravis[J].Muscle Nerve,2008,37(2):141-149.
[7]景筠,张晓君,于磊,等.眼肌型重症肌无力向全身型转化的预后因素[J].中华神经科杂志,2014,47(1):21-25.
[8]Sommer N, Melms A, Weller M. Ocular myasthenia gravis, A critical review of clinical and pathophysiological aspects[J].Doc Ophthalmol,1993,84(4):309-333.
[9]Hughes BW, Decasillas MLM, Kaminski HJ. Pathophysiology of myasthenia gravis[J]. Semin Neurol,2004,24(1):21-30.
[10]刘银红,许贤豪,侯世芳.重症肌无力患者临床绝对评分和电生理检查相关性研究[J]. 中国神经免疫学和神经病学杂志,2005,12(2): 67-69.
[11]Weimberg DH, Rizzo JF, Hayes MT, et al. Ocular myasthenia gravis: predictive value of single-fiber electromyography[J].Muscle Nerve,1999,22(9):1222-1227.
[12]Hong YH, Kwon SB, Kim BJ, et al. Prognosis of ocular myasthenia in korea: A retrospective multicenter analysis of 202 patients[J].Neurol Sci, 2008, 273(1-2):10-14.
[13]Kupersmith MJ. Ocular myasthenia gravis: Treatment successes and failures in patients with long-term follow-up[J].Neurol, 2009,256(8):1314-1320.
(本文编辑:时秋宽)
Effects of electrophysiological testing results on the prognosis of patients with ocular myasthenia gravis
HOUShifang,LIUYinhong*,XUXianhao,WANGXiang.
*DepartmentofNeurology,BeijingHospital,NationalCenterofGerontology,Beijing100730,China
Corresponding author: LIU Yinhong, Email:liuyh302@126.com
ObjectiveTo analyze the predictive value of electrophysiological results on generalized myasthenia gravis(gMG) progression in patients with ocular myasthenia gravis (oMG) and assess related influencing factors of generalized transformation. MethodsA retrospective analysis of clinical data of 76 oMG patients hospitalized from May 2006 to May 2009 in Department of Neurology, Beijing hospital, whose symptoms were still confined to the extraocular muscles after at least three months of the onset was performed.According to test results of repetitive nerve stimulation (RNS) and Single Fiber Electromyography (SFEMG) during hospitalization, patients were divided into the electrophysiological testing negative and positive groups. We followed up all patients for 5-10 years, analyzed their clinical characteristics, therapeutic interventions (thymectomy and/or immunosuppressive therapy) situation and prognostic outcome during hospitalization, and related influencing factors of transformation were further analyzed in patients transformed into gMG. Results17 of 76 patients (22.37%) were ultimately transformed into gMG, and the percentage of gMG transformation in the electrophysiological positive group was significantly higher than that of the electrophysiological negative group (33.33%vs. 6.45%;χ2=7.638,P<0.01). The transformation time: 6 cases in 2 years, 10 cases in 2-5 years, only one case after 5 years. The percentage of abnormal thymus (thymic hyperplasia or thymoma)(94.11%vs. 64.41%;χ2=4.312,P<0.05) and age of onset[(44.24±24.43)vs.(31.08±25.03)years old;t=-1.927,P<0.05] in patients converted to gMG were significantly higher than those of the untransformed group (oMG group). Whether the electrophysiological results were positive or not, early therapeutic interventions (thymectomy and/or immunotherapy) showed no significant effect on clinical outcome. ConclusionsOnly a few of oMG patients will transfer to gMG and the electrophysiological results are more commonly positive. Transformation time is mostly within 5 years. Early therapeutic interventions (thymectomy and/or immunotherapy) showed no significant effect on clinical outcome. Abnormal thymus (thymic hyperplasia or thymoma) and old age of onset are also risk factors for generalized transformation.
myasthenia gravis; ocular; electrophysiological testing
10.3969/j.issn.1006-2963.2016.05.003
100730 北京医院神经内科 国家老年医学中心
刘银红,Email:liuyh302@126.com
R746.1
A
1006-2963(2016)05-0317-05
2016-04-26)
