胚胎神经干细胞对巨噬细胞分泌炎性反应因子的影响
2016-10-14祝文王涛宁焦峰军贺西京
祝文 王涛宁 焦峰军 贺西京
胚胎神经干细胞对巨噬细胞分泌炎性反应因子的影响
祝文王涛宁焦峰军贺西京
目的探讨小鼠胚胎皮质来源的神经干细胞(neural stem cells,NSCs)对小鼠骨髓来源巨噬细胞炎性因子和一氧化氮(nitric oxide,NO)表达的影响。方法体外分离、培养NSCs与巨噬细胞。实验分组为NSCs组、小鼠骨髓来源巨噬细胞组(简称为巨噬细胞组)、小鼠骨髓来源巨噬细胞+NSCs非接触型共培养组(简称为非接触型共培养组)和小鼠骨髓来源巨噬细胞+NSCs接触型共培养组(简称为接触型共培养组)。培养24 h后添加10 ng/mL干扰素γ(interferon-γ,IFN-γ)再孵育24 h后收集各组上清液,利用ELISA检测上清液炎性反应因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(IL-1β)和IL-10的表达,采用Griess法测量NO的表达水平。结果成功体外分离、培养原代NSCs和巨噬细胞。与巨噬细胞组相比,非接触型共培养组和接触型共培养组巨噬细胞分泌NO、TNF-α、IL-1β明显下降,而IL-10明显增加(均P<0.01)。与非接触型共培养组比较,接触型共培养组TNF-α降低〔(65.68±7.15)pg/mL比(90.99±5.57)pg/mL〕,IL-10升高〔(531.38±60.11)pg/mL比(324.32±45.41)pg/mL〕(均P<0.01),而IL-1β和NO表达无统计学差异(P>0.05)。结论NSCs能够明显降低活化巨噬细胞NO和促炎性因子TNF-α、IL-1β的释放,增加抗炎性因子IL-10的分泌,减轻炎性反应程度,其机制可能主要通过NSCs分泌可溶性因子起作用。
神经干细胞;巨噬细胞;炎症因子
脊髓损伤(spinal cord injury,SCI)是神经科领域致死率、致残率高的创伤之一,给个人、家庭和社会带来严重负担。炎性反应被认为是SCI后继发性损伤的关键因素之一。采取积极有效措施抑制免疫炎性反应,是目前防治SCI后继发损害的重要途径之一。随着研究的深入,人们亦发现免疫炎性反应抑制剂的副作用和不利因素,如何恰当及有效调节SCI后的炎性反应仍是研究的重点。
神经干细胞(neural stem cells,NSCs)是一类具有自我复制及多向分化潜能的细胞[1],给中枢神经系统损伤及神经退行性疾病治疗带来希望[2]。NSCs的免疫调节作用已经被广泛证实。如在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,NSCs可通过减少Th1细胞和增加调节性T细胞等发挥作用[3]。活化的巨噬细胞及其分泌的因子是SCI后炎性反应的重要组成成分。基于活化巨噬细胞及其分泌的因子在神经炎性反应中的重要作用和NSCs的抗炎、免疫调节特性,推测NSCs可能具有抑制活化的巨噬细胞介导的炎性反应,从而实现神经保护及促进SCI神经修复、功能恢复的作用。本研究采用干扰素-γ(interferon-γ,IFN-γ)刺激骨髓来源的巨噬细胞建立体外炎性反应模型,观察NSCs对巨噬细胞肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-10和一氧化氮(nitric oxide,NO)表达的影响并初步探索其作用方式,旨在为探索NSCs免疫调控及炎性反应调节作用、机制及其在SCI等中枢神经系统损伤重大疾病应用奠定基础。
1 材料和方法
1.1实验动物SPF级6~8周C57BL/6小鼠10只和孕14 d C57BL/6孕鼠2只,均由西安交通大学医学院动物实验中心提供,实验过程中对动物的处置符合动物伦理学标准。
1.2主要试剂与仪器小鼠成纤维细胞株L929购自中科研究细胞库,IFN-γ、表皮细胞生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)均购自Millipore公司,青霉素-链霉素溶液为Sigma公司产品,细胞培养基DMEM/F12、高糖DMEM、B27添加剂均购自GIBCO公司,胎牛血清为Cellgro公司产品,TNF-α、IL-1β和IL-10 ELISA试剂盒购自Biolegend公司,大鼠抗小鼠F4/80抗体、兔抗小鼠nestin抗体、大鼠抗小鼠β-tubulin单克隆抗体、兔抗小鼠GFAP单克隆抗体购自Abcam公司,5′-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)增殖检测试剂盒、荧光二抗Alexa Fluor®555山羊抗兔抗体和Alexa Fluor®488山羊抗大鼠抗体为Life Technologies公司产品。主要仪器包括荧光显微镜(尼康公司)和CO2细胞培养箱(Thermo公司)等。
1.3方法
1.3.1NSCs的分离及鉴定:取孕14 d小鼠胚胎端脑作为NSCs来源,其培养方法参照文献[4]。主要步骤如下:将孕14 d的小鼠麻醉后剖开腹腔,暴露子宫,取出胚胎置于预冷磷酸缓冲盐溶液(phoshate buffer saline,PBS)液中。固定胚胎头部,沿正中暴露大脑,取出部分脑皮质。显微镜下剥离表面脑膜(以见不到含有血管的脑膜为准),用预冷的PBS液洗2次后,将脑组织剪成1 mm3大小的碎块,并用吸管轻轻吹打制成单细胞悬液。用70 μm细胞筛过滤后,用NSCs培养基〔DMEM/F12+20 ng/mL EGF+10 ng/mL bFGF+2%(体积分数) B27+1%(质量分数)青霉素-链霉素溶液〕重悬单细胞。台盼蓝染色计数后,按1×106个细胞/10 mL接种于直径10 cm的培养皿,置于37℃、5%(体积分数)CO2的培养箱内。每隔2~3 d半量换液1次,生长至第7~8天后进行传代。传代过程如下:收集培养的神经球,以800g离心5 min,弃上清;加入1 mL的Accutase,孵育5 min左右,将神经球消化成单细胞悬液,加入等体积的PBS终止消化;以1000g离心5 min,弃上清;按(1.5~2.5)×105/mL的水平接种。将第3代细胞固定后行NSCs标志物Nestin、分化标记物β微管蛋白(β-tubulin)、胶质纤维酸性蛋白(gial fibrillary acidic protein,GFAP)鉴定及EdU增殖实验。
1.3.2免疫荧光染色和EdU增殖实验:将细胞爬片用1%(质量浓度)BSA+0.3%(体积浓度)Triton X-100封闭1 h,分别加兔抗Nestin抗体(1∶200)、大鼠抗β-tubulin抗体(1∶200)、兔抗GFAP抗体(1∶400)、大鼠抗F4/80抗体(1∶400),4℃孵育过夜,PBS洗涤5 min×3次,二抗Alexa Fluor®555山羊抗兔抗体或Alexa Fluor®488山羊抗大鼠抗体(1∶600),室温、避光孵育1 h并使用DAPI(1∶1000)染核5 min,PBS洗涤后封闭,荧光显微镜观察并分析体外培养的巨噬细胞标志物F4/80、NSCs标志物Nestin、NSCs分化标志物GFAP和β-tubulin的表达。EdU实验步骤如下:添加10 mmol/L EdU孵育细胞2 h,固定、破膜30 min,然后根据说明书配制EdU反应溶液,避光反应30 min,染核、洗涤、封片、观察及分析体外培养的NSCs增殖能力标志物EdU表达情况。
1.3.3骨髓来源的巨噬细胞分离、培养及鉴定[5]:首先,收集L929上清液,按15%(体积分数)L929上清液+5%(体积分数)FBS配制巨噬细胞培养液;然后在无菌操作下取出6~8周成年小鼠完整的股骨及胫骨,在干骺端两头切开并用27G针头冲出全部骨髓细胞,制成单细胞悬液,调整细胞(不包括红细胞)水平至12×106/10 mL,于37℃、5%(体积分数)CO2培养箱中培养7 d后进免疫荧光鉴定。
1.3.4实验分组及处理:(1)NSCs组:将NSCs接种于24孔板,单独培养;(2)小鼠骨髓来源巨噬细胞组(以下简称“巨噬细胞组”):将小鼠骨髓巨噬细胞接种于24孔板,单独培养;(3)小鼠骨髓来源巨噬细胞+NSCs非接触型共培养组(以下简称“非接触型共培养组”):将小鼠骨髓巨噬细胞接种于24孔板,然后在孔径为0.4 μm的Transwell小室上层加入NSCs共培养;(4)小鼠骨髓来源巨噬细胞+NSCs接触型共培养组(以下简称“接触型共培养组”):将小鼠骨髓巨噬细胞接种于24孔板,直接加入NSCs共培养。经处理24 h后4组细胞均用终浓度为10 ng/mL的IFN-γ刺激24 h,收集培养上清液。各组样本数12。
1.3.5ELISA法检测TNF-α、IL-1β及IL-10水平:在96孔板中每孔加入100 μL Capture抗体稀释液(1∶200),4℃过夜;洗涤4次后,每孔加入200 μL 1%(质量分数)BSA室温封闭1 h;洗涤4次,加入相应的标准品,每一样本设两个重复孔,室温摇晃2 h;洗涤4次,每孔加入100 μL Detection抗体稀释液(1∶200),室温孵育1 h;洗涤4次,加入100 μL Avidin-HRP稀释液(1∶1000),室温1 h;洗涤5次后,加入100 μL TMB溶液,室温避光孵育15~30 min;加入100 μL终止液(1 mol/L硫酸),采用酶标仪于570 nm读取吸光度值,制作标准曲线。然后以相同方法,检测各炎性因子吸光度值,通过标准曲线计算TNF-α、IL-1β及IL-10的表达水平。
1.3.6NO含量的检测:将50 μL上清液与Griess试剂以1∶1加入96孔板,室温孵育10 min,然后在酶标仪540 nm处读取吸光度值;将待测孔的吸光度值减去空白孔吸光度值,计算结果。
1.4统计学处理采用SPSS 20.0软件进行统计学分析,计量资料采用均数±标准差表示,均数间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1NSCs形态观察及鉴定结果见图1。原代NSCs 培养5~7 d后,可形成边缘规则、清晰神经球,神经球均匀表达Nestin阳性。同时,EdU增殖实验可检测到大量EdU阳性细胞。在含10%(体积分数)胎牛血清的培养液中诱导分化5 d后可检测到星形胶质细胞标志物GFAP阳性细胞和神经元标志物β-tubulin阳性细胞,提示成功体外分离培养NSCs,其具有较高增殖和多向分化能力。

NSCS:神经干细胞,表1同;GFAP:胶质酸性纤维蛋白;A:光镜下观察原代神经球形态(右下角小图为神经球Nestin鉴定);B:NSCs增殖标志物EdU荧光染色, EdU阳性呈红色;C: NSCs分化后星形胶质细胞标志物GFAP荧光染色,GFAP阳性呈红色; D: NSCs分化后神经元标志物Tuj1荧光染色,绿色为Tuj1阳性,其中细胞核用DAPI标志,呈蓝色 图1 孕14 d小鼠胚胎NSCs的形态学观察及鉴定
2.2骨髓来源巨噬细胞的形态及鉴定培养7 d后,免疫荧光染色结果显示90%以上细胞呈现F4/80阳性, 提示获得纯化的、满足实验条件的巨噬细胞(图2)。
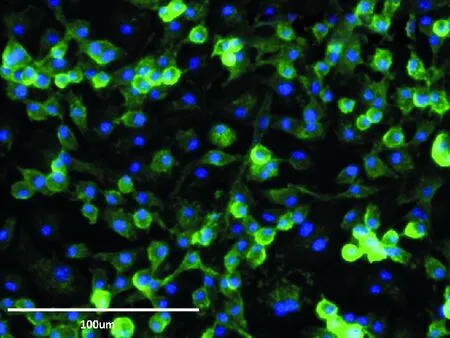
荧光显微镜下巨噬细胞标志物F4/80染色结果:F4/80呈绿色,DAPI呈蓝色 图2 小鼠骨髓来源巨噬细胞培养鉴定结果(免疫荧光)
2.3培养上清中TNF-α、IL-1β、IL-10及NO含量的变化情况与巨噬细胞组相比,非接触型共培养组和接触型共培养组培养上清液中TNF-α、IL-1β和NO水平均明显减少(均P<0.01),而IL-10均明显升高(均P<0.01);与非接触型共培养组相比,接触型共培养组TNF-α水平降低(P<0.05),IL-10升高(P<0.01),而IL-1β(P=0.921)和NO(P=0.520)含量比较无统计学差异(均P>0.05)。结果见表1。
3 讨论
SCI的病理生理过程一般分为原发性损伤和继发性损伤两个阶段。炎性反应被认为是SCI后继发性损伤的关键因素,有效控制SCI早期炎性反应可降低继发性损伤,是保存脊髓功能、促进功能恢复的关键点。SCI引发强烈的炎性反应,如
外周白细胞募集进入脊髓组织和固有免疫细胞激活。损伤区浸润的中性粒细胞、单核细胞和淋巴细胞直接影响神经细胞存亡。近年来不少研究发现活化小胶质细胞/巨噬细胞在SCI、脑外伤等中枢神经系统损伤的病理发生、发展过程中发挥关键作用,成为治疗疾病的新靶点。小胶质细胞是中枢神经系统固有的免疫细胞,而在SCI后外周单核细胞可向损伤区行迁移并成熟为巨噬细胞。外周骨髓来源的巨噬细胞在SCI后3~4 d进入脊髓组织,于SCI后1周聚集于损伤中心区并长期存在[6],是阻碍神经再生的重要因素。目前调控巨噬细胞促进损伤修复正成为研究热点。
近年来,NSCs的免疫调节越来越受到重视[7]。NSCs对T细胞和B细胞等免疫细胞的免疫调控已经得到广泛认可。但目前,NSCs针对巨噬细胞的作用影响及机制尚未明确。本实验通过NSCs和骨髓来源的巨噬细胞共培养,结果显示NSCs可抑制IFN-γ激活巨噬细胞TNF-α、IL-1β和NO分泌,而促进IL-10分泌。TNF-α和IL-1β是主要促炎性因子,其中TNF-α是细菌感染、组织损伤以及肿瘤细胞等多种刺激激活巨噬细胞产生的一种炎性因子。TNF-α mRNA在SCI后表达水平明显上调[8]。SCI后TNF-α可诱导神经元死亡。同时,TNF-α能够诱导核心转录因子(NF-κB)的活化,形成级联反应上调、加强免疫应答。利用TNF-α抑制剂或TNFR1敲除抑制TNF-α作用可减少细胞凋亡和降低炎性反应,改善SCI后运动功能[9]。IL-1β于SCI 1 h即开始升高,给予IL-1β受体拮抗剂可有效保护损伤的组织[10]。NO是细胞传递因子,过量NO具有神经毒性作用[11]。SCI后NO表达水平增加,与脊髓组织的水肿密切相关,提示NO参与SCI病理生理改变[12]。IL-10具有免疫调节作用,可抑制TNF-α、IL-1β等炎性因子的释放。SCI后IL-10可与神经元IL-10受体结合起到神经保护作用[13]。利用转基因工程手段使脊髓组织过表达IL-10可显著增加SCI后神经元存活数量和促进运动功能改善[14]。本实验结果表明NSCs可减少骨髓来源巨噬细胞NO和促炎性因子TNF-α和IL-1β的分泌,同时增加抗炎性因子IL-10的释放,从而减轻炎性反应的程度,对巨噬细胞介导的炎性反应起抑制作用,为NSCs修复SCI的机制提供一种新可能。
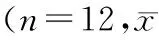
表1 各组培养细胞上清液中细胞因子及NO表达水平比较±s)
注:NO:一氧化氮;TNF-α:肿瘤坏死因子α;IL-1β:白细胞介素1β;与巨噬细胞组比较,aP<0.01;与非接触型共培养组比较,bP<0.01
细胞间作用方式一般分为下列两种:(1)通过分泌某一种或一些可溶性因子,扩散后作用于效应细胞;(2)通过细胞与细胞直接接触发挥效应。该实验通过利用Transwell小室进行小鼠骨髓巨噬细胞+NSCs非接触共培养,结果显示,与巨噬细胞组相比,非接触共培养组上清液中TNF-α、IL-1β和NO含量均明显降低,而IL-10明显升高,提示NSCs能够通过分泌可穿透过0.4 μm Transwell膜的可溶性因子,实现减少活化巨噬细胞NO和炎性因子的释放,从而减轻炎性反应的程度,对巨噬细胞介导的炎性反应起抑制作用。同时,本实验发现,接触型共培养组TNF-α表达较非接触型共培养组低,而IL-10表达水平升高,IL-1β和NO表达水平比较无统计学差异,提示NSCs对巨噬细胞TNF-α和IL-10分泌的调节作用中,细胞间直接接触亦可发挥作用。细胞间接触和分泌因子两种方式均起作用。但是,对于IL-1β和NO释放的调控,并不需要细胞间直接接触。
巨噬细胞可分为M1型和M2型,前者具有促炎性,表达iNOS等标志物,可分泌大量促炎性因子如TNF-α、IL-1β等;后者具有抗炎性,主要表现为高表达Arginase1、Ym1等标志物,可大量分泌抗炎性因子如IL-10,而低表达促炎性因子。本研究结果显示,经NSCs处理过的巨噬细胞分泌的因子与M2型巨噬细胞相对一致,可进一步推测NSCs调控巨噬细胞的炎性反应不仅影响其因子分泌,同时也调控巨噬细胞表型的极化。作者后继的实验结果也证实:NSCs处理后巨噬细胞M2标志物Arg-1 mRNA表达明显水平升高(数据待发表)。有关NSCs对巨噬细胞表型的确切影响需利用流式细胞仪和Western blot方法在蛋白水平进一步验证;另外NSCs发挥作用的具体因子还不清楚,需进一步利用蛋白微阵阐明具体哪种或哪些因子起作用。
综上所述,NSCs能够明显降低活化巨噬细胞促炎性因子的释放和增加抗炎性因子IL-10的分泌,主要通过分泌可溶性因子达到抑制巨噬细胞介导的炎性反应而发挥神经保护及神经修复作用。从细胞水平为NSCs基础和临床治疗SCI等神经免疫炎症疾病提供一定理论依据。
[1]Clarke DL. Neural stem cells[J]. Bone Marrow Transplantation,2003, 32(Suppl 1):S13-17.
[2]Gage FH. Mammalian neural stem cells[J]. Science, 2000, 287(5457):1433-1438.
[3]Einstein O, Fainstein N,Vaknin I, et al. Neural precursors attenuate autoimmune encephalomyelitis by peripheral immunosuppression[J]. Ann Neurol, 2007, 61(3):209-218.
[4]Truong NH, Dinh TH, Le DM, et al. Isolation and culture of neural stem cells from murine foetal brain[J].J Anim Vet Adv, 2014, 4(1):24-29.
[5]Wang X, Chen T, Leng L, et al. MIF produced by bone marrow-derived macrophages contributes to teratoma progression after embryonic stem cell transplantation[J]. Cancer Res, 2012, 72(11):2867-2878.
[6]Wang X, Cao K, Sun X, et al. Macrophages in spinal cord injury: Phenotypic and functional change from exposure to myelin debris[J]. Glia, 2015, 63(4):635-651.
[7]Lee ST, Chu K, Park HK, et al. New concept of neural stem cell transplantation: Anti-inflammatory role[J]. Int J Stem Cells, 2008, 1(1):36-42.
[8]Karaveliogˇlu E, Gönül Y, Kokulu S, et al. Anti-inflammatory and antiapoptotic effect of interleukine-18 binding protein on the spinal cord ischemia-reperfusion injury[J]. Inflammation, 2014, 37(3):917-923.
[9]Genovese T, Mazzon E, Crisafulli C, et al. TNF-alpha blockage in a mouse model of SCI: evidence for improved outcome[J]. Shock, 2008, 29(1):32-41.
[10]Nesic O, Xu GY, Mcadoo D, et al. IL-1 receptor antagonist prevents apoptosis and caspase-3 activation after spinal cord injury[J]. J Neurotrauma, 2001, 18(9):947-956.
[11]Broholm H, Andersen B, Wanscher B, et al. Nitric oxide synthase expression and enzymatic activity in multiple sclerosis[J]. Acta Neurol Scand, 2004, 109(4):261-269.
[12]邵擎东, 肖建如, 包聚良,等. 脊髓损伤后一氧化氮含量及一氧化氮合酶活性的变化与脊髓水肿的关系[J]. 中国矫形外科杂志, 2000, 7(10):989-990.
[13]Zhou Z, Peng X, Insolera R, et al. IL-10 promotes neuronal survival following spinal cord injury[J]. Exp Neurol, 2009, 220(1):183-190.
[14]Lau D, Harte SE, Morrow TJ, et al. Herpes simplex virus vector-mediated expression of interleukin-10 reduces below-level central neuropathic pain after spinal cord injury[J]. Neurorehabil Neural Repair, 2012, 26(7):889-897.
(本文编辑:时秋宽)
Effect of neural stem cells on IFN-γ-induced secretion of inflammatory cytokines from macrophages
invitroZHUWen,WANGTaoning,JIAOFengjun*,HEXijing.
*DepartmentofCriticalCareMedicine,theFirstPeople′sHospitalofXianyangCity,XianyangShaanxi710021,China
Corresponding author: JIAO Fenjun, Email: jiaofengjun@aliyun.com
ObjectiveTo investigate the effect of embryonic neural stem cells (NSCs) from C57BL/6 mouse on secretion of inflammatory cytokines and nitric oxide(NO) from mouse bone marrow-derived macrophages stimulated by interferon-γ(IFN-γ). MethodsNSCs were derived from the cerebral cortex of embryonic mice. They were collected on the 14thday of pregnancy and cultured in Dulbecco′s Modified Eagle′s Medium(DMEM)/F12 medium. The medium was supplemented with 20 ng/mL epidermal growth factor(EGF) and basic fibroblast growth factor (bFGF). Macrophages were isolated from bone marrowinvitroand cultured in DMEM medium with 15% L929 supernatant and 5% fetal bovine serum (FBS). There were four groups in the experiment: (1) NSCs were co-cultured alone in the NSCs group. (2) Bone-marrow derived macrophages were cultured alone without NSCs in the macrophage group. (3) Macrophages were co-cocultured with NSCs by using the transwell system in the non-contact type group. (4) Macrophages were directly co-cocultured with NSCs in the contact type group. After 24 h of culture, macrophages were treated with IFN-γ for 24 h and the levels of tumor necrosis factor-α (TNF-α), interleukin-1β(IL-1β), interleukin-10 (IL-10) and NO in the supernatants were detected by using enzyme-linked immunosorbent assay and Greiss assay. ResultsNSCs and macrophages were primarily isolated and culturedinvitro. Compared with the simple bone-marrow derived macrophages group, the level of TNF-α, IL-1β and NO significantly decreased(TNF-α:F=55.98,P<0.01; IL-1β:F=63.53,P<0.01; NO:F=31.32,P<0.01), and IL-10 significantly increased in the contact and non-contact type groups(F=101.36,P<0.01). Compared with the non-contact type group, the level of TNF-α was lower in the contact type group[(65.68±7.15)pg/mLvs.(90.99±5.57)pg/mL]and IL-10 was higher[(531.38±60.11)pg/mLvs.(324.32±45.41)pg/mL,P<0.01, respectively] and there was no statistically significant difference in expression of IL-1β and NO(P>0.05). ConclusionsNSCs can obviously reduce the levels of inflammatory cytokines(TNF-α, IL-1β) and increase anti-inflammatory factor(IL-10) level secreted by the activated macrophages to ameliorate inflammatory reactions, mainly through the secretion of soluble factors.
neural stem cells;macrophage; inflammatory cytokines
10.3969/j.issn.1006-2963.2016.05.001
国家自然科学基金资助项目(30973023,81571209)
712000咸阳市第一人民医院重症医学科(祝文、王涛宁、焦峰军);710004 西安交通大学医学院第二附属医院骨科(贺西京)
焦峰军,Email: jiaofengjun@aliyun.com
R392
A
1006-2963(2016)05-0307-05
2016-04-06)
