不同氧化程度的掺硼金刚石膜电极的电化学性能及电荷转移速率研究
2016-10-14于鹏邢璇王婷
于鹏 邢璇 王婷
不同氧化程度的掺硼金刚石膜电极的电化学性能及电荷转移速率研究
于鹏1,2邢璇3王婷2,†
1. 北京大学深圳研究生院环境与能源学院, 深圳 518055; 2. 北京大学环境工程系, 水沙科学教育部重点实验室, 北京 100871; 3. 中央民族大学生命与环境学院, 北京 100081; † 通信作者, E-mail: wang_ting@pku.edu.cn
通过阳极电化学氧化法, 制备不同氧化程度的掺硼金刚石膜(BDD)电极, 并对其进行表征。分别采用循环伏安法和 Mott-Schottky 曲线, 研究不同氧化程度的 BDD 电极的电化学性质和电荷转移速率。扫描电子显微镜和拉曼光谱分析表明, 氧化后的 BDD 电极形貌和晶型结构几乎未发生变化, 但 EDX 能谱分析发现BDD表面氧含量明显增加。循环伏安法和 Mott-Schottky 曲线阳极电流法研究发现, 电荷转移速率随氧化程度的增大而逐渐增大。接触角实验进一步证实, 随着 BDD 电极氧化程度的增加, 接触角减小, 电极表面亲水性逐渐增大, 因此以阳极电流方式表示的电荷转移速率增大。然而, Mott-Schottky 曲线以氧化还原电位差方式表示的电荷转移速率随氧化程度的增大, 先增大, 后减小, 这是由于在不同的氧化时间下, 表面基团的种类及其各成分在总含氧量中所占比例不同, 因此产生的电荷转移速率也不相同。
掺硼金刚石膜; 氧化程度; 电荷转移速率; 平带电压
掺硼金刚石膜(boron doped diamond, BDD)电极作为一种半导体材料, 在通过电化学手段矿化含氮杂环化合物[1]、邻苯二甲酸酯[2]等有机物方面, 具有较宽的电势窗口、较高的析氧电位、低背景电流等优点, 在难降解有机废水处理方面应用前景广阔[3]。BDD 电化学氧化法主要通过水在电极表面的电解产生羟基自由基(· OH)来实现对有机分子的氧化[4]。然而, 耿榕等[5]发现只有氧终端的 BDD 电极才能产生· OH, 而氢终端的 BDD 电极不能产生· OH。这两种表面终端的电极性质存在很大差异: 氢终端的 BDD 电极表面呈现负电子亲和势和疏水性[6–8], 氧终端的电极表面呈现正电子亲和势和亲水性[9]。采用电化学氧化[10]、氧等离子体溅射[11]、强氧化剂氧化[12]等方法, 可以将氢终端的电极表面氧化为氧终端, 从而使电极的物理、化学性质发生明显改变。Wang[13]比较了电化学氧化、紫外光照氧化法和氧等离子体溅射法形成的 BDD 表面的化学成分, 结果显示, 在各自的氧化条件下, 3 种方法均形成少量的 C=O (~5%), 表面 C—O 的含量依次为: 等离子体溅射法~6%, 电化学氧化法~14%, 紫外光照法(55 分钟) ~29%, 其中电化学氧化法主要形成C—OH。文献[13]讨论了 BDD 表面化学成分与其接触角和化学性质的关系。
Azevedo 等[14]讨论了掺硼量对电极表面终端的影响, 证实掺硼量的增大使电极表面的氧含量增多, 表面呈现正电子亲和势。Actis 等[15]研究了氢、氧、氮 3 种终端的掺硼金刚石薄膜电极的电化学性质, 发现氢、氧终端的电极呈现典型的半导体行为, 而氮终端的电极在 pH<11 时是半导体行为, pH>11时呈现金属导体的行为。Baldan 等[16]系统研究了不同 sp2/sp3比例的金刚石薄膜电极的形貌、电化学性质。Simon 等[10]也讨论了特定氧化条件下电极的电化学性质和电荷转移速率。然而, 当前研究多关注特定氧化程度的 BDD 电极对有机物的矿化行为, 对不同氧化程度的 BDD 电极的电化学性质和电荷转移速率鲜有研究。
本研究采用阳极电化学氧化法制备不同氧化程度的金刚石薄膜电极, 采用扫描电子显微镜(SEM)、能量色散谱(EDX)表征技术分析 BDD 电极的形貌和表面元素组成, 通过循环伏安法和 Mott-Schottky曲线研究电极的电化学性质, 并分别以氧化还原电位差和阳极电流的方式, 研究不同氧化程度的电极的电荷转移速率变化。
1 材料与方法
1.1 不同氧化程度的BDD电极制备
采用热丝化学气相沉积法, 在硅衬底上沉积制备多晶掺硼金刚石薄膜电极, 掺硼量约 1020cm-3, 具体制备方法见文献[17–19]。
以一系列热沉积出的 BDD 电极为阳极, 不锈钢电极为阴极, 1.0 mol/L 的 NaOH 溶液为电解液, 电势窗-0.4~1.5V在电极表面施加1.0 V恒定电 压[13,20], 此条件下电流密度约为10-4A/cm2。Girard等[20]研究了氧化电流密度对BDD电极氧化效果的影响, 发现在电流密度为 10-4和 10-1A/cm2氧化条件下, 由 XPS 分析得到的BDD表面含氧量分别为21%和 13%, 表明低电流密度有利于 BDD 表面含氧基团的形成。实验中使用的 DH1765-1 型程控直流稳压稳流电源的恒电流模式电流可精确到 10-4A,因此难以维持电流稳定在 10-4A, 所以本实验采用恒电压 1.0 V 的氧化方式。通过控制氧化时间分别为 10, 20, 60, 120, 180 分钟, 制备出不同氧化程度的BDD电极。
1.2 BDD电极表征
制备的 BDD 电极形貌结构采用 SEM (Quanta 200 FEG, FEI, 美国)进行表征, EDX用于分析电极表面元素含量, 拉曼光谱(RM-1000, Renishaw, 英国)用于分析 BDD 电极的结构及分子相互作用, 接触角测量系统用于测量电极的亲疏水性。
1.3 BDD电极电化学性能分析
使用电化学工作站(Autolab PGSTAT 204, Me-trohm, 瑞士)连接三电极系统。以BDD电极(1 cm×1 cm)为工作电极, 铂片(1 cm×1 cm)为对电极, 饱和甘汞电极为参比电极, 进行电化学性质分析。以20 mmol/L[Fe(CN)6]3-/4-和0.1 mol/L KCl为溶液电解液, 通过循环伏安法分析电极的电化学性质, 扫描范围为-1~1 V, 扫描速率为100 mV/s。
改变电解液为1.0 mol/L KCl溶液, 采用Mott-Schottky 曲线分析电极的能带结构。Mott-Schottky曲线的物理意义是在半导体的空间电荷层施加电压, 可以获得半导体的能带信息, 其表达式[21]如下:

式中,p表示电容,a表示载流子密度,和0分别为介电常数和真空中的电容率,为工作电极的实际面积,和fb分别表示外界施加的电压和平带电位,的值约为0.025 V, 通常忽略不计。以p-2对作图, 直线的延长线在纵轴上的截距为fb, 从直线的斜率可求得a。平带电位fb决定了电极的氧化还原电位差[22]。
2 结果与讨论
2.1 BDD电极形貌结构表征
由图 1(a)的扫描电子显微镜图可知, 制备的掺硼金刚石薄膜表面致密均匀, 没有明显的裂缝。电极表面呈明显的三角形结构, 主要为(110)和(111)晶面, 晶粒尺寸约为 2 µm[23]。图 1(b)为掺硼金刚石薄膜电极的拉曼光谱图。~1300 cm-1处的尖锐峰为金刚石特征峰, ~1250 cm-1和~500 cm-1处的峰是由硼掺杂引起[24]。~1500 cm-1处没有明显的峰值, 说明制备的金刚石薄膜电极不存在sp2石墨烯碳。
对新制备出的和电化学氧化后的 BDD 电极表面进行EDX能谱分析, 结果如图 2 所示。BDD 电极薄膜表面主要由碳和氧两种元素组成, 氧化后的电极表面氧元素含量明显增加, 质量百分比由5.14%增加到 9.12%, 表明电化学氧化过程中电极表面的氢终端逐渐氧化为氧终端。Hoffmann 等[25]利用 AFM 方法研究了单晶金刚石表面氧化电位与电极表面氧化程度的关系, 发现氧化电位由2 V 增大到 6 V 时, 金刚石表面氧化程度由 42%增加到93%。Girard 等[20]的研究表明, 在轻微氧化 (10−4A/cm2)和强烈氧化 (10−1A/cm2)两种条件下, 电极氧化程度(O/C+O)分别为 20%和 10%, 与新制备电极 4%的氧化程度相比明显提高; 并且, 氧元素在电极表面主要以C—O存在, 其次是C=O。
2.2 不同氧化程度 BDD 电极的循环伏安曲线
为了研究电极电荷转移速率与电极氧化程度之间的关系, 首先对氧化程度前后的电极进行循环伏安分析, 结果如图 3 所示。氧化 180 分钟后电极氧化还原电位略有减小, 而阳极电流明显增大。本研究分别通过氧化还原电位差∆和阳极电流来评估电极的电荷转移速率, 据报道, 氧化还原电位差越小, 阳极电流越大, 表明电荷转移速率越大[10]。因此, 氧化 180 分钟以后的电荷转移速率比未氧化前增大。
氧化还原电对: 20 mmol/L [Fe(CN)6]3-/4-, 1.0 mol/L
KCl; 标准电极SCE
图3 0分钟和180分钟时BDD电极在20 mmol/L [Fe(CN)6]3-/4-+ 1.0 mol/L KCl溶液中的循环伏安曲线
Fig. 3 Cyclic voltammograms of BDD anodes in 20 mmol/L [Fe(CN)6]3-/4-+ 1.0 mol/L KCl with electrolysis time of 0 min and 180 min
2.3 Mott-Schottky曲线
对不同氧化程度的金刚石薄膜电极进行电容–电压分析, 绘制 Mott-Schottky曲线(图 4)。不同氧化程度下的 BDD 电极平带电位fb和载流子密度a见表 1。由图 4 可知, 直线斜率均为负值, 证明电极均为 P 型半导体。随着BDD 电极氧化程度的增大, 载流子密度a逐渐增大, 平带电压fb先减小、后增大。
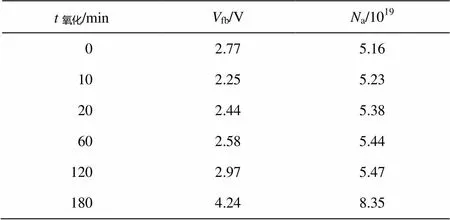
表1 BDD电极的载流子密度和平带电位随电极氧化时间之间的变化关系
图5 曲线a给出阳极电流与电极氧化程度之间的关系。阳极电流随着电极氧化程度的增加而逐渐增大, 表明电荷转移速率逐渐增大。由式(1)可知, 空间电荷载流子密度a由Mott-Schottky曲线的斜率决定, 推导后公式为

阳极电流表达式为

式中,a为电流密度,a为速率常数,s为表面上的载流子密度,red为还原剂浓度,an为阳极反应过程中的活化能。
由式(2)和(3)可知, Mott-Schottky公式中的斜率与电流密度呈反比, 由图 4 中不同氧化程度电极的Mott-Schottky 斜率(图 5 曲线 b)可知, 随着氧化程度的增大, Mott-Schottky 斜率逐渐减小, 即电流密度逐渐增大, 与循环伏安法研究结果一致。
进一步对电极表面的接触角(图 6)进行分析可知, 随着氧化时间的增加, 电极表面的接触角逐渐减小, 即亲水性逐渐增大。Girard[26]研究了接触角和 BDD 表面氧化程度的关系, 结果表明接触角的大小可以定性表示 BDD 表面的氧化程度, 即接触角越小, 电极表面氧化程度越大。因此, 如图 6 所示, 在10, 20, 60, 120, 180分钟氧化时间下, BDD表面氧化程度逐渐增大。Charrrier 等[27]的研究表明, 4种氧化剂(Ce4+, MnO4-, H2O2和S2O82-)可以提高BDD电极表面氧元素的含量, 尤其是 C—O的比例显著提高, 使电极表面的接触角减小, 其中Ce4+和MnO4-两种氧化剂对BDD电极表面 C—O的增量大于H2O2和S2O82-处理过的电极, 并且前两者在表面均形成C=O。对Ce4+和MnO4-氧化后的表面比较分析可知, MnO4-以氧化形成C—O—C 键为主, 而Ce4+更倾向于形成C—OH, 这与电化学氧化法非常相似。对 BDD 电极电荷转移速率的研究发现, Ce4+和 MnO4-氧化处理后的 BDD 电极电荷转移速率也明显大于 H2O2和 S2O82-处理过的电极, 说明 BDD 电极表面氧元素的增加有利于提高电极的电荷转移速率。本研究中, 随着氧化时间的延长, 电极表面含氧量增加, 接触角逐渐减小, 推断电荷转移速率增大, 与循环伏安曲线研究结果一致。
绘制氧化还原电位差与平带电位随氧化时间的关系曲线, 结果如图 7 所示。由图 7 曲线 a 可知, 随着氧化程度的增大, 电极氧化还原电位差∆呈现先减小、后增大的趋势。由对半导体电极的能级结构分析可知, 通过改变施加在电极表面的电压m, 使导带c和价带v的弯曲量发生改变。当弯曲量为零(如图 8 所示), 此时的电压(即平带电压bf)也等于半导体的费米能级f, 而半导体的费米能级与[Fe(CN)6]4-/3-的redox的电位差即决定了循环伏安图中的氧化还原电位差, 所以, 电极的氧化还原电位差由平带电位决定[10]。由图 7 曲线 b 及表 1 平带电位与电极氧化程度的关系可知, 平带电位的变化趋势与电极的氧化还原电位差的变化趋势相同, 均是先减小、后增大。由于新制备的 BDD电极表面以氢终端为主, 存在表面氢化层, 呈现负电子亲和势[10], 电极表面与带负电荷的[Fe(CN)6]4-之间有微弱的吸引作用。在起始微弱的氧化阶段(0~10 分钟), 电极表面氢化层尚未消失, 表面与带负电荷的[Fe(CN)6]4-之间的吸引力使电荷转移速率较大。随着电极氧化程度的增大(10~180 分钟), 氢终端逐渐变为氧终端, 呈现正电子亲和势, 表面与分子之间存在微弱的排斥力, 且这一过程中电极平带电位逐渐增大, 电荷转移速率逐渐变小[27–28]。因此, 随着氧化程度的增大, 电荷转移速率先增大、后减小。这与前面研究结果不一致。根据报道, BDD 电极氧化后表面可以形成 C—OH, C—O—C, C=O, COOH 等多种基团, 其中以 C—OH 为主, 这些基团均可以使表面含氧量增大[13,28]。但是每种基团与带负电荷的[Fe(CN)6]4-之间的作用力并不相同, 产生的电荷转移速率也不相同, 所以还需进一步通过 XPS 分析在各个氧化时间点下电极表面的基团种类及其在总含氧量中所占的比例, 才能进一步解释电荷转移速率与氧化程度之间的变化关系。
3 结论
1) 采用阳极氧化的方式, 制备了不同氧化程度的 BDD 电极, SEM 和 Raman 光谱及 EDX 分析发现, 氧化后的 BDD 电极形貌和晶型结构未发生明显变化, 但表面氧含量明显增加。
2) 采用循环伏安法、接触角、Mott-Schottky曲线电流密度分析发现, 电荷转移速率随氧化程度的增大而增大。
3) Mott-Schottky 曲线以氧化还原电位差方式表示的电荷转移速率随氧化程度的增大而先增大后减小, 这可能是由于 BDD 电极氧化后表面可以形成 C—OH,C—O—C,C=O,COOH 等多种基团, 其中以 C—OH 为主, 这些基团均可以使表面含氧量增大。但是, 每种基团与带负电荷的[Fe(CN)6]4-的作用力并不相同, 在不同的氧化时间下, 表面基团的种类及其在总含氧量中所占比例不同, 因此产生的电荷转移速率也不相同。
参考文献
[1]Xing X, Zhu X, Li H, et al. Electrochemical oxidation of nitrogen-heterocyclic compounds at boron-doped diamond electrode.Chemosphere, 2012, 86(4): 368–375
[2]Li H N, Zhu X P, Jiang Y, et al. Comparative electrochemical degradation of phthalic acid esters using boron-doped diamond and Pt anodes. Chemos-phere, 2010, 80(8): 845–851
[3]冯玉杰, 崔玉虹, 孙丽欣, 等. 电化学废水处理技术及高效电催化电极的研究与进展. 哈尔滨工业大学学报, 2004, 36(4): 450–455
[4]Zhu X P, Tong M P, Shi S Y, et al. Essential explanation of the strong mineralization performance of boron-doped diamond electrodes. Environmental Science & Technology, 2008, 42: 4914–4920
[5]耿榕, 赵国华, 刘梅川, 等. 掺硼金刚石膜电极表面产生羟基自由基的原位 ESR 研究. 物理化学学报, 2010, 26(6): 1493–1498
[6]Maier F, Riedel M, Mantel B, et al. Origin of surface conductivity in diamond. Physical Review Letters, 2000, 85(16): 3472–3475
[7]Takeuchi D, Kato, H, Ri G, et al. Direct observation of negative electron affinity in hydrogen-terminated diamond surfaces. Applied Physics Letters, 2005, 86(15): 152103
[8]Hayashi K, Yamanaka S, Watanabe H, et al. Investigation of the effect of hydrogen on electrical and optical properties in chemical vapor deposited on homoepitaxial diamond films. Journal of applied physics, 1997, 81(2): 744–753
[9]Duo I, Levy-Clement C, Fujishima A, et al. Electron transfer kinetics on boron-doped diamond Part Ⅰ: influence of anodic treatment. Journal of Applied Electrochemistry, 2004, 34(9): 935–943
[10]Simon N, Girard H, Ballutaud D, et al. Effect of H and O termination on the charge transfer of mode-rately boron doped diamond electrodes. Diamond and Related Materials, 2005, 14: 1179–1182
[11]Liu F B, Wang J D, Liu B, et al. Effect of electronic structures on electrochemical behaviors of surface-terminated boron-doped diamond film electrodes. Diamond and Related Materials, 2007, 16(3): 454–460
[12]Azevedo A F, Baldan M R, Ferreira N G. Doping level influence on chemical surface of diamond electrodes. Journal of Physics and Chemistry of Solids, 2013, 74(4): 599–604
[13]Wang Mei. Comparison of the chemical composition of boron-doped diamond surfaces upon different oxidation processes. Electrochimica Acta, 2009, 54: 5818–5824
[14]Azevedo A F, Baldan M R, Ferreira N G. Doping level influence on chemical surface of diamond electrodes. Journal of Physics and Chemistry of Solids, 2013, 74(4): 599–604
[15]Actis P, Denoyelle A, Boukherroub R, et al. Influence of the surface termination on the electro-chemical properties of boron-doped diamond (BDD) interfaces. Electrochemistry Communications, 2008, 10(3): 402–406
[16]Baldan M R, Azevedo A F, Couto A B, et al. Cathodic and anodic pre-treated boron doped diamond with different sp2content: morphological, structural, and impedance spectroscopy characterizations. Journal of Physics and Chemistry of Solids, 2013, 74(12): 1830–1835
[17]Yu Z M, Wang J, Wei Q P, et al. Preparation, characterization and electrochemical properties of boron-doped diamond films on Nb substrates. Trans-actions of Nonferrous Metals Society of China, 2013, 23(5): 1334–1341
[18]Doi T, Fukaishi T, Hiramatsu C, et al. Effectiveness of a hot-filament chemical vapor deposition method for preparation of a boron-doped superconducting dia-mond film with higher superconducting transition temperature. Diamond and Related Materials, 2012, 25: 5–7
[19]Zhao J W, Wang J L, Zhi J F, et al. Preparation of grain size controlled boron-doped diamond thin films and their applications in selective detection of glucose in basic solutions. Science China-Chemistry, 2010, 53(6): 1378–1384
[20]Girard H, Simon N, Ballutaud D, et al. Effect of anodic and cathodic treatments on the charge transfer of boron doped diamond electrodes. Diamond and Related Materials, 2007, 16(2): 316–325
[21]Ramesham R. Determination of flatband potential for boron doped diamond electrode in 0.5 M NaCl by AC impedance spectroscopy. Thin Solid Films, 1998, 322: 158–166
[22]Azevedo A F, Baldan M R, Ferreira N G. Doping level influence on chemical surface of diamond electrodes. Journal of Physics and Chemistry of Solids, 2013, 74(4): 599–604
[23]Dincer C, Laubender E, Hees J, et al. SECM detection of single boron doped diamond nanodes and nano-electrode arrays using phase-operated shear force technique. Electrochemistry Communications, 2012, 24: 123–127
[24]Zhang T, Wang X C, Shen B, F, et al. The effect of deposition parameters on the morphology of micron diamond powders synthesized by HFCVD method. Journal of Crystal Growth 2013, 372: 49–56
[25]Hoffmann R, Obloh H, Tokuda N, et al. Fractional surface termination of diamond by electrochemical oxidation. Langmuir, 2012, 28(1): 47–50
[26]Girard H A. Controlled anodic treatments on boron-doped diamond. Electrodes Monitored by Contact Angle Measurements Electrochemical and Solid-State Letters, 2007, 10(8): F34–F37
[27]Charrier G, Levy S, Vigneron J, et al. Electroless oxidation of boron-doped diamond surfaces: compa-rison between four oxidizing agents: Ce4+, MnO4-, H2O2and S2O82-. Diamond and Related Materials, 2011, 20(7): 944–950
[28]Girard H A, Simon N, Ballutaud D, et al. Effects of controlled anodic treatments on electrochemical behaviour of boron doped diamond. Diamond and Related Materials, 2007, 16: 888–891
Electrochemical Performance and Charge Transfer Rate of Boron Doped Diamond with Different Oxidation Extent
YU Peng1,2, XING Xuan3, WANG Ting2,†
1. School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Department of Environmental Engineering, Peking University, The Key Laboratory of Water and Sediment Sciences (MOE), Beijing 100871; 3. College of Life and Environmental Sciences, Minzu University of China, Beijing 100081; † Corresponding author, E-mail: wang_ting@pku.edu.cn
The boron doped diamond (BDD) with different oxidation extent was prepared through electrochemical anodic oxidation, followed by characterization with various methods. The electrochemical properties and charge transfer rates of boron doped diamond electrodes with different oxidation extent were investigated by cyclic voltammetry and Mott-Schottky plot. As results, BDD morphology and quality rarely changed after oxidation by scanning electron microscopy and Raman scattering spectroscopy techniques, while the O/C+O ratio obviously increased through EDX analysis. With the help of cyclic voltammetry and Mott-Schottky plot expressed by anodic current, it showed that the charge transfer rate enhanced with the increase of BDD oxidation extent. Moreover, the surface wettability decreased with the increasing oxidation extent, thus the hydrophilic property enhanced, suggesting the charge transfer rate expressed by anodic current increased. However, results from Mott-Schottky plot expressed by redox potential difference showed completely different result, i.e., the charge transfer rate increased and then decreased. This may be due to the kinds and ratios of functional groups on the BDD surface at different oxidation time, which may cause different charge transfer rates.
boron doped diamond; oxidation extent; charge transfer rate; flat band potential
10.13209/j.0479-8023.2016.034
O471.5
2015-03-26;
2015-05-22; 网络出版日期: 2016-09-01
国家自然科学基金(51409285)资助
