L-谷氨酸氧化酶与CBD的融合表达及其在微晶纤维素上固定化分析
2016-10-13宋辉张文宇王鹏举谭焕波苏文成赵树欣邹培建
宋辉,张文宇,王鹏举,谭焕波,苏文成,赵树欣,邹培建
L-谷氨酸氧化酶与CBD的融合表达及其在微晶纤维素上固定化分析
宋辉1,2,张文宇2,王鹏举2,谭焕波2,苏文成2,赵树欣1,邹培建2
1 天津科技大学生物工程学院,天津 300457;2 中国科学院天津工业生物技术研究所工业酶国家工程实验室,天津 300308
酶的固定化作为一种重要的技术,已在生物催化领域得到了广泛的应用。现将来源于普拉特链霉菌3304 (NTU3304) 产生的胞外L-谷氨酸氧化酶 (L-glutamate oxidase,Gox) 基因融合到来源于粪碱纤维单胞菌的纤维素结合域 (CBDcex) 的基因上,构建表达载体pETM10-Gox-CBD,并在大肠杆菌中表达。通过蛋白纯化获得融合蛋白,并命名为Gox-CBD。利用CBD对微晶纤维素特异性吸附的特性将其固定在微晶纤维素上,并对固定化酶的制备条件、结合量、酶学性质及其微晶纤维素结合稳定性等进行了研究。在4 ℃条件下结合约1 h,融合蛋白Gox-CBD结合在纤维素上的结合量即可达到9.0 mg/g。通过对重组型、融合表达游离的以及固定化在微晶纤维素上的谷氨酸氧化酶的酶学性质进行比较发现,固定化酶的比酶活有所降低;但固定化酶的热稳定性相对于游离酶有了很大的提高,在60 ℃孵育30 min后还保留有约70%的活性,而游离的重组Gox在相同条件下几乎完全失去活性。当固定化结合蛋白在pH<10或者盐浓度>5 mmol/L的NaCl条件下可以牢固结合。并且可以通过一步纯化方法固定化融合蛋白Gox-CBD于微晶纤维素上。因此,L-谷氨酸氧化酶与纤维素结合域融合表达的研究为蛋白的纯化及酶的固定化提供了一种新策略。
L-谷氨酸氧化酶,纤维素结合域,固定化
L-谷氨酸氧化酶 (EC 1.4.3.11) (简称Gox) 作为一种工具酶,它是一种以黄素腺嘌呤二核苷酸(FAD)为辅基的黄素蛋白酶类,其作为一种工具酶,能专一地将谷氨酸氧化脱氨基生成α-酮戊二酸,同时伴随着氨气和过氧化氢的产生[1]。其催化反应式为:
谷氨酸氧化酶广泛应用于食品、化学和医药等领域[2]。利用谷氨酸氧化酶对谷氨酸的特异性催化反应原理建立的传感器及试剂盒可以在谷氨酸的生产中对谷氨酸的生产发酵进行实时监测[3],在临床上可以对血清中谷丙转氨酶、谷草转氨酶和γ-谷氨酰基转移酶进行活性检测,从而可以诊断身体组织如心脏和肝脏的健康状况[4]。根据Gox能将L-谷氨酸氧化脱氨基作用生成α-酮戊二酸的原理,Niu等[5]对酶法生产α-酮戊二酸进行了研究,从而给α-酮戊二酸的生产提供了一个绿色生产工艺。由于Gox是一种应用比较广泛的工具酶,因而从它的发现至今,仍然是一种研究比较热门的工具酶之一。
Gox已在毒蛇、动植物组织和微生物等[2, 6-9]中发现,微生物中主要来源于链霉菌属。而对来源于普特拉链霉菌NTU3304胞外产生的Gox研究发现,它具有较高的比酶活和较强底物专一性等优于其他Gox的酶学特性[10]。
酶的固定化技术在工业生产中具有诱人的前景,它易于从反应系统中分离,易于控制,并能反复利用,便于自动化生产[11]。而纤维素是分布最广、含量最多的多糖,是比较廉价的材料,可以作为实用的固定化酶的载体。在研究纤维素酶降解纤维素时,发现纤维素酶由两个结构域组成,即纤维素结合域 (CBD) 和纤维素催化域,两者之间通过Linker (PT) 连在一起构成了纤维素酶,而Linker的存在能够更易于水解纤维素[12-13]。进一步研究发现,CBD能够牢固地锚定纤维素底物,从而使酶能够更好地酶解底物。根据氨基酸序列、结合特异性和结构,将CBD分为14个家族,大部分属于Ⅰ、Ⅱ、Ⅲ家族;CBD包含有30–180个氨基酸,在一个蛋白中可能存在1个、2个或者3个结合域[13]。来源于粪碱纤维单细胞的CBDcex属于Ⅱa家族,由β-筒状构成基本骨架[14]。已有一些酶与CBD融合表达,并对其酶学特性进行了研究及分析[15-19]。由于CBD能结合在纤维素载体上,它不仅可以作为亲和标签来纯化蛋白[20-21],而且也用于酶的固定化研究[22],通过加入Linker和酶切位点融合表达目的蛋白,从而节约了蛋白纯化的成本。
目前对Gox的固定化研究主要采用化学交联的方法,如通过戊二醛交联法[23-24]将谷氨酸氧化酶固定化,形成酶膜,然后置于安培电极上进行L-谷氨酸的检测。但目前还没有将Gox与CBD重组表达的方式进行固定化的报道。
本论文主要是通过基因工程的方法将来源于NTU3304的Gox (GenBank Accession No. AF239797.1) 的基因[2]成功地在大肠杆菌内表达;并将该基因与来源于革兰氏阳性菌中纤维素结合蛋白域[25](CBDcex) 融合表达,融合蛋白为Gox-CBD,然后通过对融合蛋白进行一步纯化、酶学特性测定以及融合蛋白结合微晶纤维素 (MCC) 的酶学测定,并对融合蛋白结合MCC的稳定性进行了研究和探讨,以期对固定化L-谷氨酸氧化酶在工业生产应用中提供理论依据和数据支持。
1 材料与方法
1.1 材料
质粒pETM10-CBDcex和pET-24a(+)由本实验室保存。菌株BL21(DE3)、DH5α购自北京全式金生物科技有限公司。LB培养基(胰蛋白胨10 g/L,酵母提取物 (均购自OXOID) 5 g/L,NaCl 10 g/L) 用于的培养。抗生素和诱导剂的储存浓度:硫酸卡那霉素50 mg/mL,异丙基-β-D-硫代半乳糖苷(IPTG) 为1 mol/L。4-氨基安替比林和20种氨基酸购自Sigma。苯酚购自上海泰坦科技有限公司。过氧化氢标准液购自Alfa Aesar公司。辣根过氧化物酶购自南京建成生物工程研究所。
Trans2K Plus DNA Marker和T4 DNA ligase购自北京全式金生物技术有限公司。限制性内切酶和蛋白Marker均购自Thermo Scientific公司。琼脂糖购于天根生化科技(北京) 有限公司。高纯度质粒小提试剂盒购买自Axgen公司。PCR高纯度片段回收试剂盒购买自Omega公司。BCA蛋白定量试剂盒购自康为世纪生物技术有限公司。HisTrapTMFF购自GE公司。PCR扩增引物合成和DNA测序由金唯智生物技术有限公司完成。
1.2 方法
1.2.1 表达质粒pET-24a(+)-Gox和pETM10- Gox-CBD的构建
为了便于Gox的异源表达及其后期纯化,根据大肠杆菌密码子偏好性,将Gox的碱基序列进行优化,由上海捷瑞生物技术有限公司进行全基因合成。通过Ⅰ/Ⅰ酶切位点构建在pET-24a(+) 上,并命名为pET-24a(+)-Gox。
以pET-24a(+)-Gox为模板,使用PCR扩增引物 (表1) 扩增Gox基因片段。PCR反应程序为:95 ℃预变性2 min;95 ℃变性20 s,63 ℃退火20 s,72 ℃延伸1 min 30 s,30个循环;72 ℃延伸5 min。PCR产物通过琼脂糖凝胶电泳,检测目的条带。检测到目的条带以后,使用cycle- pure核酸一步纯化试剂盒将目的基因片段回收,得到完整的基因片段。用Ⅰ和dⅢ核酸内切酶对目的基因片段和载体pETM10-CBDcex进行酶切,37 ℃酶切1 h。使用cycle-pure核酸一步回收试剂盒回收目的基因片段,载体使用胶回收试剂盒回收。将片段和载体使用T4 DNA连接酶连接,然后转化DH5α,对得到的克隆进行菌落PCR验证,将阳性克隆进行DNA序列测定,确定构建正确的序列,并命名为pETM10-Gox-CBD。
表1 PCR引物的设计
Note: the underlined bases representⅠ andd Ⅲcutting site respectively.
1.2.2 重组蛋白Gox与Gox-CBD的表达与纯化
将pET-24a(+)-Gox与pETM10-Gox-CBD表达质粒转化至BL21 (DE3) 中,对目的蛋白的表达情况进行研究。异源蛋白可溶性表达是由多因素决定的,它与基因序列、载体、蛋白结构、宿主及培养条件等密切相关[26],为了提高目的蛋白的可溶性,重组蛋白Gox和Gox-CBD的表达分别采用16 ℃,IPTG浓度为0.5 mmol/L培养12 h和16 ℃,IPTG浓度为 0.1 mmol/L培养12 h的条件进行诱导表达。
根据蛋白表达条件进行菌体的培养,然后用缓冲液A (50 mmol/L Tris-HCl, pH 7.4, 100 mmol/L NaCl)悬浮充分,加入终浓度为 1 mmol/L的苯甲基磺酰氟 (PMSF),高压匀浆破碎仪破碎3遍,低温离心 (4 ℃、15 000 r/min离心1 h),收集上清,然后用0.45 µm的滤膜过滤除杂质。采用HisTrapTMFF亲合层析柱纯化蛋白,用缓冲液B (50 mmol/L Tris-HCl, pH 7.4, 100 mmol/L NaCl, 500 mmol/L咪唑) 梯度洗脱,根据峰图收集有活性洗脱液,并进行SDS-PAGE检测。
1.2.3 结合量测定及蛋白定量
称取1.0 g微晶纤维素 (MCC) 于15 mL离心管中,先用去离子水洗2遍 (5 000 r/min离心5 min),然后使用缓冲液C (20 mmol/L KPB, 100 mmol/L NaCl, pH 7.4) 平衡MCC,离心并倒去上清液。将10 mL纯化的蛋白 (蛋白浓度为 1.435 mg/mL) 与MCC于4 ℃孵育4 h,期间取样 (10、20、25、30、60、90、120和240 min) 测定结合量。结合完成后,4 ℃离心,倒去并保留上清液,然后使用含有1 mol/L NaCl的缓冲液D (20 mmol/L KPB, 1 mol/L NaCl, pH 7.4) 对非特异结合蛋白进行洗脱。将各部分收集,测定蛋白浓度。蛋白结合量即为结合前的蛋白总量减去离心上清液与洗脱上清液的蛋白总和。结合蛋白使用10%的SDS-PAGE分析检测。
蛋白定量方法:蛋白测定法采用Bradford法测定。
1.2.4 酶活测定
通过4-氨基安替吡啉苯酚法来测定过氧化氢的增加量[8]。将1 mL的反应液在30 ℃反应10 min,测定其在505 nm下每分钟吸光值的增加量。Gox一个酶活单位的定义为:30 ℃下每分钟释放1 µmol过氧化氢所需的酶量。1 mL的反应液体系包括10 U/mL的过氧化物酶、 25 mmol/L的L-谷氨酸、2 mmol/L的4-氨基安替吡啉、10 mmol/L的苯酚和适量的酶于pH 7.4的磷酸盐缓冲液中。
1.2.5 重组酶Gox和Gox-CBD的酶活性质
分别对异源表达的Gox、游离的Gox-CBD和固定到MCC的Gox-CBD进行酶活性检测。通过对温度、热稳定性、pH、金属离子的影响和底物特异性来对重组表达的GOX、Gox-CBD和固定在微晶纤维素上的Gox-CBD进行检测 (以下实验每组平行测定多次)。
最适反应温度:按照酶活测定方法,将等量的纯酶分别于20–80 ℃的条件下测定酶活,以所测的不同反应温度下的最高酶活为100%,研究不同温度对酶的影响。
热稳定性测定:按照酶活测定方法,将等量的酶置于20–80 ℃条件下,在不同温度下孵育30 min,然后测定剩余酶的酶活,以最高酶活为100%,研究其热稳定性。
最适反应pH:按照酶活测定方法,将纯化的酶置于pH 4.5–8.5 (pH 4.5–5.5为0.1 mol/L的柠檬酸缓冲液;pH 6.0–8.0为0.1 mol/L的磷酸盐缓冲液;pH 8.0–9.0为含有0.1 mol/L NaCl的50 mmol/L Tris-HCl) 范围内,在最适反应温度下测定酶活,以所测的最高酶活为100%,研究不同pH下对其活性的影响。
金属离子的影响:按照酶活测定方法,在反应液中加入不同的金属离子,以对照组不含金属离子为100%,研究金属离子对其的影响。
底物特异性:按照酶活测定方法,将以L-谷氨酸为底物的换成其他的氨基酸,测定不同底物对其的影响,以L-谷氨酸为底物测定的酶活为100%。
操作稳定性:按照酶活测定方法,将固定化酶置于反应液中,然后离心倒去反应液,将固定化酶用0.1 mol/L的磷酸盐缓冲液 (pH 7.4) 多次离心洗涤固定化酶,洗去表面残留的未反应的底物和反应后的产物,然后,重新转入底物溶液中测定残留酶活力,如此反复操作,以初始酶活为100%,考察随着使用次数的增加,固定化酶的酶活力保留情况。
1.2.6 结合稳定性测定
将固定化的Gox进行结合稳定性研究,纤维素结合域有可能会被双蒸水、低盐 (<5 mmol/L) 或pH>9的缓冲液等洗脱掉[27],为了使纤维素结合域能够牢固地结合在纤维素,通过测定这些条件对结合蛋白的影响,并确定Gox结合到MCC上稳定性的参数,以便为以后的应用提供参考。
低盐的影响:配制50 mmol/L的Tris-HCl (pH 7.4),然后进行洗脱,再对洗脱液进行SDS-PAGE、蛋白定量以及酶活测定,测定使用该缓冲液对结合蛋白的影响。
低盐耐受度检测:配制含有1 mol/L NaCl的去离子水,然后对结合蛋白进行梯度 (NaCl梯度为1 mol/L、0.5 mol/L、0.2 mol/L、0.1 mol/L、90 mmol/L、50 mmol/L、30 mmol/L、20 mmol/L、15 mmol/L、10 mmol/L、5 mmol/L、0 mmol/L) 洗脱,每个梯度以10倍体积 (CV) 进行洗脱,对蛋白洗脱液进行蛋白浓度测定。
pH对结合量的影响:在缓冲液缓冲范围内,配制pH 4.5–12 (pH 4.5–5.5为0.1 mol/L的柠檬酸缓冲液;pH 6.0–8.0为0.1 mol/L的磷酸盐缓冲液;pH 8.0–9.0为含有0.1 mol/L NaCl的50 mmol/L Tris-HCl;pH 9.0–10.0为0.1 mol/L的甘氨酸-氢氧化钠缓冲液;pH 11.0为0.1 mol/L的磷酸氢二钠-氢氧化钠缓冲液;pH 12.0为0.1 mol/L的氯化钾-氢氧化钠缓冲液) 的缓冲液,对结合蛋白进行洗脱检测。
1.2.7m值的测定
在标准酶活测定方法的条件下,测定底物L-谷氨酸的浓度在3–15 mmol/L下的反应速度,按照Lineweaver-Burk双倒数法,分别对重组Gox、游离Gox-CBD和固定化的Gox-CBD的m和比活力进行测定。
1.2.8 一步纯化融合蛋白Gox-CBD
按照1.2.2操作,将菌体经破碎离心上清液与MCC 4 ℃孵育4 h,结合完成后,将结合液通过重力柱,然后使用含有1 mol/L NaCl的缓冲液D (20 mmol/L KPB, 1 mol/L NaCl, pH 7.4) 对非特异结合蛋白进行洗脱。各部分取样用10%的SDS-PAGE分析检测。
2 结果与分析
2.1 表达载体的构建
通过序列检索与分析,密码子优化Gox基因,以全基因合成的pET-24a(+)-Gox为模板,PCR扩增的基因片段,然后通过Ⅰ和dⅢ 双酶切及T4 DNA连接酶的连接,将连接在已构建完成的pETM10-CBDcex载体上,最终完成表达载体pETM10-Gox-CBD的构建。Gox通过Linker连接到CBD的N端,Linker的加入确保融合蛋白保持自身的生物活性[28]。结果显示,扩增的片段大小约2 000 bp (图1),与目标基因带大小一致。然后,对转化质粒提取单菌落,进行菌落PCR验证,将与目的条带大小一致的送交测序,并将测序结果通过DNAMAN序列比对,测序正确的确定为阳性克隆。
图1 gox基因的PCR扩增
2.2 融合蛋白Gox-CBDcex的表达
根据1.2.2的实验条件,将表达载体pET-24a(+)-Gox与pETM10-Gox-CBD转化到BL21(DE3)中,16 ℃培养12 h,10%的SDS-PAGE检验,融合蛋白分子量大小分别约为78 kDa (图2) 和88 kDa (图3),与理论分子量一致。
来源于NTU3304的Gox是由α、β、γ三个亚基构成的,分子量约为74 kDa[2]。经蛋白序列比对发现,它与链霉菌X-119-6 (sp.X-119-6) 的蛋白序列约有84%的序列一致性,并且都有α、β、γ亚基结构。Arima等[8]在大肠杆菌重组表达实验中发现,当采用灰色链霉菌的金属内肽酶进行消化处理,不仅催化活性提高了,而且恢复了同源二聚体的结构,其酶活特性几乎接近于野生菌株产生的Gox。本研究通过大肠杆菌来表达重组Gox蛋白,蛋白分子量约为78 kDa,而成熟蛋白的分子量约为74 kDa,这是由于蛋白的翻译后修饰的作用。而在固定化研究中,融合表达蛋白Gox-CBD是以前体蛋白的形式存在的,本论文是对固定化到纤维素载体的融合蛋白的初步探索以及可行性进行研究。
图2 诱导表达重组蛋白Gox的SDS-PAGE分析
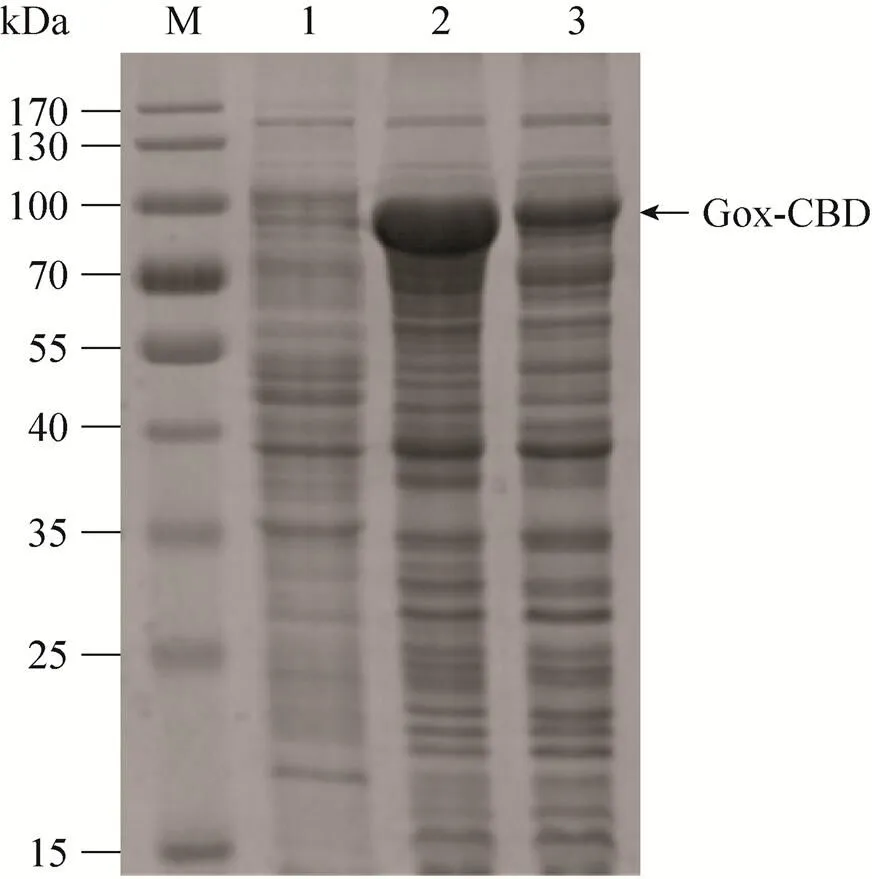
图3 诱导表达重组蛋白Gox-CBD的SDS-PAGE分析
2.3 融合蛋白Gox-CBD的纯化
将重组表达载体pET-24a(+)-Gox和pETM10- Gox-CBD分别转化至BL21 (DE3) 中。挑取单菌落培养在含有50 µg/mL硫酸卡那霉素的LB培养基中,37 ℃过夜培养作为一级种子液,然后,按1∶100的比例转接至2 L的摇瓶中,37 ℃、220 r/min培养至菌体浓度 (600) 约为0.6时,开始诱导表达,诱导表达条件参照2.2。
离心收获细菌 (4 ℃,5 000 r/min,30 min),然后加入含有终浓度为1 mmol/L的PMSF的裂解液 (50 mmol/L Tris-HCl,pH 7.4,100 mmol/L NaCl) 悬浮菌泥。使用高压破碎仪破碎菌液3遍,将细胞破碎液通过高速离心 (4 ℃、15 000 r/min离心1 h) 收集上清液。将上清液通过0.45 µm的滤膜过滤除杂,使用Ni-NTA亲和层析纯化。操作过程中各步骤分别取样将通过10%的SDS-PAGE进行分析检测,约在78 kDa和88 kDa处分别得到了纯化蛋白Gox和Gox-CBD (图4)。
2.4 纤维素结合融合蛋白的测定
融合蛋白具有CBD标签,而来源于的CBDcex标签具有很强的结合纤维素能力[29-30],通过将过量融合蛋白Gox-CBD与MCC在4 ℃下不同时间段取样,可以确定Gox-CBD的结合量,非特异结合的蛋白将通过加入含有1 mol/L NaCl的缓冲液D除去。通过在不同时间段对蛋白进行取样检测,确定其吸附结合到MCC上的蛋白结合量。结果表明,融合蛋白结合到MCC的量约为9.0 mg/g (图5)。
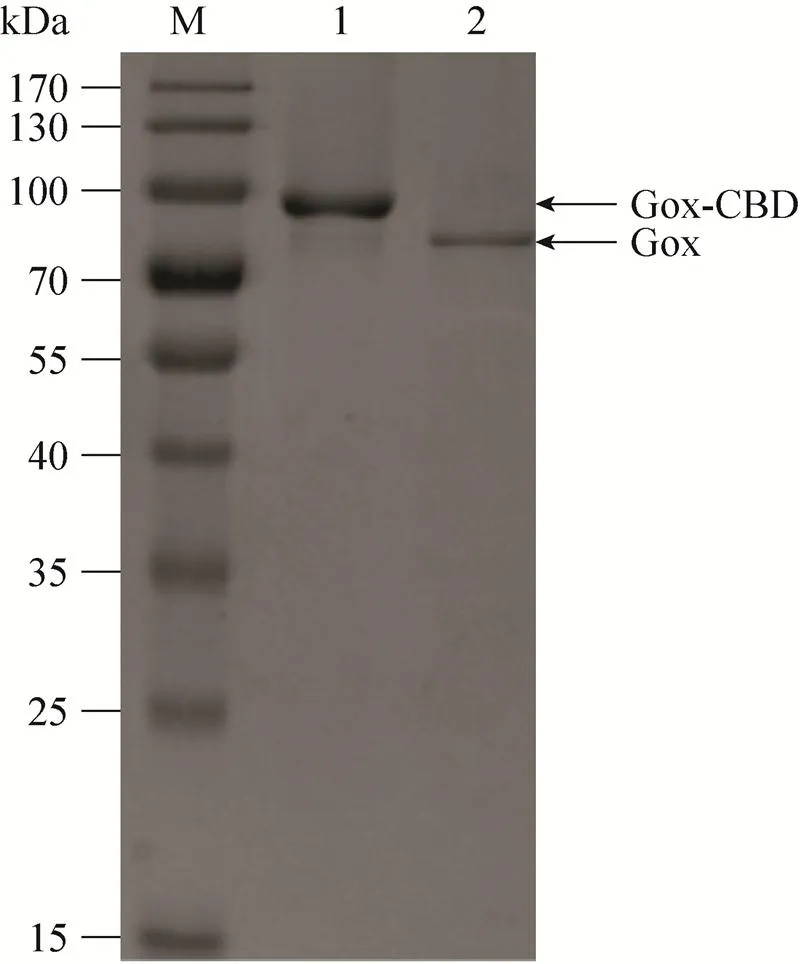
图4 SDS-PAGE分析:Ni-NTA柱亲和纯化重组蛋白Gox-CBD和Gox
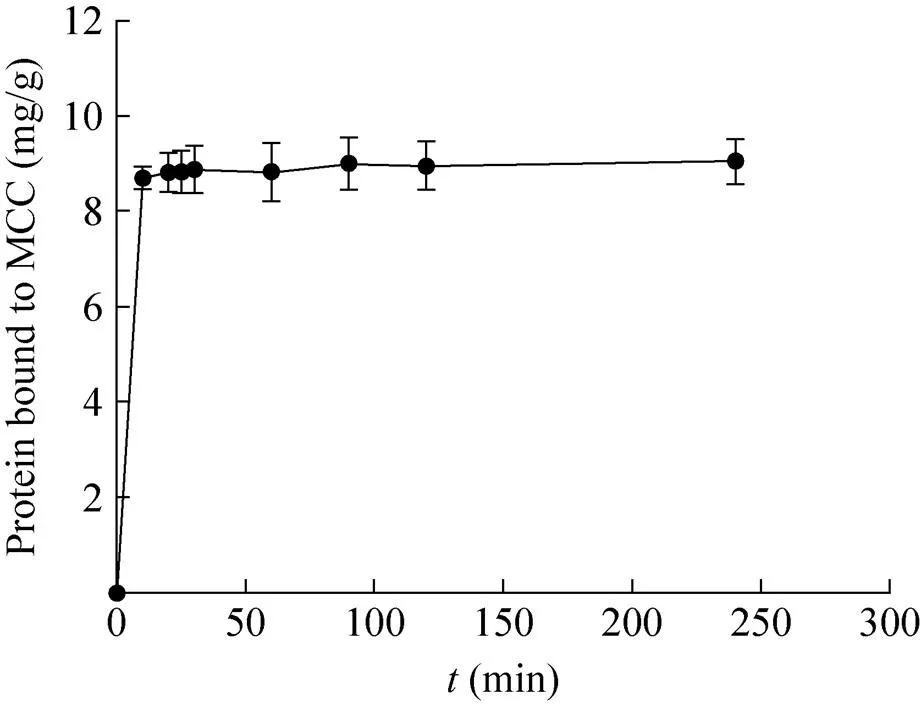
图5 Gox-CBD结合微晶纤维素 (MCC) 的结合量
2.5 Gox与Gox-CBD的酶学特性测定
2.5.1 不同pH对酶活性的影响
使用不同pH的缓冲液 (pH 4.5–5.5为0.1 mol/L的柠檬酸缓冲液;pH 6.0–8.0为0.1 mol/L的磷酸盐缓冲液;pH 8.0–9.0为含有0.1 mol/L NaCl的50 mmol/L Tris-HCl)对重组表达的Gox、游离和固定化到MCC上的Gox-CBD的酶活进行测定,按照酶学测定方法进行操作。实验结果表明,在pH约6.5时,酶活达到最大,为该酶的最适反应pH;当随着pH的升高时,酶活不断下降 (图6)。
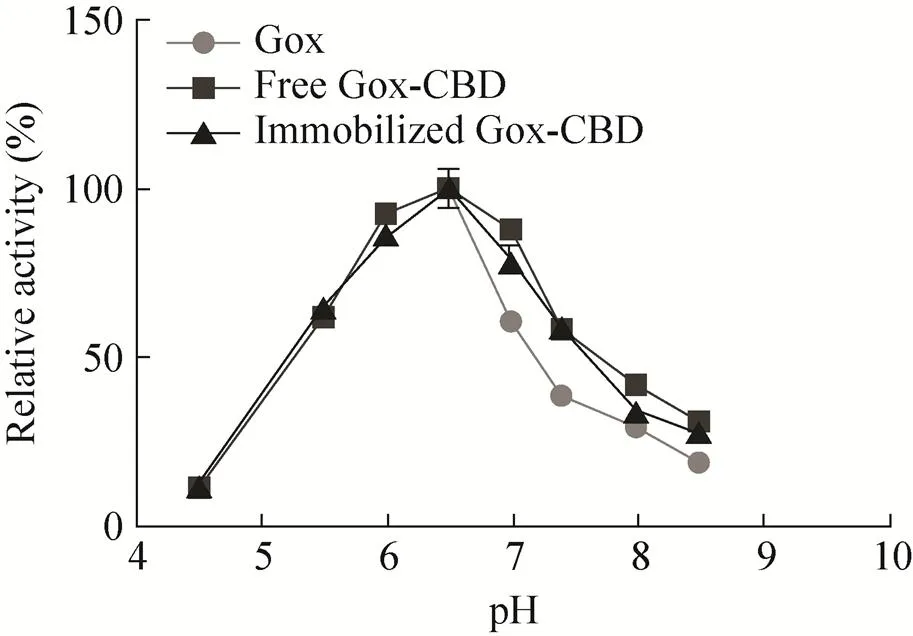
图6 pH值对酶活性的影响
2.5.2 最适反应温度和热稳定性
本实验对重组表达的Gox、游离和固定化到MCC上的Gox-CBD的最适反应温度进行了测定,测定方法按照标准酶活测定方法操作。结果表明,在温度为20–40 ℃时,随着温度的升高,酶活也在逐步升高;当到达40 ℃时,酶活达到最大值,随着温度的升高,不同重组Gox、游离Gox-CBD和固定化Gox-CBD的酶活逐渐降低 (图7)。
同时,将重组Gox、游离和固定化Gox-CBD置于20–80 ℃条件下30 min,待温度降至室温后进行酶活检测,以测定其热稳定性。结果显示,融合表达的游离和固定化的Gox的热稳定性有一定提高,而固定化Gox-CBD比游离Gox-CBD具有更高的热稳定性;特别是在60 ℃时,重组表达的Gox几乎失去了活性,而固定化的Gox酶活保存有70%左右的活性 (图8)。
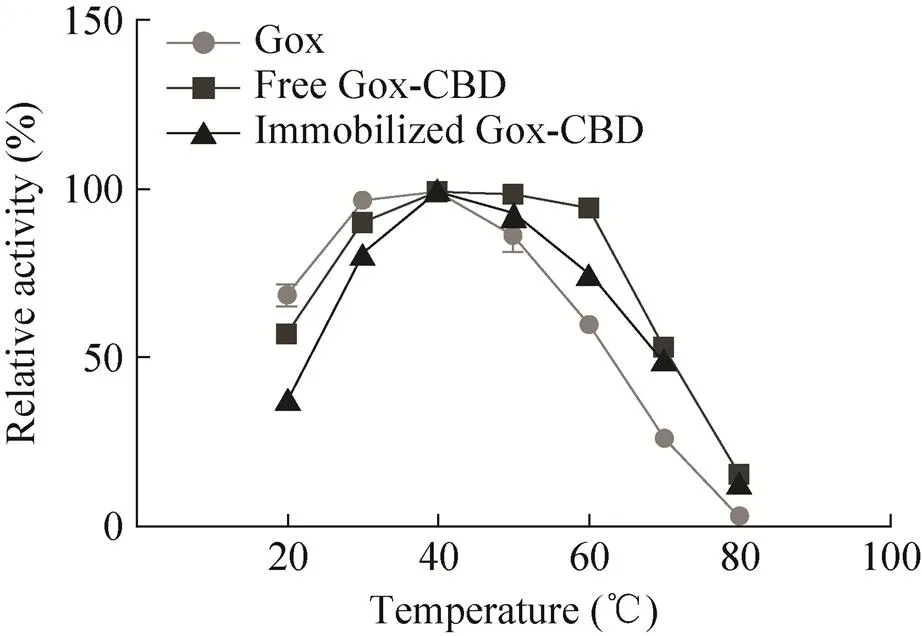
图7 温度对酶的活性影响
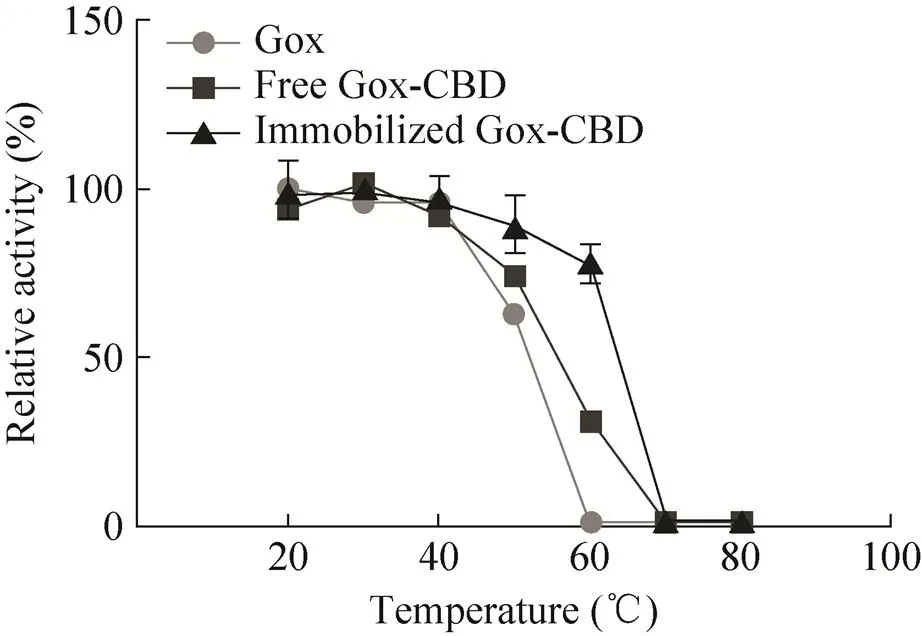
图8 酶的热稳性
2.5.3 金属盐对酶活性的影响
在酶的反应液中加入终浓度为1 mmol/L的金属盐溶液,测定金属盐离子对酶活性的影响,采用标准酶活测定方法进行酶活测定,以未加入金属盐溶液的反应为对照,并记作100%。结果显示,HgCl2和CuCl2对重组Gox、游离Gox-CBD和固定化Gox-CBD的酶活具有明显的抑制作用 (图9)。
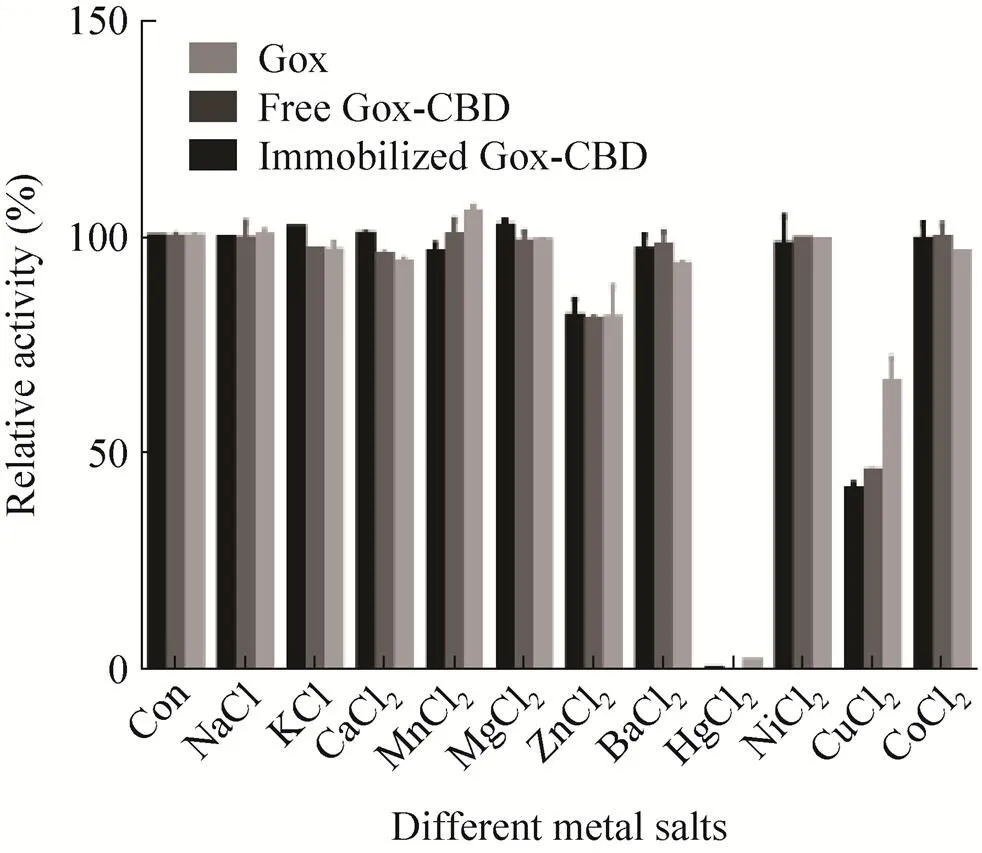
图9 不同金属离子对酶活性的影响
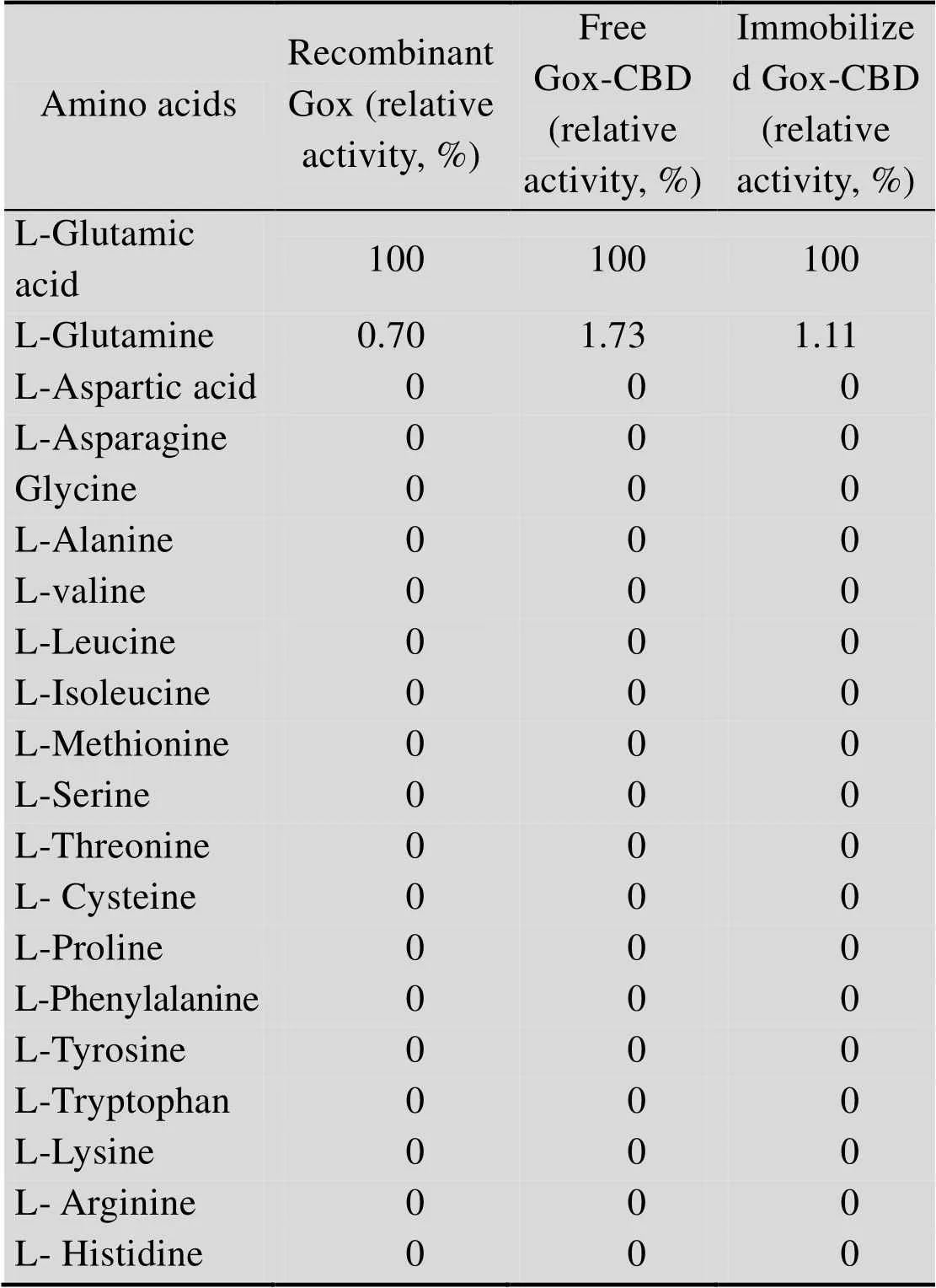
表2 Gox底物特异性分析
2.5.4 酶的底物特异性
由表2可知,Gox除对L-谷氨酸起作用外,还对L-谷氨酰胺有微弱的活性,对其他的氨基酸则没有反应。而来源于NTU3304胞外产生Gox,具有优于其他L-谷氨酸氧化酶更好的性能[10]。针对重组表达的L-谷氨酸氧化酶,很有可能是因为产生前体蛋白,而没有经过翻译后修饰,以及蛋白的空间结构发生了微弱的变化引起的,从而影响底物特异性。
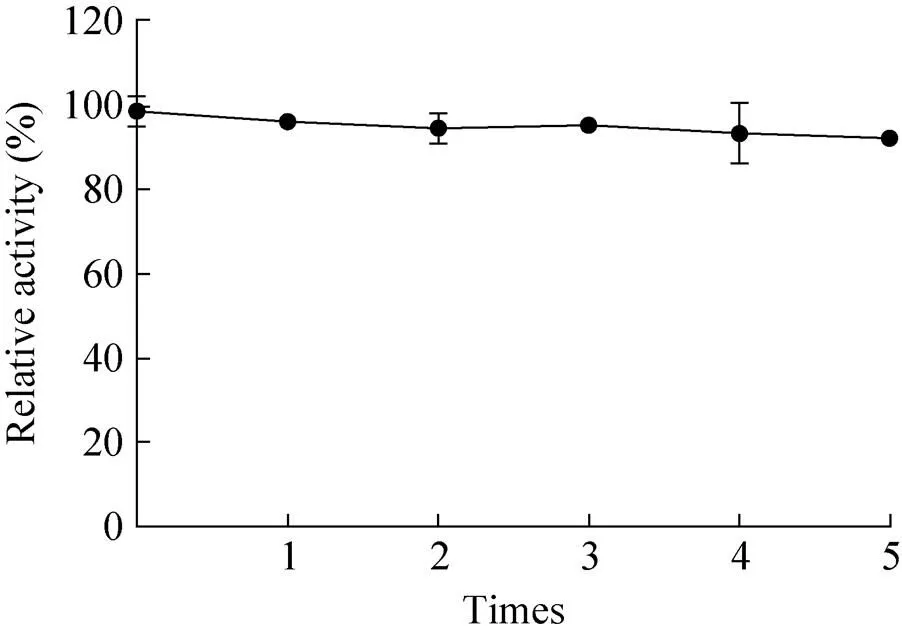
图10 固定化Gox-CBD的操作稳定性
2.5.5 操作稳定性研究
在实际应用中酶的重复使用效率是评价固定化酶的重要指标之一[31],尤其是在工业应用中。从图10中可以看出,经5次重复性操作后,固定化酶的酶活依然可以保存有较高的活性,从验证结果中可以说明固定化酶Gox-CBD具有较好的操作稳定性。
2.6 固定化酶Gox-CBD结合稳定性研究
纤维素结合蛋白能牢固地结合在微晶纤维素上,但由于在不同操作条件下对结合到MCC上的Gox结合稳定性产生影响[27]。因此,本实验研究了不同操作条件对固定化Gox-CBD与MCC的结合稳定进行了研究。试验结果显示 (图11),使用在Tris-HCl (pH 7.4) 的条件下,Gox-CBD与MCC结合稳定性较高,即使洗脱40 CV,固定化酶的结合量也没有发生变化。对于盐耐受程度,使用1 mol/L的NaCl进行梯度洗脱,实验结果表明,通过梯度洗脱的过程中没有检测到结合蛋白从纤维素载体上洗脱下来,直到NaCl浓度降到5 mmol/L时,开始检测到了有Gox-CBD洗脱下来 (图12),很有可能由于氢键或者疏水作用的原因[15],但洗脱过程中融合蛋白洗脱下来是一个很缓慢的过程,当最后使用200 CV去离子水继续洗时,发现还是有残留蛋白结合在纤维素载体上。从图13中可以看出pH对结合蛋白的影响,在pH为4–10时,Gox-CBD与MCC结合稳定,但当pH≥10时,开始有蛋白从纤维素载体上洗脱下来,但由于在pH≥10时,L-谷氨酸氧化酶几乎已失去活性,因此,只要保证在Gox活性范围内则可保证牢固结合到微晶纤维素上。
2.7 Km值的测定
m是酶对底物亲和力程度的重要特征性常数,m越大表示酶与底物亲和力越弱,m越小表示酶与底物的亲和力越强。根据Lineweaver- Burk双倒数作图法,通过酶活测定结果分别计算1/和1/[],计算得到Gox、游离Gox-CBD和固定化Gox-CBD的m(表3)。结果表明,固定化和游离的Gox-CBD的m值高于重组表达的Gox,融合表达重组酶对底物的亲和力低于重组Gox,固定化后比酶活略有降低。这很有可能是由于在固定化的过程中只有CBD参与完成的定向固定化[32],对酶的结构影响不是太大。
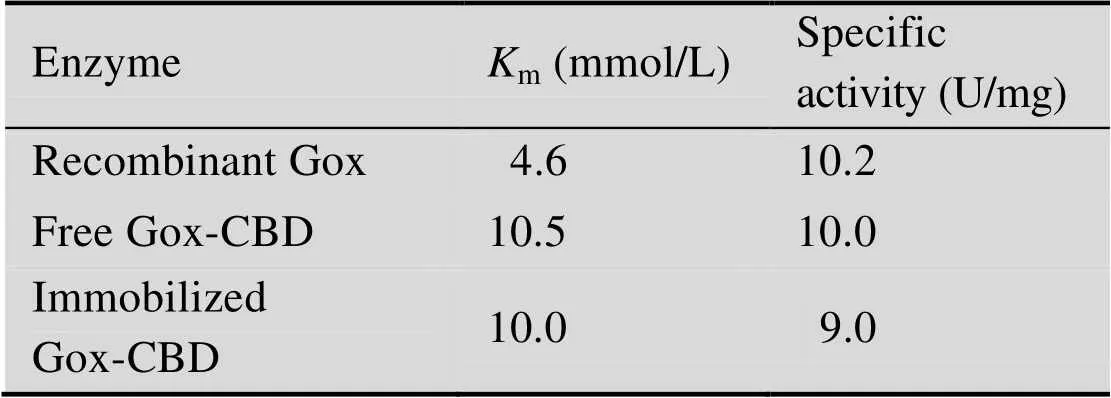
表3 酶常数的测定
2.8 一步纯化融合蛋白Gox-CBD
融合蛋白Gox-CBD的一步纯化操作:将上述操作的蛋白直接与MCC结合,并对蛋白结合过程中各部分取样进行SDS-PAGE检测 (图14)。从图中可以看出,通过一步纯化可以得到纯度比较高的蛋白,因此在后期应用中可以通过简单破碎处理,然后将破碎液与MCC进行孵育结合,从而实现目的蛋白的快速高效的纯化,节约时间,并将蛋白纯化成本降到最低。
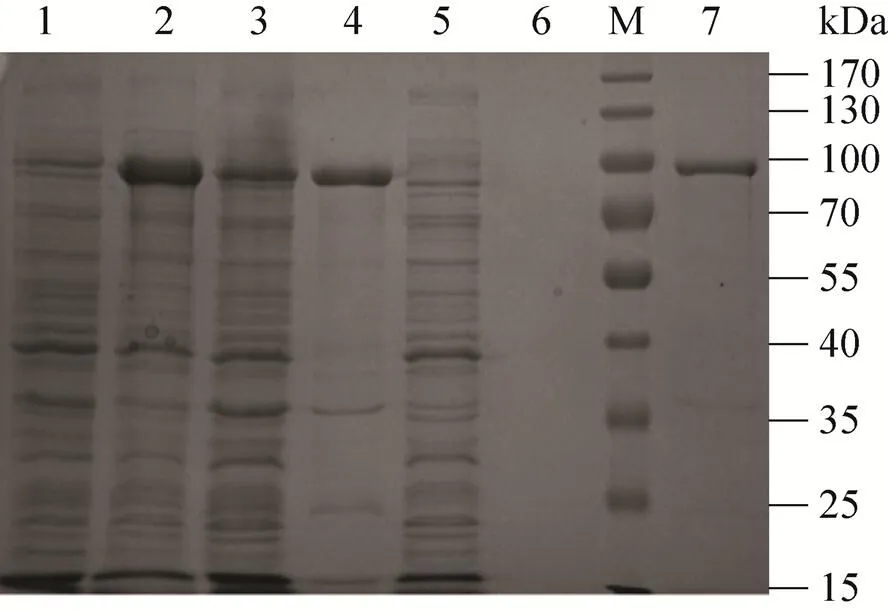
图14 SDS-PAGE分析Gox-CBD的一步纯化固定到MCC上
3 结论
本文通过构建CBD与Gox的重组质粒,然后转化到BL21 (DE3)中,并成功进行了融合蛋白Gox-CBD的重组表达。优化表达条件为诱导物IPTG终浓度为0.1 mmol/L条件下,16 ℃诱导表达过夜。通过对重组表达的Gox、游离Gox-CBD和固定到微晶纤维素上的Gox-CBD进行相关酶学性质的分析。纯化的融合蛋白 (Gox-CBD),在4 ℃条件下,固定1 h左右几乎可以结合饱和,达到9.0 mg/g;该重组酶Gox、游离酶Gox-CBD和固定化酶Gox-CBD的最适反应pH、最适温度明显变化;固定化酶Gox-CBD相对于重组蛋白Gox的比酶活略有降低,但在热稳定性上固定化酶比游离酶提高了很多,在60 ℃放置30 min还保留有75%的活性,而游离酶则完全丧失了活性。并可以通过一步纯化的方法将融合蛋白Gox-CBD固定到微晶纤维素上,得到比较纯的蛋白,该方法具有操作方法简便、经济实惠、节约成本、蛋白结合量高等特点。
而目前的固定化研究中主要以戊二醛为交联剂的化学法。戊二醛是一种双功能偶联剂,它对酶来说是一种变性剂,在固定化的过程中是由戊二醛的醛基与蛋白氨基的相互作用,这样容易造成目的蛋白活性位点的空间结构发生变化,并且还很有可能由于醛基与氨基的错综交互,酶分子的活性中心受到醛基的束缚,活性中心受到破坏,产生空间位阻,极大地降低了酶蛋白的活性及改变酶的底物特异性,甚至导致酶分子失活[33]。而与重组表达的Gox相比,融合蛋白Gox-CBD固定到MCC的研究中,其还保留有较高的酶活活性。
通过对固定化Gox的物化特性进行分析,对于以后的应用是必不可少的。本文根据纤维素结合蛋白的特性,以廉价的纤维素为载体研究酶的固定化,为以后以纤维素为载体固定化L-谷氨酸氧化酶提供了研究基础,如:1) 可以通过亲和吸附的方法将酶固定到纤维素载体上制作成酶膜,用于传感器,对工业发酵L-谷氨酸产品进行监测分析及在临床医学上的应用等;2) 利用固定化Gox也可以对α-酮戊二酸酶催化的方法进行生产,便于后期产物的分离纯化,实现生态友好型生产α-酮戊二酸。通过本文的研究,为固定化酶的研究及应用提供了新策略。
REFERENCES:
[1] Bi CY, Li L, Li JL. Research progress on L-glutamate oxidase. Chin Bull Life Sci, 2012, 24(2): 169–173 (in Chinese). 毕春元, 李玲, 李敬龙. L-谷氨酸氧化酶的研究进展. 生命科学, 2012, 24(2): 169–173.
[2] Chen CY, Wu WT, Huang CJ, et al. A common precursor for the three subunits of L-glutamate oxidase encoded bygene fromNTU3304. Can J Microbiol, 2001, 47(3): 269–275.
[3] Basu AK, Chattopadhyay P, Roychudhuri U, et al. Development of biosensor based on immobilized L-glutamate oxidase for determination of monosodium glutamate in food. Ind J Exp Biol, 2006, 44(5): 392-398.
[4] Huang XJ, Choi YK, Im HS, et al. Aspartate aminotransferase (AST/GOT) and alanine aminotransferase (ALT/GPT) detection techniques. Sensors, 2006, 6(7): 756–782.
[5] Niu PQ, Dong XX, Wang YC, et al. Enzymatic production of α-ketoglutaric acid from L-glutamic acidL-glutamate oxidase. J Biotechnol, 2014, 179: 56–62.
[6] Sukhacheva MV, Netrusov AI. Extracellular L-glutamate oxidase ofsp. Z-11-6: obtainment and properties. Microbiology, 2000, 69(1): 17–20.
[7] Du XY, Clemetson KJ. Snake venom L-amino acid oxidases. Toxicon, 2002, 40(6): 659–665.
[8] Arima J, Tamura T, Kusakabe H, et al. Recombinant expression, biochemical characterization and stabilization through proteolysis of an L-glutamate oxidase fromsp. X-119–6. J Biochem, 2003, 134(6): 805–812.
[9] Wachiratianchai S, Bhumiratana A, Udomsopagit S. Isolation, purification, and characterization of L-glutamate oxidase fromsp. 18G. Electr J Biotechnol, 2004, 7(3): 9–10.
[10] Chen CY, Su YC. Amperometric L-glutamate sensor using a novel L-glutamate oxidase fromNTU 3304. Anal Chim Acta, 1991, 243: 9–15.
[11] Xu L, Hou HP. Research progress in immobilization of enzyme. Liquor-Mak Sci Technol, 2010, (1): 86–89, 94 (in Chinese).徐莉, 侯红萍. 酶的固定化方法的研究进展. 酿酒科技, 2010, (1): 86–89, 94.
[12] Black GW, Rixon JE, Clarke JH, et al. Cellulose binding domains and linker sequences potentiate the activity of hemicellulases against complex substrates. J Biotechnol, 1997, 57(1/3): 59–69.
[13] Levy I, Shoseyov O. Cellulose-binding domains: biotechnological applications. Biotechnol Adv, 2002, 20(3/4): 191–213.
[14] Nagy T, Simpson P, Williamson MP, et al. All three surface tryptophans in type IIa cellulose binding domains play a pivotal role in binding both soluble and insoluble ligands. FEBS Lett, 1998, 429(3): 312–316.
[15] Ong E, Gilkes NR, Miller RC, et al. Enzyme immobilization using a cellulose-binding domain: properties of a β-glucosidase fusion protein. Enzyme Microb Technol, 1991, 13(1): 59–65.
[16] Rotticci-Mulder JC, Gustavsson M, Holmquist M, et al. Expression inoflipase B and lipase B fused to a cellulose-binding domain. Prot Expr Purific, 2001, 21(3): 386–392.
[17] Santiago-Hernández J, Vásquez-Bahena J, Calixto-Romo M, et al. Direct immobilization of a recombinant invertase to Avicel by.overexpression of a fusion protein containing the extracellular invertase fromand the carbohydrate-binding domain CBDCexfrom. Enzyme Microb Technol, 2006, 40(1): 172–176.
[18] De Los Ángeles Calixto-Romo M, Santiago-Hernández JA, Vallejo-Becerra V, et al. Expression, purification and immobilization of the intracellular invertase INVA, fromon crystalline cellulose and Nylon-6. J Industr Microbiol Biotechnol, 2008, 35(11): 1455–1463.
[19] Wang JJ, Zhu JG, Min C, et al. CBD binding domain fused γ-lactamase fromis an efficient catalyst for (-) γ-lactam production. BMC Biotechnol, 2014, 14: 40.
[20] Wan W, Wang DM, Gao XL, et al. Expression of family 3 cellulose-binding module (CBM3) as an affinity tag for recombinant proteins in yeast. Appl Microbiol Biotechnol, 2011, 91(3): 789–798.
[21] Hong J, Wang YR, Ye XH, et al. Simple protein purification through affinity adsorption on regenerated amorphous cellulose followed by intein self-cleavage. J Chromatogr A, 2008, 1194(2): 150–154.
[22] Li M, Yang J, Qu H, et al. Novel immobilization of arginase Icellulose-binding domain and its application in producing of L-ornitine. Appl Biochem Microbiol, 2014, 50(1): 43–48.
[23] Matsumoto K, Sakoda K, Osajima Y. Determination of L-glutamate by amperometric flow-injection analysis using immobilized glutamate oxidase: manifold for simultaneous detection of component signal and blank signal. Anal Chim Acta, 1992, 261(1/2): 155–159.
[24] Burmeister JJ, Gerhardt GA. Self-referencing ceramic-based multisite microelectrodes for the detection and elimination of interferences from the measurement of L-glutamate and other analytes. Anal Chem, 2001, 73(5): 1037–1042.
[25] Ong E, Greenwood JM, Gilkes NR, et al. The cellulose-binding domains of cellulases: tools for biotechnology. Trends Biotechnol, 1989, 7(9): 239–243.
[26] Schein CH, Noteborn MHM. Formation of soluble recombinant proteins inis favored by lower growth temperature. Nat Biotechnol, 1988, 6(3): 291–294.
[27] Novy R, Yaeger K, Miller S. New pET expression vectors generate fusion proteins with cellulose binding domains. Novag Innovat Newsl, 1997, 7: 4–7.
[28] Chen XY, Zaro JL, Shen WC. Fusion protein linkers: property, design and functionality. Adv Drug Deliv Rev, 2013, 65(10): 1357–1369.
[29] Ong E, Gilkes NR, Miller RC, et al. The cellulose‐binding domain (CBDCex) of an exoglucanase from: production inand characterization of the polypeptide. Biotechnol Bioeng, 1993, 42(4): 401–409.
[30] Bray MR, Gilkes NR, Kilburn DG, et al. Probing the role of tryptophan residues in a cellulose-binding domain by chemical modification. Prot Sci, 1996, 5(11): 2311–2318.
[31] Bai YX, Li YF, Wang MT. Study on synthesis of a hydrophilic bead carrier containing epoxy groups and its properties for glucoamylase immobilization. Enzyme Microb Technol, 2006, 39(4): 540−547.
[32] Cao LM, Chen HL. The methods of oriented immobilized enzymes and the activities of enzymes affected by oriented immobilization. J Chin Biotechnol, 2003, 23(1): 22–29 (in Chinese). 曹黎明, 陈欢林. 酶的定向固定化方法及其对酶生物活性的影响. 中国生物工程杂志, 2003, 23(1): 22–29.
[33] Li Y. Enzymes immobilization and their application. J Mol Catal, 2008, 22(1): 86-89.李晔. 酶的固定化及其应用. 分子催化, 2008, 22(1): 86–89.
(本文责编 郝丽芳)
Analysis of immobilized L-glutamate oxidase fused with cellulose binding domain on microcrystalline cellulose
Hui Song1,2, Wenyu Zhang2, Pengju Wang2, Huanbo Tan2, Wencheng Su2, Shuxin Zhao1, and Peijian Zou2
1 College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457, China;2 National Engineering Laboratory for Industrial Enzymes, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
Immobilization of enzymes is important and widely applied in biocatalysis.gene, encoding an extracellular L-glutamate oxidase (Gox), was fusedto cellulose binding domain (CBDcex) fromand the recombinant protein Gox-CBD was expressed in. The fusion protein (Gox-CBD) was immobilized onto microcrystalline cellulose. The preparation conditions, binding capacity, properties and stability of the immobilized enzyme were studied. Under the condition of 4 ℃, for 1 hour, the fusion protein Gox-CBD was able to bind microcrystalline cellulose at a ratio of 9.0 mg of protein per gram of microcrystalline cellulose. Enzymatic properties of free and immobilized L-glutamic oxidase (Gox-CBD) were compared. The specific activity of the immobilized enzyme decreased, but its thermal stability increased a lot compared with that of the free Gox-CBD. After incubation at 60 ℃ for 30 min, 70% of the total activity remained whereas the free recombinant Gox completely lost its activity. The immobilized protein was tightly bound to microcrystalline cellulose at pH below 10 or more than 5 mmol/L NaCl. The fusion protein of Gox-CBD can be specifically immobilized on the microcrystalline cellulose on a single step. Therefore, our findings can provide a novel strategy for protein purification and enzyme immobilization.
L-glutamate oxidase, cellulose binding domain, immobilized
March 1, 2016; Accepted:May 12, 2016
Peijian Zou. Tel/Fax: +86-22-24828722; E-mail: zou_pj@tib.cas.cn
Supported by:Tianjin Municipal Science & Technology Project (No. 14ZCZDSY00057).
天津科技支撑计划项目 (No. 14ZCZDSY00057) 资助。
