水中无机氮形态变化对酮洛芬光降解的影响
2016-10-13刘国光吕文英王枫亮潘夏玲张利朋马京帅林晓璇
邓 芠,刘国光,吕文英,陈 平,王枫亮,潘夏玲,张利朋,马京帅,林晓璇
水中无机氮形态变化对酮洛芬光降解的影响
邓 芠,刘国光*,吕文英,陈 平,王枫亮,潘夏玲,张利朋,马京帅,林晓璇
(广东工业大学环境科学与工程学院,广东 广州 510006)
研究了模拟太阳光照射下水环境中不同形态氮(NO3-、NO2-和NH4+)对酮洛芬(KET)光解的影响.结果表明,KET在平均波长(200~450nm)下量子产率o为0.14. NO3-浓度从0.01mmol/L-增至1.0mmol/L时, KET光解速率常数从0.0109降至0.0085; NO2-浓度从0.01mmol/L增至1.0mmol/L时, KET光解速率常数从0.0095降至0.0069, NH4+对KET的光解基本无影响. NO3-的光掩蔽现象对KET光解的影响起主要作用; NO2-则通过光掩蔽现象和羟基自由基猝灭来抑制KET的光解.同时研究了当水环境中pE值发生变化而引起水中无机氮形态转化时,不同形态氮共存对KET光解的复合影响,随着pE值的增大,KET的光解速率先减小后增大;当NO2-和NH4+共存时,两者对KET光解的影响存在拮抗作用,这一拮抗作用也存在于NO2-和NO3-之间.
酮洛芬;光降解;不同形态氮;量子产率;pE值;光屏蔽因子;羟基自由基
药物及个人护理品(PPCPs)通常在污水处理厂仅略被转化或甚至不受任何降解即进入水生环境[1-6],在环境中结构稳定或假稳定[7-11],在生物体中生物累积具有潜在危险[12-14].所以,PPCPs在环境中的存在,影响和风险的研究一直成为焦点[15].
酮洛芬(KET)为1-(3-苯氧基)苯丙酸,是一种重要的非甾体消炎药,目前我国每年生产和使用KET约92t[16].KET在水环境中经常被检测出来[17-19],在我国,CAO等[20]在漳卫南运河流域中测得KET的浓度为31.4ng/L.存在于水体中的KET对生物体具有潜在的风险[21].前人研究了KET在模拟水环境中受紫外光照的光解行为及降解产物[22,31],然而对于在模拟太阳光下水中共存物质对KET光解的影响研究仍较欠缺.
当PPCPs类污染物在天然水体中发生光解时[23],水中存在的光敏性物质会对其光解行为产生影响[24-25].天然水体中存在着大量的无机氮,其存在形态通常为NO3-,NO2-及NH4+,其中NO3-, NO2-具有光化学活性可受光产生·OH等中间活性体(ROS)[26],本文采用350W氙灯模拟太阳光,对含有不同形态氮的KET水溶液进行光照,研究水中不同形态氮对KET光降解的影响.
1 材料与方法
1.1 试剂
酮洛芬,纯度>98.0%,TCI试剂公司;乙腈,色谱纯,美国ACS恩科化学;草酸铁钾,纯度>98.0%,中国Alfa Aesar化学;氢氧化钠,硫酸,硝酸钠,亚硝酸钠,冰乙酸均为分析纯,成都科试.
1.2 实验方法
光化学实验 实验使用乙腈配制1g/L的KET母液.配制浓度为4mg/L的KET溶液时,准确移取0.8mL母液于200mL容量瓶中,使用高纯氮吹干乙腈,并用超纯水(Smart2Pure超纯水/纯水一体化系统,德国TKA)定容.当配制含有NO3-的4mg/LKET溶液时,准确移取0.8mL母液于200mL容量瓶中,使用高纯氮吹干乙腈后,分别加入不同量的硝酸钠溶液,使用超纯水定容,使得NO3-浓度分别为0, 0.01, 0.1, 1.0mmol/L,并用0.1%NaOH和H2SO4调溶液pH值至中性.模拟太阳光光照下的降解实验采用SGY-ⅡB.Y1型旋转光化学反应仪,其装置如图1所示.移取20mL的反应溶液于25mL的石英试管中,并置于旋转反应仪中进行反应,控制反应器温度为(25±1)℃,用350W氙灯照射(350W Xe arc lamp, 南京斯东柯电气设备有限公司),每隔30s取样一次,每个时间点的样品至少设3个重复,取平均值.含有NO2-和NH4+的KET溶液的配制和光解方法同上.
1.2.2 模拟水体pE值变化 pE值是用于衡量体系接收或迁移电子的能力(pE=-lge,e为电子活度)的参数[26,29-30].水中N主要是以NO3-和NH4+的形式存在,但在某些条件下,也有中间氧化态NO2-的存在,不同形态N之间会随着环境氧化还原电位的不同而发生转换,如半反应式(1)和(3)所示.通过控制不同形态N的添加浓度来模拟不同pE值引起的氮的形态变化,以考察当水体pE值发生变化,不同形态N共存对KET光解的影响.设定水体中的总氮浓度为1.00×10-3mol/L.
含有NO2-和NH4+的半反应为:
根据含有NO2-和NH4+的半反应可求得:
含有NO3-和NO2-的半反应为:
根据含有NO3-和NO2-的半反应可求得:
1.3 分析测定方法
高效液相色谱仪(LC-20AT,SHIMADZU),色谱条件:流动相是乙腈-0.5%冰乙酸(45:55,体积比);色谱柱(InertSustain C18,GL Sciences);检测器为光电二极管阵列检测器(SPD-M20A),检测波长为260nm,流速为1mL/min,进样量10μL,柱温40℃.紫外分光光度计(UV-2100,北京瑞利).
1.4 光量子产率及光屏蔽因子的测定方法
1.4.1 光量子产率测定方法光量子产率0是指光照过程中产生的激发态分子物质的量与所吸收光子物质的量的比率.使用草酸铁(K3Fe(C2O4)3)作为露光计来计算底物的量子产率[26-27].
式中:为KET;a为草酸铁钾;为反应速率常数;为摩尔吸光系数;L为入射光强,a=1.2.
1.4.2 光屏蔽因子测定方法 含不同浓度的NO3-对直接光解的影响可由光屏蔽因子(λ)来评估[27].含不同NO3-浓度的溶液由紫外分光光度计扫描,扫描波长范围为200~450nm.收集到的吸光度被用于计算某一波段点光屏蔽因子及总屏蔽因子:
式中:S为NO3-在波长下对KET的光屏蔽因子;∑S为NO3-(或NO2-)在紫外吸收波长范围内对KET的总屏蔽因子;为NO3-(或NO2-)在波长下的吸光度;为KET在波长下的摩尔吸光系数;1为光程;L为氙灯的光强百分比.
2 结果与讨论
2.1 不同形态氮对KET溶液光解的影响
2.1.1 NO3-对KET光降解的影响 在350W氙灯模拟太阳光照射下,KET在纯水中光解的一级动力学反应速率常数o为0.0114(表1),而草酸铁钾(0.01mol/L)的光解反应速率常数a为0.0541 (图2).根据式(5)计算其平均波长(200~450nm)量子产率o为0.14,与Martinez等[31]对KET光解的量子产率计算结果相似.
从表2可以看出, 在模拟太阳光照射下,在添加不同浓度 NO3-的情况下, KET的光解动力学均较好地符合伪一级反应动力学方程.与不添加NO3-的KET溶液相比,添加NO3-的KET溶液光解速率减小,且当NO3-浓度从0.01mmol/L增至1.0mmol/L时,KET光解速率从0.0109降至0.0085,表明NO-会抑制KET的光解,并且,抑制率随共存 NO3-浓度的增大而增大,这与这与NO3-对啶虫脒在水溶液中光解的影响[32]的实验现象一致.

表1 NO3-对KET光降解影响的动力学方程及相关常数Table 1 Photodegradation rate constants of KET with NO3-
如反应式(8)、(9)、(10)所示[29],NO3-中可以产生O2·-,而O2·-迅速和水反应,生成它本身的共轭酸·OH,一种强烈的氧化剂,所以从理论上讲,NO3-的加入可促进KET的光氧化降解.
(10)
从图3可见,NO3-的吸收光谱范围为200~ 330nm,而KET的吸收光谱范围为200~320nm,所以在模拟太阳光的照射下,NO3-与KET的吸收光谱范围有重合,即会发生NO3-与KET竞争吸收光子,从而抑制KET的降解.
由表2可知,随着NO3-浓度的增大,掩蔽效果增强.将∑S与KET在纯水中光解时所得反应速率常数o相乘可得KET在各NO3-浓度下因光掩蔽影响时光解的理论光解反应速率常数值o∑S.理论o∑S值与实际s值相差不大.由此可知,在添加了NO3-的KET光解反应中,NO3-的光掩蔽现象对KET光解的影响起主导作用,而体系中没明显出现生成ROS来促进KET光降解的现象.

表2 不同浓度NO3-、NO2-下KET光解动力学常数及光屏蔽因子Table 2 Apparent rate constants with NO3-or NO2-in different concentrations and screening factor
2.1.2 NO2-对KET光降解的影响 从表3可以看出,在添加不同浓度NO2-的情况下,KET的光解动力学较好地符合伪一级反应动力学方程. 与不添加NO2-的KET溶液相比,添加NO2-的KET溶液光解速率减小,且当NO2-浓度从0.01mmol/L增至1.0mmol/L时,KET光解速率从0.0095降至0.0069,表明NO2-会抑制KET的光解,抑制率随共存NO2-浓度的增大而增大.本课题组研究NO2-对萘普生[28]和双氯酚酸光解的影响[25]表明,NO2-同样存在光抑制作用.

表3 NO2-对KET光降解影响的动力学方程及相关常数Table 3 Photodegradation rate constants of KET with NO2-
从图3可见,NO2-的吸收光谱范围为200~ 400nm,而KET的吸收光谱范围为200~320nm, NO2-与KET的吸收光谱有重合,从而NO2-与KET产生竞争吸收,抑制KET的直接光解.
本研究同样引入光掩蔽系数来研究NO2-对KET的抑制作用.由表2可知,随着NO2-浓度的增大,总掩蔽系数也随之增大,但增大效果不明显.根据式(6)、(7)计算出理论o∑S值,通过与实际s值做比较,发现KET在不同NO2-浓度下光降解的理论o∑S值均大于相应的实际s值,且随着NO2-浓度的增大,两者之间的差值越大.
NO2-会清除·OH,如反应式(12)所示[27].
由此推测此差值是由于NO2-猝灭羟基自由基引起的,NO2-浓度越大,NO2-猝灭羟基自由基的作用越大,导致KET的光解速率下降越明显.通过对比加入和不加入异丙醇(猝灭羟基自由基)体系KET的光解反应速率,结果如表4所示.
表4的结果证实,KET在纯水中单独光解会生成羟基自由基(自敏化光解),并由式(14)估算出·OH对KET光解的贡献率[29]为13.2%.本研究对50,100mmol/L的异丙醇进行猝灭实验,结果一致.
式中:·OH为·OH对KET光降解的贡献率;o、isopropanol分别为KET分别在纯水和添加了·OH的光解过程的速率常数.
猝灭实验表明,KET光解过程中生成羟基自由基参与反应.由此证明,NO2-对KET光解的影响除光屏蔽现象外,还有对自由基的猝灭作用,且对羟基自由基的猝灭在体系中起到主要的抑制作用.

表4 ·OH猝灭实验及KET光解动力学参数及贡献率Table 4 Photodegradation kinetic parameters of KET with ·OH quenching experiment and the rate of contribution
注:异丙醇浓度为100mmol/L.
2.1.3 NH4+对KET光降解的影响 从表5可见,NH4+对KET光解影响不大,NH4+浓度从0.01mmol/L增加到1mmol/L,KET的光解半衰期无明显变化,这与NH4+对水杨酸在水溶液中光解的影响[30]的实验结果一致.这是由于NH4+在紫外可见光范围内没有光吸收,既不会通过竞争光子来抑制KET的光解(图3),也不会产生ROS来促进其光解.
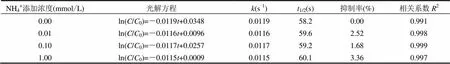
表5 NH4+对KET光降解影响的动力学方程及相关常数Table 5 Photodegradation rate constants of KET with NH4+
2.2 水体pE值对无机氮降解KET的影响
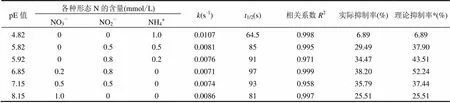
表6表明,pE值从4.82增至6.85时,无机N对KET的光解抑制率逐渐增大;pE值从6.85增至8.15时,无机N对KET的光解抑制率逐渐下降,且其对KET的抑制作用不是简单的叠加关系. NO2-和NO3-对KET的降解都起抑制作用,且NO2-的抑制率大于NO3-,NH4+对KET的降解基本无影响.所以,当pE值从4.82上升到6.85时,反应液中NO2-的浓度增大,即反应液中无机N对KET光解的总抑制率随着NO2-浓度的增大而增大,故降解速率降低;当pE值从6.85上升至8.15时,反应液中NO2-的浓度减少,即反应液中无机N对KET光解的总抑制率随着NO2-浓度的减小而减小,故降解速率变快.同时,对比在不同pE值下,无机N对KET光解的实际抑制率和理论抑制率,可以发现,当NH4+和NO2-共存时,实际抑制率小于理论抑制率,说明NO2-和NH4+对KET光解的影响是起拮抗作用的.这可以解释为NO2-和NH4+共存时发生氨氧化反应[33-34],如式(13),使NO2-浓度降低,减弱了对KET光解的抑制;而NO3-和NO2-共存时,发现实际抑制率也小于理论抑制率,所以这种拮抗作用也同样存在于NO3-和NO2-之间,由图4可知(以0.2mmol/L NO3-和0.8mmol/L NO2-共存为例), NO3-与NO2-共存时,其吸光度小于两者单独存在时之和,减弱了与KET的光的竞争,从而减弱了对KET光解的抑制.这与我们之前分别研究pE值对磺胺二甲基嘧啶[35]和双氯芬酸在水溶液中光解的影响[26]的实验现象一致.
注:理论抑制率*是由不同形态N单独存在时的光解抑制率相加之和.
3 结论
3.1 模拟太阳光照射下,KET的光解符合一级动力学规律.
3.2 NO3-与NO2-均抑制KET的降解,而且随着NO3-和NO2-浓度的增加,其抑制作用逐渐增强.这主要由于NO3-和NO2-的吸收光谱波长范围(200~400nm)与KET的吸收光谱波长范围(200~ 320nm)重叠,产生与KET竞争吸收光子的现象.
3.3 NO3-对KET光解的光掩蔽现象是其对KET光解影响的主要原因,在光解过程中没有明显产生ROS来促进其光解. NO2-对KET光解的影响除光屏蔽现象外,还有对羟基自由基的猝灭作用.
3.4 NH4+对KET的光解基本无影响,是由于NH4+在紫外可见光范围内没有光吸收,既不会通过竞争吸光来抑制KET光解,也不会产生ROS来促进其光解.
3.5 模拟水体pE值发生变化时,无机氮对KET光解的影响表明,当NO2-和NH4+共存时,两者对KET的光解存在拮抗作用,且这一拮抗作用也存在于NO2-和NO3-之间.
[1] Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data [J]. Toxicol. Lett., 2002,131:5-17.
[2] Boxall A B A, Kolpin D W, Halling-Sorensen B, et al. Peer reviewed: Areveterinary medicines causing environmental risks? [J]. Environ. Sci. Technol., 2003,37:286A-294A.
[3] Ashton D, Hilton M, Thomas K V. Investigating the environmental transport of human pharmaceuticals to streams in the United Kingdom [J]. Sci. Total Environ., 2004,333:167-184.
[4] Bendz D, Paxéus N A, Ginn T R, et al. Occurrence and fate of pharmaceutically active compounds in the environment, a case study: Höje River in Sweden [J]. Hazard. Mater., 2005,122:195- 204.
[5] Santos L H M L M, Araújo A N, Fachini A, et al. Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment [J]. Hazard. Mater., 2010,175:45-95.
[6] Dsikowitzky L, Schwarzbauer J, Littke R. Distribution of polycyclic musks inwater and particulate matter of the Lippe River (Germany) [J]. Org. Geochem., 2002,33:1747-1758.
[7] Daughton C G, Ternes T A. Pharmaceuticals and personal care products in the environment: agents of subtle change? [J]. Environ. Health Perspect, 1999,107:907-938.
[8] Monteiro S C, Boxall A B A. Factors affecting the degradation of pharmaceuticals in agricultural soils [J]. Environ. Toxicol. Chem., 2009,28:2546-2554.
[9] Peck A. Analytical methods for the determination of persistent ingredients of personal care products in environmental matrices [J]. Anal. Bioanal. Chem., 2006,386:907-939.
[10] Brain R A, Ramirez A J, Fulton B A, et al, Herbicidal effects of sulfamethoxazole in Lemna gibba: using p-aminobenzoic acid as abiomarker of effect [J]. Environ. Sci. Technol., 2008,42:8965- 8970.
[11] Daughton C G. Pharmaceuticals and personal care products in the environment: overarching issues and overview, in: Pharmaceuticals and Care Products in the Environment [M]. American Chemical Society, 2001:2-38.
[12] Mackay D, Barnthouse L. Integrated risk assessment of household chemicalsand consumer products: addressing concerns about triclosan [J]. Integr. Environ.Assess. Manag., 2010,6:390- 392.
[13] Nakata H. Occurrence of synthetic musk fragrances in marine mammalsand sharks from Japanese coastal waters [J]. Environ. Sci. Technol., 2005,39:3430-3434.
[14] Kannan K, Reiner J L, Yun S H, Perrotta E E, et al. Polycyclic musk compounds in higher trophic level aquatic organismsand humans from the United States [J]. Chemosphere, 2005,61:693- 700.
[15] Daughton C. Pharmaceuticals in the environment: Sources and their management, in: M. Petrovic, D. Barcelo (Eds.), Analysis, Fate and Removal of Pharmaceuticals in the Water Cycle [J]. Elservier Science, 2007,50:1-58.
[16] Duan Yan-Ping, Meng Xiang-Zhou, Wen Zhi-Hao, et al. Acidic pharmaceuticals in domestic waste water and receiving water from hyper-urbanization city of China (Shanghai): environmental release and ecological risk [J]. Environ. Sci. Pollut. Res., 2013, 20:108-116.
[17] Nakada N, Tanishima T, Shinohara H, et al. Pharmaceutical chemicals and endocrine disrupters in municipal wastewater in Tokyo and their removal during activated sludge treatment [J]. Water Research, 2006,40(17):3297-3303.
[18] Santos J L, Aparicio I, Alonso E. Occurrence and risk assessment of pharmaceutically active compounds in wastewater treatment plants A case study: Seville city (Spain). [J]. Environment International, 2007,33(4):596-601.
[19] Lindqvist N, Tuhkanen T, Kronberg L. Occurrence of acidic pharmaceuticals in raw and treated sewages and in receiving waters [J]. Water Research, 2005,39(11):2219-2228.
[20] Cao J, Shi J, Han R, et al. Seasonal variations in the occurrence and distribution of estrogens and pharmaceuticals in the Zhangweinanyun River System [J]. Chinese Science Bulletin, 2010,55(27):3138-3144.
[21] 温智皓,段艳平,孟祥周,等.城市污水处理厂及其受纳水体中5中经典PPCPs的赋存特征和生态风险 [J]. 环境科学, 2013,34(3):927-932.
[22] Szabó R K, Cs M, Illés E , et al. Phototransformation of ibuprofen and ketoprofen in aqueous solutions [J]. Chemosphere, 2011,84(11):1658-63.
[23] 靳 娜,刘欣伟,宋雨辰,等.不同波段下黄海中二甲基硫光氧化动力学研究 [J]. 中国环境科学, 2016,36(1):167-174.
[24] Robinson P F, Liu Q T, Riddle A M, et al. Modeling the impact of direct phototransformation on predicted environmental concentrations (PECs) of propranolol hydrochloride in UK and US rivers [J]. Chemosphere, 2007,66(4):757-766.
[25] 葛林科,张思玉,谢 晴,等.抗生素在水环境中的光化学行为 [J]. 中国科学:化学, 2010,40(2):124-135.
[26] Zhang Nan, Liu Guo-guang, Liu Hai-jin, et al. Diclofenac photodegradation under simulated sunlight: Effect of different forms of nitrogen and Kinetics [J]. Journal of Hazardous Materials, 2011,192:411-418.
[27] 葛林科.水中溶解性物质对氯霉素类和氟喹诺酮类抗生素光降解的影响 [D]. 大连:大连理工大学, 2009.4-5,38-41.
[28] 季跃飞.光化学及光催化降解水溶液中药物及个人护理品阿替洛尔和2-苯基苯并咪挫-5-磺酸 [D]. 南京:南京大学, 2014:30-31.
[29] 马杜娟.水环境中萘普生光化学降解行为研究 [D]. 广州:广东工业大学, 2013:51-53.
[30] Wang Gang, Liu Guo-guang, Liu Hai-jin, et al. Photodegradation of salicylic acid in aquatic encironment: Effect of different forms of nitrogen [J]. Science of the Total Environment, 2012,435-436: 573-577.
[31] Martinez C, Vilarino S. Mechanism of degradation of ketoprofen by heterogeneous photocatalysis in aqueous solution [J]. Applied Catalysis B: Environmental, 2013,142-143:633-646.
[32] 李 超,谢国红,刘国光,等.不同形态氮转化对啶虫脒在水溶液中光解的影响 [J]. 环境科学学报, 2009,29(9):1918-1922.
[33] 谢志儒.厌氧氨氧化细菌在有机碳源条件下的非氨氧化特性研究 [D]. 广州:中山大学, 2008.
[34] 于 鑫,叶 林,李旭东,等.饮用水生物处理小试工艺中NH4+-N的非硝化去除途径分析 [J]. 环境科学, 2008,29(4):909-914.
[35] 肖华花,刘国光,陈智明,等.水体中不同形态氮对兽药磺胺二甲基嘧啶溶液光降解的影响 [J]. 环境化学, 2015,34(5):971-976.
致谢:感谢刘国光教授对本论文的指导以及陈平等对本实验的协助.
* 责任作者, 教授, liugg615@163.com
Photodegradation of ketoprofen in aquatic environment: Effect of different forms of nitrogen
DENG Wen, LIU Guo-guang*, LV Wen-ying, CHEN Ping, WANG Feng-liang, PAN Xia-ling, ZHANG Li-peng, MA Jing-shuai, LIN Xiao-xuan
(School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006, China)., 2016,36(5):1456~1462
The impacts of different nitrogen forms (NO3-, NO2-and NH4+) on the photodegradation of KET were investigated under Xe lamp irradiation. The direct photolysis solar quantum yield of KET was observed to be 0.14. Increasing the concentration of NO3-from 0.01mmol/L to 1.0mmol/L, the apparent rate constants of KET were decreased from 0.0109 to 0.0085. The apparent rate constants of KET decreased from 0.0095 to 0.0069when the concentration of NO2-increased from 0.01mmol/L to 1.0mmol/L. NH4+had no influence on KET photolysis. The screening effect of NO3-was the major factor on KET photolysis while NO2-inhibited photolysis via both attenuating light and quenching×OH. Photodegradation of KET was also investigated under different pE values. The photodegradation rate of KET decreased at first, then it increased with the increasing pE values. The antagonistic effect existed on the photodegradation of KET when NO2-coexisted with NH4+. And it also existed when NO2-coexisted with NO3-on the photodegradation of KET.
ketoprofen;photodegradation;different forms of nitrogen;quantum yield;pE values;screening factor;×OH
X703
A
1000-6923(2016)05-1456-07
邓 芠(1991-),广东广州人,广东工业大学硕士研究生,主要研究方向为环境化学及水中污染物治理与环境行为.
2015-11-09
国家自然科学基金资助项目(21377031);广东省科技项目(2013B020800009)
