钒酸钙碳化铵化生产钒氧化物的反应规律
2016-10-13王少娜郑诗礼
闫 红,王少娜,杜 浩,郑诗礼,张 懿
钒酸钙碳化铵化生产钒氧化物的反应规律
闫 红,王少娜,杜 浩,郑诗礼,张 懿
(中国科学院过程工程研究所绿色过程与工程重点实验室,湿法冶金清洁生产技术国家工程实验室,北京100190)
以钒渣亚熔盐法钒铬共提工艺所得到的中间产品钒酸钙为研究对象,针对钒酸钙后续产品转化问题,提出钒酸钙碳化铵化生产钒氧化物的工艺路线;研究NH4HCO3转化溶出钒的工艺条件,考察是否通入CO2、NH4HCO3的添加量、反应温度、不同液固比以及反应时间等对钒酸钙转化溶出效果的影响。结果表明:钒酸钙碳化铵化反应的最佳条件为反应温度75 ℃,液固比20:1,通入CO2,且流速1.5 L/min,铵钒摩尔比1.0,反应时间1 h,此条件下钒酸钙中钒转化率为97.35%。
钒渣;亚熔盐;钒酸钙;碳化铵化;碳酸氢铵
钒是一种重要的战略金属,被称为“现代工业的味精”。约有85%的钒作为炼钢合金添加剂用于钢铁行业,另外钒也广泛应用于航空航天、催化、电化学储能以及颜料生产等领域[1−2]。钒钛磁铁矿经高炉冶炼后获得的钒渣是提钒的主要原料,全球58%的钒产品来源于钒渣[3]。钠化焙烧是目前钒渣提钒的主流工 艺[4−6],其优点是工艺成熟,操作简单,但同时存在着反应温度高(750~850℃),钒提取率低(多次提取率不足80%),钒渣中的铬无法回收,产生有害窑气、高盐度氨氮废水环境危害大及处理成本高等问题[7−10]。
针对传统钒渣钠化焙烧工艺存在的资源环境问题,中科院过程工程研究所提出了钒渣亚熔盐法钒铬高效共提工艺[11]。该工艺利用亚熔盐介质优良的反应特性[12]强化钒渣中钒、铬尖晶石矿相的分解,可将反应温度降至200 ℃以下,并且实现了钒渣中钒铬的高效共提(钒的单次转化率达95%以上,铬的转化率达85%以上)。同时,该工艺通过分步结晶实现了钒酸盐、铬酸盐的高效分离[13],得到中间产品钒酸钠和铬 酸钠。
中间产品钒酸钠的清洁转化是工艺产品转化的关键环节。本课题组前期研究结果表明[14],通过向含钒溶液中加入CaO可生成钒酸钙沉淀,钒的转化率达97%以上,所得钒酸钙纯度在90%以上,反应方程式如式(1)所示。

从式(1)可以看出,钒酸钠与氧化钙反应之后生成氢氧化钠和钒酸钙,不仅实现了钠钒分离获得钒酸钙,且NaOH溶液可返回到亚熔盐液相反应阶段,实现了NaOH的循环回用。式(1)得到的钒酸钙既可以作为冶炼钒铁的原料,也可以进一步加工成应用更广泛的初级钒产品V2O5。钒酸钙转化为V2O5的主要方法有硫酸法、水解沉淀法、酸性铵盐沉淀法等[15−16],但这些方法均在工业化以及环境处理中存在着很多弊端。申小清等[17]提出钒酸钙沉钒−碳酸铵转化溶出回收钒工艺流程并对转化后的含钒溶液采用铵盐沉钒法制得了纯度为99.2%的V2O5,为工业化应用奠定了基础。张中豪[18]研究了用CO2碳酸化的方法提取钒酸钙中的钒,在CO2气氛中,碳酸盐可与钒酸钙反应生成溶解度更小的碳酸钙沉淀,没有酸的消耗,减小了酸浸对设备的损害。基于这两种方法,本文作者提出采用NH4HCO3溶液浸出,并通入CO2气体以控制整个浸出体系呈弱碱性的方法,促进钒酸钙向sp更小的碳酸钙转化,具体化学反应方程式见式(2):

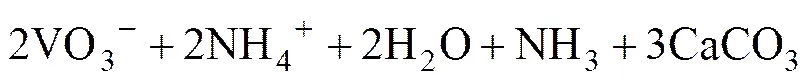
由式(2)可以看出,碳化铵化反应之后液相形成了NH4VO3-NH4HCO3-H2O溶液体系。赵楚等[19]对其溶解度相图进行了研究,结果如图1所示。研究表明:NH4VO3在体系中的溶解度随温度升高而明显增大。以此溶解度曲线为依据,为了实现溶液中钒的高效提取,初步设计在较高温度(75 ℃)下进行碳化铵化反应,并通过降温结晶实现偏钒酸铵从溶液中的分离。
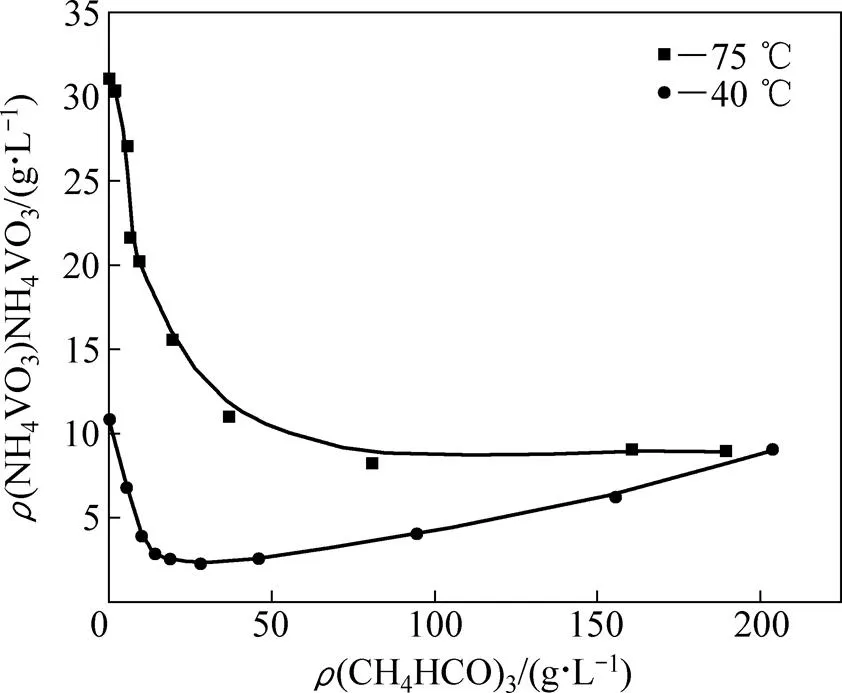
图1 40和75 ℃时NH4HCO3-NH4VO3-H2O溶解度曲线
关于钒酸钙在NH4HCO3溶液中反应的研究至今还未见相关报道,本文作者研究了NH4HCO3转化溶出钒的工艺条件,系统考察了不同液固比、碳酸氢铵添加量、反应温度对钒酸钙转化溶出效果的影响,确定了钒酸钙的最佳转化条件。
1 实验
1.1 实验试剂
钒酸钙为自制。钒酸钙的成分如表1所列,其物相组成如图2所示。

表1 钒酸钙化学组成
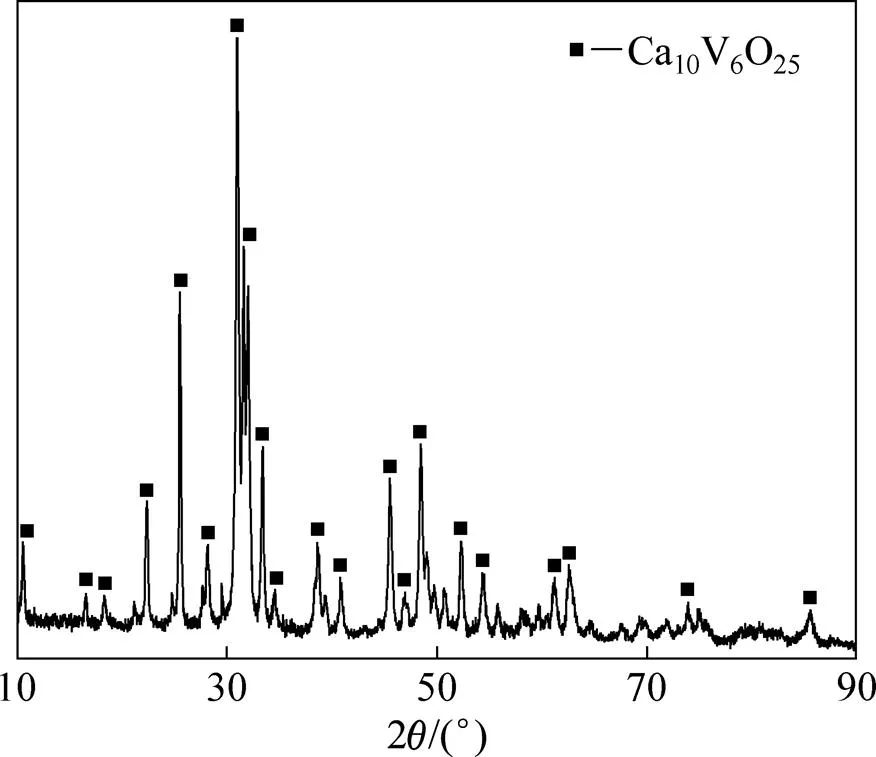
图2 自制钒酸钙的XRD谱
碳酸氢铵(NH4HCO3,西陇化工股份有限公司生产),分析纯,纯度大于99%。
高纯水(美国Millipore公司生产),环境温度下电阻率高于18.2 MΩ∙cm。
1.2 实验仪器及装置
Metter AE 163型分析天平(北京光学仪器厂生产);DF−101S型积热式磁力搅拌加热器(金坛市医疗仪器厂生产),D−841−WZ型数显控速搅拌机(天津实验仪器厂生产),SHZ−DIII型循环水式真空泵(巩义市予华仪器有限责任公司生产),DHG−9140A型电热鼓风干燥箱(上海一恒科学仪器有限公司生产),250 mL三口玻璃烧瓶。反应实验装置如图3所示。
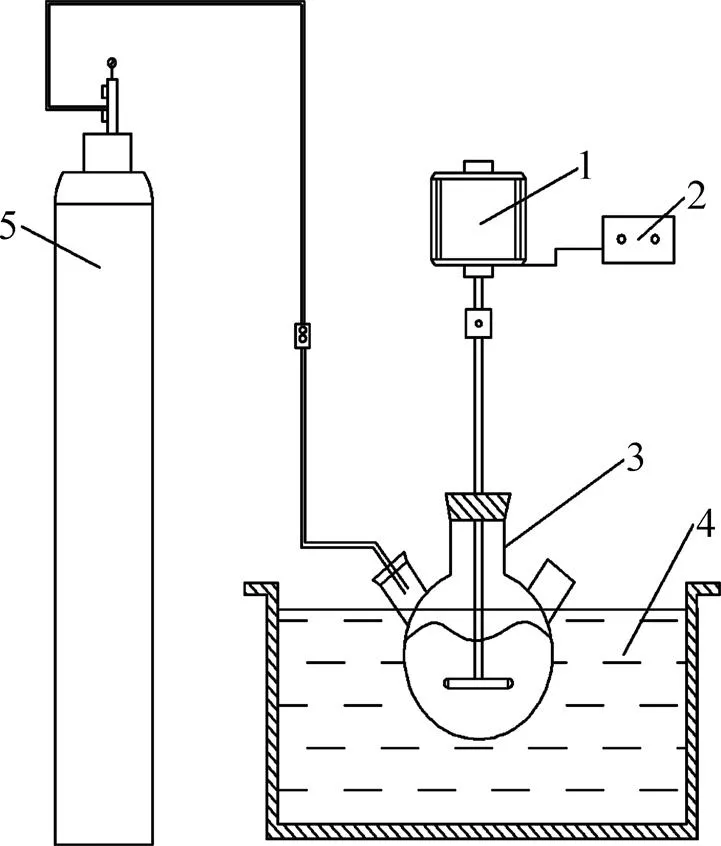
图3 碳化铵化反应实验装置示意图
1.3 分析方法
溶液中的钒含量采用Optima 5300 DV型电感耦合等离子体原子发射光谱仪(美国Perkin-Elmer仪器公司生产)分析;溶液中的铵含量采用UV9100型系列紫外可见分光光度计(北京莱伯泰科仪器有限公司生产)分析;固相粉末的物相鉴定采用X' Pert PRO MPD型X射线衍射仪(荷兰帕纳克公司生产)分析。
1.4 实验方法
准确称取一定量的钒酸钙加入三口烧瓶中,将三口瓶固定在搅拌装置上,加入一定体积的纯水,设置搅拌速度为200 r/min,校正水浴温度为反应温度。将通气管插入三口烧瓶中,并保证气体均匀分散进入溶液。打开气瓶主阀门,调节负阀门之流量计示数稳定在1.5 L/min。然后加入一定量的碳酸氢铵,反应2 h。当碳化反应结束后,关闭气瓶主副阀门,在反应温度下保温抽滤。抽滤结束后,用量筒称取液相并取样分析。固相用去离子水洗涤后,在反应温度下用鼓风干燥箱中烘干,取样分析。
1.5 钒转化率的计算
由式(2)可以看出,碳化铵化反应生成碳酸钙,因此钙不进入液相,可以认为固相中钙总量保持不变,若将钙含量以CaO计,则反应前后固相中氧化钙含量保持不变。假设反应前加入含钒固相g,其中氧化钙质量分数为53.9%;反应后得到的固相总质量为g,其中氧化钙含量为,则有
=53.9,即=53.9/(3)
通过反应前后固相中的钒含量的变化可以计算得到钒酸钙中钒浸出进入液相的转化率。设反应后得到的固相中钒含量(V2O5计)为,则可得到反应后固相中钒占总钒的比例为/(46.1),钒的转化率为
=[(1−/(46.1))]×100% (4)
将式(3)代入式(4),得到
=(1−1.17/)×100% (5)
2 结果与分析
2.1 通入CO2对钒酸钙中钒转化率的影响
从反应(2)中可以看出,若将钒酸钙中的钙离子完全转化为碳酸钙,需要三倍于钒酸钙物质的量的碳酸氢铵,但大量碳酸氢铵的加入会产生刺激性气味甚至跑氨,不利于工业化操作。而在反应过程中通入CO2不但可以为反应体系提供充足的碳源,使钙离子完全转化为碳酸钙,还可以减少碳酸氢铵的用量,防止跑氨现象的产生。
在铵根离子与钒酸钙中钒的摩尔比为1、液固比分别为15和20、反应温度75 ℃、搅拌速率200 r/min、反应时间2 h条件下,研究了不通入CO2与通入CO2时钒的转化效果,结果分别如图4和5所示。

图4 75 ℃不通CO2条件下碳化铵化反应钒转化率

图5 75 ℃通CO2条件下碳化铵化反应钒转化率
通过对比发现,通入CO2的碳化铵化反应,在相同的反应时间下得到的固相钒转化率明显高于未通入CO2的碳化铵化反应的固相钒转化率,且其钒转化率达到稳定值所需的反应时间要小于未通CO2所需反应时间。这说明,在碳化铵化反应中通入CO2能有效地提高碳化铵化反应的反应速度和反应限度。
实验所用的钒酸钙成分为 Ca10V6O25,即3Ca3(VO4)2·CaO,其中Ca3(VO4)2含量为70.08%(质量分数)。赵东峰等[20]对反应式(2)和(3)的吉布斯自由能进行计算,结果如图6。从图6中可以看出,反应(3)的吉布斯自由能明显低于反应(2)的,即液相中的碳酸根会先与氧化钙反应再与钒酸钙反应。由此推断,为了保证钒酸钙在反应中完全转化,必须向体系提供足够的碳源以生成碳酸钙,由此验证了通入CO2的必要性。

图6 不同温度下反应的吉布斯自由能
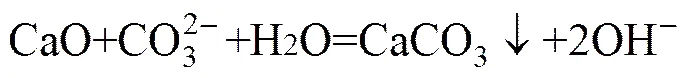
另外,通入CO2进行气液传质,不但可以使CO32−在反应体系中分散的更加均匀,还可以使物料更加充分的混合,从而提高反应效率。
2.2 NH4HCO3添加量对钒转化率的影响
2.2.1 反应液固比及碳酸氢铵加入量的确定
由图1可知,采用冷却结晶的方法可以从体系中分离NH4VO3。因此,若要提高偏钒酸铵结晶率,需要保证反应后液相中的偏钒酸铵含量在比较高的水平。从图1可以看出,75 ℃条件下,碳酸氢铵浓度为0 g/L 时,对应的偏钒酸铵溶解度最高,为31.02 g/L;那么在75 ℃的碳化铵化反应中,反应理论液固比应以得到偏钒酸铵浓度为31.02 g/L的饱和溶液为目的(对应反应液中V2O5理论物质的量应为0.135 mol/L)。即反应前固相中钒含量(以V2O5计)理论上与反应后进入液相的钒含量(以V2O5计)相等。假设钒酸钙的钒含量(以V2O5计)为,理论液固比为:1,反应液总体积为150 mL。则有,即=/2.457。
由于反应固相中钒含量为46.1%(质量分数),可知理论液固比为18.76:1,因此,选择液固比15以及20进行碳化铵化反应。
为考察碳酸氢铵加入量对碳化铵化的反应的影响,加入碳酸氢铵的量应能保证碳化铵化反应完全进行。设加入的碳酸氢铵的质量为g,为了保证钒酸钙中的钒完全转化为偏钒酸铵,理论上碳酸氢铵的物质的量应等于钒酸钙中钒的物质的量,即碳酸氢铵与钒酸钙中钒的物质的量之比(以下简称铵钒摩尔比)为1,
为了研究不同碳酸氢铵加入量条件下碳化铵化反应规律,考查了铵钒摩尔比为1、2和3条件下的反应情况。
2.2.2 NH4HCO3添加量对钒转化率的影响实验研究
在液固比20:1、反应温度75 ℃、搅拌速率200 r/min、CO2流量1.5 L/min、碳化时间2 h条件下,考察了铵与钒摩尔比为1、2、3条件下的碳化铵化反应规律。图7所示为不同铵钒摩尔比条件下碳化铵化反应的固相钒含量。由图7可知,不同铵钒摩尔比条件下固相中的钒含量变化趋势基本一致,这也印证了在通入CO2引入足够碳源的条件下即可反应完全的结论。

图7 不同碳酸氢铵加入量条件下碳化铵化反应体系中固相钒含量
图8所示为不同碳酸氢铵加入量条件下碳化铵化反应液相钒含量。从图8可以看出,碳酸氢铵加入量对反应液中钒含量影响很大,随着碳酸氢铵加入量的增加,液相中钒含量明显降低。由图1可知,75 ℃时,偏钒酸铵在碳酸氢铵溶液中的溶解度随碳酸氢铵浓度的增加而降低,因此,过多的碳酸氢铵加入量会降低偏钒酸铵在溶液中的溶解度。因此,选择铵钒摩尔比为1作为反应条件,可以使后续溶液中碳酸氢铵含量最低,从而最大限度提高偏钒酸铵在体系中的溶解度,进而提高在反应后液相中进行的偏钒酸铵结晶的结晶率。
图8 不同碳酸氢铵加入量条件下碳化铵化反应体系中液相钒含量变化曲线
Fig. 8 Changing curves of vanadium concentrations in liquid phase of carbonization-ammonium reaction under different additions of NH4HCO3
2.3 反应温度对钒转化率的影响及碳化铵化反应规律研究
为了探究碳化铵化反应在不同温度下的反应规律,在液固比20:1、铵与钒摩尔比1、搅拌速率200 r/min、CO2流量1.5 L/min、碳化时间2 h条件下,选择温度40、55、60和75 ℃进行反应。
图9所示为不同温度下碳化铵化反应体系中固相钒含量变化曲线。由图9可以看出,在40~60 ℃温度条件下,固相钒含量变化趋势以及数值几乎一致,即0~5 min内固相钒含量均急剧降低;在5~30 min内,降低速度变缓;在30 min之后固相钒含量呈平稳降低趋势;反应120 min后,固相钒含量均降至3%左右。反应温度为75 ℃时固相钒含量变化趋势与其他温度相同,但从反应5 min开始,其固相钒含量低于其他温度下固相钒含量。以上结果表明,在40~75 ℃之间碳化铵化反应均可发生,但在75 ℃时反应更为彻底。另外,相关研究表明[21],只要浸出溶液中铵根离子浓度不太高,温度不低于70 ℃时,不会生成偏钒酸铵沉淀,因此,选择75 ℃进行反应可以实现钒的高效浸取。
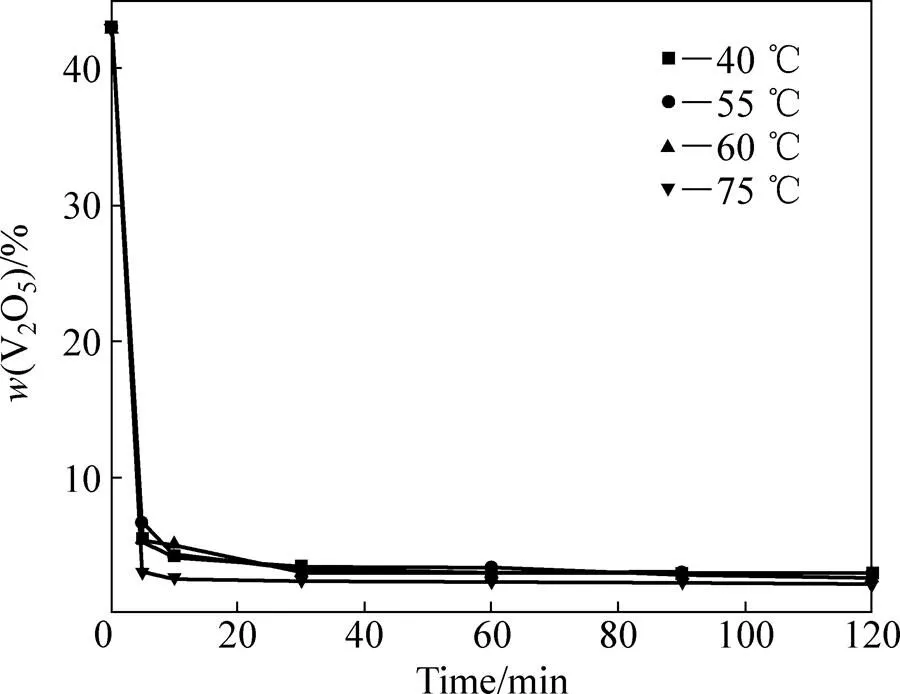
图9 不同温度下碳化铵化反应体系中固相钒浓度变化曲线
为进一步考察碳化铵化反应过程中过饱和偏钒酸铵的沉淀规律,需对反应体系中的液相钒浓度进行监测。鉴于碳化铵化反应为吸热反应,其反应限度应随反应温度的降低而升高,同时较低的反应温度也能降低反应溶液中偏钒酸铵的溶解度,从而加强碳化铵化反应过程中过饱和偏钒酸铵溶液的沉淀过程,因此,选择在40 ℃较低液固比(液固比分别为4、6、8、10)下进行反应,并将40 ℃下偏钒酸铵溶解度的理论最低点(即碳酸氢铵的量为25 g/L)作为理论反应终点,则加入的碳酸氢铵量为在铵钒摩尔比为1的基础上再加25 g/L碳酸氢铵。
图10所示为40℃低液固比条件下碳化铵化反应体系中固相钒含量随时间的变化曲线。由图10可以看出,与图9结果相似,在10 min内固相钒含量降低速度极快,在10 min时已接近浓度的最低点,即10 min之内碳化铵化反应已基本反应完全。图11所示为40 ℃低液固比条件下碳化铵化反应的液相钒浓度随时间变化关系曲线。从图11可以看出,在不同液固比条件下,液相中钒浓度均随反应时间的增加而降低,且经过120 min沉淀,均趋向3.5 g/L左右,接近理论条件下偏钒酸铵溶解度最低的点(2.4 g/L)。但相较于碳化铵化反应的快速完成,液相钒浓度的降低,也就是偏钒酸铵的结晶过程至少需要120 min才能趋于平稳,这说明偏钒酸铵过饱和溶液的沉淀结晶是一个相对缓慢的过程。即通过40 ℃低液固比条件下的碳化铵化反应验证了反应过程中快速反应、缓慢结晶的反应规律。

图10 40 ℃碳化铵化反应体系中固相钒含量变化曲线
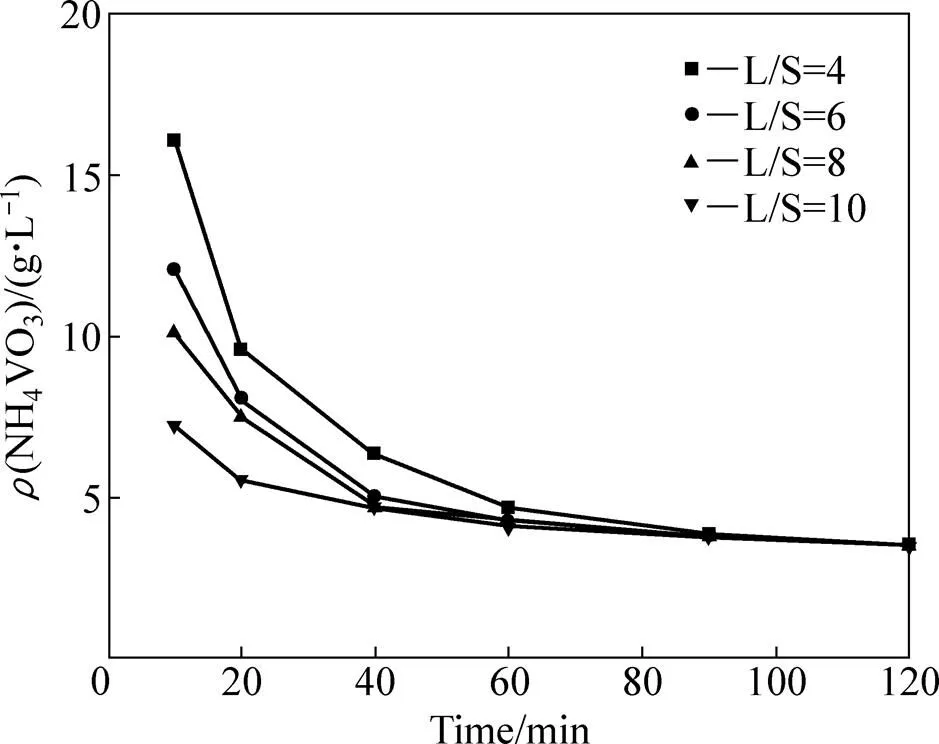
图11 40 ℃碳化铵化反应体系中液相钒浓度变化曲线
2.4 液固比对钒转化率的影响
在铵钒摩尔比1、反应温度75 ℃、搅拌速率200 r/min、CO2流量1.5 L/min、碳化时间2 h条件下,研究了液固比为15和20时钒的转化效果,实验结果分别如图12和13所示。

图12 不同液固比条件下碳化铵化反应体系中固相钒含量变化曲线
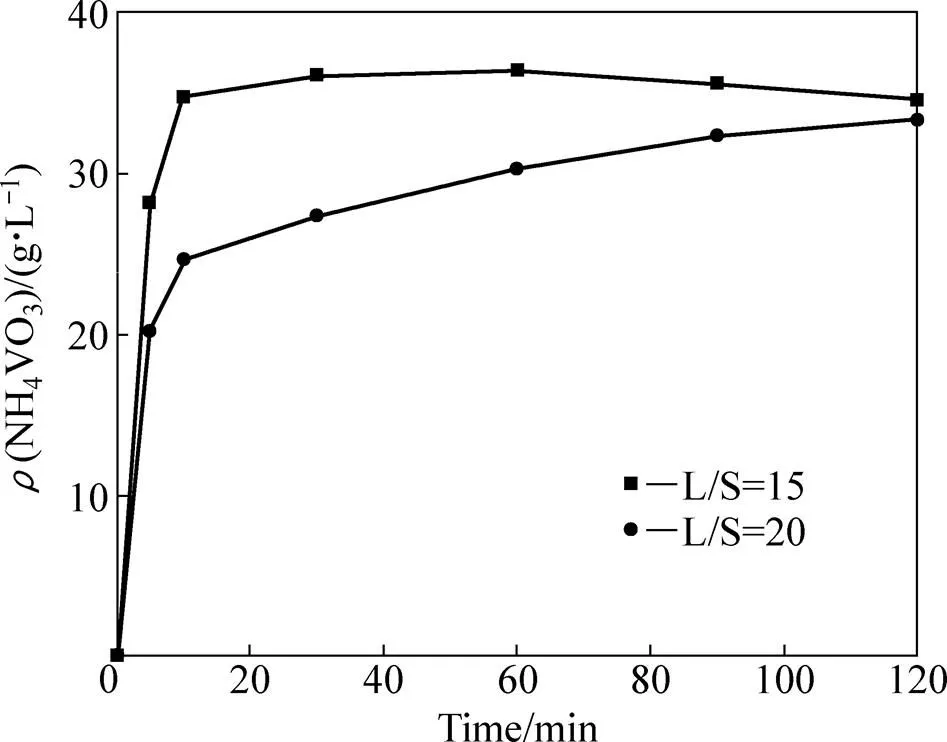
图13 不同液固比条件下碳化铵化反应体系中液相钒浓度变化曲线
图12所示为不同液固比时碳化铵化反应体系中固相钒含量变化曲线。由图12可以看出,液固比的15和20的条件下,固相钒含量变化趋势相似,即在0~5 min时间范围内,固相钒含量急剧降低;在5~10 min范围内时,其降速放缓;10 min后,固相钒含量呈平稳降低趋势;反应120 min后,固相钒含量分别降到2.26%以及2.13%。相比于液固比为15的情况,液固比为20时的固相钒含量可以在短时间内降到更低的水平,并且在反应5~120 min期间一直保持更低的固相钒含量。
图13所示为不同液固比条件下碳化铵化反应体系中液相钒浓度变化曲线。从图13可以看出,液固比为15时,液相中的NH4VO3含量呈先增加后降低的趋势,这是因为液相中偏钒酸铵的浓度不仅与含钒固相的碳化铵化反应有关,还受到液相中偏钒酸铵的过饱和沉淀影响。反应7 min后,溶液中的NH4VO3含量即达到过饱和状态;反应60 min时,NH4VO3形成沉淀进入固相使反应液相中的浓度有所降低。而在液固比为20时,由于液固比较大,偏钒酸铵在反应90 min时才达到饱和之后无沉淀析出,因此,可以得到钒含量较低的固相产物。
综合对比液固比为15以及20时的反应情况,液固比为20时,反应固相中的钒含量能更快降低并维持在较低水平,而液相中的偏钒酸铵也未沉淀进入固相造成钒的损失,因此,选择液固比为20进行工艺实验。
另外,通过对反应过程的监测发现,75 ℃、液固比20、铵与钒摩尔比1时,碳化铵化反应在1 h之后各物相基本不再变化,从成本以及节能角度考虑,将反应时间定为1 h。
2.5 最优工艺实验方案
由以上的分析可知,碳化铵化反应最佳工艺条件如下:反应温度为75 ℃,液固比为20,通入CO2流速为1.5 L/min,铵与钒摩尔比为1,反应1 h。在最佳工艺条件下进行碳化铵化实验。最佳工艺条件如下:反应温度为75 ℃,液固比为20,通入CO2流速为1.5 L/min,铵与钒摩尔比为1,反应1 h。在最佳工艺条件下进行碳化铵化实验,采用7.5 g钒酸钙固相、150 mL浸出液反应,反应后钒酸钙相中V2O5含量为2.04%(质量分数),液相中NH4VO3浓度为26.9 g/L,此时碳化铵化反应钒转化率达到97.35%。
另外,对反应后固相产物进行X射线衍射分析,得到结果如图14所示。明确得到的产物为碳酸钙。

图14 碳化铵化反应产物的XRD谱
2.6 碳化铵化-结晶工艺设计
综上所述可知,偏钒酸铵的结晶是一个相对缓慢的过程,并且其结晶率取决于偏钒酸铵在碳化铵化温度(75 ℃)和冷却结晶温度(40 ℃)下的溶解度。在75 ℃、液固比20、铵钒摩尔比为1条件下进行碳化铵化反应,由于碳酸氢铵的理论加入量等于碳酸氢铵的理论消耗量,即与钒酸钙中的钒等物质的量,则碳化铵化后液中碳酸氢铵的理论含量为0 g/L。因此,反应后溶液中偏钒酸铵理论浓度为31.02 g/L。此时,若直接降温至40 ℃使偏钒酸铵结晶,由于溶液中碳酸氢铵理论含量为0 g/L,则结晶终点时溶液中偏钒酸铵理论含量为10.79 g/L,理论结晶率为65.2%。
为了进一步提高结晶率,可将40 ℃时溶液中的碳酸氢铵浓度控制在偏钒酸铵溶解度最低的25 g/L处,即采用碳酸氢铵盐析结晶的方式,通过提高碳酸氢铵浓度调整溶液中偏钒酸铵的溶解度,使结晶过程由降温结晶转变为降温−盐析结晶,从而达到提高结晶率的目的。在40 ℃降温结晶时,向溶液中补加25 g/L的碳酸氢铵,将溶液中偏钒酸铵溶解度降低至2.2 g/L,理论结晶率可达92.9%。具体工艺流程设计如图15所示。

图15 碳化铵化反应工艺设计流程图
3 结论
1) 钒酸钙碳化铵化反应的最佳条件如下:通入CO2流速1.5 L/min,反应温度75 ℃,液固比20,铵钒摩尔比为1.0,反应时间1 h,此条件下钒转化率可达97.35%。
2) 明确了碳化铵化反应快速反应、缓慢结晶的特性,确定了降温加盐析结晶分离偏钒酸铵的方法,理论结晶率可达92.16%。
3) 钒酸钙碳化铵化生产钒氧化物实现了反应介质的循环利用,全过程无废水排放。
REFERENCES
[1] MOSKALYK R R, ALFANTAZI A M. Processing of vanadium: A review[J]. Miner Eng, 2003, 16: 793−805.
[2] NAVARRO R, GUZMAN J, SAUCEDO I, REVILLA J, GUIBAL E. Vanadium recovery from oil fly ash by leaching, precipitation and solvent extraction processes[J]. Waste Manage, 2007, 27: 425−438.
[3] 付自碧. 钒钛磁铁矿提钒工艺发展历程及趋势[J]. 中国有色冶金, 2011, 6: 29−33. FU Zi-bi. Development process and trends of vanadium extraction from vanadium-titanium magnetite ore[J]. China Nonferrous Metallurgy, 2011, 6: 29−33.
[4] WANG Zhong-hang, ZHENG Shi-li, WANG Shao-na, QIN Ya-ling, DU Hao, ZHANG Yi. Electrochemical decomposition of vanadium slag in concentrated NaOH solution[J]. Hydrometallurgy, 2015, 151: 51−55.
[5] SONG Wen-chen, Li Hong, ZHU Fu-xing, LI Kun, ZHENG Quan. Extraction of vanadium from molten vanadium bearing slag by oxidation with pure oxygen in the presence of CaO[J]. Transactions of Nonferrous Metal Society of China, 2014, 24: 2687−2694.
[6] 王秋霞, 马化龙. 我国钒资源和V2O5研究、生产的现状及前景[J]. 矿产保护与利用, 2009(5): 47−50.WANG Qiu-xia, MA Hua-long. Status and prospects of V2O5product research & production and China’s vanadium resources[J]. Conservation and Utilization of Mineral Resources, 2009(5): 47−50.
[7] 陈 迪, 张 强. 我国钒产业概况及其环境问题[J]. 冶金丛刊, 2009, 10(5): 39−42.CHEN Di, ZHANG Qiang. The profiles of vanadium industry in China and its environmental problems[J]. Metallurgical Collections, 2009, 10(5): 39−42.
[8] 别 舒, 王兆军, 李清海, 张衍国. 石煤提钒钠化焙烧与钙化焙烧工艺研究[J]. 稀有金属, 2010, 34(2): 291−297.BEI Shu, WANG Zhao-jun, LI Qing-hai, ZHANG Yan-guo. Review of vanadium extraction from stone coal by roasting technique with sodium chloride and calcium oxide[J]. Chinese Journal of Rare Metals, 2010, 34(2): 291−297.
[9] FENG Man, ZHENG Shi-li, WANG Shao-na, DU Hao, ZHANG Yi. Solubility investigations in the quaternary NaOH-Na3VO4-Na2CrO4-H2O system at 40 and 80℃[J]. Fluid Phase Equilibria, 2013, 360: 338−342.
[10] 刘挥彬, 杜 浩, 刘 彪, 王少娜, 郑诗礼, 张 懿. KOH亚熔盐中钒渣的溶出行为[J]. 中国有色金属学报, 2013, 23(4): 1129−1139.LIU Hui-bin, DU Hao, LIU Biao, WANG Shao-na, ZHENG Shi-li, ZHANG Yi. Dissolution behavior of vanadium slag in KOH sub-molten salt[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(4): 1129−1139.
[11] 郑诗礼, 杜 浩, 王少娜, 张 懿, 陈东辉, 白瑞国. 亚熔盐法钒渣高效清洁提钒技术[J]. 钢铁钒钛, 2012, 33(1): 15−19.ZHENG Shi-li, DU Hao, WANG Shao-na, ZHANG Yi, CHEN Dong-hui, BAI Rui-guo.Efficient and cleaner technology of vanadium extraction from vanadium slag by sub-molten salt method[J]. Iron Steel Vanadium Titanium, 2012, 33(1): 15−19.
[12] 潘自维, 王大卫, 杜 浩, 陈 刚, 郑诗礼, 王少娜, 张 懿.活性炭强化钒渣中钒、铬提取技术[J]. 中国有色金属学报, 2014, 24(8): 2171−2180.PAN Zi-wei, WANG Da-wei, DU Hao, CHEN Gang, ZHENG Shi-li, WANG Shao-na, ZHANG Yi. Extraction technology of vanadium and chromium From vanadium slags in presence of activated carbon[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(8): 2171−2180.
[13] 杨 娜, 王少娜, 杜 浩, 秦亚灵, 郑诗礼, 张 懿. KOH介质多元体系中铬酸钾与钒酸钾的高效结晶分离[J]. 过程工程学报, 2012, 12(3): 402−407.YANG Na, WANG Shao-na, DU Hao, QIN Ya-ling, ZHENG Shi-li, ZHANG Yi. Efficient crystallization separation of K2CrO4and K3VO4in alkaline multi-component system of KOH medium[J]. The Chinese Journal of Process Engineering, 2012, 12(3): 402−407.
[14] 赵 楚, 郑诗礼, 王少娜, 杜 浩, 杨 娜. 钒酸钾钙化沉钒制备钒酸钙[J]. 过程工程学报, 2013, 13(3): 442−446.ZHAO Chu, ZHENG Shi-li, WANG Shao-na, DU Hao, YANG Na. Preparation of calcium vanadate by calcification of potassium orthovanadate[J]. The Chinese Journal of Process Engineering, 2013, 13(3): 442−446.
[15] 陈厚生. 钒渣石灰焙烧法提取V2O5工艺研究[J]. 钢铁钒钛, 1992, 13(6): 1−9. CHEN Hou-sheng. Technical study on extracting V2O5using vanadium slag lime roasting method[J]. Iron Steel Vanadium Titanium, 1992, 13(6): 1−9.
[16] 康兴东, 张一敏, 刘 涛, 刘建明, 陆 岷, 王 萍.酸性铵盐沉钒制备高纯V2O5的试验研究[J].矿产综合利用, 2008, 4: 14−18. KANG Xing-dong, ZHANG Yi-min, LIU Tao, LIU Jian-ming, LU Min, WANG Ping. Experimental study on preparation of high-purity V2O5with acidic ammonium salt precipitation of vanadium-rich liquor[J]. MultipurposeUtilization of Mineral Resources, 2008, 4: 14−18.
[17] 申小清, 杨林莎, 许 闽, 李中军. 从含钒酸浸液中回收钒的工艺研究[J]. 河南化工, 1999, 1: 16−18. SHEN Xiao-qing, YANG Lin-sha, XU Min, LI Zhong-jun. Technical study on recovery of vanadium from vanadium-containing acid leaching solution[J]. Henan Chemical Industry, 1999, 1: 16−18.
[18] 张中豪. 钙化焙烧冶炼V2O5新工艺研究[J]. 新技术新工艺, 1999, 12(3): 23−24. ZHANG Zhong-hao. New technology study on smelting V2O5by baking with calcium compounds[J].New Technology & New Process, 1999, 12(3): 23−24.
[19] 赵 楚, 冯 曼, 王少娜, 杜 浩, 郑诗礼, 谢 华. 40 ℃和75 ℃下三元体系NH4HCO3-NH4VO3-H2O中NH4VO3溶解度的测定[J]. 化工进展, 2014, 33(6): 1408−1412. ZHAO Chu, FENG Man, WANG Shao-na, DU Hao, ZHENG Shi-li, XIE Hua. Solubility investigation of NH4VO3in the ternary NH4HCO3-NH4VO3-H2O system at 40 ℃ and 75 ℃[J]. Chemical Industry and Engineering Progress, 2014, 33(6): 1408−1412.
[20] 赵东峰, 田 侣, 丁瑞锋, 刘桂华, 周秋生, 李小斌, 彭志宏. 铬酸钠碱性液中加石灰除钒[J]. 中国有色金属学报, 2011, 21(12): 3162−3168. ZHAO Dong-feng, TIAN Lu, DING Rui-feng, LIU Gui-hua, ZHOU Qiu-sheng, LI Xiao-bin, PENG Zhi-hong. Vanadate removal from alkaline sodium chromate solution by adding lime[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(12): 3162−3168.
[21] 蒋馥华, 张 萍, 何其荣. 钙化焙烧法从石煤中提取五氧化二钒[J]. 湖北化工, 1992, 1: 20−22. JIANG Fu-hua, ZHANG Ping, HE Qi-rong. Extracting V2O5from stone coal by calcium roasting method[J]. Chemistry & Bioengineering, 1992, 1: 20−22.
Reaction rules of carbonization-ammonium process roducing vanadium oxide
YANG Hong, WANG Shao-na, DU Hao, ZHENG Shi-li, ZHANG Yi
(National Engineering Laboratory for Hydrometallurgical Cleaner Production Technology, Key Laboratory for Green Process and Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China)
A new process which transforms calcium vanadate, the intermediate product during the previous vanadium-chromium co-extraction by vanadium slag sub-molten salt roasting process, to vanadium oxide using carbonization-ammonium method was proposed. The subsequent transformation of calcium vanadate and the vanadium extraction using NH4HCO3as reactant was studied. The effects of CO2, NH4+-V mole ratio, liquid-solid ratio and reaction time were investigated. By controlling the reaction temperature at 75 ℃, liquid-solid ratio of 20, CO2flow rate of 1.5 L/min, NH4+-V mole ratio of 1 and reaction time of 1 h, the optimal process conditions are obtained, which make the vanadium conversion from calcium vanadate reach 97.35%.
vanadium slug; sub-molten salt; calcium vanadate; carbonization-ammonium process; ammonium bicarbonate
Project(2013CB632605) supported by the Major State Basic Research Development Program of China; Project(51404227, 51274179) supported by National Natural Science Foundation of China; Project(KDJ-SW-STS-148) supported by the Science and Technology Service Network Initiative of Chinese Academy of Science
2015-08-11; Accepted date:2015-12-14
WANG Shao-na; Tel: +86-10-82544856; E-mail: shnwang@ipe.ac.cn
1004-0609(2016)-09-2023-09
TF111
A
国家重点基础研究发展计划资助项目(2013CB632605);国家自然科学基金资助项目(51404227,51274179);中国科学院材料服务网络计划资助项目(KDJ-SW-STS-148)
2015-08-11;
2015-12-14
王少娜,副研究员,博士;电话:010-82544856;E-mail:shnwang@ipe.ac.cn
(编辑 龙怀中)
