来源于电子垃圾污染地区的重金属抗性菌株研究
2016-10-12张青岩黄通旺
胡 昱,陈 飚,阚 劼,张青岩,黄通旺*
(1.汕头市金山中学,广东汕头 515063; 2.汕头大学生物系,广东汕头 515063)
来源于电子垃圾污染地区的重金属抗性菌株研究
胡昱1,a,陈飚2,a,阚劼2,张青岩1,黄通旺2*
(1.汕头市金山中学,广东汕头515063;2.汕头大学生物系,广东汕头515063)
通过对电子垃圾污染环境来源的样品利用选择性培养基进行微生物培养与纯化,分离、筛选出12株对重金属铜(Cu2+)具有较高抗性的菌株;其中,菌株HZB同时对铬(Cr2+)和镉(Cd2+)也具有较高的抗性.通过对菌株HZB的生理生化特性及16S rDNA序列进行分析,结果表明菌株HZB属于蜡状芽孢杆菌,它在中性环境中生长良好.利用重金属最低抑制浓度的检测,发现菌株HZB能单抗4.2 mmol/L的Cr2+、2.5 mmol/L的Cu2+和0.7 mmol/ L的Cd2+.在Cu2+的环境中,菌株HZB对Cu2+具有明显的吸附作用;并且在应激和适应的状态下,菌株HZB显示出相似的吸附曲线.曲线拟合结果表明,在适应的状态下,HZB菌体对Cu2+的吸附更符合Langmuir吸附理论.
重金属;抗性菌株;铜离子;电子垃圾
当今世界环境问题日益突出,被淘汰及废弃的电器、电子产品所形成的电子垃圾造成的环境污染问题也越来越引起人们的重视.据统计,全世界每年约有4 000万吨废旧电子产品被丢弃,其中约70%在中国拆解与遗弃[1].汕头贵屿、清远龙塘等电子垃圾拆解区每年处理电子垃圾近百万吨,主要采用手工拆解、焚烧、填埋等粗放式的处理方式[2].电子垃圾电器元件含有砷、铅、铬、铜、汞等重金属和其它多种有害物质,很容易对土壤和水体造成严重污染[3].
自然界中存在种类繁多的微生物,其中有许多对重金属具有抗性,在含有重金属的环境中能良好的生长,同时在形态、生理、遗传上显示出某些特定的生物学反应[4];而且微生物在修复被重金属污染的环境方面具有独特的作用.本课题组[5]前期研究了贵屿受电子垃圾污染地区的土壤和沉积物样品的重金属污染状况,发现其中Cu和Pb超标严重,Zn的含量也处于较高水平;同时,利用变性梯度凝胶电泳(DGGE)分析、构建16S rRNA文库,证实污染地区样品中存在丰富的微生物类群,其中变形菌门和未定义的门类含量最高,分别为40%和28%.本研究进一步从受电子垃圾污染地区的土壤中分离纯化了对重金属具有抗性的微生物菌株,并对其中的典型菌株特性以及对重金属抗性进行了研究,为微生物修复受重金属污染环境积累资料.
1 材料与方法
1.1重金属抗性菌株的分离、筛选
采集汕头贵屿的污染土壤和河流沉积物样品,装于无菌采样瓶中,4℃储存送回实验室,24 h内进行实验.将样品10 g溶于含90 mL无菌蒸馏水和玻璃珠的三角瓶中,在25℃摇床于220 r/min振荡1 h;静置30 min后取上清,做梯度稀释并涂布在牛肉膏琼脂平板上,25℃温箱避光培养2天.挑取平板中的单菌落,在牛肉膏琼脂平板上进行划线培养,挑取单菌落划线培养,连续三次培养出单菌落,且其性状没有发生改变,即得到纯的菌株.
为了进行抗重金属铜的菌株初选,设置含较高铜浓度2.0 mmol/L牛肉膏液体培养基对所纯化得到的株进行25℃摇床于220 r/min振荡培养,观察其生长情况,得到重金属抗性菌株.
1.2菌株生理生化特性研究
准备250 mL液体牛肉膏培养基,以1%接种量接种后混匀,25℃下震荡培养,每1.5 h取5 mL于一支试管中在4℃冰箱里冻存,最后一起测定其OD600的值,以测定菌株的生长曲线.
设计pH梯度5.5、6.0、6.5、7.0、7.5、8.0培养24 h,测量其OD600的值,以测定不同pH对菌株生长的影响.
1.3菌株16S rRNA基因序列分析
依照细菌16S rDNA基因中最保守的序列,采用正向引物F26:5-GAG AGT TTG ATC CTG GCT CAG-3;反向引物R1492:5-CGG CTA CCT TGT TAC GAC TTC-3对菌株进行菌落PCR,挑取单菌落于20 μL无菌水中,100℃水浴7 min,12 000 rpm离心5 min,取1 μL上清液作为PCR模板.30 μL反应体系:10×PCR Buffer(with Mg2+)3 μL,dNTP(2.5 mmol/L each)2 μL,引物(10 μmol/L)各1 μL,模板1 μL,加MilliQ水至30 μL.反应条件:95℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸30 s,33个循环,72℃最终延伸9 min.PCR反应的产物用1%琼脂糖凝胶电泳检测;产物经纯化后克隆于pUCm-T载体,并转化入DH5α.经过抽提质粒和PCR验证正确后,送基因测序公司测定其DNA序列,最后将测定的序列提交GenBank数据库,与数据库中已有的16S rRNA基因序列进行相似性比较分析.用ClustalX进行序列比对后采用MEGA4.0软件进行系统发育分析.
1.4菌株重金属最低抑制浓度(MIC)的测定
挑取抗性菌株的单菌落于新鲜的牛肉膏液体培养基中,25℃振荡培养,待菌液比较浑浊时,移取1%的接种量至含有新鲜定量的牛肉膏液体培养基中,25℃继续振荡培养,待OD600值达到0.2左右,在其中加入相应的重金属浓度,24 h后取出,检测菌体生长状况.
1.5菌株重金属吸附能力测定及反应动力学研究
将斜面保藏的菌株活化后制成菌悬液,25℃振荡培养,待菌液比较浑浊时,移取1%的接种量至含有新鲜定量的牛肉膏液体培养基中,25℃继续振荡培养;待OD600值达到0.2左右,在其中加入相应的重金属浓度,每3 h后取出一定菌液;10 000 r/min离心5 min收集上清液,用原子吸收分光光度计测定上清液中金属的浓度并计算吸附率.以加有等量去离子水的液体培养基为对照,以对菌株对重金属吸附的反应动力学进行测定[6].
2 结果与讨论
2.1电子垃圾污染地区来源重金属抗性菌株的分离
从汕头贵屿受电子垃圾污染地区的样品中,初步分离到12株具有抗Cu2+能力的菌株,其菌落形态差异明显(如表1所示);与本课题组前期研究获得的结果一致[5].
选取其中抗Cu2+能力强的菌株HZB,鉴定其菌种,并进一步研究其生理生化特性和抗重金属能力.
2.2菌株HZB的生理生化特性及鉴定
2.2.1生理生化特性
从菌落形态上观察,菌株HZB为圆形、凸起菌落,其边缘整齐,呈乳白色,表面光滑;显微镜观察为短杆菌,经革兰氏染色为阳性菌.通过对其生理生化特性分析,结果显示该菌株为氧化酶阳性,甲基红阳性,V-P试验阳性,吲哚试验阴性.

表1 具重金属铜抗性菌株初步筛选结果统计
对菌株HZB进行培养,测定其OD600以确定其生长曲线,结果如图1所示.菌株在25℃振荡培养,于4 h后进入对数生长期,在20 h后达到生长后期,24 h后进入衰减期.
为了测定不同pH值对菌株生长的影响,设计pH梯度5.5、6.0、6.5、7.0、7.5、8.0培养24 h,测量OD600的值,其生长状况如图2.菌株在不同的pH值的液体培养基中培养都能达到OD600为0.6左右的最高菌体浓度,因为所用的pH值偏于酸,说明菌株对不同的pH值具有较强的适应能力.
进一步分析发现,菌株在较低pH值(如5.5、6.0、6.5)达到生长最高峰所需的时间要比在较高pH(如7.0、7.5、8.0)的要长,说明不同的pH值对菌株的生长速率有一定的影响.为了研究菌株的抗重金属能力,后续的实验都选择在pH值7.0的条件下进行.

图1 菌株HZB的生长曲线

图2 不同pH值培养下菌株HZB的生长曲线
2.2.2菌株16S rRNA基因序列分析
取菌株HZB单菌落,对其16S rRNA基因中最保守的序列进行测序.对测定后的16S rRNA基因序列进行BLAST比对分析(如图3),发现菌株HZB与Bacillus cereus的菌株相似性达99%,因此初步将其归于Bacillus属,并命名为Bacillus sp.HZB,同时将其序列提交到Genbank(基因序列号为FJ790330).
早在1977年就有人发现了Cu2+能刺激B.cereus菌产生重金属结合能力的铜蛋白粪卟啉Ⅲ[7].对B. cereus菌株抗重金属汞的研究有多篇报道,在一株能在50 mM HgCl2条件下生长的B.cereus中,研究者发现Hg2+能增加细菌还原性NADPH的产量[8];从受汞严重污染的帕丽卡湖底沉积物中分离出一些具有汞抗性的B.cereus菌,实验表明这些菌的汞抗性是由染色体基因决定的,其中有5个菌株具有merA和merB3基因,而其它不具备这些基因的B.cereus菌可能具有其它抗汞的机制[9].

图3 菌株HZB的16S rRNA基因系统进化树
2.3菌株对重金属的最低抑制浓度(MIC)
最低抑菌浓度(MIC)是指在体外试验中,各种重金属能抑制培养液中细菌生长的最低浓度,MIC值越大,重金属对菌体的毒性越小;相反,其对菌体的毒性就越大.本实验通过测定Cr2+、Cu2+和Cd2+三重金属离子对菌株的毒性,获得结果如图4所示.菌株HZB具有单抗4.2 mmol/L Cr2+、2.5 mmol/L Cu2+和0.7 mmol/L Cd2+的能力.
Maiti等[10]发现B.cereus菌对Cd2+、Zn2+、Cu2+和Pb2+等都具有较强的抗性,说明B.cereus菌的重金属抗性的独特性质.曾奇玉等[11]研究发现肠杆菌ZM-12具有较强的Cu2+、Pb2+、Mn2+、Ni2+耐受性,在不同种类的重金属培养基中,其MIC值各不相同,菌株ZM-12对Cu2+、Pb2+、Mn2+、Ni2+的MIC值分别为22.33 mmol/L、14.48 mmol/L、>200 mmol/L和58.69 mmol/L.
2.4菌株HZB对Cu2+的吸附能力及反应动力学
将斜面保藏的菌株活化后制成菌悬液,25℃振荡培养,待菌液比较浑浊时,移取1%的接种量至含有新鲜定量的牛肉膏液体培养基中,25℃继续振荡培养,待OD600值达到0.2左右,在其中加入Cu2+,每3 h后取出一定菌液,10 000 r/min离心5 min收集上清液,用原子吸收分光光度计测定上清液中金属的浓度并计算吸附率,并把这种情况设定为应激抗性的情况.
另设一个适应的情况,在含重金属的培养基中培养菌株,使其达到适应重金属浓度的状态,移取1%的接种量至含有新鲜定量含重金属Cu2+的牛肉膏液体培养基中,25℃继续振荡培养,每3 h后取出一定菌液,10 000 r/min离心5 min收集上清液,用原子吸收分光光度计测定上清液中金属的浓度并计算吸附率.
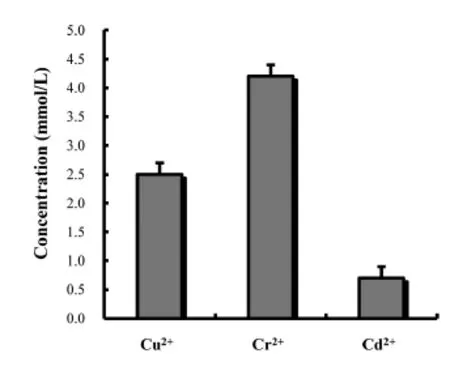
图4 不同重金属对菌株HZB的最低抑制浓度
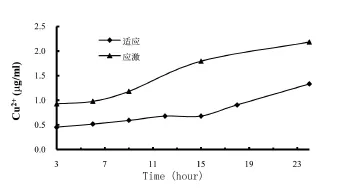
图5 菌株HZB对重金属铜在不同时间长度下的吸附量
菌株HZB吸附Cu2+过程如图5、6所示,表明在生长周期中菌株对Cu2+的吸附量随时间的增长而增加,以1%接种量在24 h后,吸附量达到了2.1 g/mL.但单位菌株Cu2+吸附量有一个先减后增的过程,在15 h菌密度达到最高时,单位菌株Cu2+吸附量最少;而且在不同培养时间段加入重金属对菌体的生长和吸附也有影响.
通过研究B.cereus、B.subtilis、E.coli和Pseudomonas aeruginosa四种菌株对Ag+、Cd2+、Cu2+、La3+的吸附特性,Mullen等[12]发现P.aeruginosa和B.cereus在1 mM浓度下对Cd2+和Cu2+具有很高的吸附效率;电子显微镜检测显示La3+的吸附主要集中在细菌的表面,在表面形成针形的簇状结构,但Cd2+、Cu2+由于不能提供更强的电子,而未能确定其在细菌上的吸附位置.

图6 在应激和适应生长条件下的单位菌株的重金属吸附量及菌株生长曲线
Langmuir吸附理论认为固体吸附剂表面均匀地分布着具有吸附能力的位点,每个位点只能吸附一个分子,吸附热不随吸附而产生变化.Freundlich吸附理论认为吸附热随着吸附量的增加呈对数形式的降低[13].Lu等[14]用肠杆菌属的菌株J1开展吸附Pb2+、Cu2+和Cd2+的研究,结果表明菌株J1对Cu2+和Cd2+的吸附能很好的符合Langmuir和Freundlich等温吸附理论,但对Pb2+的吸附则表现为一种不同的模型;他们认为这可能与细胞内的重金属积累有关.Maiti等[10]利用固定的B.cereus菌株M1对六价的Cr进行吸附,他们分别检测了在不同流速、浓度、固定床高度条件下的细菌表面吸附速率和胞内吸附速率,结果表明细菌表面的重金属吸附起到了决定性的作用.
通过曲线拟合,如图7~8所示,菌株HZB在适应条件下菌体对Cu2+的吸附更加符合Langmuir吸附理论,其拟合方程R=0.962 0;而Freundlich吸附方程拟合R=0.894 6;说明HZB菌体吸附Cu2+接近于单分子层吸附的理想状态.
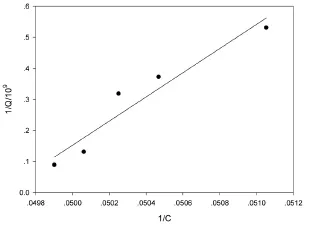
图7 Langmuir吸附方程拟合(R=0.962 0)

图8 Freundlich吸附方程拟合(R=0.894 6)
黄志钧等[15]从四川红原地区土壤中分离纯化得到对Cu2+具有良好抗性的菌株YS-22;利用该菌进行生物吸附研究,结果显示其对水体中的Cu2+具有良好的吸附性能,吸附行为能很好地符合Pseudo二级动力学模型和Langmuir等温吸附模型.李兰松等[16]发现铜抗性细菌BX在优化的条件下,Cu2+吸附率达85.84%,吸附量为128.74 mg/g,其对Cu2+的吸附符合准二级动力学方程和Freundlich等温吸附模型.
本文从电子垃圾污染地区样品中获得了多株具有较高抗重金属(铜、铅、镉)能力的菌株,其中蜡状芽孢杆菌HZB对铜、铅、镉的抗性明显;并初步研究了菌株HZB的相关特性.进一步深入研究这些菌株的重金属抗性机制、修复电子垃圾污染地区能力,具有重要的理论意义和应用价值.
[1]WU J P,LUO X J,ZHANG Y,et al.Bioaccumulation of polybrominated diphenyl ethers(PBDEs)and polychlorinated bi-phenyls(PCBs)in wild aquatic species from an electronic waste(e-waste)recycling site in South China[J].Environment International,2008,34(8):1109-1113.
[2]ZHANG K,SCHNOOR J L,ZENG E Y.E-waste recycling:where does it go from here[J].Environmental Science&Technology,2012,46(20):10861-10867.
[3]TANG X,SHEN C,CHEN L,et al.Inorganic and organic pollution in agricultural soil from an emerging e-waste recycling town in Taizhou area,China[J].Journal of Soils and Sediments,2010,10(5):895-906.
[4]HAFERBURG G,KOTHE E.Microbes and metals:interactions in the environment[J].Journal of Basic Microbiology,2007,47(6):453-467.
[5]CHEN B,LIN B K,LUN J S,et al.Distribution of microbial communities in Guiyu soils and sediments investigated by 16S rRNA gene library and denaturing gradient gel electrophoresis(DGGE)fingerprinting[J].African Journal of Microbiology Research,2013,7(15):1443-1450.
[6]HAYTOGLU B,DEMIRER GN,YETIS U.Effectiveness of anaerobic biomass in adsorbing heavy metals[J].Water Science and Technology,2001,44(10):245-252.
[7]YAMADA-ANKEI T,IWASAKI H,MORI T.Production of copper coproporphyrin III by Bacillus cereus.I.Purification and identification of copper coproporphyrin III[J].Journal of Biochemistry,1977,81(4):835-42.
[8]IZAKI K.Enzymatic reduction of mercurous and mercuric ions in Bacillus cereus[J].Canadian Journal of Microbiology,1981,27(2):192-7.
[9]KANNAN SK,MAHADEVAN S,KRISHNAMOORTHY R.Characterization of a mercury-reducing Bacillus cereus strain isolated from the Pulicat Lake sediments,south east coast of India[J].Archives of Microbiology,2006,185(3):202-211.
[10]MAITI SK,BREA D,CHATTOPADHYAY P,et al.Determination of Kinetic Parameters in the Biosorption of Cr(VI)on Immobilized Bacillus cereus M(1)(16)in a Continuous Packed Bed Column Reactor[J].Applied Biochemistry and Biotechnology,2009,159(2):488-504.
[11]曾奇玉,梁丽妮,杨永凤,等.一株重金属高耐受菌的分离及鉴定[J].生物技术进展,2015,5(5):387-391.
[12]MULLEN MD,WOLF DC,FERRIS FG,et al.Bacterial sorption of heavy metals[J].Applied and environmental microbiology,1989,55(12):3143-3149.
[13]GESSNER PK,HASAN MM.Freundlich and Langmuir isotherms as models for the adsorption of toxicants on activated charcoal[J].Journal of Pharmaceutical Sciences,1987,76(4):319-32.
[14]LU W B,SHI J J,WANG C H,et al.Biosorption of lead,copper and cadmium by an indigenous isolate Enterobacter sp.J1 possessing high heavy-metal resistance[J].Journal of Hazardous Materials,2006,134(1-3):80-86.
[15]黄志钧,李大平.重金属铜离子抗性菌株的筛选和吸附性能[J].应用与环境生物学报,2012,18(6):964-970.
[16]李兰松,杨永珍,贾虎生,等.铜抗性菌株的筛选及其对Cu2+的吸附性能[J].化工学报,2013,64(9):3381-3389.
A Study on a Heavy Metal Resistant Strain Isolated from Electronic Waste Pollution Region
HU Yu1,CHEN Biao2,KAN Jie2,ZHANG Qing-yan1,HUANG Tong-wang2
(1.Jinshan Middle School of Shantou,Shantou,Guangdong,515063;2.Biology Department of Shantou University,Shantou,Guangdong,515063)
Twelve strains with a high resistance to heavy metal(Cu2+)were isolated from the electronic-waste sample by selective mediums.Strain HZB,one of the 12 bacteria,exhibited a high resistance to Cr2+and Cd2+,too.It performed the resistance against 4.2 mmol/L of Cr2+,2.5 mmol/L of Cu2+and 0.7 mmol/L of Cd2+,respectively.The results from physiological-biochemical characteristics and 16S rDNA sequence indicated that strain HZB belonged to Bacillus cereus.Under the pressure of copper,strain HZB had an obvious capacity of copper adsorption,and showed similar adsorption curve under the condition of stress and adaptation.The biosorption of HZB toward Cu2+at adaptation of state was in accordance with the Langmuir model.
heavy metal;resistant strain;Cu2+;electronic-waste
X 172
A
1007-6883(2016)03-0078-06
责任编辑朱本华
2016-01-22
广东省科技计划项目(项目编号:2012B060400016).
胡昱(1999-),女,湖南攸县人,汕头市金山中学在读学生.a:并列第一作者,*:通讯作者twhuang@stu.edu.cn.
