斑马鱼SFPQ蛋白的原核表达及纯化
2016-10-11杨川胡敏
杨川 胡敏
(四川大学生命科学学院,成都 610041)
斑马鱼SFPQ蛋白的原核表达及纯化
杨川 胡敏
(四川大学生命科学学院,成都 610041)
Splicing Factor Proline and Glutamine Rich简称为SFPQ,是广泛表达在脊椎动物中的一类蛋白。它作为抑癌基因,对生物体内肿瘤发生具有重要的调控作用。目前对于SFPQ的研究主要集中在人和小鼠上,对于斑马鱼SFPQ的研究还比较少。为了获得原核表达的SFPQ蛋白进行下一步研究,构建了斑马鱼SFPQ-pET28a重组质粒,然后转化到BL21化学感受态细胞中,探索用IPTG进行低温诱导蛋白的最适条件,然后用Ni-NTA琼脂糖镍柱纯化SFPQ蛋白。实验结果表明,当IPTG浓度为0.75 mmol/L,诱导时间为10 h时,蛋白表达量最大,Western blot结果表明纯化得到的斑马鱼SFPQ蛋白可以和抗体特异性结合,说明纯化得到的斑马鱼SFPQ蛋白可以用于下一步实验。
斑马鱼SFPQ;原核表达;蛋白纯化
脯氨酸、谷氨酰胺的剪接因子(Splicing factor proline and glutamine rich,SFPQ),最先被人们发现与前体mRNA剪切相关的蛋白,分子量为72 kD,由707个氨基酸组成,碱基序列中GC含量丰富,为广泛分布在动物体内的核蛋白[1,2]。SFPQ对DNA的修复、细胞凋亡、转录调控和RNA的转运起到至关重要的作用[3],不仅可以单独参与DNA损伤的修复,它还可以介导DNA修复蛋白RAD51D来对DNA进行修复[4-7],对DNA的修复起到极大的作用。
SFPQ同时也是体内重要的抑癌蛋白。在人结直肠腺癌上皮细胞中,SFPQ的沉默会导致通过caspase-3途径的细胞凋亡的产生[8]。在人体内,SFPQ可以与非编码RNA MALAT-1特异性结合,调控人体内肿瘤的形成[10];人们已经发现在小鼠体内,SFPQ可以和非编码RNA Vl30特异性结合来调节下游基因的表达[11-13]。
在小鼠大脑中,SFPQ大量富集于分化的神经元中,表明它可能与神经特异性剪切有关[14]。SFPQ也在斑马鱼的大脑发育中发挥重要作用,SFPQ缺陷的斑马鱼胚胎发育28 h后即出现死亡[15]。我们比对分析了斑马鱼SFPQ和人的SFPQ,发现斑马鱼SFPQ同样存在RNA结合域。本研究从斑马鱼胚胎中提取总RNA,将RNA逆转为cDNA,以cDNA为模板扩增出斑马鱼SFPQ基因,构建SFPQ原核表达载体,并对蛋白进行诱导和纯化,旨在为后续研究SFPQ在斑马鱼中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 斑马鱼 斑马鱼取自四川大学生物治疗国家重点实验室斑马鱼中心。
1.1.2 表达载体及菌株 pET28a(+)原核表达载体由本实验室保存;DH5α大肠杆菌购自南京唯赞生物公司;大肠杆菌BL21(DE3)感受态细胞购自全式金生物。
1.1.3 酶类与抗体PCR扩增用酶PrimeSTAR HS购自TaKaRa公司;各种限制性内切酶、T4DNA连接酶和去磷酸化酶购自Thermo公司。斑马鱼SFPQ蛋白抗提购自ABCAM公司。
1.1.4 生化试剂与试剂盒 TRIzol®Reagent购自Invitrogen公司;逆转录试剂盒购自Life Technologies公司;DNA marker购自Biomed公司;质粒提取试剂盒、胶回收试剂盒购自OMEGA公司;Ni-NTA琼脂糖镍柱购自QIAGEN公司;蛋白纯化柱购自Bio-Rad公司;Western blot显色液购自milipore公司。
1.2 方法
1.2.1 斑马鱼SFPQ基因的扩增 取发育48 h的斑马鱼胚胎,用TRIzol®Reagent提取斑马鱼胚胎总RNA,以RNA为模板,用逆转录试剂盒转录出cDNA,保存备用;在GenBank上得到斑马鱼SFPQ的全序列,根据所得序列,设计出斑马鱼扩增引物,上游引物包含Xho I 酶切位点,序列为5'-3' CCGCTCGAGCGG atggggatgcgcggtggcat,下游引物包含BamH I 酶切位点,序列为5'-3' CGCGGATCCGC GTCAGAAGCGTGGCTTCTTGG;以所得cDNA 为模板扩增斑马鱼SFPQ基因。
1.2.2 原核表达载体的构建 用Xho I和BamH I双酶切pET28a(+)载体,去磷酸化酶处理质粒,胶回收备用;将通过PCR得到的SFPQ片段用Xho I和BamH I酶切过夜,胶回收备用;将片段连入pET28a(+)中,转化入DH5α大肠杆菌感受态细胞中,用带有卡纳抗性的平板培养基37℃培养10-12h,挑取单菌落,提取质粒后双酶切鉴定,将鉴定为阳性的质粒送去测序。
1.2.3 SFPQ蛋白的诱导表达 将测序正确的pET28a-SFPQ质粒转化入BL21(DE3)大肠杆菌中,分别设置不同IPTG浓度、时间、来探索蛋白表达的最佳条件。IPTG浓度:其他条件不变,用含有卡纳抗性的LB液体培养基37℃培养细菌,待OD600值达到0.6时,分别向菌液中加入终浓度为0.25、0.5,0.75和1 mmol/L的IPTG进行诱导;诱导时间:其他情况不变,分别设置4、6、8、10、12 h进行诱导。待诱导完毕后,收集菌体,弃培养基,用PBS吹悬菌体,加入终浓度为80 mg/mL的溶菌酶,冰上放置30 min,超声波裂解细菌,超声10 s,间歇10 s,重复6次,5 000×g离心菌体15 min,SDS-PAGE分析。
1.2.4 SFPQ蛋白的纯化 取500 μL的Ni-NTA琼脂糖镍柱,加入纯化柱中,用蒸馏水重悬珠子,待水从纯化柱下方流出后,用Binding buffer(NaH2PO450mmol/L,NaCl 0.5 mol/L,咪唑(pH6.0)10 mmol/L,最终调pH为8.0)重悬,重复2次,备用;从50 mL菌液中收集细菌,5 000×g 10 min,用Binding buffer重悬菌体,加入8 mg溶菌酶,冰上放置30 min,然后用超声波裂解细菌,30%功率,超声10 s,间歇10 s,3 000×g离心15 min,取5 μL上清SDSPAGE跑胶分析;将离心得到的上清加入含有琼脂糖珠子的纯化柱中,4℃在旋转仪上与珠子孵育2 h后,将上清从纯化柱下方流出,取5 μL SDS-PAGE跑胶分析;用wash buffer(NaH2PO450 mmol/L,NaCl 0.5 mol/L,咪唑(pH6.0)20 mmol/L,最终调pH为8.0)洗涤树脂,重复4次,分别取5 μL漂洗液SDS-PAGE胶分析;漂洗完毕后用elution buffer(NaH2PO450 mmol/L,NaCl 0.5 mol/L,咪唑(pH6.0)0.25 mol/L,最终调pH为8.0)洗脱蛋白,每200μL洗脱1次,重复1次,分别取5 μL漂洗液SDSPAGE胶分析,纯化好的蛋白-80℃保存备用。
1.2.5 质谱分析 将纯化所得蛋白送去公司进行质谱分析。
1.2.6 Western blot分析 将纯化得到的SFPQ蛋白用10% SDS-page电泳分离,90 V 1 h 将蛋白转至PVDF膜上,5%脱脂牛奶封闭1 h,用鼠抗斑马鱼的SFPQ一抗室温孵育1 h,用山羊抗鼠的二抗孵育1 h,显色液显色检测。
2 结果
2.1 斑马鱼SPFQ基因的扩增
以逆转录得到的cDNA为模板进行PCR扩增,设置不同的退火温度,将扩增产物用1%琼脂糖凝胶检测,如图1所示,当退火温度为55.6℃时,斑马鱼SFPQ基因扩增效率最高,扩增出的片段位于marker的2 kb处,与GenBank上给出的大小符合,表明成功的扩增出斑马鱼SFPQ基因。

图1 斑马鱼SFPQ基因的扩增
2.2 双酶切鉴定
将含有卡纳抗性的平板培养基上的单菌落挑出,用LB液体培养基培养过夜,提取质粒,用Xho I和BamH I双酶切鉴定,用1%琼脂糖凝胶进行检测,结果如图2所示,在2 kb处有一被切下的片段,表明SFPQ基因已被连入pET28a质粒中,所得的阳性质粒测序结果显示,序列中无任何突变,阅读框正常,表明重组pET28a-SFPQ质粒成功构建。
2.3 SFPQ蛋白的诱导表达
将重组pET28a-SFPQ质粒转化到BL21感受态细胞中,37℃ 200 r/min培养至OD600为0.6时,加入终浓度分别0.25、0.5、0.75和1 mmol/L的IPTG诱导过夜,裂解细菌,分别取裂解液沉淀和上清用10%SDS PAGE胶电泳检测,结果如图3-A所示,泳道2-5和泳道7-10中,在72 kD区域均出现了目的条带,表明SFPQ蛋白成功被诱导,且在IPTG浓度为0.75 mmol/L时,SFPQ诱导量达到最大。在探究诱导时间对SFPQ蛋白表达的影响中,分别设置了4、6、8、10、12 h不同的时间来诱导,实验结果(图3-B)表明,当诱导时间为10 h时,得到的SFPQ蛋白的量最大。
2.4 SFPQ蛋白的纯化
将收集好菌液后,用超声波裂解细菌,将裂解得到的上清与Ni-NTA琼脂糖镍柱孵育,带有his标签的SFPQ蛋白会与镍柱特异性结合,如图4第2泳道为与纯化柱孵育后的上清,在72 kD左右的区域未见明显条带,表明诱导得到的SFPQ蛋白已结合在镍柱上,经过4轮的漂洗,非特异性结合在镍柱上的分子被洗脱下来,泳道7和8分别为第1次洗脱和第2次洗脱,在72 kD左右区域均出现明显条带,表明SFPQ蛋白被成功洗脱下来。
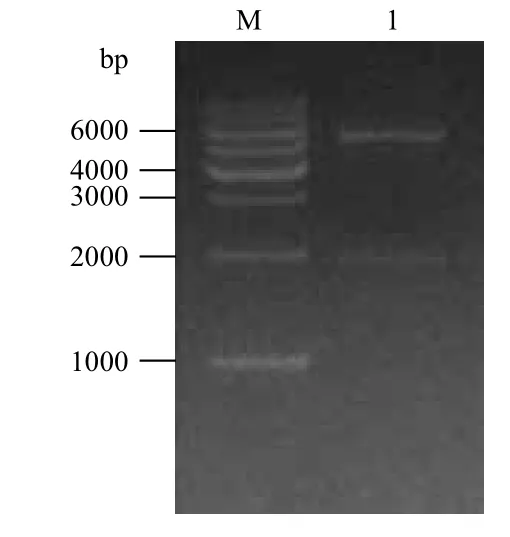
图2 阳性重组子双酶切鉴定
2.5 纯化SFPQ蛋白的质谱分析
为确定纯化所得的蛋白为斑马鱼SFPQ蛋白,进行了质谱分析,质谱分析结果如图5所示,质谱得到的肽段为PKIQSAPPKIQSP,经NCBI查询,所得肽段位于斑马鱼SFPQ中。
2.6 Western blot检测重组SFPQ蛋白
为了进一步确定我们所纯化的蛋白就是所需要的斑马鱼SFPQ蛋白,用了小鼠抗斑马鱼SFPQ蛋白的抗体作为一抗,以辣根过氧化物标记的山羊抗鼠的lgG作为二抗,进行Western blot检测(图6),在72 kD区域左右,PVDF膜上有明显的反应条带,表明斑马鱼SFPQ蛋白抗体能够与我们纯化得到的蛋白特异性结合,说明纯化得到的蛋白即为斑马鱼SFPQ蛋白。
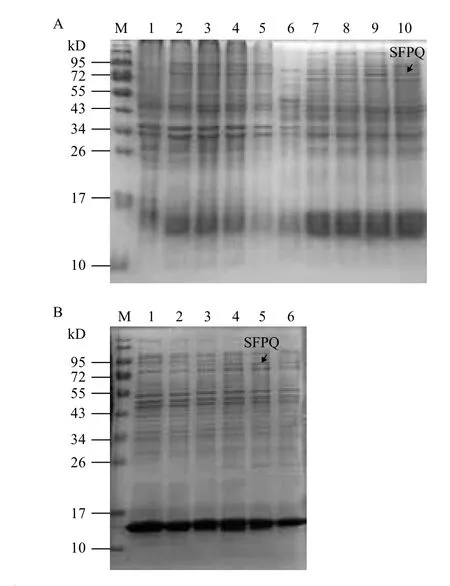
图3 斑马鱼SFPQ蛋白的诱导表达
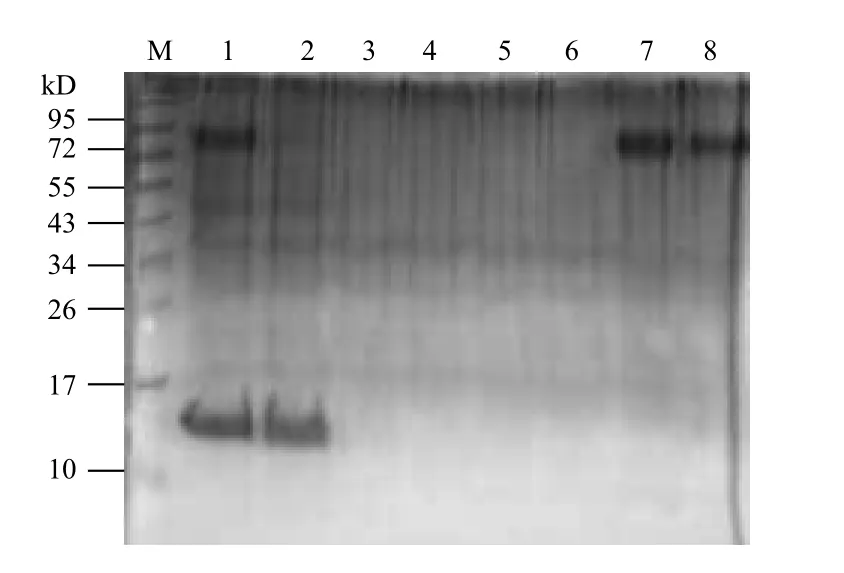
图4 斑马鱼SFPQ蛋白的纯化
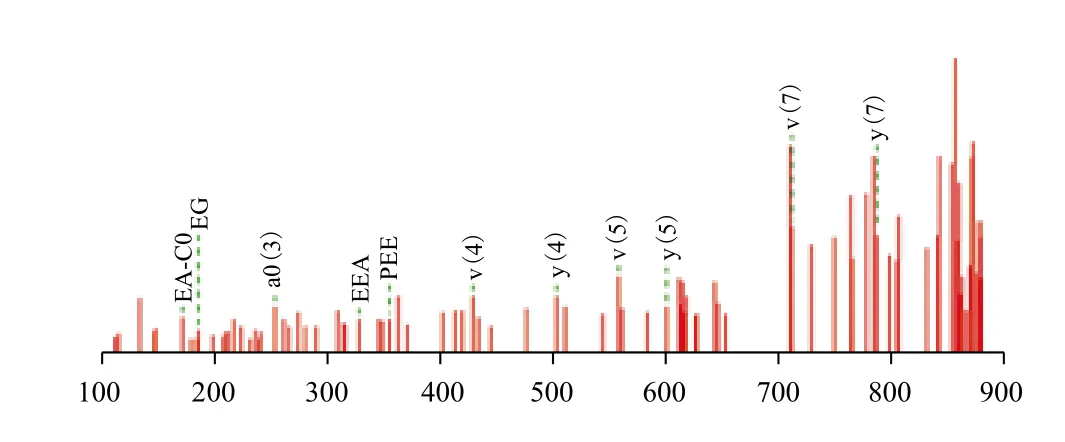
图5 纯化SFPQ蛋白质谱结果
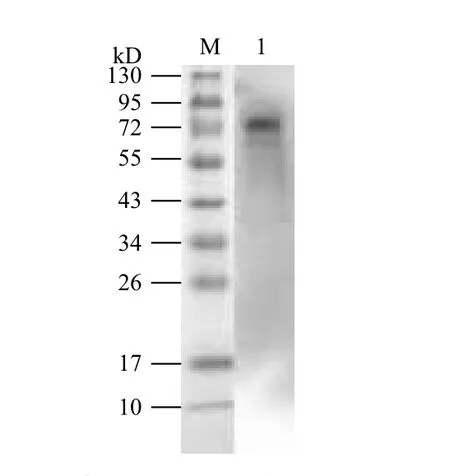
图6 斑马鱼SFPQ Western Blot检测
3 讨论
SFPQ广泛存在于脊椎动物中,它的高级结构中存在DNA结合域和RNA结合域,这对于参与核酸的相互作用具有重要的意义[2,16,17]。我们分析了人、小鼠、大鼠和斑马鱼中SFPQ的序列,发现其RNA结合域1高度保守。据报道,SFPQ在小鼠中与非编码RNA VL30结合,调控下游反应;在人中与非编码RNA NEAT1相结合,调控IL8的表达,发挥重要作用。因此可以选择斑马鱼作为模式动物,研究SFPQ与非编码长链RNA的相互作用。
SFPQ最开始被发现为前体mRNA的剪切因子[9],有研究发现,在患有老年痴呆症和皮克氏病的患者大脑中SFPQ是异常表达[18-20];在小鼠中,SFPQ参与调控P450scc基因的表达,对于胆固醇的形成具有重要的调节作用[21]。在斑马鱼中,SFPQ蛋白的缺失导致斑马鱼胚胎在发育28 h内即死亡,表明SFPQ对斑马鱼胚胎细胞的生长具有重要的作用,尤其对斑马鱼大脑发育起至关重要的作用[16]。
本实验从斑马鱼胚胎着手,用Trizol法提取了斑马鱼总RNA,并逆转录为cDNA,以cDNA为模板扩增出了斑马鱼SFPQ基因,经限制性内切酶酶切后,连入pET28a载体中,为了确保我们构建的载体中没有突变,将质粒测序,测序结果显示构建的载体没有发生碱基的替换、移码等突变。为了得到原核蛋白,将重组质粒转化入大肠杆菌BL21感受态细胞中,用不同浓度的IPTG对蛋白进行诱导,结果显示在终浓度为0.75 mmol/L时,SFPQ蛋白表达量最大,为了测定不同的诱导时间对蛋白表达的影响,我们分别取4、6、8、10、12 h为时间点对蛋白表达进行检测,结果表明在诱导时间为10 h时,SFPQ蛋白表达量达到最大。为了确认我们纯化得到的蛋白即为SFPQ蛋白,进行了质谱分析,同时以小鼠抗斑马鱼SFPQ蛋白的抗体作为一抗做Western blot检测,结果显示在72 kD区域出现了明显的条带,说明纯化得到的蛋白为斑马鱼SFPQ蛋白,并且具有抗原活性,可以用来研究非编码RNA调控SFPQ蛋白在斑马鱼大脑发育中的机制。
4 结论
本实验成功构建了斑马鱼SFPQ原核表达载体,纯化得到了重组斑马鱼SFPQ蛋白,质谱结果和Western blot结果显示,纯化所得蛋白为斑马鱼SFPQ蛋白,可以用于研究非编码RNA调控SFPQ蛋白在斑马鱼大脑发育中的机制。
[1] Patton JG, Porro EB, Galceran J, et al. Cloning and characterization of PSF, a novel pre-mRNA splicing factor[J]. Genes Dev, 1993, 7:393-406.
[2] Lee M, Sadowska A, et al. The structure of human SFPQ reveals a coiled-coil mediated polymer essential for functional aggregation in gene regulation[J]. Nucleic Acids Research, 2015, 43(7):3826-3840.
[3] Shav-Tal Y, Zipori, D. PSF and p54(nrb)/NonO-multi-functional nuclear proteins[J]. FEBS Letter, 2002, 531:109-114.
[4] Ha K, Takeda Y, Dynan WS. Sequences in PSF/SFPQ mediate radioresistance and recruitment of PSF/SFPQ-containing complexes to DNA damage sites in human cells[J]. DNA Repair(Amst),2011, 10(3):252-259.
[5] Morozumi Y, Takizawa Y, Takaku M, et al. Human PSF binds to RAD51 and modulates its homologous-pairing and strand-exchange activities[J]. Nucleic Acids Res, 2009, 37:4296-4307.
[6] Rajesh C, Baker DK, Pierce AJ, et al. The splicing-factor related protein SFPQ/PSF interacts with RAD51D and is necessary for homology-directed repair and sister chromatid cohesion[J]. Nucleic Acids Res, 2011, 39:132-145.
[7] Salton M, Lerenthal Y, Wang SY, et al. Involvement of Matrin 3 and SFPQ/NONO in the DNA damage response[J]. Cell Cycle, 2010, 9:1568-1576.
[8] Tsukahara T, Matsuda Y, Haniu H. PSF knockdown enhances apoptosis via downregulation of LC3B in human colon cancer cells[J]. Biomed Res Int, 2013, 2013:204973.
[9] Passon DM, Lee M, Rackham O, et al. Structure of the heterodimer of human NONO and paraspeckle protein component 1 and analysis of its role in subnuclear body formation[J]. PNAS, 2012, 109(13):4846-4850.
[10] Imamura K, Imamachi N, Akizuki G, et al. Long noncoding RNA NEAT1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli[J]. Mol Cell, 2014, 53:393-406.
[11] Zhang JQ L, LiuX, et al. Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J]. Br J Cancer, 2014, 111: 736-748.
[12] Song X, Sun Y, Garen A. Roles of PSF protein and VL30 RNA in reversible gene regulation[J]. Proc Natl Acad Sci USA, 102,12189-12193.
[13] Song X, Sui AW, Garen A. Binding of mouse VL30 retrotransposon RNA to PSF protein induces genes repressed by PSF:Effects on steroidogenesis and oncogenesis[J]. PNAS, 2004(101):621-626
[14] Chanas-Sacre G, Mazy-Servais C, Wattiez R. Identification of PSF,the polypyrimidine tract-binding protein-associated splicing factor,as a developmentally regulated neuronal protein[J]. J NeurosciRes, 1999, 57:62-73.
[15] Lowery LA, Sive RJ, H. Whitesnake/sfpq is required for cell survival and neuronal development in the zebrafish[J]. Dev Dyn,2007, 236:1347-1357.
[16] Kowalska E, Ripperger JA, Muheim C, et al. Distinct roles of DBHS family members in the circadian transcriptional feedback loop[J]. Mol Cell Biol, 2012, 32:4585-4594.
[17] Duong HA, Robles MS, Knutti D. A molecular mechanism for circadian clock negative feedback[J]. Science, 2011, 332:1436-1439.
[18] Guttula VS, Allam A, Gumpeny RS. Analyzing microarray data of Alzheimer’s using cluster analysis to identify the biomarker genes[J]. International Journal of Alzheimer’s Disease, 2012:649456.
[19] Ke Y, Dramiga J, Schu U. Tau-mediated nuclear depletion and cytoplasmic accumulation of SFPQ in Alzheimer’s and Pick’s disease[J]. PLoS ONE, 7(4):e35678.
[20] Götz J, Matamales M, Götz NN, et al. Alzheimer’s disease models and functional genomics— How many needles are there in the haystack?[J]Frontiers in Physiology, 2012, 3:320.
[21] Urban RJ, Bodenburg Y, Kurosky A, et al. Polypyrimidine tractbinding protein-associated splicing factor is a negative regulator of transcriptional activity of the porcine p450scc insulin-like growth factor response element[J]. Mol Endocrinol, 2000, 14(6):774-82.
(责任编辑李楠)
Prokaryotic Expression and Purification of Zebrafish SFPQ
YANG Chuan HU Min
(College of Life Science,Sichuan University,Chengdu 610041)
Splicing Factor Proline and Glutamine Rich(SFPQ)is a protein that expresses widely in vertebrates. As a tumor suppressor gene, it plays the vital regulation role in tumorigenesis of living organisms. So far the researches of SFPQ were focused on human being and mice,little has been known about the SFPQ of zebrafish. In order to acquire the prokaryotic-expressed SFPQ protein for further research, recombinant pET28a-SFPQ plasmid of zebrafish was constructed and transformed into the chemical competent cells of BL21. The optimal condition was explored while IPTG was applied to induce the expression of zebrafish SFPQ protein in low-temperature, and the SFPQ protein was purified by Ni-NTA agarose nickel column. The results demonstrated that the expression of the protein was the most while inducing for 10 h by 0.75 mmol/L IPTG at 27℃. The results of Western blot revealed that the purified SFPQ protein specifically bound with the antibody, indicating that the purified zebrafish SFPQ protein may be utilized in the further experiments.
zebrafish SFPQ;prokaryotic expression;protein purification
10.13560/j.cnki.biotech.bull.1985.2016.01.027
2015-07-28
杨川,男,硕士研究生,研究方向:细胞生物学;E-mail:108504802@qq.com
胡敏,男,博士,研究方向:细胞生物学;E-mail:gym_w@163.com
