食物功能性成分对动物基因组DNA甲基化影响的研究进展
2016-10-11赵静李楠吴茹杨占威胡文兵王文君
赵静 李楠 吴茹 杨占威 胡文兵 王文君
(江西农业大学 南昌市农产品加工与质量控制重点实验室,南昌 330045)
食物功能性成分对动物基因组DNA甲基化影响的研究进展
赵静 李楠 吴茹 杨占威 胡文兵 王文君
(江西农业大学 南昌市农产品加工与质量控制重点实验室,南昌 330045)
DNA甲基化是表观遗传学的一部分。功能性成分如多酚、黄酮、维生素、n-3不饱和脂肪酸等对DNA甲基化有重要影响。功能性成分主要通过影响甲基转移酶活性和活性甲基基团数量实现对DNA甲基化的影响,结合研究成果阐述多种功能成分:多酚、黄酮、维生素(叶酸、VB12、VB6)、n-3多不饱和脂肪酸等对DNA甲基化的影响和作用机制进行综述,以期为从分子角度探究功能性成分的作用机理提供新思路。
DNA甲基化;食物功能性成分;多酚;黄酮;维生素;n-3不饱和脂肪酸
DNA甲基化作为一种重要的表观遗传机制,主要通过甲基转移酶的作用将甲基引入DNA中,导致基因表达水平改变从而引起表型变化。大量研究表明,DNA甲基化与人类的多种疾病及动植物的生长、发育、衰老等密切相关。功能性成分因其可调节人体机能而日益受到人们的重视,其调节机制也成为科研工作者的研究重点。研究显示生物体DNA甲基化水平因自身和环境因素改变而变化,而多种具有生物活性的功能成分也对其有重要影响。
1 DNA甲基化
DNA甲基化是最早发现的一种与基因抑制相关的表观遗传机制,它不改变DNA的碱基组成而影响基因的表达,并广泛存在于动、植物基因组中。哺乳动物DNA甲基化过程是由S-腺苷甲硫氨酸(SAM)活化甲基,在甲基转移酶(DNMT)催化下将甲基基团转移到胞嘧啶的第五个碳原子上[1],DNMT作为DNA甲基化的核心调控物质在此过程中起“指挥”作用:DNMT主要分为DNMT1、DNMT3a、DNMT3b 3种,DNMT1在DNA复制过程中维持了DNA子链与母链相同的甲基化状态[2],DNMT3a和DNMT3b则是从头参与合成甲基化[3],DNA甲基化参与包括基因印记,维持染色体完整性,调节基因表达等多种生理过程[4],DNA甲基化因其对多种疾病都有重要影响而成为近年来医学和营养学研究的重点。
2 有机功能性成分对DNA甲基化的影响
2.1 多酚和黄酮类化合物对DNA甲基化的影响
多酚和黄酮类物质是一类从天然产物中提取的具有生物活性的有机类化合物。黄酮类物质的中心结构由两个具有酚羟基结构的苯环通过一个三碳环连接组成的C6-C3-C6结构,由于 C环的结构不同,黄酮类化合物又可分为异黄酮类、二氢黄酮、黄酮类、花色素等;多酚类化合物是指分子结构中有若干个酚性羟基的植物成分的总称,普遍存在于植物种子、水果蔬菜及中草药中,其具有抗病毒、消炎、利胆、强心以及抗氧化、抗衰老、免疫调节和抗肿瘤等多种药理作用[5,6]。
Paluszczak等[7]发现,植物多酚(酚酸,白藜芦醇)和黄酮类化合物(高良姜素、杨梅素、根皮素)可诱导喉癌细胞系的RARβ、RASSF1A、HIA-1等基因高甲基化并阻止其去甲基化。白倩等[8]通过MSP和RT-PCR法检测发现二氢杨梅素可抑制甲基转移酶从而诱导人的乳腺癌MCF-7细胞第10号染色体缺失的磷酸酶及张力蛋白同源基因(Phosphatase and tensin homologue deleted on chromosome 10,PTEN)的去甲基化,同时Zheng等[9]证实姜黄素也能上调PTEN的MiR-29b和下调DNMT3b介导其DNA甲基化,Chang等[10]的研究发现黄连素能降低高脂日粮大鼠MTTP基因启动子的甲基化程度。另有研究报道,不同剂量的大豆异黄酮皆可显著下调大鼠Aldh1l1基因启动子区甲基化水平,而高剂量的大豆异黄酮则上调Extl1和WAP基因启动子甲基化水平[11],新疆雪莲总黄酮可使因高甲基化无法表达的基因正常表达并抑制DNA甲基化酶活性[12]。此外,较早研究还发现以黄酮类物质为主要成分的蜂胶乙醇提取物(EEP)能提高小鼠心肌DNA甲基化水平,染料木黄酮(Genistein)可引起异常沉默的肿瘤抑制基因再次表达,茶多酚具有提高老年小鼠肝脏甲基化酶活性的作用。
多酚和黄酮类化合物在影响甲基化过程中通常是和饮食中的多种活性成分相互协同起作用,而单一成分对甲基化影响并不明显,其对DNA甲基化的可能作用机制有以下几点:(1)通过与甲基转移酶(DNMT1)催化位点作用抑制其活性从而影响DNA甲基化状态;(2)通过改变能量代谢间接改变相关基因的甲基化水平[13];(3)将S-腺苷甲硫氨酸(SAM)转变为S-腺苷高半胱氨酸(SAH)从而达到抑制DNMT的作用[14]。
2.2 维生素对DNA甲基化的影响
维生素是人和动物生长发育过程中所必需的营养素,生物体不能自身合成,必须从食物中获得。维生素分为脂溶性(维生素A、D、E和K)和水溶性(B族维生素,维生素C)两类,若长期缺乏某种维生素将引起严重的生理功能障碍。维生素作为人和动物维持正常生理功能的一种有机成分,对DNA甲基化有非常重要的影响。其中叶酸、维生素B12、维生素B6、维生素B2是最主要的影响物质,它们通过一碳单位代谢参与调节DNA甲基化(图1)。叶酸是一种水溶性B族维生素,由小肠吸收转化为四氢叶酸(THF)再经一系列辅助因子参与调节后不可逆的变为5-甲基四氢叶酸,此过程中的甲基最终传递给SAM为DNA甲基化提供了甲基供体;其次维生素B12作为一种重要辅助因子参与了同型半胱氨酸(Hcy)转化为甲硫氨酸和5-甲基四氢叶酸转化为四氢叶酸的过程;而维生素B6则参与Hcy转化为半胱氨酸,THF转化为亚甲基四氢叶酸的过程[15];维生素B2作为多种辅酶的前体物质影响叶酸和维生素B12的代谢。作为甲基的重要来源物质,它们中的任何一种缺乏或过剩都会影响DNA甲基化水平。此外,维生素C也可阻止甲醛介导的支气管上皮细胞系DNA氧化和甲基化,并支持了DNA氧化可诱导其甲基化假说[16],同时胆碱也是一种可改变DNA甲基化水平引起人的神经系统发育的物质。
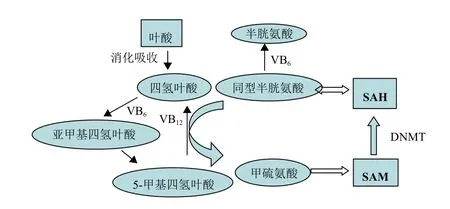
图1 维生素的一碳单位代谢与DNA甲基化
大量实验证明了以上物质在DNA甲基化中的重要作用,Duthie等[17]通过小鼠试验发现叶酸缺乏可致小鼠肝脏和结肠中的SAM/SAH下降进而引起DNA低甲基化,Kotsopoulos等[18]的研究指出断奶后饲料中叶酸缺乏将导致大鼠肝脏中甲基化水平上升而这种状态将维持到成年直至饲料中的叶酸增加;长时间缺乏维生素B12可能诱导食管鳞状细胞癌和贲门腺癌和DNA低甲基化[19],还有报道表明围孕期饮食中的B族维生素含量可能改变其后代的胰岛素样生长因子(IGF-2)基因 DNA 甲基化模式[20]。因此,适当的补充这几种维生素将维持体内DNA甲基化的稳定,减少患癌几率,促进婴幼儿神经发育。2.3 n-3多不饱和脂肪酸对甲基化的影响
n-3多不饱和脂肪酸(n-3 PUFAs)又名ω-3多不饱和脂肪酸,是一类含有两个以上双键的不饱和脂肪酸。常见的多不饱和脂肪酸有:α-亚麻酸、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)和二十二碳五烯酸(DPA),主要存在于坚果和深海鱼类中,能够促进婴幼儿脑部和神经系统的发育,降低心血管疾病发病率,抑制血栓形成,降血压,保护视力[21]。国内外近期研究表明,n-3多不饱和脂肪酸也参与调控DNA甲基化,对阿拉斯加Yup’ik地区的185位n-3 PUFAs摄入最多和最少的当地土著人的470 000个DNA甲基化位点做出评估显示,与生物学有关的27个不同甲基化CpG位点有表观遗传学上的极显著差异(P<1×10-7)[22];申文雯等[23]对3组分别喂养n-6 PUFAs、n-3 PUFAs和正常脂饲料的小鼠脂肪组织基因组DNA总甲基化和甲基转移酶活性进行了测定,结果表明n-3 PUFAs组的总甲基化程度明显低于n-6 PUFAs组,但n-3 PUFAs组甲基转移酶的表达无变化,可见n-3 PUFAs并不作用于甲基转移酶改变DNA甲基化状态。目前关于n-3多不饱和脂肪酸影响DNA甲基化的作用机制还未明确,仍需做进一步研究。
2.4 其他物质对DNA甲基化的影响
除以上几类功能成分影响DNA甲基化外,仍有许多物质可改变DNA甲基化水平,报道指出很多精神活性作用的生物碱的滥用也可干扰DNA甲基化状态。例如,可卡因的过量摄入可以使母体内的小鼠PKCε基因启动子邻近区域激活蛋白-1(AP-1)结合位点甲基化程度上升从而抑制了PKCε的转录和表达。酒精也能间接引起DNA甲基化异常,其作用机制主要是通过影响营养物质和维生素的代谢导致甲基供体和SAM合成被抑制。甲基苯丙胺也能通过改变DNA甲基化水平抑制其转录[24]。吗啡可通过抑制兴奋性氨基酸3型转运体介导的半胱氨酸摄入量减少因氧化还原引起的人的神经元SH-SY5Y细胞全基因甲基化[25],这些精神活性物质大多通过增加或降低甲基化程度进而抑制DNA转录过程。
黄芪多糖可使人胚肺二倍体成纤维细胞(HDF)的P16基因外显子Ⅰ限制性内切酶SmaⅠ位点的甲基化水平随着年龄增加而减少,通过改变SA-β-gal活性延缓细胞衰老[26];树舌多糖(GF)有防止小鼠HepA瘤基因组低甲基化的作用[27]。植物性的异硫氰酸酯多存在于十字花科蔬菜中,如花椰菜,辣根等。目前的研究已经证实异硫氰酸酯类化合物具有抗癌,抗肿瘤等功效[28-30],马旭东等[31]的研究表明异硫氰酸苯己酯能将P15基因高甲基化的Molt-4细胞去甲基化,使该基因重新表达,Crescenti等[32]研究发现富含多种脂肪酸和维生素E的可可提取物能够降低人的外周血白细胞DNA甲基化程度,并抑制甲级转移酶的表达。
3 无机功能成分对DNA甲基化的影响
无机功能成分在影响DNA甲基化方面的作用也不容忽视。目前的研究现状显示对DNA甲基化有影响的无机功能成分主要有硒、锌等微量元素。蒋智慧[33]发现低硒日粮组鸡的肌肉、肝脏、脑、免疫组织中的DNA总甲基化水平低于对照组,甲基转移酶DNMT1,DNMT3a,DNMT3b的mRNA表达水平也有降低趋势,硒的缺乏也可导致结肠癌细胞DNA的低甲基化[34];郭欣欣等[35]用不同剂量的锌物质对不同时期的果蝇进行干预发现:锌对提高果蝇DNA甲基化多态性有一定帮助。此外,锌还能导致鼠肝脏基因组DNA的低甲基化[36]。
硒和锌主要通过一碳循环中酶的辅助因子或作为必要物质发挥作用进而影响DNA甲基化,硒还可改变DNMT1的活性使甲基基团失效影响已甲基化的DNA分子的复制过程[37],锌参与合成甲硫氨酸[38],而甲硫氨酸是SAM的重要原料,因此锌的缺乏也将引起DNA正常甲基化受阻。
4 小结
食物功能性成分不仅为机体提供能量和多种营养物质,同时通过改变和修饰染色质的结构调节基因的表达,使得机体表型发生变化。研究结果表明从食物中获得的各种功能活性成分通过相互影响或协同作用对动物基因组DNA 甲基化产生影响,它们作用于甲基转移酶、一碳单位代谢和某些尚未明确的分子机制。功能性成分因其对调节人体各种机能的重要作用而越来越被大家重视,我国对功能性食品的研究投入逐年增加但批准程序却更加严格,作为一类药食同源的物质研究其在体内的表观遗传作用机制显得越加重要,DNA甲基化的研究热点目前仍集中在医学上,对于食品方面的研究还有大量空白区域,从表观遗传学的角度探讨功能性成分的分子营养学机制可为进一步研究开发在预防和改善高血脂、高血糖等现代文明病,保障机体健康方面的功能性食品方面提供理论依据,通过食物功能性成分调控表观遗传,将成为一个重要的研究领域。
[1] Bird AP. CpG islands as gene markers in the vertebrate nucleus[J]. Trends Genetics, 1987, 3:342-347.
[2] Law JA, Jacobsen SE. Establishing, maintaining and modifying DNA methylation patterns in plants and animals[J]. Nature Reviews Genetics, 2010, 11(3):204-220.
[3] Okano M, Bell DW, Haber DA, et al. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development[J]. Cell, 1999, 99(3):247-257.
[4] Li E, Beard C, Jaenisch R. Role for DNA methylation in genomic imprinting[J]. Nature, 1993, 366:362-365.
[5] Schindler R, Mentlein R. Flavonoids and vitamin E reduce the release of the angiogenic peptide vascular endothelial growth factor from human tumor cells[J]. J Nutr, 2006, 136(6):1477-1482.
[6]Cárdenas M, Marder M, Blank C, et al. Antitumor activity of some natural flavonoids and synthetic derivatives on various human and murine cancer cell lines[J]. Bioorganic & Medicinal Chemistry,2006, 14(9):2966-2971.
[7]Paluszczak J, Krajka-Kuzniak V, Małecka Z, et al. Frequent gene hypermethylation in laryngeal cancer cell lines and the resistance to demethylation induction by plant polyphenols[J]. Toxicology in Vitro, 2011, 25(1):213-221.
[8]白倩, 谢琦, 彭晓莉, 等. 二氢杨梅素通过抑制甲基转移酶诱导人乳腺癌MCF-7细胞PTEN基因的去甲基化[J]. 第三军医大学学报, 2014, 36(1):20-24.
[9]Zheng JJ, Wu CZ, Lin Z, et al. Curcumin upregulates phosphatase and tensin homologue deleted on chromosome 10 through micro RNA mediated control of DNA methylation - a novel mechanism suppressing liver fibrosis[J]. FEBS Journal, 2014, 281(1):88-103.
[10]Chang XX, Yan HM, Fei J, et al. Berberine reduces methylation of the MTTP promoter[J]. Journal of Lipid Research, 2010, 51(9):2504-2510.
[11]Blei T, Soukup ST, Schmalbach K, et al. Dose-dependent effects of isoflavone exposure during early lifetime on the rat mammary gland:Studies on estrogen sensitivity, isoflavone metabolism, and DNA methylation[J]. Molecular Nutrition & Food Research,2015, 59(2):270-283.
[12]吕方, 李雪峰, 张晓梅, 等. 新疆雪莲总黄酮对DNA甲基化酶抑癌作用的影响[J]. 时珍国医医药, 2014, 25(9):2098-2100.
[13] Li YY, Tollefsbol TO. Impact on DNA methylation in cancer prevention and therapy by bioactive dietary components[J]. Current Medicinal Chemistry, 2010, 17:2141-2151.
[14] Fang MZ, Chen DP, Yang CS. Dietary polyphenols may affect DNA methylation[J]. The Journal of Nutrition, 2007, 137:S223-S228.
[15]杨凤. 动物营养学[M]. 第2版. 北京:中国农业出版社,1993.
[16] Ke Y, Hu J, Cheng J, et al. Effect of ascorbic acid on formaldehydemediated DNA oxidation and methylation in human bronchial epithelial cell lines[J]. Free Radical Biology and Medicine,2012, 53(1):S118.
[17] Duthie SJ, Grant G, Pirie LP, et al. Folate deficiency alters hepatic and colon MGMT and OGG-DNA repair protein expression in rats but has no effect on genome-wide DNA methylation[J]. Cancer Prevention Research, 2010, 3(1):92-100.
[18] Kotsopoulos J, Sohn KJ, Kim YI. Postweaning dietary folate deficiency provided through childhood to puberty permanently increases genomic DNA methylation in adult rat liver[J]. The Journal of Nutrition, 2008, 138(4):703-709.
[19] Weatherspoon LJ, Worthen HD, HandUD. Nutrition risk and associated factors in congregate meal participants in northern Florida:role of Elder Care Services(ECS)[J]. Journal of Nutrition for the Elderly, 2004, 24(2):37-45.
[20] Sinclair K D, Allegrucci C, Singh R, et al. DNA methylation, insulin resistance, and blood pressure in offspring determined by maternal periconceptional B vitamin and methionine status[J]. Proc Natil Acad Sci USA, 2007, 104(49):19351-19356.
[21] 蒋汉明, 张凤珍, 翟静, 等. ω-3多不饱和脂肪酸与人类健康[J]. 预防医学论坛, 2005, 11(1):65-69.
[22] Aslibekyan S, Wiener HW, Havel PJ, et al. DNA methylation patterns are associated with n-3 fatty acid intake in Yup’ik people[J]. The Journal of Nutrition, 2014, 144(4):425- 430.
[23] 申文雯, 樊超男, 夏露露, 等. 肥胖小鼠DNA甲基化改变以及n-3多不饱和脂肪酸的影响作用[J]. 中国儿童保健杂志,2012, 20(4):333-335.
[24] 文睿婷, 梁建辉. 精神活性物质与DNA甲基化[J]. 中国药理学通报, 2008, 24(8):996-999.
[25] Trivedi M, Shah J, Hodgson N, et al. Morphine induces redox based changes in global DNA methylation and retrotransposon transcription by inhibition of excitatory amino acid transporter type 3-mediated cysteine uptake[J]. Molecular Pharmacology, 2014,85(4):747-757.
[26]赵丹威. 黄芪多糖对衰老HOF端粒长度及P16基因外显子Ι甲基化水平的影响[D]. 佳木斯:佳木斯大学, 2005.
[27]宋高臣, 孙玺媛, 于英君. 树舌多糖GF对小鼠HePA瘤基因组DNA甲基化影响的实验研究[J]. 中国优生与遗传, 2005,13(1):51-52.
[28]Murillo G, Mehta RG. Cruciferous vegetables and cancer prevention[J]. Nutrition and Cancer, 2001, 41(1-2):17-28.
[29]Tseng E, Scott-Ramsay EA, Morris ME, et al. Dietary organic isothiocyanates are cytotoxic inhuman breast cancer MCF-7 and mammary epithelial MCF-12A cell lines[J]. Experimental Biology and Medicine, 2004, 229(8):835-842.
[30]Rong HU, Kim BR, Chen C, et aL. The roles of JNK and apoptotic signaling pathways in PEITC-mediated responses in human HT-29 colon adenocarcinoma cells[J]. Carcinogenesis, 2003, 24(8):1361-1367.
[31] 马旭东, 黄轶群, 蒋少红, 等. PHΙ调控Molt-4细胞组蛋白甲基化诱p15基因去甲基化后再表达[J]. 中国实验血液学杂志, 2010, 18(3):583-587.
[32]Crescenti A, Sola` R, Valls RM, et al. Cocoa consumption alters the gobal DNA methylation of peripheral leukocytes in humans with cardiovascular disease risk factors:A randomized controlled trial[J]. PLoS One, 2013, 8(6):e65744.
[33] 蒋智慧. 硒缺乏对鸡组织DNA甲基化水平的影响[D]. 哈尔滨:东北农业大学, 2012.
[34] Davis CD, Uthus EO. Dietary folate and selenium affect dimethyhydrazine-induced aberrant crypt formation, global DNA methylation and one-carbon metabolism in rats[J]. The Journal of Nutrition, 2003, 133(9):2907-2914.
[35]郭欣欣, 毛雪, 张敏. 锌对不同发育时期子代果蝇基因组DNA甲基化的影响[J]. 生物多样性, 2012, 20(6):710-715.
[36]Sharif R, Thomas P, Zalewski P, et al. The role of zinc in genomic stability[J]. Mutation Research, 2012, 733(1 /2):111-121.
[37] Fiala ES, Staretz ME, Pandya GA, et al. Inhibition of DNA cytosine methyltransferase by chemopreventive selenium compounds, determined by an improved assay for DNA cytosine methyltransferase and DNA cytosine methylation[J]. Carcinogenesis, 1998, 19(4):597-604.
[38] Tian X, Diaz FJ. Acute dietary zinc;deficiency before conception compromises oocyte epigenetic programming and disrupts embryonic development[J]. Journal of Developmental Biology,2013, 376(1):51-61.
(责任编辑狄艳红)
Research Advance on the Effect of Food Functional Components on Animal Genomic DNA Methylation
ZHAO Jing LI Nan WU Ru YANG Zhan-wei HU Wen-bing WANG Wen-jun
(Key Lab for Agricultural Products Processing and Quality Control,Jiangxi Agricultural University,Nanchang 330045)
DNA methylation is one of the major epigenetic modifications in eukaryotic genomes, which can be influenced by certain food functional components, such as polyphenols, flavonoids, vitamin, n-3 polyunsaturated fatty acid etc. The effects of food functional components on DNA methylation are two-fold, either modulating the methyltransferase’s activity, and/or changing the number of methyl groups. Based upon the recent progress on the ongoing research, this paper expounds the effects and the possible mechanisms of a variety of functional components, i. e. , polyphenols, flavonoids, vitamin(folic acid, VB12, VB 6), n-3 polyunsaturated fatty acid etc. , on the DNA methylation, which is expected to provide new ideas on exploring the molecular mechanisms of food functional components on DNA methylation modifications.
DNA methylation;food functional components;research advance;polyphenols; flavonoids; vitamin, n-3 polyunsaturated fatty acid
10.13560/j.cnki.biotech.bull.1985.2016.01.004
2015-04-06
国家自然科学基金资助项目(31160319),江西省自然科学基金项目(20151BAB204037),江西省高等学校科技落地计划资助项目(KJLD13027),江西省教育厅科技计划资助项目(GJJ13281),江西省研究生创新项目(YC2014-S188)
赵静,女,硕士研究生,研究方向:分子营养学;E-mail:401272236@qq.com
王文君,男,博士,教授,研究方向:食品化学与分子营养学;E-mail:wwjun9999@sina.com
