白三叶化感作用的物候规律与关键部位
2016-10-10高素萍杨丽娟
雷 霆,高素萍,谢 苑,杨丽娟
(四川农业大学 园林研究所, 四川 成都 611130)
·生命科学·
白三叶化感作用的物候规律与关键部位
雷霆,高素萍,谢苑,杨丽娟
(四川农业大学 园林研究所, 四川 成都611130)
研究白三叶化感作用的物候特征和主要部位。在白三叶返青、开花、种子成熟与枯黄4个物候期,用其叶、根-匍匐茎与根际土壤制备成水浸提液,而后处理受体(高羊矛)种子。种子成熟期提取液使受体种子萌发能力与幼苗形态最小。返青与枯黄期提取液使受体幼苗生物量显著降低。叶片提取液显著削弱了受体种子的萌发和生长。根-匍匐茎与根际土提取液抑制作用较弱。当RI<0时,RI叶片小于RI根-匍匐茎和RI根际土。白三叶化感作用效应依赖于物候期,生殖生长期白三叶化感作用对受体种子萌发与幼苗形态抑制作用最强,营养生长期对受体幼苗生物量抑制效应最大;叶片可能是最主要的化感物质储存部位。
白三叶;化感作用;物候
白三叶(TrifoliumrepensL.)属豆科多年生宿根草本植物,是重要牧草和观赏草,但由于其很强的侵占性,已经被我国定为入侵植物[1]。白三叶侵入禾本科草坪主要依赖于获得更多的光、水和营养[2],而化感作用可能是另一个重要原因[3-4]。白三叶水提取液中含有酚类化合物[5-6],可抑制其他植物繁殖和生长,认为其具有化感作用[5-8]。目前对白三叶化感作用的研究主要集中在化感物质的类型[9]和对不同受体植物的影响[6,8]。然而化感作用通常只发生在植物生活史中一段时期[10]。白三叶的化感作用是否也存在阶段性,其化感物质的分布如何?尚无报道,本研究试图揭示化感作用在白三叶的生活史中如何变化以及化感物质的空间分布特点,可进一步解释白三叶入侵的时空变化问题,为牧草生产有效管理和园林景观应用提供科学依据。
1 材料与方法
1.1材料
以白三叶(T.repensL.)为供体,高羊茅(Festucaarundinacea)为受体。在四川农业大学雅安校区老板山,于自然生长的白三叶返青、开花、种子成熟和枯黄4个物候期,采用随机取样的方法,收集叶片、根-匍匐茎和根际土壤。
1.2白三叶浸提液的制取
1)分别取白三叶的叶和根-匍匐茎(切成2cm长),按鲜重100g加500mL超纯水于20℃浸泡40h。依次使用滤纸和0.45 μm 滤膜过滤获得0.2g/mL的母液。稀释为0.1g/mL,放入4℃冰箱保存备用。
2)抖根法收集根际土壤,过筛网去除根际土中残留的须根等。取风干的根际土,研磨后过筛,以100g加500mL超纯水的比例装入试剂瓶,振荡90min,于20℃放置40h,再用双层滤纸过滤,获得0.2g/mL的母液。稀释为0.1g/mL,放入4℃冰箱保存备用。
1.3种子萌发与幼苗生长测定
在15cm的培养皿中放入两层滤纸,加入15mL水浸提液(对照加超纯水),每处理100粒饱满的高羊茅种子,重复3次。培养条件20℃恒温,光照12h黑暗12h,并补充适量水浸液(对照加清水)。胚根突破种皮2~3mm记为萌发。幼苗生长15d后,每个培养皿中随机抽取20株幼苗,测量株高与根长,然后测定20株幼苗生物量。
发芽率 (%)=(7d内萌发种子数/种子总数)×100%;发芽势 (%)=(3d内萌发种子数/种子总数)×100%。化感指数(RI)[11]:RI=1-C/T (T≥C);RI=T/C-1 (T
1.4统计分析方法
先用各处理观测值除以对应时期的对照值得到相对值,对照记为100%,使用Two-way ANOVA模型分析取样部位和不同时期水浸提液对受体的影响(不计算对照);采用one-way ANOVA 模型分析同一时期不同部位水浸提液对高羊茅种子萌发与幼苗生长的影响(计算对照);采用Duncan′s Multiple Range Test在0.05水平上进行多重比较。统计软件为SAS 9.2。
2 结果与分析
2.1白三叶水提取物对高羊茅种子萌发的影响
白三叶水浸提液对受体种子发芽率与发芽势的作用效应受取样时期和部位显著影响(表1)。
表1白三叶不同时期与部位水浸提液对高羊茅种子和幼苗影响两因素方差分析表
Tab.1Results of the two-way ANOVA for the effects ofT.repenswater extracts from different stages and parts treatments and their interactions onF.arundinaceaseeds and seedlings
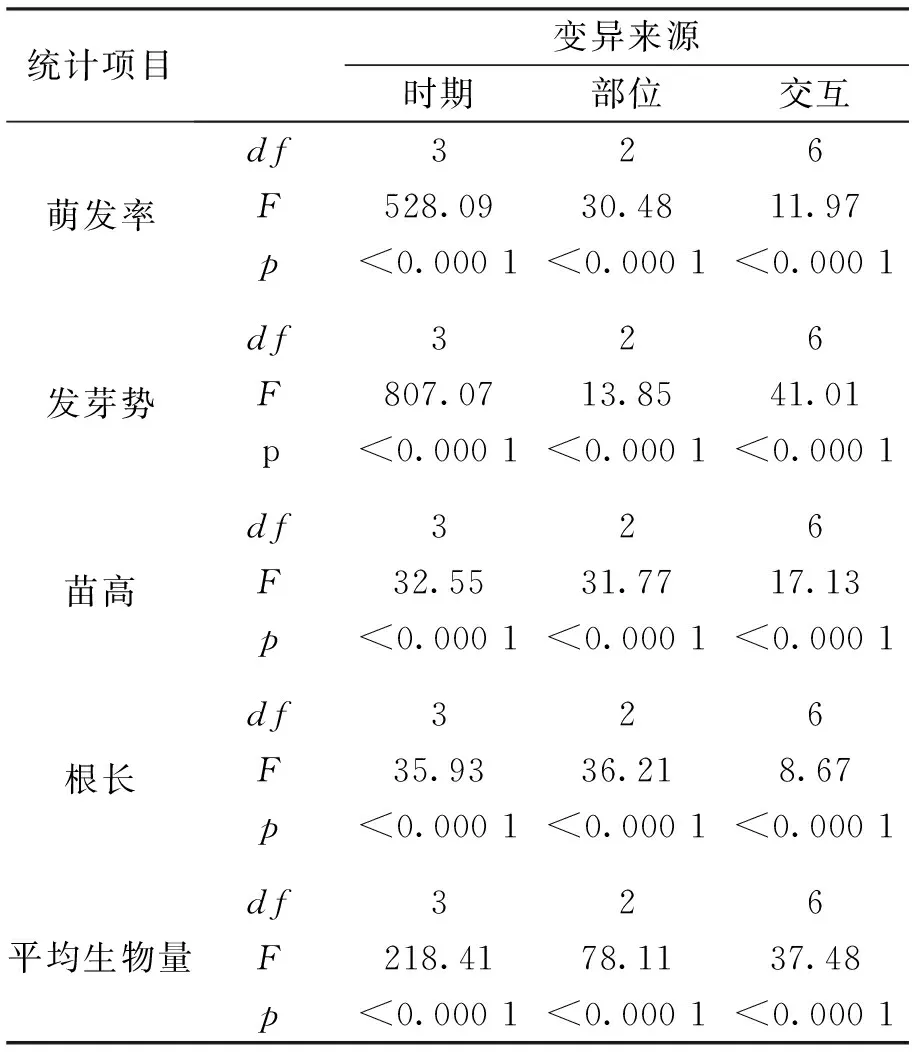
统计项目变异来源时期部位交互萌发率df326F528.0930.4811.97p<0.0001<0.0001<0.0001发芽势df326F807.0713.8541.01p<0.0001<0.0001<0.0001苗高df326F32.5531.7717.13p<0.0001<0.0001<0.0001根长df326F35.9336.218.67p<0.0001<0.0001<0.0001平均生物量df326F218.4178.1137.48p<0.0001<0.0001<0.0001
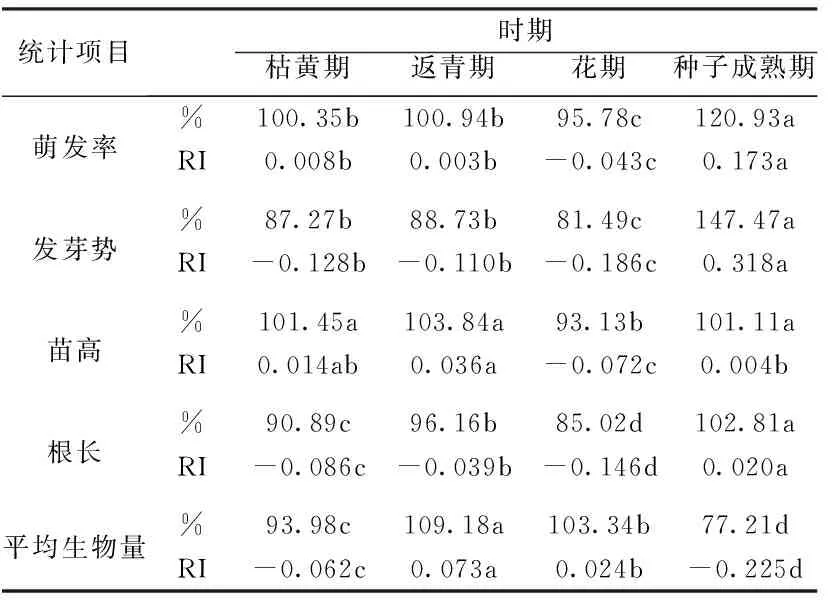
种子成熟期水浸提液处理使受体种子萌发率与萌发势均最低;枯黄期水浸提液却促进受体种子萌发(表2)。除枯黄期外的3个时期,叶片提取液都显著抑制种子萌发(图1)。当白三叶RI<0时,叶片对萌发的RI都为同时期内最小值(表3)。处于生殖生长时期的白三叶不同部位的水浸提液对受体种子萌发都具有显著的抑制作用,叶片提取液抑制作用最强。
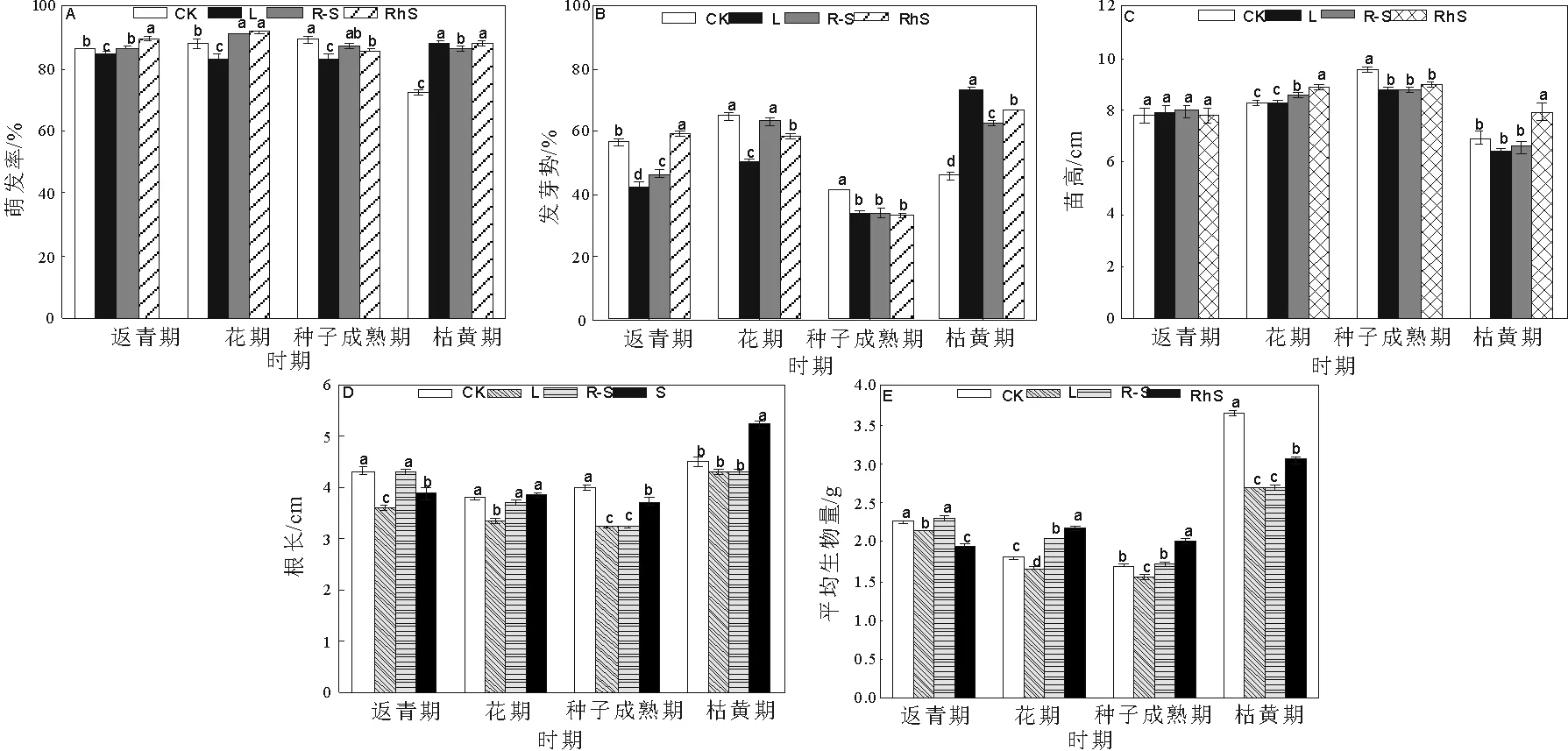
A=萌发率 Germination rate, B=发芽势Germination energy, C=苗高 Seedling height, D=根长 Root length, E=平均生物量 Average biomass。CK=对照 Control, L=叶片 Leaf, R-S=根-匍匐茎 Root-Stolon, RhS=根际土壤 Rhizosphere Soil同时期内数据不同小写字母表示在P < 0.05水平差异有统计学意义。图1 白三叶水浸提液对高羊茅种子和幼苗的影响Fig.1 The effects of T. repens the water extracts on the seeds and seedlings of F. arundinacea
2.2白三叶水提取物对高羊茅幼苗形态的影响
不同取样时期与部位的白三叶水浸提液对高羊茅幼苗高度与根长有显著影响(表1)。种子成熟期水浸提液显著抑制受体苗高,返青、开花和种子成熟3个时期水浸提液都使根长下降,种子成熟期RI<0且显著低于其他时期(图1,表2)。当白三叶RI<0时,RI叶片 2.3白三叶水提取物对高羊茅生物量影响 白三叶对高羊茅幼苗生物量的影响依赖于采样时期和部位变化(表1)。高羊茅生物量受返青期与枯黄期白三叶水提液抑制,受花期与种子成熟期水提取液促进,枯黄期抑制作用最显著,(表2)。白三叶各时期叶片提取液都减少了高羊茅生物量,RI叶片最小(图1,表3)。白三叶提取液显著削弱了高羊茅营养物质积累,返青与枯黄期抑制效应最强;叶片对生物量抑制效应强于根-匍匐茎和根际土。 表2不同采样时期水浸提液对高羊茅种子与幼苗的影响 Tab.2The effects ofT.repenswater extracts from different stages onF.arundinaceaseeds and seedlings 处理萌发率发芽势苗高根长平均生物量返青期CK0.000b0.000a0.000a0.000a0.000aL-0.023c-0.253c0.012a-0.167b-0.053bR-S-0.005b-0.176b0.024a-0.007a0.013aRhS0.037a0.045a0.005a-0.083a-0.146c花期CK0.000b0.000a0.000c0.000a0.000cL-0.054c-0.22d0.002bc-0.116b-0.081dR-S0.036a-0.026b0.035b-0.018a0.123bRhS0.043a-0.084c0.071a0.017a0.177a种子成熟期CK0.000a0.000a0.000a0.000a0.000bL-0.067c-0.203b-0.078b-0.191c-0.086cR-S-0.022ab-0.176b-0.070b-0.187c0.004bRhS-0.039b-0.177b-0.067b-0.061b0.153a枯黄期CK0.000b0.000d0.000b0.000b0.000aL0.181a0.376a-0.074c-0.041b-0.260cR-S0.162a0.266c-0.045bc-0.039b-0.259cRhS0.175a0.313b0.132a0.141a-0.154b CK=对照 Control, L=叶片 Leaf, R-S=根与匍匐茎 Root-Stolon, RhS=根际土壤 Rhizosphere Soil。同时期内同列数据不同小写字母表示在P< 0.05水平差异有统计学意义。 表3白三叶不同采样部位水浸提液对高羊茅的化感指数 Tab.3The allelopathy reactive index ofT.repenswater extracts from different parts onF.arundinacea 统计项目时期返青期花期种子成熟期枯黄期萌发率%100.35b100.94b95.78c120.93aRI0.008b0.003b-0.043c0.173a发芽势%87.27b88.73b81.49c147.47aRI-0.128b-0.110b-0.186c0.318a苗高%101.45a103.84a93.13b101.11aRI0.014ab0.036a-0.072c0.004b根长%90.89c96.16b85.02d102.81aRI-0.086c-0.039b-0.146d0.020a平均生物量%93.98c109.18a103.34b77.21dRI-0.062c0.073a0.024b-0.225d 同行数据不同小写字母表示在P< 0.05水平差异有统计学意义。(处理数值/对照)×100%。 植物化感作用是广泛存在的重要生态机制。自然环境中化感作用是多种化学物质的共同作用结果,因此,实验中使用粗提液比一种确定的化合物作用于受体植物更接近真实情况。因供体材料提取物来源和浓度差异,化感作用会表现出促进和抑制两种效应[6,8]。本研究表明白三叶对高羊茅的化感作用效应因取材物候期和部位的差异表现出抑制和促进两种效应,以抑制效应为主,证明白三叶各部位的化感作用有差异,并且随着自身物候期变化而改变。 化感作用是植物对环境变化的一种适应[10],那么化感作用是否是一种主动竞争策略呢?本实验中白三叶生殖生长期提取液恰好对受体种子萌发显著抑制,但促进生物量积累;而在营养生长期内,对受体生物量积累显著抑制,但对种子萌发表现为促进或者微弱的抑制。抑制营养生长,导致生殖生长供养不充分。抑制种子萌发,意味着种群更新障碍。因此,依赖于化感作用,在生殖生长期白三叶抑制其他植物种子萌发和幼苗生长,在营养生长期削弱周围植物生物量积累,这样的化感作用物候特征可能是其入侵或竞争的生态对策。 白三叶叶片提取液有80%情况为RI<0,并且当RI<0时RI叶片最小;即使RI>0时,叶片促进作用也最弱。根-匍匐茎提取液RI<0的情况有60%,根际土仅35%机会RI<0。一方面,证明受体植物的感受位点对化感作用的敏感性不同,或者说化感作用对受体植物生理过程也具有选择性和特异性。另一方面,也证明叶片可能是白三叶化感成分重要的储存库。 [1]XU H G, QIANG S, GENOVESI P, et al. An inventory of invasive alien species in China[J].NeoBiota, 2012, 15:1-26. [2]TUKEY H B. Implications of allelopathy in agricultural plant science[J].The Botanical Review, 1969, 35(1):1-16. [3]BAIS H P, VEPACHEDU R, GILROY S, et al. Allelopathy and exotic plant invasion: from molecules and genes to species interactions[J]. Science, 2003, 301(5):1377-1380. [4]ABHILASHA D, QUINTANA N, VIVANCO J, et al. Do allelopathic compounds in invasive Solidago canadensis s.l. restrain the native European flora? [J]. Journal of Ecology, 2008, 96:993-1001. [5]朱旺生, 沈益新. 白三叶和高羊茅对青菜幼苗生长的化感抑制效应[J]. 草业学报, 2004, 13(5):106-111. [6]梁静, 程智慧, 徐鹏, 等. 白三叶腐解液对5种草坪草的化感作用研究[J].草地学报, 2011, 19(2):257-287. [7]朱旺生, 沈益新. 白三叶和高羊茅不同品种对萝卜幼苗的化感作用[J]. 南京农业大学学报, 2004, 27(1):28-31. [8]余婷, 孟焕文, 温艳斌, 等. 白三叶根系分泌物对5种草坪草的化感作用[J]. 草地学报,2013,21(4):729-736. [9]韩银凤. 白车轴草醇提取物的薄层色谱分析[J]. 光谱实验室, 2012, 29(3):1692-1695. [10] INDERJIT DAKSHINIK M M. On laboratory bioassays in allelopathy [J]. The Botanical Review, 1995,61(1):28-44. [11] WILLIAMSON G B, RICHARDSON D. Bioassay for allelopathy: measuring treatment responses with independent controls [J]. Jouranl of Chemical Ecology, 1998,14:181-187. (编辑徐象平) The phenological law and the key part of the allelopathy inTrifoliumrepens LEI Ting, GAO Su-ping, XIE Yuan, YANG Li-Juan (Landscape Research Institute, Sichuan Agricultural University, Chengdu 611130, China) To evaluating the phenological characteristics and main parts of allelopathy ofTrifoliumrepens. The leaf, root-stolon, and rhizosphere soil ofT.repenswere collected at return green, florescence, seed mature and wither stages. The seeds ofFestucaarundinaceaas the receptor that imbibed in the water extracts from different stages and parts were analyzed. The germination and morphology of the receptor were the minimum after imbibing in the extract fromT.repensin seed mature stage. The extracts fromT.repensat return green and wither stages resulted in the biomass were the smallest. The extract of leaf reduced the germination and growth ofF.arundinaceasignificantly. Root-stolon and rhizosphere soil exposed a little inhibitory effect. When RI is blew zero, RI(leaf)is lower than RI(root-stolon)and RI(soil). The allelopathy inT.repensdepends on its phenological. In reproductive growth stage,T.repensinhibits the seed germination and the seedling form of the receptor mostly. In vegetative growth stages,T.repensinhibits the biomass of the receptor strongly. Leaf may be the main part which stores up the allelopathy compounds inT.repens. white clover (Trifoliumrepens); allelopathy; phenological 2015-03-21 四川省科技支撑计划基金资助项目(2012FZ0083) 雷霆,男,四川内江人,四川农业大学博士生,从事园林植物生理生态与遗传育种方面研究。 高素萍,女,四川雅安人,四川农业大学教授,从事园林植物生理生态与遗传育种方面研究。 S541+.2 A 10.16152/j.cnki.xdxbzr.2016-02-015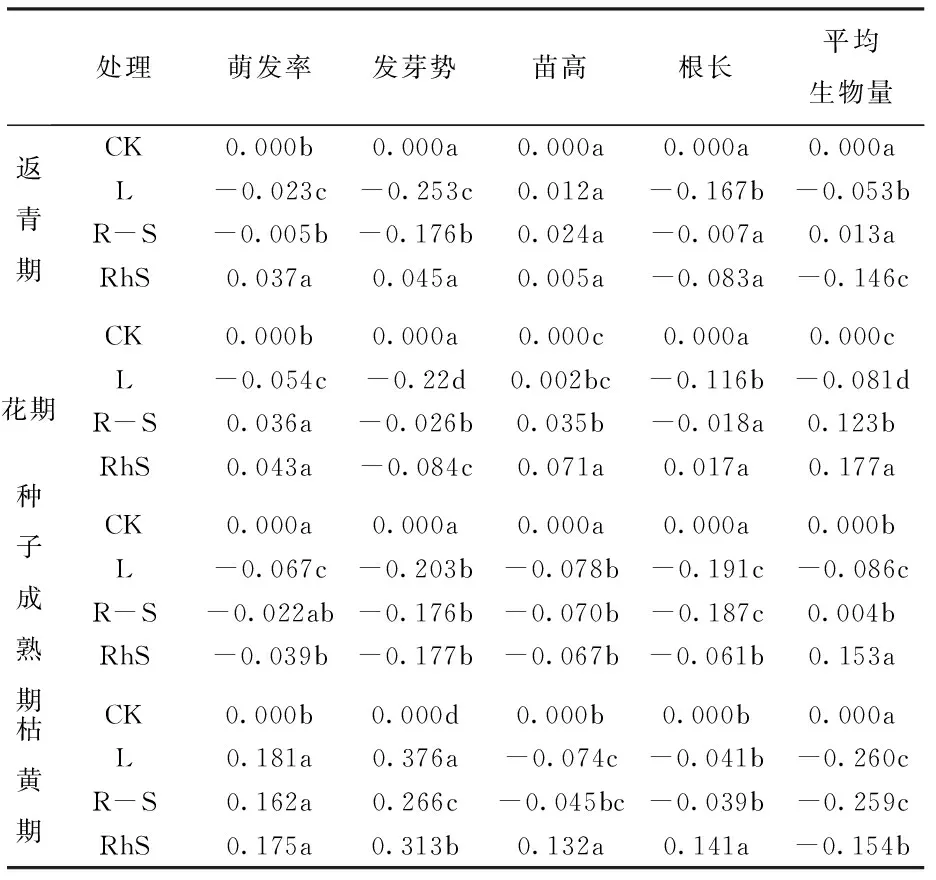
3 讨 论
