转化生长因子β1及转化生长因子β受体基因多态性与脑动静脉畸形患者脑出血的关系研究
2016-10-09魏健强薛婷婷
魏健强,李 健,薛婷婷,马 剑
转化生长因子β1及转化生长因子β受体基因多态性与脑动静脉畸形患者脑出血的关系研究
魏健强,李 健,薛婷婷,马 剑
目的探讨转化生长因子β1(TGFβ1)及转化生长因子β受体(TGFβR2)基因多态性与脑动静脉畸形患者脑出血的关系。方法选取2012年4月—2015年4月延安大学附属医院收治的脑动静脉畸形患者106例,根据脑出血发生情况分为脑出血组46例与非脑出血组60例。采用聚合酶链反应限制性片段长度多态性技术(PCR-RFLP)检测TGFβ1、TGFβR2基因多态性,脑动静脉畸形患者脑出血发生风险的分析采用多因素logistic回归分析。结果两组患者TGFβ1基因型及等位基因频率比较,差异无统计学意义(P>0.05)。两组患者TGFβR2基因型比较,差异无统计学意义(P>0.05);脑出血组患者TGFβR2基因G等位基因频率高于非脑出血组(P<0.05)。多因素logistic回归分析结果显示,携带TGFβR2基因G等位基因的脑动静脉畸形患者脑出血发生风险是非携带者的3.312倍〔RR=3.312,95%CI(1.476,7.624),P<0.05〕。结论携带TGFβR2基因G等位基因的脑动静脉畸形患者脑出血发生风险增高,但不受TGFβ1基因多态性的影响
颅内动静脉畸形;转化生长因子β1;受体,转化生长因子β;多态性,单核苷酸;脑出血
魏健强,李健,薛婷婷,等.转化生长因子β1及转化生长因子β受体基因多态性与脑动静脉畸形患者脑出血的关系研究[J].实用心脑肺血管病杂志,2016,24(8):39-41.[www.syxnf.net]
WEI J Q,LI J,XUE T T,et al.Relationship between gene polymorphism of TGFβ1,TGFβR2 and cerebral hemorrhage in patients with intracranial arteriovenous malformations[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(8):39-41.
目前,临床通常采用病灶切除术治疗脑动静脉畸形,但患者术后脑出血发生率较高,有学者认为脑动静脉畸形病灶中过度的血管重建是导致脑出血的重要原因[1],准确评估脑动静脉畸形患者预后及脑出血发生风险具有重要的临床意义[2]。转化生长因子β1(TGFβ1)是一种促血管生成因子,近年研究表明,TGFβ1及转化生长因子β受体(TGFβR2)基因多态性是多种遗传性脑血管疾病及出血性疾病的危险因素[3],但目前其对脑动静脉畸形患者脑出血的影响尚不明确。本研究旨在探讨TGFβ1及TGFβR2基因多态性与脑动静脉畸形患者脑出血的关系,以期从遗传学角度为脑动静脉畸形患者脑出血的防治提供参考,现报道如下。
1 资料与方法
1.1一般资料选取2012年4月—2015年4月延安大学附属医院收治的脑动静脉畸形患者106例,均依据临床表现、颅脑CT或MRI检查确诊,并对本研究知情同意;排除有脑出血家族史、肝肾疾病、心血管疾病病史患者等。根据脑出血发生情况将所有患者分为脑出血组46例与非脑出血组60例。两组患者性别、年龄、吸烟率及Spetzler-Martin分级比较,差异无统计学意义(P>0.05,见表1),具有可比性。
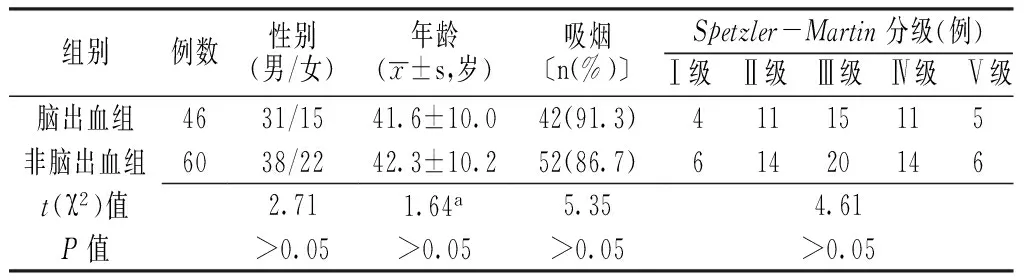
表1 两组患者一般资料比较
注:a为t值
1.2方法
1.2.1标本采集方法采集两组患者空腹外周静脉血2 ml,采用二水乙二胺四乙酸抗凝并置于-80 ℃环境中备用、待测。
1.2.2引物合成方法采用德国Qiagen公司生产的全血DNA试剂盒提取DNA,采用美国ABI公司生产的7300PCR仪进行扩增,以β-actin为内参照(基因库序列号:AY128650)。采用Primer 5.0软件进行引物设计,通过http://www.ncbi.nlm.nih.gov GeneBank检索发现TGFβ1基因、TGFβR2基因多态性位点分别为rs1800469、rs3087465,分别位于上游509 bp、875 bp处。采用上海生工生物工程技术服务有限公司合成的正向引物作为测序引物,采用聚合酶链反应限制性片段长度多态性技术(PCR-RFLP)检测TGFβ1、TGFβR2基因多态性,TGFβ1、TGFβR2基因上下游引物及扩增片段见表2。
1.2.3聚合酶链式反应(PCR)采用25 μl反应体系,包含1 U/μl Tag酶1 μl和200 ng DNA模板。PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,TGFβ1、TGFβR2分别在60 ℃、58 ℃退火45 s,72 ℃延伸60 s,共进行38个循环,最后72 ℃延伸10 min;提取PCR扩增产物6 μl,160 V电压下在2.0%琼脂糖凝胶上电泳10 min;采用限制性内切酶Bsu361酶切TGFβ1的PCR产物,采用限制性内切酶Rsal酶切TGFβR2的PCR产物;提取PCR酶切产物10 μl,150V电压下在3.0%琼脂糖凝胶上电泳20 min;采用凝胶成像系统拍摄存图后观察电泳条带位置及数目。TGFβ1、TGFβR2扩增产物分别有3个片段,前者分别为150 bp、89 bp、61 bp,后者分别为124 bp,99 bp、25 bp(见图1);前者基因型分别为TT、TC、CC,后者基因型分别为GG、GA、AA;前者碱基包括T和C,后者碱基包括G和A。

表2 TGFβ1、TGFβR2上下游引物及扩增片段
注:TGFβ1=转化生长因子β1,TGFβR2=转化生长因子β受体
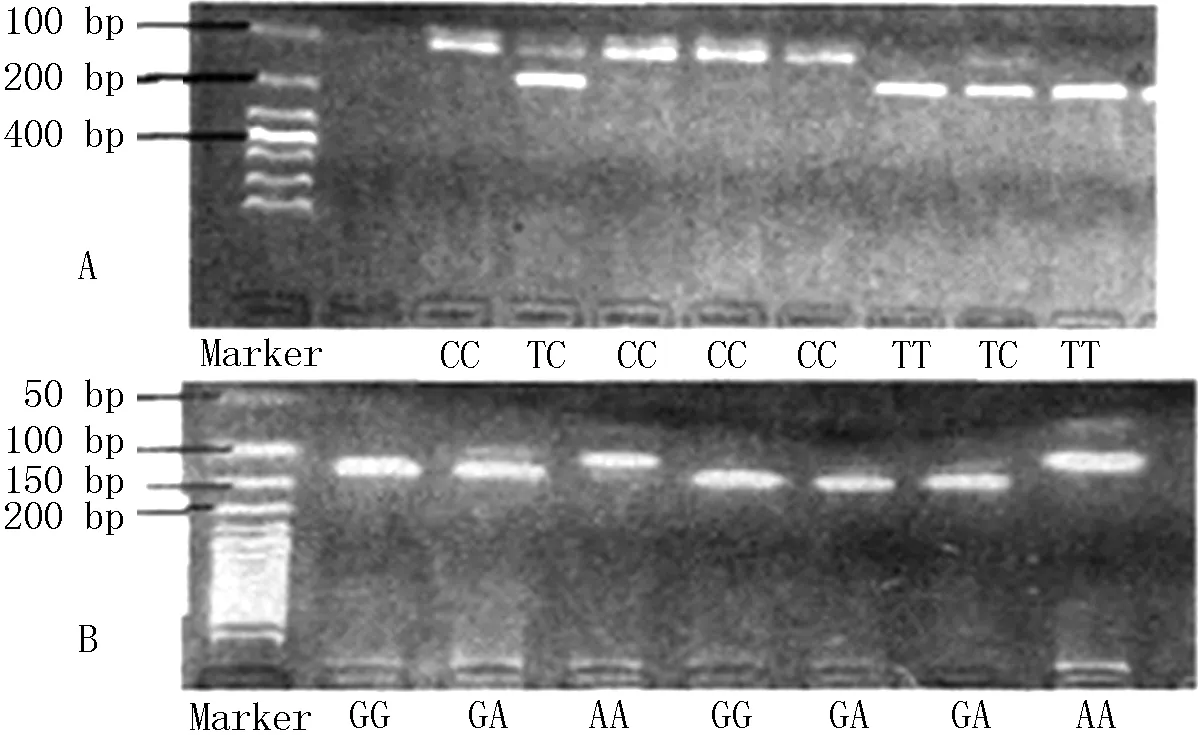
注:A为TGFβ1,B为TGFβR2;TGFβ1=转化生长因子β1,TGFβR2=转化生长因子β受体
图1TGFβ1、TGFβR2 PCR扩增及电泳结果
Figure 1PCR amplification and electrophoretic results of TGFβ1and TGFβR2
2 结果
2.1TGFβ1基因型及等位基因频率两组患者TGFβ1基因型及等位基因频率比较,差异无统计学意义(P>0.05,见表3)。
2.2TGFβR2基因型及等位基因分布两组患者TGFβR2基因型比较,差异无统计学意义(P>0.05);脑出血组患者TGFβR2基因G等位基因频率高于非脑出血组,差异有统计学意义(P<0.05,见表4)。多因素logistic回归分析结果显示,携带TGFβR2基因G等位基因的脑动静脉畸形患者脑出血发生风险是非携带者的3.312倍〔RR=3.312,95%CI(1.476,7.624),P<0.05〕。
表3两组患者TGFβ1基因型及等位基因频率比较(%)
Table3ComparisonofgenotypeandallelefrequencyofTGFβ1betweenthetwogroups
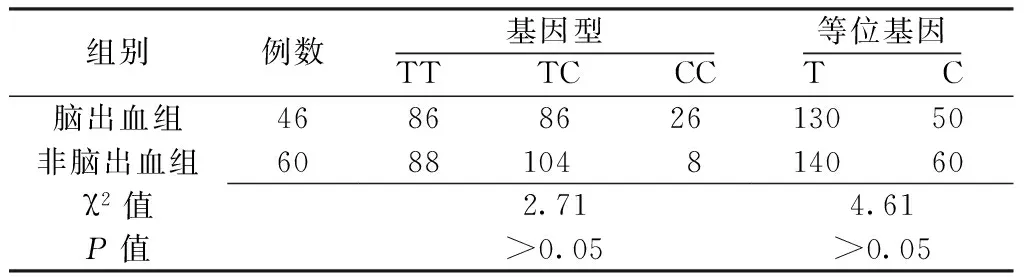
组别例数基因型TT TC CC等位基因T C脑出血组4686862613050非脑出血组6088104814060χ2值2.714.61P值>0.05>0.05
表4两组患者TGFβR2基因型及等位基因频率比较(%)
Table 4Comparison of genotype and allele frequency of TGFβR2 between the two groups
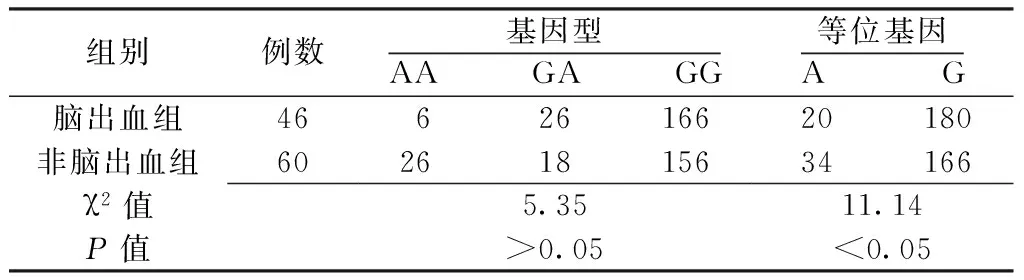
组别例数基因型AA GA GG等位基因A G脑出血组4662616620180非脑出血组60261815634166χ2值5.3511.14P值>0.05<0.05
3 讨论
TGFβ1是转化生长因子β(TGFβ)的异构体,位于染色体19q13.1.2上,全长23.56 kbp,包含6个内含子和7个外显子。TGFβ1包含多个基因多态性位点,而位于启动子区上游的TGFβ1位点基因多态性可影响TGFβ1的表达,进而参与脑出血的发生、发展及转归。但目前TGFβ1基因多态性导致脑出血的作用机制尚不明确,尤其是在脑动静脉畸形患者中[4-6]。TGFβR2是TGFβ的主要受体,位于启动子区上游的TGFβR2位点基因多态性可提高其转录活性,进而影响TGFβR2的表达,而TGFβR2表达水平可影响TGFβ1功能[7-12]。本研究从遗传学角度探讨TGFβ1及TGFβR2基因多态性与脑动静脉畸形患者脑出血的关系,旨在为脑动静脉畸形患者脑出血的有效防治提供参考。
本研究结果显示,两组患者TGFβ1基因型及等位基因频率间、TGFβR2基因型间无明显差异,而脑出血组患者TGFβR2基因G等位频率高于非脑出血组;多因素logistic回归分析结果,携带TGFβR2基因G等位基因的脑动静脉畸形患者脑出血发生风险是非携带者的3.312倍,提示携带TGFβR2基因G等位基因的脑动静脉畸形患者脑出血发生风险增高,但不受TGFβ1基因多态性影响。但目前有关TGFβ1及TGFβR2基因多态性与脑动静脉畸形患者脑出血关系的研究报道较为少见,本研究纳入的样本量及观察指标有限,限于临床条件未进行相关因素的校正,仍需在今后的研究中进一步完善。
综上所述,本研究从遗传学角度探讨了TGFβ1及TGFβR2基因多态性与脑动静脉畸形患者脑出血的关系,发现携带TGFβR2基因G等位基因的脑动静脉畸形患者脑出血发生风险增高,但不受TGFβ1基因多态性影响,应引起临床重视。但考虑到基因多态性的种群、地区差异及脑出血危险因素的多样性,本研究所得结果及结论仍需进一步验证,而TGFβ1及TGFβR2基因多态性导致脑动静脉畸形患者脑出血的具体作用机制也需深入探讨。
作者贡献:魏健强进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;李健、薛婷婷进行实验实施、评估、资料收集;马剑进行质量控制及审校。
本文无利益冲突。
[1]樊骏.低级别幕上脑动静脉畸形的临床治疗方式选择及疗效比较[J].中外医疗,2015,34(28):87-88.
[2]李志平,黄小山.脑动静脉畸形栓塞术后颅内出血影响因素的多元回归分析[J].河南外科学杂志,2015,4(4):3-6.
[3]陈研修,张斌,陈德哲,等.脑动静脉畸形患者癫癎发作的相关因素分析[J].卒中与神经疾病,2015,10(6):328-331.
[4]曾涛,陈衔城,秦智勇,等.碱性成纤维细胞生长因子对人脑动静脉畸形血管平滑肌细胞增殖和表达骨桥蛋白的影响[J].中国病理生理杂志,2008,24(2):382-383,387.
[5]郑海军,娄晓辉,王朝晖,等.介入栓塞术对于脑动静脉畸形患者病灶部位相关细胞因子的影响研究[J].浙江创伤外科,2015,20(5):841-843.
[6]李雪松,江楠,郭少雷,等.脑动静脉畸形显微手术后周围脑组织血流变化及病理特征[J].中华显微外科杂志,2009,32(2):130-132,插7.
[7]山常国,蔡林波,洪伟平,等.立体定向放射外科治疗脑动静脉畸形的效果观察[J].实用心脑肺血管病杂志,2014,22(6):86-87.
[8]秦梓良.三维数字减影血管造影与磁共振成像图像融合对脑动静脉畸形术的评估价值[J].实用心脑肺血管病杂志,2013,21(7):69-70.
[9]ALARAJ A,SHAKUR S F,Amin-Hanjani S,et al.Changes in wall shear stress of cerebral arteriovenous malformation feeder arteries after embolization and surgery[J].Stroke,2015,46(5):1216-1220.
[10]SHAKUR S F,AMIN-HANJANI S,MOSTAFA H,et al.Hemodynamic characteristics of cerebral arteriovenous malformation feeder vessels with and without aneurysms[J].Stroke,2015,46(7):1997-1999.
[11]KHAGHANI S A,DENYER M C T,YOUSEFFI M.Effect of Transforming Growth Factor-β1in Biological Regulation of Primary Chondrocyte[J].American Journal of Biomedical Engineering,2012,2(1):1-8.
[12]AHMADIAFSHAR A,TAYMOURZADEH B,SHEIKHI A,et al.Evaluation of IL10,TGF-B and Specific IgE and IgG Levels during Sublingual Rye Grass Immunotherapy Executive Editors Allergy & Therapy[J].Allergy & Therapy,2013,4(2):1-4.
(本文编辑:鹿飞飞)
Relationship between Gene Polymorphism of TGFβ1,TGFβR2 and Cerebral Hemorrhage in Patients with Intracranial Arteriovenous Malformations
WEIJian-qiang,LIJian,XUETing-ting,MAJian.
DepartmentofCardiac-cerebralVascularDisease,theAffiliatedHospitalofYan′anUniversity,Yan′an716000,China
LIJian,DepartmentofCardiac-cerebralVascularDisease,theAffiliatedHospitalofYan′anUniversity,Yan′an716000,China;E-mail:2059025965@qq.com
ObjectiveTo investigate the relationship between gene polymorphism of TGFβ1,TGFβR2 and cerebral hemorrhage in patients with intracranial arteriovenous malformations.MethodsA total of 106 patients with intracranial arteriovenous malformations were selected in the Affiliated Hospital of Yan′an University from April 2012 to April 2015,and they were divided into A group(complicated with cerebral hemorrhage,n=46)and B group(did not complicate with cerebral hemorrhage,n=60)according to the incidence of cerebral hemorrhage.PCR-RFLP was used to detect the gene polymorphism of TGFβ1and TGFβR2,and mutivariate logistic regression analysis was used to analyze the risk of cerebral hemorrhage in patients with intracranial arteriovenous malformations.ResultsNo statistically significant differences of genotype or allele frequency of TGFβ1was found between the two groups,nor was genotype of TGFβR2(P>0.05);while G allele frequency of TGFβR2 of A group was statistically significantly higher than that of B group(P<0.05).Mutivariate logistic regression analysis showed that,occurrence risk of cerebral hemorrhage of intracranial arteriovenous malformations patients with G allele of TGFβR2 was 3.312 times of patients without G allele of TGFβR2 〔RR=3.312,95%CI(1.476,7.624),P<0.05〕.ConclusionG allele of TGFβR2 can increase the occurrence risk of intracranial arteriovenous malformations,while it is not affected by gene polymorphism of TGFβ1.
Intracranial arteriovenous malformations;Transforming growth factor beta1;Receptors,transforming growth factor beta;Polymorphism,single nucleotide;Cerebral hemorrhage
国家自然科学基金(81341112)
716000陕西省延安市,延安大学附属医院心脑血管专科病区
李健,716000陕西省延安市,延安大学附属医院心脑血管专科病区;E-mail:2059025965@qq.com
R 743.4
A
10.3969/j.issn.1008-5971.2016.08.010
2016-04-05;
2016-07-20)
