内皮祖细胞移植对盐敏感性高血压大鼠心肌重构的影响研究
2016-10-09方汉军李锋华刘富强牟建军廉秋芳
漆 秦,方汉军,李锋华,许 成,刘富强,牟建军,廉秋芳
·论著·
内皮祖细胞移植对盐敏感性高血压大鼠心肌重构的影响研究
漆 秦,方汉军,李锋华,许 成,刘富强,牟建军,廉秋芳
目的分析内皮祖细胞(EPCs)移植对盐敏感性高血压大鼠心肌重构的影响。方法2015年1月—2016年2月于陕西省医学实验动物中心实验室进行实验,选取Dahl盐敏感大鼠66只,按随机数字表法分为正盐组、高盐组及EPCs移植组,各22只。正盐组大鼠每日予以0.3%氯化钠饮食,高盐组及EPCs移植组大鼠每日予以8%氯化钠饮食,其中EPCs移植组大鼠尾静脉注入CM-Dil标记的EPCs;3组大鼠均连续喂养6周。观察第3代EPCs形态,比较3组大鼠心肌重构指标〔前壁厚度、后壁厚度、左心室舒张末期内径(LVDd)、左心室收缩末期内径(LVDs)、短轴缩短率(FS)、左心室射血分数(LVEF)〕、新生毛细血管数、血管内皮细胞生长因子(VEGF)和CXC趋化因子配体16(CXCL16)基因及蛋白表达情况,同时观察3组大鼠CM-Dil标记阳性细胞及心肌纤维化情况。结果第3代EPCs生长迅速、纯度高、形态单一。正盐组、EPCs移植组大鼠前壁厚度、FS、LVEF高于高盐组,LVDs、LVDd低于高盐组(P<0.05);EPCs移植组大鼠前壁厚度、FS、LVEF高于正盐组,LVDs低于正盐组(P<0.05)。正盐组、EPCs移植组大鼠新生毛细血管数多于高盐组(P<0.05);EPCs移植组大鼠新生毛细血管数多于正盐组(P<0.05)。正盐组、EPCs移植组大鼠VEGF mRNA相对表达量高于高盐组,CXCL16 mRNA相对表达量低于高盐组(P<0.05);EPCs移植组大鼠VEGF mRNA相对表达量高于正盐组,CXCL16 mRNA相对表达量低于正盐组(P<0.05)。正盐组、EPCs移植组大鼠VEGF蛋白相对表达量高于高盐组,CXCL16蛋白相对表达量低于高盐组(P<0.05);EPCs移植组大鼠VEGF蛋白相对表达量高于正盐组,CXCL16蛋白相对表达量低于正盐组(P<0.05)。EPCs组大鼠可见CM-Dil标记阳性细胞,正盐组和高盐组大鼠未见CM-Dil标记阳性细胞。正盐组大鼠未发生心肌纤维化,高盐组及EPCs移植组大鼠均出现不同程度的心肌纤维化;与高盐组比较,EPCs移植组心肌纤维化程度较轻,巨噬细胞浸润较少。结论EPCs移植可延缓盐敏感性高血压大鼠心肌重构,增加大鼠心肌毛细血管数并上调VEGF基因及蛋白的表达,下调CXCL16基因及蛋白的表达,有利于减少心肌纤维化。
高血压;大鼠,近交Dahl;干细胞;心室重构
漆秦,方汉军,李锋华,等.内皮祖细胞移植对盐敏感性高血压大鼠心肌重构的影响研究[J].实用心脑肺血管病杂志,2016,24(8):9-15.[www.syxnf.net]
QI Q,FANG H J,LI F H,et al.Impact of endothelial progenitor cells transplantation on myocardial remodelling of salt-sensitive hypertensive rats[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(8):9-15.
研究表明,盐是高血压发生的重要影响因素,而人们的盐敏感性并不相同[1-4]。研究表明,我国高血压患者约占总人口数的20%,其中盐敏感性高血压约占50%[5-7]。盐敏感性高血压的发生与外界因素及患者自身功能改变等有关[8-13]。盐敏感性可引起血压大幅度波动,昼夜差值减小等,导致患者出现心、脑、肾等脏器功能损伤。研究表明,盐敏感性可导致多种慢性病的发生[14-16],其是引发心血管疾病的重要影响因素[17-18]。长期高血压可导致患者心脏前后负荷增加,血流动力学改变,同时使机体的神经-内分泌调节系统发生改变,造成心肌重构[19-21]。心肌重构是由于部分有生理功能的心肌丢失或无功能的瘢痕形成造成的,其常见的病理改变为心肌纤维化;另外,心肌重构是高血压患者发生心血管事件的危险因素。最新研究发现,纤维化过程中常伴有炎性细胞浸润,且其与趋化因子密切相关[22]。目前,趋化因子介导的炎性反应与长期高血压患者心肌细胞纤维化间的关系尚不明确,尤其是盐敏感性高血压。内皮祖细胞(EPCs)在不同的环境中可向不同方向分化[23],当予以某种特定刺激时,EPCs可以被动员,并向血管损伤部位进行定向迁移、分化及修复等。近年来有学者提出利用细胞重塑来改善患者心肌重构的概念。研究发现,EPCs移植在血管性及缺血损伤性疾病治疗等方面具有重要作用[24]。本研究旨在分析EPCs移植对盐敏感性高血压大鼠心肌重构的影响,现报道如下。
1 材料与方法
1.1实验材料
1.1.1实验动物选取SPF级健康成年雄性Dahl盐敏感大鼠66只,体质量(155±5)g,周龄6周,由陕西省医学实验动物中心实验室提供,动物编号:41003100000664;于该中心实验室清洁级屏蔽环境中喂养,实验前采用正常饲料(含盐0.5%)喂养,自由饮水;健康指标均符合要求,实验时对动物的处置方式符合动物伦理学要求。
1.1.2实验试剂兔单克隆抗CXCL16抗体(货号ab119350)购自美国Abcam公司;Masson trichrome staining试剂(货号HT15-1KKT)购自美国Sigma公司;DAB试剂盒购自中国迈新生物技术公司。
1.1.3实验仪器Vev0770TM高分辨小动物超声成像系统及RMV707B型高频超声探头购自加拿大visualsonies公司,全自动无创血压测量仪购自成都泰盟科技有限公司,液氮容器购自乐山市东亚机电工贸有限公司,电泳仪、电泳槽、凝胶玻璃板、固定夹购自北京六一仪器厂,UVP凝胶图像扫描仪购自BIO-RAD 公司,水合氯醛购自中天实验仪器有限公司,Masson trichrome staining试剂购自美国Sigma公司。
1.2分组与建立模型2015年1月—2016年2月于陕西省医学实验动物中心实验室进行实验。将Dahl盐敏感大鼠按随机数字表法分为正盐组、高盐组及EPCs移植组,各22只。正盐组大鼠每日予以0.3%氯化钠饮食,高盐组及EPCs移植组大鼠每日予以8%氯化钠饮食。3组大鼠均按国际动物饲养中心的标准连续喂养6周。采用尾套法,应用大鼠血压仪测量收缩压,当收缩压>160 mm Hg(1 mm Hg=0.133 kPa)时表示建模成功,EPCs移植组大鼠尾静脉注入CM-Dil标记的EPCs 3×106/L,连续3 d。
1.3观察指标观察第3代EPCs的形态,比较3组大鼠心肌重构指标〔前壁厚度、后壁厚度、左心室舒张末期内径(LVDd)、左心室收缩末期内径(LVDs)、短轴缩短率(FS)、左心室射血分数(LVEF)〕、新生毛细血管数、血管内皮细胞生长因子(VEGF)和CXC趋化因子配体16(CXCL16)基因及蛋白表达情况,观察3组大鼠CM-Dil标记阳性细胞及心肌纤维化情况。
1.3.1第3代EPCs将冷冻保存的EPCs复苏后重悬于新鲜的EPCs细胞培养液中,多数细胞生长良好;选取第3代EPCs细胞培养约10 d可见条索样结构形成,移植后2周,细胞长满培养瓶底壁,形成典型“鹅卵石样”外观;细胞按1∶2传代培养4~5 d长满瓶底。采用倒置相差显微镜(BX51型,Olympus公司,日本)动态观察单个核细胞形态及生长状态并拍照。
1.3.2心肌重构指标采用超声心动图检测大鼠心肌重构指标,移植2周后采用2%异氟烷麻醉大鼠,调节夹鼠板温度,保持在36~38 ℃,心率为200~300次/min;固定大鼠,行检查前准备,待大鼠呼吸和心率稳定后进行检查;准确定位并移动探头,使图像清楚显示。
1.3.3新生毛细血管数移植2周后处死大鼠并迅速取出心肌组织,石蜡包埋,切片,厚度为4 μm,并进行免疫组化染色,抗体为小鼠抗兔vWF因子;每只大鼠取5个较好的切片,随机选5个视野进行观察并计数,后取平均值为最终结果。由病理学专家进行监督且全过程在双盲下完成。
1.3.4VEGF和CXCL16基因及蛋白表达采用反转录-聚合酶链反应(RT-PCR)检测转染后基因的表达情况。按Trizol说明书进行操作,取细胞总RNA。VEGF上游引物:5′-CTGCTCTCTTGGGTCCACTGG-3′,下游引物:5′-CACCGCCTTGGCTTGTCACAT-3′;CXCL16上游引物:5′-AAAGAGCTCACTCGTCCCAA-3′,下游引物:5′-CAAGCTTCATTCTTGGCTC-3′;内参照β-actin上游引物:5′-CTGGAACGGCGAAGGTGACAG-3′,下游引物:5′-GGTGGCTTTTAGGATGGCAAG-3′。配置25 μl反应体系,其中模板cDNA 100 ng,Taq酶0.125 μl;反应条件:94 ℃变性2 min,重复33个循环后于94 ℃变性30 s,58 ℃/55 ℃(β-actin)退火30 s,72 ℃延伸30 s,最后一次反应时延伸时间设置为10 min;采用1.5%琼脂糖凝胶电泳扩增产物,后应用UVP凝胶成像,检测灰度值并进行统计学分析。
采用酶联免疫吸附法(ELISA)检测VEGF和CXCL16蛋白的表达,依据试剂盒的操作步骤稀释标准品,制作标准曲线,并按照说明书中的上样量对各孔进行上样,置于室温下温育,共2 h,后应用缓冲液彻底洗板,共5次;向各孔中添加一抗工作液,置于室温下1 h,后重复上述洗板步骤;添加酶标抗体,再次重复上述步骤;向各孔添加底物,将其置于黑暗环境中10 min,添加显色液,后添加终止液并迅速放入仪器中判读结果。
1.3.5CM-Dil标记阳性细胞将取出的心肌组织迅速冷冻处理,应用切片机将其切成5 μm的薄片,缓慢移至载玻片上并完全贴敷,添加丙酮固定并进行观察;采用荧光显微镜观察CM-Dil标记阳性细胞,CM-Dil标记阳性细胞呈红色荧光。
1.3.6心肌纤维化采用7HE及Masson三色法检测心肌纤维化情况。THE法:移植EPCs后继续喂养2周,从3组大鼠中分别随机取出5只,处死后收集整个心脏组织,行浸蜡包埋处理,后应用切片机切片,贴敷于载玻片上,行脱蜡及浸水处理;将标本置于苏木精染液中15 min,后应用乙醇分化5 s,应用氨水进行反蓝,共10 min;行伊红染色,共5 min,应用系列浓度乙醇脱水,并采用二甲苯进行透明,共10 min,封片后置于光镜下观察。
Masson三色法:移植2周后,3组大鼠中分别随机取出5只,处死后收集整个心脏、浸蜡包埋及浸水等,置于Boutins液中过夜,次日取出并用流水持续冲洗,共3 h,后应用铁苏木精染色15~20 min,再次洗涤,共30 s,应用0.5%乙醇进行分化,并用氨水进行反蓝处理;应用Biebrich Sclarlet-Acid染色,共10~15 min,流水冲洗30 s,置于磷酸溶液中2~3 min,苯胺蓝中12~13 min,再次流水冲洗;脱水、透明、封片等处理后进行观察。

2 结果
2.1第3代EPCs的形态第3代EPCs生长迅速、纯度高、形态单一,详见图1。
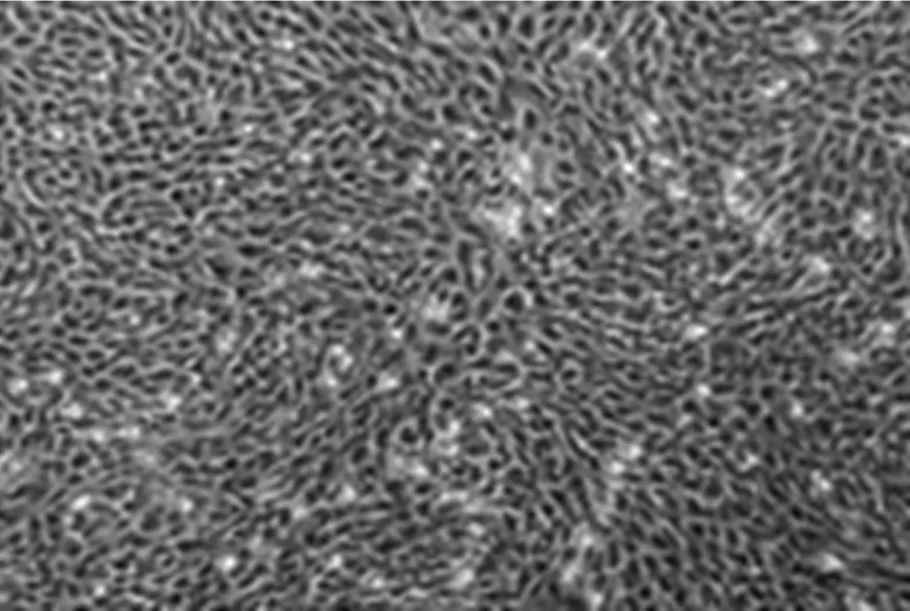
图1 第3代EPCs的形态(免疫荧光染色,×200)
2.2心肌重构指标3组大鼠前壁厚度、后壁厚度、LVDd、LVDs、FS、LVEF比较,差异有统计学意义(P<0.05);正盐组、EPCs移植组大鼠前壁厚度、FS、LVEF高于高盐组,LVDs、LVDd低于高盐组,差异有统计学意义(P<0.05);EPCs移植组大鼠前壁厚度、FS、LVEF高于正盐组,LVDs低于正盐组,差异有统计学意义(P<0.05,见表1)。
2.3新生毛细血管数正盐组大鼠新生毛细血管数为(782.5±36.3)条,高盐组大鼠新生毛细血管数为(411.3±30.4)条,EPCs移植组新生毛细血管数为(824.7±48.2)条。3组大鼠新生毛细血管数比较,差异有统计学意义(F=748.11,P<0.05);正盐组、EPCs移植组大鼠新生毛细血管数多于高盐组,差异有统计学意义(q值分别为44.633、49.701,P<0.05);EPCs移植组大鼠新生毛细血管数多于正盐组,差异有统计学意义(q=5.074,P<0.05)。
2.4VEGFmRNA、CXCL16mRNA表达情况3组大鼠VEGFmRNA、CXCL16mRNA相对表达量比较,差异有统计学意义(P<0.05);正盐组、EPCs移植组大鼠VEGFmRNA相对表达量高于高盐组,CXCL16mRNA相对表达量低于高盐组,差异有统计学意义(P<0.05);EPCs移植组大鼠VEGFmRNA相对表达量高于正盐组,CXCL16mRNA相对表达量低于正盐组,差异有统计学意义(P<0.05,见表2,图2)。

Table2ComparisonofrelativeexpressionquantityofVEGFmRNAandCXCL16mRNAamongthethreegroups

组别只数VEGFmRNACXCL16mRNA正盐组221.19±0.11a1.25±0.10a高盐组220.72±0.082.01±0.11EPCs移植组221.82±0.12ab0.80±0.09abF值611.12817.42P值0.0000.001
注:与高盐组比较,aP<0.05,与正盐组比较,bP<0.05;VEGF=血管内皮细胞生长因子,CXCL16=CXC趋化因子配体16
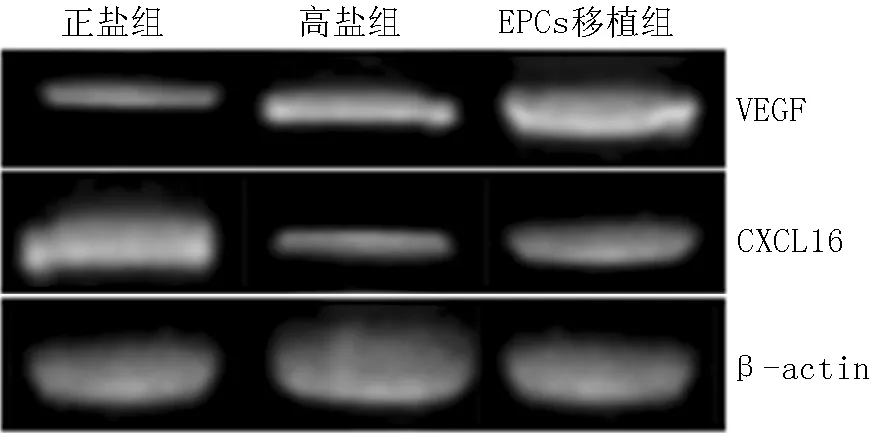
注:β-actin=β-肌动蛋白;VEGF=血管内皮细胞生长因子,CXCL16=CXC趋化因子配体16
图23组大鼠VEGF mRNA、CXCL16 mRNA的电泳结果
Figure 2Electrophoretic results of VEGF mRNA and CXCL16 mRNA of the three groups
2.5VEGF、CXCL16蛋白表达情况3组大鼠VEGF、CXCL16蛋白相对表达量比较,差异有统计学意义(P<0.05);正盐组、EPCs移植组大鼠VEGF蛋白相对表达量高于高盐组,CXCL16蛋白相对表达量低于高盐组,差异有统计学意义(P<0.05);EPCs移植组大鼠VEGF蛋白相对表达量高于正盐组,CXCL16蛋白相对表达量低于正盐组,差异有统计学意义(P<0.05,见表3,图3)。
Table3ComparisonofrelativeexpressionquantityofVEGFproteinandCXCL16proteininthethreegroups

组别只数VEGFCXCL16正盐组221.90±0.12a2.01±0.11a高盐组221.23±0.092.42±0.12EPCs移植组222.38±0.13ab1.46±0.10abF值558.88419.57P值0.0020.000
注:与高盐组比较,aP<0.05,与正盐组比较,bP<0.05

图3 3组大鼠VEGF、CXCL16蛋白的电泳结果
Figure 3Electrophoretic results of VEGF protein and CXCL16 protein of the three groups
2.6CM-Dil标记阳性细胞EPCs组大鼠可见CM-Dil标记阳性细胞,正盐组和高盐组大鼠未见CM-Dil标记阳性细胞,详见图4。
2.7心肌纤维化正盐组大鼠未发生心肌纤维化,高盐组及EPCs移植组大鼠均出现不同程度的心肌纤维化;与高盐组比较,EPCs移植组心肌纤维化程度较轻,且巨噬细胞浸润较少,详见图5。
3 讨论
近年来,随着人们生活水平的提高及生活方式的改变,高血压发病率呈逐年上升趋势,严重时可损伤患者心、脑、肾或其他器官功能[25-27]。据调查显示,机体盐摄入量与高血压的发生密切相关,若连续30年盐日摄入量>6 g,则收缩压升高约8 mm Hg,且心血管事件发生率明显升高[28]。研究表明,盐敏感性高血压发生率较高,且易出现其他器官损伤[29-34];同时,盐敏感性高血压患者心血管事件发生率较高[35-40]。随着患者发生高血压时间的延长及心脏负荷的加重,易引发心肌肥厚及心功能障碍,严重时可导致心力衰竭[41-43]。采用干细胞移植修复受损心肌细胞为心肌重构患者带来了曙光。EPCs来源于外周血、骨髓及脐血等多种组织,来源广泛。

表1 3组大鼠心肌重构指标比较±s)
注:与高盐组比较,aP<0.05,与正盐组比较,bP<0.05;LVDd=左心室舒张末期内径,LVDs=左心室收缩末期内径,FS=短轴缩短率,LVEF=左心室射血分数

注:A为正盐组,B为高盐组,C为EPCs移植组
图43组大鼠CM-Dil标记阳性细胞(×200)
Figure 4CM-Dil marked positive cells of the three groups

注:A为正盐组,B为高盐组,C为EPCs移植组
图53组大鼠心肌纤维化情况(Masson三色法,×200)
Figure 5Myocardial fibrosis of the three groups
本研究采用性别、周龄相同的大鼠制造盐敏感性高血压模型,且各组大鼠体质量间无差异,故排除了一般因素的影响。本研究结果显示,正盐组、EPCs移植组大鼠前壁厚度、FS、LVEF高于高盐组,LVDs、LVDd低于高盐组;EPCs移植组大鼠前壁厚度、FS、LVEF高于正盐组,LVDs低于正盐组,提示EPCs可改善盐敏感性高血压大鼠心肌重构。正盐组、EPCs移植组大鼠新生毛细血管数多于高盐组;EPCs移植组大鼠新生毛细血管数多于正盐组,提示EPCs可增加盐敏感性高血压大鼠毛细血管数。正盐组、EPCs移植组大鼠VEGF mRNA表达高于高盐组,CXCL16 mRNA表达低于高盐组,EPCs移植组大鼠VEGF mRNA表达高于正盐组,CXCL16 mRNA表达低于正盐组;正盐组、EPCs移植组大鼠VEGF蛋白表达高于高盐组,CXCL16蛋白表达低于高盐组,EPCs移植组大鼠VEGF蛋白表达高于正盐组,CXCL16蛋白表达低于正盐组,提示EPCs可提高盐敏感性高血压大鼠VEGF基因及蛋白的表达,降低CXCL16基因及蛋白的表达。炎性因子浸润可能引发心肌重构,且趋化因子作为一种小分子蛋白,参与了各种类型的炎性反应及免疫应答。CXCL16属于趋化因子家族,其在平滑肌中可诱导炎症,在Dhal盐敏感性高血压大鼠心肌重构中发挥着重要作用。
综上所述,EPCs移植可改善盐敏感性高血压大鼠的心肌重构,增加大鼠心肌毛细血管数,提高VEGF基因及蛋白的表达,降低CXCL16基因及蛋白的表达,减少心肌纤维化的发生,有一定的临床参考价值。但本研究未说明心肌重构的发病机制,需进一步研究探讨。
作者贡献:漆秦参与实验设计,并进行实验实施、撰写论文初稿;方汉军、李锋华、许成进行具体实验及资料收集;刘富强进行资料整理、分析数据;牟建军进行实验指导;廉秋芳进行实验设计、质量控制及审校。
本文无利益冲突。
[1]牟建军.盐与高血压研究进展[J].中国医学前沿杂志(电子版),2011,39(2):70-73.
[2]HUA Q,REN H R.High salt and hypertension[J].Journal of Capital Medical University,2011,32(5):617-625.
[3]夏鹏程,何振仿,丁宏.社区老年高血压患者高血压相关知识及行为方式分析[J].安徽医学,2012,33(4):489-491.
[4]花学美,陈宏平.两种健康教育方式对社区高血压患者血压和认知行为的影响[J].中华全科医学,2012,10(2):248.
[5]尤洪帅,魏万林,张灵,等.膳食中钠钾含量对血压及靶器官的影响[J].中国老年学杂志,2013,33(22):5764-5766.
[6]和秀娟.高血压患者低盐饮食认知行为调查及影响因素探讨[J].心血管病防治知识:学术版,2016,6(2):10-12.
[7]勇琴歌,于建辉,杜彩霞.老年高血压患者盐敏感性认知的调查[J].解放军护理杂志,2010,27(7):508-509.
[8]DOAEI S,GHOLAMALIZADEH M.The association of genetic variations with sensitivity of blood pressure to dietary salt: A narrative literature review[J].ARYA Atheroscler,2014,10(3):169-174.
[9]HAN Y L,LI Y L,JIA L X,et al.Reciprocal interaction between macrophages and T cells stimulates IFN-γ and MCP-1 production in Ang II-induced cardiac inflammation and fibrosis[J].Plos One,2012,7(5):e35506.
[10]殷丽天,李媛,李莉,等.感觉神经损伤性盐敏感性高血压大鼠心、肾AT1R的表达[J].中国比较医学杂志,2011,21(8):10-14.
[11]牟建军,任珂宇.盐敏感性高血压的诊断和机制[J].诊断学理论与实践,2012,11(6):543-546.
[12]田亚平.氢氯噻嗪治疗盐敏感性高血压临床体会[J].基层医学论坛,2013,15(20):2711-2712.
[13]闻加升,张娴,颜新林,等.吲达帕胺治疗盐敏感性高血压效果的研究[J].心血管病防治知识:学术版,2014,4(10):26-28.
[14]MA L,WANG W,ZHAO Y,et al.Combination of amlodipine plus angiotensin receptor blocker or diuretics in high-risk hypertensive patients: a 96-week efficacy and safety study[J].Am J Cardiovasc Drugs,2012,12(2):137-142.
[15]高峰,周静,万招飞,等.调节血糖代谢对盐敏感性高血压患者盐敏感性的影响[J].心血管康复医学杂志,2012,21(3):270-272.
[16]ARONOW W S.Current approaches to the treatment of hypertension in older persons[J].Postgrad Med,2012,124(1):50-59.
[17]奥唐奈,何斌斌.钠摄入与心血管疾病相关性数据为何不一致[J].糖尿病临床,2013,7(7):322-329.
[18]郭晓雷,马吉祥,颜流霞,等.山东省居民食盐摄入量与血压的关系[J].中华预防医学杂志,2014,48(2):119-123.
[19]胡咏梅,刘小蓉,赵思勤,等.原发性高血压患者盐敏感性与血管重构的探讨[J].中华老年心脑血管病杂志,2010,12(7):590-592.
[20]郝丽娜.高龄高血压患者的盐敏感性及血管重构相关性分析[J].安徽医学,2013,34(12):1821-1822.
[21]曲红培,胡杨,黄秀萍.高血压患者中不同左心室构型的结构和功能变化与血浆BNP的相关因素分析[J].中国社区医师:医学专业,2014,30(36):152-153.
[22]ZHAO Q,GU D,HIXSON J E,et al.Common variants in epithelial sodium channel genes contribute to salt sensitivity of blood pressure: The GenSalt study[J].Circ Cardiovasc Genet,2011,4(4):375-380.
[23]LEI Y,POH K K.Enhancing endothelial progenitor cell for clinical use[J].世界干细胞杂志:英文版(电子版),2015,7(6):894-898.
[24]SAMBATARO M,SEGANFREDDO E,CANAL F,et al.Prognostic significance of circulating and endothelial progenitor cell markers in type 2 diabetic foot[J].Int J Vasc Med,2014(2014):589412.
[25]徐中山.盐敏感性高血压患者血压波动情况与昼夜尿钠排泄量的临床观察[J].心脑血管病防治,2015,15(4):281-283.
[26]孙荣,易东,谈世进,等.性激素对卵巢切除自发性高血压大鼠心脏组织结构的影响[J].山东医药,2016,56(17):31-33.
[27]田孝东.血府逐瘀汤联合西药对老年高血压45例患者心室重构状态的影响观察[J].中国医药指南,2015,13(20):224-225.
[28]贾芳芳.盐敏感性高血压[J].人人健康,2013,32(21):39.
[29]韩珏,李祖胜,范敏华.社区成年人盐敏感性高血压的影响因素研究[J].中国全科医学,2015,18(34):4196-4201.
[30]申风娟,王腾飞,王越淇,等.盐敏感性高血压及其易感基因相关性的研究进展[J].中国老年学杂志,2015,35(16):4730-4731.
[31]牟建军,张涛,方媛,等.血压盐敏感者早期血管内皮功能改变研究[J].中华心血管病杂志,2011,39(1):61-64.
[32]MU J J,ZHANG T,FANG Y,et al.Vascular endothelial function in salt sensitive and non-salt sensitive subjects[J].Zhonghua Xin Xue Guan Bing Za Zhi,2011,39(1):61-64.
[33]沈玉婧,曾伟芳,李华,等.血醛固酮水平与高血压患者靶器官损害的关系[J].诊断学理论与实践,2012,11(6):576-579.
[34]刘叶舟,武晶晶,张玲,等.原发性高血压患者盐敏感性的影响因素和急性盐负荷后血压及钠钾代谢的变化[J].中华心血管病杂志,2013,41(12):1015-1019.
[35]JBS3 Board.Joint British Societies′ consensus recommendations for the prevention of cardiovascular disease (JBS3)[J].Heart,2014(2):ii1-67.
[36]KHALESI S,SUN J,BUYS N,et al.Effect of probiotics on blood pressure:a systematic review and meta-analysis of randomized,controlled trials[J].Hypertension,2014,64(4):897-903.
[37]LYNCH A I,TANG W,SHI G,et al.Epistatic effects of ACE I/D and AGT gene variants on left ventricular mass in hypertensive patients: the HyperGEN study[J].J Hum Hypertens,2012,26(2):133-140.
[38]GU D,KELLY T N,HIXSON J E,et al.Genetic variants in the renin-angiotensin-aldosterone system and salt sensitivity of blood pressure[J].J Hypertens,2010,28(6):1210-1220.
[39]YOSHINAGA M,TODA N,TAMURA Y,et al.Japanese traditional miso soup attenuates salt-induced hypertension and its organ damage in Dahl salt-sensitive rats[J].Nutrition,2012,28(9):924-931.
[40]GILDEA J J,LAHIFF D T,SCIVER R E V,et al.A linear relationship between the ex-vivo sodium mediated expression of two sodium regulatory pathways as a surrogate marker of salt sensitivity of blood pressure in exfoliated human renal proximal tubule cells:the virtual renal biopsy[J].Clin Chim Acta,2013(421):236-242.
[41]WADEI H M,TEXTOR S C.The role of the kidney in regulating arterial blood pressure[J].Nat Rev Nephrol,2012,8(10):602-609.
[42]朱桂平,王卓,林忠伟,等.MMP-9/TIMP-1在自发性高血压大鼠左室重构中的表达及血脂康胶囊的调控作用[J].中国老年学杂志,2015,35(11):2946-2949.
[43]KAMEZAKI F,TSUTSUI M,TAKAHASHI M,et al.Plasma levels of nitric oxide metabolites are markedly reduced in normotensive men with electrocardiographically determined left ventricular hypertrophy[J].Hypertension,2014,64(3):516-522.
(本文编辑:李洁晨)
Impact of Endothelial Progenitor Cells Transplantation on Myocardial Remodelling of Salt-sensitive Hypertensive Rats
QIQin,FANGHan-jun,LIFeng-hua,XUCheng,LIUFu-qiang,MVJian-jun,LIANQiu-fang.
DepartmentofCardiacVascularSurgery,XianyangHospitalofYan′anUniversity,Xianyang712000,China
LIANQiu-fang,DepartmentofCardiology,XianyangHospitalofYan′anUniversity,Xianyang712000,China;E-mail:314126474@qq.com
ObjectiveTo investigate the impact of endothelial progenitor cells(EPCs)transplantation on myocardial remodelling of salt-sensitive hypertensive rats.MethodsFrom January 2015 to February 2016,this experiment was carried out in the laboratory of Shaanxi Medical Laboratory Animal Center.A total of 66 salt-sensitive Dahl rats were selected and divided into A group,B group and C group according to random number table,each of 22 rats.Rats of A group were fed with 0.3% sodium chloride diet,rats of B group and C group were fed with 0.9% sodium chloride diet,meanwhile rats of C group received caudal vein injection of CM-Dil marked EPCs;rats of the three groups were continuously fed for 6 weeks.Cellular forms of the third generation of EPCs were observed,index of myocardial remodelling (anterior wall thickness,posterior wall thickness,LVDd,LVDs,FS and LVEF),number of new blood capillary,gene expression and protein expression of VEGF and CXCL16 were compared among the three groups,CM-Dil marked cells and incidence of myocardial fibrosis were observed.ResultsThe third generation of EPCs growed quickly with high-purity and single-form.Anterior wall thickness,FS and LVEF of A group and C group were statistically significantly higher than those of B group,while LVDs and LVDd of A group and C group were statistically significantly lower than those of B group(P<0.05);anterior wall thickness,FS and LVEF of C group were statistically significantly higher than those of A group,while LVDs of C group was statistically significantly lower than that of A gruop(P<0.05).Number of new blood capillary of A group and C group was statistically significantly more than that of B group,respectively(P<0.05),meanwhile number of new blood capillary of C group was statistically significantly more than that of A group(P<0.05).Relative expression quantity of VEGF mRNA of A group and C group was statistically significantly higher than that of B group,respectively,while relative expression quantity of CXCL16 mRNA of A group and C group was statistically significantly lower than that of B group,respectively(P<0.05);relative expression quantity of VEGF mRNA of C group was statistically significantly higher than that of A group,while relative expression quantity of CXCL16 mRNA of C group was statistically significantly lower than that of A group(P<0.05).Relative expression quantity of VEGF protein of A group and C group was statistically significantly higher than that of B group,respectively,while relative expression quantity of CXCL16 protein of A group and C group was statistically significantly lower than that of B group,respectively(P<0.05);relative expression quantity of VEGF protein of C group was statistically significantly higher than that of A group,while relative expression quantity of CXCL16 protein of C group was statistically significantly lower than that of A group(P<0.05).CM-Dil marked positive cells were detected in C group,but not in A group or B group.No rat of A group found myocardial fibrosis,while rats of B group and C group found varying degrees of myocardial fibrosis,and the degree of myocardial fibrosis of C group was statistically significantly milder than that of B group,with less macrophages infiltration.ConclusionEPCs transplantation can delay the myocardial remodelling of salt-sensitive hypertensive rats,increase the myocardial blood capillary,up-regulate the gene expression and protein expression of VEGF,down-regulate the gene expression and protein expression of CXCL16,is helpful to reduce the incidence of myocardial fibrosis.
Hypertension;Rats,inbred Dahl;Stem cells;Ventricular remodeling
国家自然科学基金(81070218);陕西省自然科学基础研究计划(2016JM8123)
712000陕西省咸阳市,延安大学咸阳医院心脏大血管外科(漆秦,方汉军,李锋华,许成),心内科(廉秋芳);陕西省人民医院心内科(刘富强);西安交通大学第一附属医院心血管内科(牟建军)
廉秋芳,712000陕西省咸阳市,延安大学咸阳医院心内科;E-mail:314126474@qq.com
R 544.1
A
10.3969/j.issn.1008-5971.2016.08.003
2016-06-07;
2016-08-10)
【编者按】亚洲人群为盐敏感性高血压高发人群,中国北方地区较南方地区多见;据统计,我国高血压患者约占总人口数的20%,其中盐敏感性高血压约占50%。盐敏感性高血压患者血压波动较大,易导致心、脑、肾等脏器功能损伤,且长时间血压升高会增加心脏前后负荷,造成血流动力学及神经-内分泌调节异常,进而引发心肌重构,严重影响患者身体健康,甚至会威胁患者生命安全。近年来,随着对干细胞研究的深入,干细胞移植修复受损心肌细胞为心肌重构的治疗提供了新方法。漆秦等所在课题组在既往研究基础上通过建立盐敏感性高血压大鼠模型而探讨内皮祖细胞(EPCs)移植对其心肌重构的影响,结果表明移植EPCs可改善盐敏感性高血压大鼠心肌重构,减少心肌纤维化的发生,具有一定临床参考价值,敬请关注!
