壬苯醇醚-9诱导小型猪阴道黏膜免疫炎症反应模型的建立
2016-10-06弓艺涓王玉柱夏敏杰职瑞娜丁训诚周新初李卫华上海市计划生育科学研究所国家计划生育药具重点实验室上海20002复旦大学公共卫生学院上海20002上海交通大学农业与生物学院上海200
黄 超, 弓艺涓, 田 芳, 王玉柱, 孙 冰,2, 夏敏杰, 职瑞娜,2, 丁训诚, 周新初, 李卫华(. 上海市计划生育科学研究所, 国家计划生育药具重点实验室, 上海 20002;2. 复旦大学公共卫生学院, 上海 20002; . 上海交通大学农业与生物学院, 上海, 200)
·论著·
壬苯醇醚-9诱导小型猪阴道黏膜免疫炎症反应模型的建立
黄超1, 弓艺涓1, 田芳1, 王玉柱1, 孙冰1,2, 夏敏杰1, 职瑞娜1,2, 丁训诚1, 周新初3, 李卫华1
(1. 上海市计划生育科学研究所, 国家计划生育药具重点实验室, 上海 200032;2. 复旦大学公共卫生学院, 上海 200032; 3. 上海交通大学农业与生物学院, 上海, 201101)
目的探索建立广西巴马小型猪阴道黏膜免疫炎症反应模型的方法。方法将6只雌性小型猪随机分为基质对照组和壬苯醇醚-9(N-9)模型组(40 mg/mL)(每组3只)。肌肉注射苯甲酸雌二醇12 d后,各组阴道给药5 mL/d,连续7 d。造模后取阴道黏膜组织进行病理检查,并根据上皮溃疡、坏死、细胞浸润、出血、充血、水肿等指标进行病理评分; 造模后24 h与72 h,采集阴道灌流液(CVL), 采用流式细胞术对CVL沉淀细胞中的中性粒细胞比例和CD45+细胞百分率进行分析; 免疫组织化学法(IHC)检测阴道黏膜组织中CD45+细胞的表达及分布。结果组织病理学观察显示,N-9模型组阴道黏膜上皮损伤明显,出现不同程度的溃疡、坏死、炎性浸润、出血、水肿等。病理评分结果显示,N-9模型组病理总分值(18.0±3.2)与基质对照组(3.3±0.2)相比明显升高(P<0.01)。N-9 模型组CVL的中性粒细胞比例为41.70%±1.63% (24 h)和51.17%±3.81% (72 h), CD45+细胞比例为58.5%±4.73%(24 h)和88.0%±3.57 %(72 h),与基质对照组相比均显著增高(P<0.01)。N-9模型组阴道黏膜CD45+细胞表达明显增多,累积光密度值为33.95± 6.69,显著高于基质对照组(23.42±3.30)(P<0.05)。结论阴道连续给予N-9凝胶7 d可以诱发小型猪阴道黏膜明显的炎性反应,符合阴道黏膜免疫炎症反应模型的特征。
小型猪; 壬苯醇醚-9(N-9); 病理组织学; 阴道灌流液(CVL); 免疫炎症反应;白细胞共同抗原CD45
美国食品药品监督管理局(FDA)推荐的家兔阴道刺激性模型(RVI)是评价阴道外用药物的局部黏膜刺激性的经典模型[1]。然而, 随着抗人类免疫缺陷病毒(HIV)阴道杀微生物剂的研发, 对阴道外用药物的临床前安全性评价指标提出了新的要求, 需要特别关注阴道黏膜炎症因子和免疫细胞的活化情况[2]。因此亟需探索更为适宜的用于评价阴道黏膜炎症反应的动物模型[3]。
目前,评价抗HIV阴道杀微生物剂的动物模型主要有三类: 小鼠单纯疱疹2病毒(HSV-2)感染模型[4]、家兔阴道刺激性模型[5]和非人灵长类模型。Patton等[6]利用非人灵长类模型对28种候选阴道杀微生物剂进行了安全性评价。考虑到非人灵长类动物昂贵的价格和有限的资源, 除猴模型外, 国外有报道采用小型猪模型代替短尾猴模型来评价候选药物对阴道黏膜的促炎症作用,检测阴道免疫细胞活化状态和细胞因子释放[7,8]。由于小型猪和人类的生殖道在组织学、亚细胞结构甚至渗透性方面都非常相似, 有望成为一种阴道免疫炎症评价模型[9]。
壬苯醇醚-9(N-9)是一种非离子型表面活性剂,是目前使用最普遍的一种外用杀精子药物。本研究选择广西巴马小型猪作为阴道黏膜免疫炎症反应研究的实验动物, 经阴道连续给予N-9(200 mg/d)7 d 后, 观察小型猪阴道组织病理损伤、阴道粘膜炎性细胞数目以及免疫细胞活化程度的变化, 探讨N-9诱导小型猪阴道黏膜免疫炎症反应模型的特征。
1 材料与方法
1.1实验动物、试剂与主要仪器
普通级成年雌性广西巴马小型猪6只, 35~40 kg,购自上海浦东新区华新物种实验动物养殖场[SCXK沪)2012-0013]。饲养于上海交通大学普通级动物房[SYXK(沪)2011-0128],温度22~28 ℃, 12 h/12 h明暗周期; 动物食用标准颗粒饲料,自由饮水[动物实验伦理审查编号: 2013-26]。
N-9胶冻剂40 mg/g(中国药科大学制药有限公司,国药准字H10930102); 苯甲酸雌二醇注射液(上海通用药业股份有限公司); 兔抗猪CD45多抗抗体美国Abcame公司); FITC标记的CD45单克隆抗体美国BD公司); SA1022-兔IgG 链霉亲和素生物素过氧化物酶复合物(SABC)免疫组织化学染色试剂盒[带二氨基联苯胺(DAB)显色液](武汉博士德生物公司); BA1003抗体(武汉博士德生物公司)。
FACS Calibur型荧光分选细胞仪, FORTESSA型流式细胞仪(美国BD公司); Olympus BX43型生物显微镜(日本Olympus公司); Leica RM2235石蜡切片机(德国Leica公司)。
1.2模型制备及动物分组
雌性小型猪6只, 购入后适应环境10 d, 根据本课题组有关黏膜刺激性试验的分组及给药量要求, 按体质量随机分成2组: 基质对照组(给予无药热敏凝胶5 mL/d); N-9 模型组(200 mg/d), 每组3只。给药前所有小型猪肌肉注射苯甲酸雌二醇400 μg/kg,肌肉注射后的12 d开始阴道给药(以小型猪的发情期约8~10 d推算)5 mL/d,连续给药7 d。末次给药后72 h处死动物取阴道黏膜进行HE染色检查评分,按照D’Cruz等[10]的方法, 采用基质对照组的平均分值 ()和标准差(s)95%参考值(±1.64 s)作为判定该药是否可被临床接受的标准, 确定造模是否成功。
1.3阴道黏膜组织病理学检查
末次给药72 h后处死,解剖取完整阴道组织,纵向切开,肉眼观察是否充血,水肿等异常表现,然后用体积分数10%中性缓冲甲醛固定、包埋、切片,HE染色进行组织病理学检查。
阴道黏膜刺激性试验组织病理学评分标准如下:按照D’Cruz等提出的小型猪阴道刺激性试验方法和标准, 通过对阴道黏膜上皮细胞病变(溃疡/坏死)、炎症细胞浸润,黏膜固有层、血管和周围组织的充血、出血和水肿几个方面半定量计分来反映刺激的严重程度,用无变化“0”、轻微“1”、温和“2”、中等“3”、严重“4”,五个等级表示,总分为3 2分。
1.4流式细胞术检测阴道灌流液(CVL)中的中性粒
细胞比例
末次给药后24 h和72 h用10 mL无菌磷酸盐缓冲液(PBS)(pH 7.2)对各组小型猪进行阴道灌洗,收集CVL。300×g离心5 min,1.0 μmL PBS(含1%庆大霉素)重悬沉淀,-20 ℃保存。用流式细胞仪检测,应用CellQuest多功能分析软件,计数10 000个CVL沉淀细胞。FlowJo软件计算各门的中性粒细胞、淋巴细胞和单核细胞占检测细胞总数的百分比(%)。
1.5流式细胞术检测CVL中CD45+细胞比例
调节CVL沉淀细胞浓度约至5×106/mL, 加入1 000倍稀释的兔抗猪CD45+多抗, 4 ℃放置30 min,以300×g, 离心5 min, 去上清后, 加入FITC标记的二抗,混合置于暗处, 室温孵育15 min后, 用流式细胞仪检测, 结果用CD45+细胞百分率(%)表示。
1.6免疫组织化学法检测CD45+在阴道黏膜中表达
石蜡切片常规脱蜡,水化,微波加热进行抗原热修复,体积分数3%H2O2灭活内源性过氧化物酶活性,滴加100倍稀释的兔抗CD45+多抗,4 ℃过夜,按照SA1022-兔IgG SABC免疫组织化学染色试剂盒说明操作,DAB室温显色,苏木素轻度复染, 脱水, 透明, 封片后镜检, 在20×物镜下所选视野内用Image-Proplus 6.0病理图像分析软件定位,锁定浏览框, 测定框内CD45+表达累积光密度值。
1.7统计分析方法
2 结果
2.1阴道黏膜组织病理学结果
与基质对照组(图1A)的阴道黏膜上皮细胞层相比, N-9模型组(图1B)的部分黏膜上皮发生溃疡、坏死以及炎性细胞浸润。与基质对照组阴道固有层(图1C, 1E)相比, N-9模型组(图1D, 1F)可见多量中性粒细胞(Gra)、单核细胞浸润、毛细血管充血、出血。

表1 小型猪阴道黏膜刺激性评分结果
2.2组织病理学评分结果
各处理组观察6张病理切片,分别记录评分。由表1可见,基质对照组病变总分值为3.3±0.2,N-9 模型组总分值明显升高为18.0±3.2(P<0.01)。
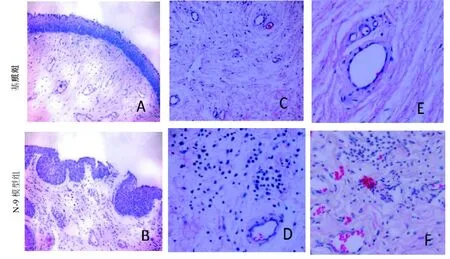
图1 小型猪阴道黏膜HE染色结果
2.3CVL沉淀细胞中Gra比例
由图2和表2可见,给药前各处理组小型猪CVL沉淀细胞中,Gra极少(图2A、2D),组间无明显差异(P>0.05)。在末次给药后24 h,与基质对照组相比,N-9模型组Gra细胞比例明显升高(图2B和2E)(P<0.01)。末次给药后72 h,与基质对照组相比,N-9模型组Gra细胞比例仍保持很高水平(图2C和2F)(P<0.01)。

表2 各处理组不同时间CVL液的中性粒细胞百分率 %
2.4CVL沉淀细胞中CD45+细胞百分率
图3A显示,给药前小型猪CVL中CD45+细胞占27.4%; 而末次给药后24和72 h CD45+细胞百分率分别可升高到55.1%和87.5%(图3B和3C)。对各处理组CVL中CD45+细胞百分率进一步分析(表3),两组小型猪给药前CVL中CD45+细胞百分率无显著性差异(P>0.05); 在末次给药后24 h和72 h, N-9模型组CVL中CD45+细胞百分率均明显升高(P<0.01)。
2.5阴道黏膜组织中CD45+的定位表达
末次给药72 h后,基质对照组CD45+细胞有少量表达,主要位于黏膜固有层,呈颗粒状或点状,而在黏膜上皮表达极少(图4A); N-9 模型组可见大量CD45+细胞,集中表达于黏膜上皮,染色深且密度高(图4B)。采用Image-Pro Plus图像分析软件, 测定各处理组累积光密度值表明, N-9模型组CD45+细胞表达的累积光密度值(33.95±6.69),显著高于基质对照组(23.42±3.30)(P<0.05)。

图2 小型猪阴道灌流液的流式细胞术细胞分析

图3 小型猪阴道灌流液沉淀细胞CD45+细胞FACS分析典型直方图(BD FITC标记CD45抗体)
3 讨论

表3 不同时间各处理组小型猪CVL液CD45+细胞百分率 %
本研究探讨了运用小型猪建立阴道外用药物的阴道黏膜免疫炎症反应模型,用以评价新型阴道外用药物是否会导致阴道黏膜刺激性及免疫炎症反应。女性生殖道外用药物包括外用避孕药、抗HIV性途径传播的杀微生物剂、阴道防御增强剂如益生菌制剂、阴道润滑剂、以及生殖道抗感染药物等,品种众多,应用广泛。
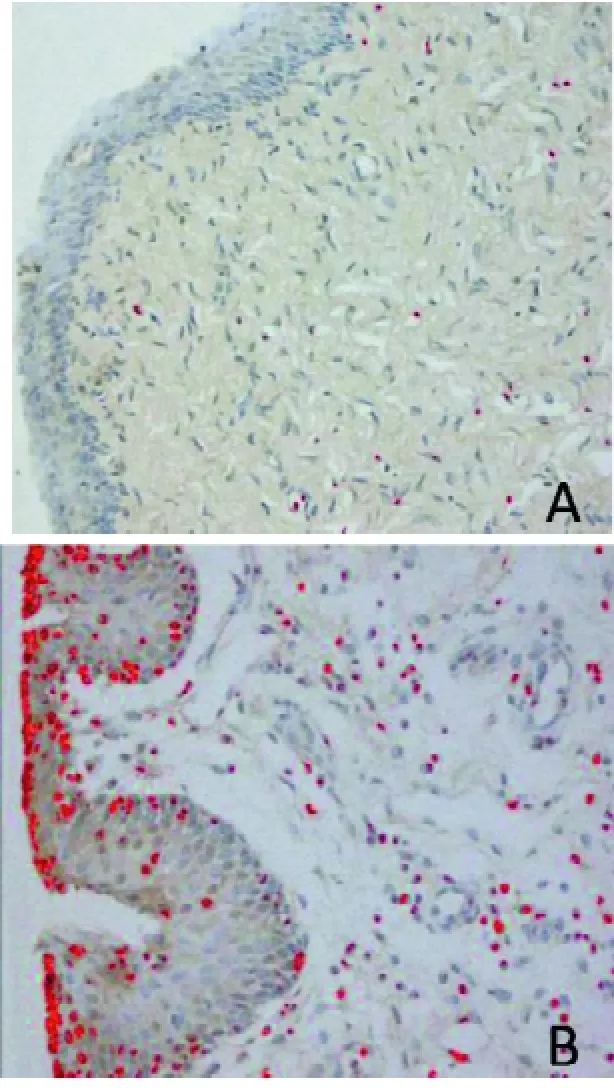
图4 小型猪阴道黏膜CD45表达结果
兔阴道刺激模型是用于评价生殖道外用药物局部安全性的经典模型[1]。本研究对传统的兔阴道刺激模型进行了改进[11],运用小型猪,在原有病理和解剖学检测指标的基础上,增加了分子水平上的检测, 这样不仅能够反映出黏膜的炎症情况,而且对免疫系统的激活情况可以有更全面的了解。
本研究结果显示, 阴道给予40 mg/mL N-9凝胶连续7 d,N-9模型组可见部分黏膜上皮发生溃疡、坏死以及炎性细胞浸润; 阴道黏膜固有层可见多量Gra、单核细胞浸润、毛细血管充血、出血; 半定量病理评分提示N-9模型组分值显著高于基质对照组,提示小型猪阴道黏膜免疫炎症反应模型造模成功。
国外研究[12]证实, N-9能引起阴道黏膜上皮的损伤和严重的组织炎症反应,激活白介素-1(IL-1)的分泌和核因子-κβ(NF-κβ)的转录,从而导致细胞因子(IL-1,IL-6和TNFα)和趋化因子(IL-8、IL-10和吞噬细胞炎症蛋白)等的释放,大量炎症细胞(特别是Gra和CD45+细胞)涌入阴道灌洗液中。CVL中的上述成分的升高与阴道黏膜损伤、免疫炎症反应甚至HIV感染增加可能相关。本研究结果显示,在末次给药后24 h,与基质对照组相比,N-9模型组CVL中性粒细胞比例明显升高。
采用免疫组织化学技术检测白细胞共同抗原(leuckocyte common antigen, LCA)-CD45在小型猪阴道黏膜的表达, 可以直观地观察到阴道黏膜炎性细胞的分布和免疫细胞的活化情况。若CD45+细胞表达较多则提示该部位的免疫炎症反应明显, 候选药物的局部刺激性明显。本研究中CD45+细胞免疫组织化学结果表明, 基质对照组阴道黏膜上皮呈现少量散在CD45+细胞, 而N-9 模型组CD45+细胞在黏膜上皮层大量表达。本研究中流式细胞仪检测结果亦提示CVL中CD45+细胞百分率显著升高, 该结果与国外报道一致[13]。
综上所述, 本研究采用广西巴马小型猪阴道黏膜免疫炎症反应模型, 通过流式细胞术、免疫组化与病理学观察相结合的检测方法, 检测CVL中的中性粒细胞比例、CD45+细胞分析以及阴道组织病理改变和组织黏膜中CD45免疫定位表达, 结果均提示N-9诱导阴道黏膜组织的炎症反应, 破坏了黏膜上皮屏障的完整性, 活化了大量免疫细胞, 显现出小型猪可作为免疫炎症反应模型的潜在特点, 证实小型猪可成为一种良好的阴道免疫炎症评价模型。本研究中关于阴道黏膜免疫炎症反应的检测指标, 对拟定阴道杀微生物剂临床前安全性评价体系具有一定的参考价值。今后, 还需进一步探索建立能客观全面评价抗HIV阴道杀微生物剂安全性的小型猪模型。
[1]Thompson IO, van der Bijl P, van Wyk CW, et al. A comparative light-microscopic, electron-microscopic and chemical study of human vaginal and buccal epithelium[J]. Arch Oral Biol, 2001, 46(12):1091-1098.
[2]Davis CC, Kremer MJ, Schlievert PM, et al. Penetration of toxic shock syndrome toxin-1 across porcine vaginal mucosa ex vivo: permeability characteristics, toxin distribution, and tissue damage[J]. Am J Obstet Gynecol, 2003, 189(6):1785-1791.
[3]D’Cruz OJ, Erbeck D, Uckun FM. A study of the potential of the pig as a model for the vaginal irritancy of benzalkonium chloride in comparison to the nonirritant microbicide PHI-443 and the spermicide vanadocene dithiocarbamate[J]. Toxicol Pathol, 2005, 33(4):465-476.
[4]Wikinson D, Tholandi M, Ramjea G, et al. Nonoxynol-9
Apermicide for prevention of vaginally acquired HIV and other sexually transmitted infections: sgstematic review and meta-analgsis of randomized controlled trials including more than 5000 women[J]. Lancet Infect Dis, 2002, 2(1):613-617.
[5]Obiero J, Mwethera PG, Hussey GD, et al. Vaginal microbicides for reducing the risk of sexual acquisition of HIV infection in women: systematic review and meta- analysis[J]. BMC Infect Dis, 2012, 12(5):289-310.
[6]Patton DL, Cosgrove SY, Paul KJ. A summary of preclinical topical microbicide vaginal safety and chlamydial efficacy evaluations in a pigtailed macaque model[J]. Sex Transm Dis, 2008, 35(10):889-897.
[7]Peuster M, Fink C, Reckers J, et al. Assessment of subacute inflammatory and proliferative response to coronary stenting in a porcine model by local gene expression studies and histomorphometry[J]. Biomaterials, 2004, 25(6):957-963.
[8]Catalone BJ, Kislr-Catalone TM, Budgeon LR, et al. Mouse model of cericoraginal toxicity and inflammation for preclinical eraluation of topical vaginal microbicides[J]. Antimicrob Agents Chemother, 2004, 48(5):1837-1847.
[9]Lard-Whiteford SL, Matecxcka D, O'Rear JJ, et al. Recommendations for the nonclinical development of topical microbicides for prevention of HIV transmission: an update[J]. J Acquir Immune Defic Syndr, 2004, 36(1):541-552.
[10] D’Cruz OJ, Uckun FM. Preclinical evaluation of a dual-acting microbicidal prodrug WHI-07 in combination with vanadocene dithiocarbamate in the female reproductive tract of rabbit, pig, and cat[J]. Toxicol Pathol, 2007, 35(7):910-927.
[11] Doncel GF, Chandra N, Fichorova RN. Preclinical assessment of the proinflammatory potential of microbicide candidates[J]. J Acquir Immune Defic Syndr, 2004, 37 (Suppl 3):S174-S180.
[12] Zalenskaya IA, Cerocchi OG, Joseph T, Donaghay MA, et al. Increased cox-2 expression in human vaginal epithelial cells exposed to nonoxynol-9, a vaginal contraceptive microbicide that failed to protect women from HIV-1 infection[J]. Am J Reprod Immunol, 2011, 65(2):569-577.
[13] Cummins JE, Doncel GF. Biomarkers of cervicovaginal inflammation for the assessment of microbicide safety[J]. Sex Transm Dis, 2009, 36(3 Suppl):S84-S91.
Establishment of Vaginal Mucosal Immunoinflammatory Response Model in Minipig
HUANG Chao1, GONG Yi-juan1, TIAN Fang1, WANG Yu-zhu1, SUN Bing1,2, ZHI Rui-na1,2, XIA Min-jie1, DING Xun-cheng1, ZHOU Xin-chu3, LI Wei-hua1
(1. State Key Lab of Family Planning Drugs and Devices, Shanghai Institute of Planned Parenthood Research, Shanghai 200032, China; 2. School of Public Health, Fudan University, Shanghai 200032;3. Shanghai Jiao Tong University School of Agriculture and Biology, Shanghai 201101, China)
ObjectiveTo establish the vaginal mucosal immuno-inflammatory model response of minipig. MethodsSix female minipigs were randomly divided into the control and Nonoxynol-9 (N-9)model group (40 mg/mL). After 12 days of estradiol benzoate intramuscular injection, the test drugs (N-9)were administered through vagina to minipigs at 5 mL/d for 7 consecutive days. On the 7th day, histopathological examination of vaginal mucosa was undertaken and the pathological scores were calculated based on histological indexes including epithelial ulceration/erosion, necrosis, cell infiltration, hemorrhage, congestion and edema. Cervicovaginal lavage (CVL) was collected at 24 h and 72 h after drug administration. The percentage of neutrophilic granulocytes and CD45+cells in the CVL deposited cells were detected by flow cytometry. The expression and location of CD45+cells in the vaginal mucosa were assessed by using immuno-histochemical (IHC) assay. ResultsHistopathological examination showed obvious lesions including inflammation, bleeding and edema in the vaginal epithelium of the N-9 group. Histological score of the N-9 group (18.0±3.2) was significantly higher than that of the control (3.3±0.2)(P<0.01). The percentage of neutrophilic granulocytes in the CVL cells of N-9 group was (41.70±1.63)% (24 h) and (51.17±3.81)% (72 h), and the percentage of CD45+cells in the CVL cells of N-9 group was (58.5±4.73) % (24 h) and (88.0±3.57)% (72 h), both showed significant increase compared to that of the control (P<0.01). CD45+cell expression increased significantly in the N-9 group. The IOD value of N-9 group was 33.95±6.69, which was significantly higher than that of the control group (28.42±8.96)(P<0.05). ConslusionThe vaginal mucosal immuno-inflammatory response model of mini-pigs could be induced by giving 40 mg/mL N-9 gel to the mini-pigs through vagina for 7 consecutive days.
Minipig; Nonoxynol-9 (N-9); Histopathology; Cervicovaginal lavage(CVL);Immuno-inflammation response; Leuckocyte common antigen-CD45
Q95-33
A
1674-5817(2016)02-0081-06
10.3969/j.issn.1674-5817.2016.02.001
2015-12-07
国家科技重大专项(2013ZX10001006-003-002); 国家科技重大专项(2012ZX10001007-009-003); 十二五国家科技支撑计划(2012BAI31B04); 上海市科委项目(13431900800)
黄超, 男, 本科, 主要从事新药研发及生殖药理评价研究。E-mail: 553026696@qq.com共同第一作者, 弓艺涓, 女, 硕士, 主要从事药物研发。E-mail: gongyijuan@126.com
李卫华, 女, 博士, 研究员, 主要从事生殖毒理和药物安全评价研究。E-mail: iamliwehua@foxmail.com
