大孔吸附树脂纯化薄荷总黄酮工艺优选
2016-09-28刘雪辉张思张志旭康信聪李坚谢红旗4刘东波
刘雪辉张 思张志旭康信聪李 坚谢红旗,3,4刘东波,3,4
(1. 湖南农业大学园艺园林学院,湖南 长沙 410128;2. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;3. 湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128;4. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
大孔吸附树脂纯化薄荷总黄酮工艺优选
刘雪辉1,2张思1,2张志旭1,2康信聪1,2李坚2谢红旗1,2,3,4刘东波1,2,3,4
(1. 湖南农业大学园艺园林学院,湖南 长沙410128;2. 国家中医药管理局亚健康干预技术实验室,湖南 长沙410128;3. 湖南省作物种质创新与资源利用重点实验室,湖南 长沙410128;4. 国家植物功能成分利用工程技术研究中心,湖南 长沙410128)
以吸附—解吸率和总黄酮含量为考察指标,采用静态和动态吸附两种方法,进行大孔吸附树脂纯化薄荷总黄酮工艺优选。试验考察ADS-7、ADS-17、NKA-9、AB-8、D101、HPD-100 六种大孔吸附树脂对薄荷总黄酮的纯化能力。结果表明:AB-8对薄荷总黄酮吸附与分离性能最佳,确定纯化薄荷总黄酮的最佳工艺条件为:流速1 mL/min,上样液中薄荷总黄酮质量浓度为2.56 mg/mL,上样量3 BV,解析液为4 BV 30%乙醇,最终得到含量90.35%的薄荷总黄酮。上述工艺对薄荷总黄酮的分离高效、稳定、可靠,为薄荷资源的综合利用提供理论依据。
薄荷;黄酮;分离;吸附;解析
薄荷(MenthahaplocalyxBrip.)又称“银丹草”、“鱼香草”,为唇形科(Lamiaceae)薄荷属(GenusMentha)多年生药食两用草本植物[1]。
现代研究发现,薄荷含有机酸、黄酮、挥发油、萜类等化学成分,对消化、呼吸、神经中枢等生理系统的药理作用显著[2],其中的黄酮类物质具有较强的抗菌[3]、抗氧化[4-5]及抗肿瘤[6]能力,故被广泛应用于医药、食品、化妆品等行业[7-8]。薄荷总黄酮显著的生理活性催生了极大的市场需求,也对其产业化研究提出了更高的要求。传统的硅胶柱分离以及溶剂萃取方式存在有机溶剂用量大、溶剂残留等缺点,而制备色谱、高速逆流等分离方法也受到有机溶剂残留以及无法大规模产业化生产等弊端的限制[9-10],而现有的关于薄荷总黄酮产业化分离纯化方面的研究不多。钟昆芮等[11]采用聚酰胺树脂分离纯化了薄荷总黄酮,其方法虽然操作简单、重复性好,但所得薄荷总黄酮纯度仅达50%,在分离效果效率以及经济成本等方面稍有不足,无法满足其后续针对性的药理药效研究和市场推广的需求,制约了薄荷资源的综合开发利用。 大孔吸附树脂是一种可重复利用的新型分离材料,具有对目标组分针对性吸附能力强、分离方法简单、高效,溶剂无毒副作用等优点,常用于药用植物中活性化合物的分离[12],本研究拟通过对不同极性的树脂进行筛查,并结合工厂大生产设备条件,对薄荷总黄酮纯化工艺进行优化,旨在探索出绿色、高效、稳定、经济的适用于产业化大生产的工艺路线。
1 材料与方法
1.1材料与试剂
薄荷干燥茎叶:北京同仁堂药材公司;
芦丁标准品:含量>98%,中国药品生物制品检定所;
ADS-7树脂、ADS-17树脂、NKA-9树脂、AB-8树脂、D101树脂、HPD-100树脂:沧州宝恩吸附材料科技有限公司;
氢氧化钠、无水乙醇、硝酸铝:分析纯,国药集团上海化学试剂有限公司。
1.2主要仪器设备
紫外可见分光光度计:UV-1800型,岛津仪器(苏州)有限公司;
电子分析天平:Mettler Toledo XS205型,上海梅特勒—托利多仪器有限公司;
恒温培养震荡器:ZHWY-2102C型,上海合恒仪器设备有限公司;
旋转蒸发仪:RE-52型,上海雅荣生化仪器设备有限公司。
1.3方法
1.3.1上样液制备称取薄荷干燥茎叶500 g,加入60%乙醇置80 ℃恒温水浴锅中回流提取1.0 h,料液比分别为1∶10和1∶8(g/mL)提取2次,合并提取液,60 ℃真空浓缩回收乙醇至无醇味,加水分散溶解,定容至2 000 mL,采用亚硝酸钠—硝酸铝—氢氧化钠显色法测定提取液中黄酮含量[13],作为上样液备用。
1.3.2静态吸附与解析试验准确称取预处理好的ADS-7、ADS-17、NKA-9、AB-8、D101、HPD-100树脂各1.0 g,装入50 mL锥形瓶中,分别加入上样液25 mL,置恒温振荡摇床上(温度30 ℃,转速100 r/min)振荡吸附,每隔1 h吸取上层清液1 mL进行黄酮含量测定,按式(1)计算吸附量,优选出最佳吸附树脂。

(1)
式中:
X——吸附量,mg/g;
a——上样液中总黄酮浓度,mg/mL;
b——吸附后溶液中总黄酮浓度,mg/mL;
v——上样液体积,mL;
m——树脂质量,g。
将充分吸附薄荷总黄酮的大孔树脂过滤后分别加入25 mL 80%乙醇,置恒温振荡摇床上(温度30 ℃,转速100 r/min)振荡解吸24 h,充分解吸后取1 mL上层清液测定总黄酮含量,按式(2)、(3)计算解吸量和解吸率,并综合吸附率与解析率优选出最佳树脂型号进行动态吸附试验。

(2)

(3)
式中:
a——上样液中总黄酮浓度,mg/mL;
b——吸附后溶液中总黄酮浓度,mg/mL;
Y——解吸量,mg/g;
Z——解吸率,%;
c——解吸液中总黄酮浓度,mg/mL;
V——解吸液体积,mL;
1.3.3上样液浓度及上样量的筛选准确量取已预处理好的AB-8型大孔吸附树脂各30 mL湿法装柱,取一系列质量浓度(1.53,1.92,2.56,3.84 mg/mL)的上样液分别上柱,以流出液中黄酮浓度达到上样液中黄酮浓度的10%作为泄漏点,测定不同上样浓度下树脂的饱和吸附量,从而优先出最佳上样浓度及上样量。
1.3.4洗脱溶剂的筛选按上述确定的最佳吸附条件进行上样,先水洗至流出液无色,然后依次用10%,20%,30%,40%,50%,60%,70%,80%,90%,100%的乙醇各1 BV进行解析,流速1 mL/min,分别收集各段解析液进行黄酮含量检测,绘制洗脱曲线并优选出最佳洗脱溶剂。
1.3.5洗脱量的筛选选用上述确定好的洗脱溶剂,流速1 mL/min,分别用1,2,3,4,5,6 BV的溶剂进行解析,计算解析量,并绘制解析曲线并优选出最佳解析体积。
2 结果与分析
2.1不同树脂对薄荷黄酮的静态吸附量与解析率
ADS-7、ADS-17、NKA-9、AB-8、D101、HPD-100 六种吸附材料对薄荷黄酮的静态吸附量与解析量见表1,ADS-7树脂对薄荷黄酮的吸附量最大,AB-8树脂次之,但在静态解析试验中,AB-8树脂的解析率最高,达到63.57%,具有较好的吸附解析效果,而同样条件下ADS-7树脂对薄荷黄酮的死吸附较多以致解析率只有15.8%,推测可能是薄荷黄酮类化合物极性较强,根据“相似相吸引”原则,ADS-7树脂作为强极性树脂,与薄荷黄酮极性相似度较高,具有较强的吸附效应,从而形成了死吸附。而AB-8树脂相对极性较弱,在针对薄荷黄酮类化合物时能够达到一种较佳的吸附—解析效应,因此综合吸附量与解析率两个因素,最终选择AB-8树脂作为薄荷总黄酮的纯化填料。
2.2不同上样液浓度下树脂对薄荷总黄酮的吸附量
将薄荷提取浓缩液稀释至黄酮含量分别为3.84,2.56,1.92,1.53 mg/mL,以泄露点为终点进行最大吸附量测定,结果见图1。当薄荷黄酮浓度为2.56 mg/mL时,树脂对薄荷总黄酮的吸附量最大,随着浓度的减少,吸附量逐渐降低,而浓度增大也会导致泄露点提前而吸附量减少,且树脂容易堵塞。因此选择浓度为2.56 mg/mL的上样液进行上柱试验。
表1不同树脂对薄荷黄酮的静态吸附量与解析率
Table 1Static adsorption capacities and desorption rates of total flavonoids inMenthahaplocalyxby various macroporous adsorption resins

树脂名称极性吸附量/mg解析量/mg解析率%ADS-7强极性67.6210.6815.80ADS-17中极性41.8419.4746.54NKA-9极性 47.3024.3651.53AB-8弱极性48.5830.8863.57D101非极性47.2625.0352.96HPD-100非极性48.0328.4559.22
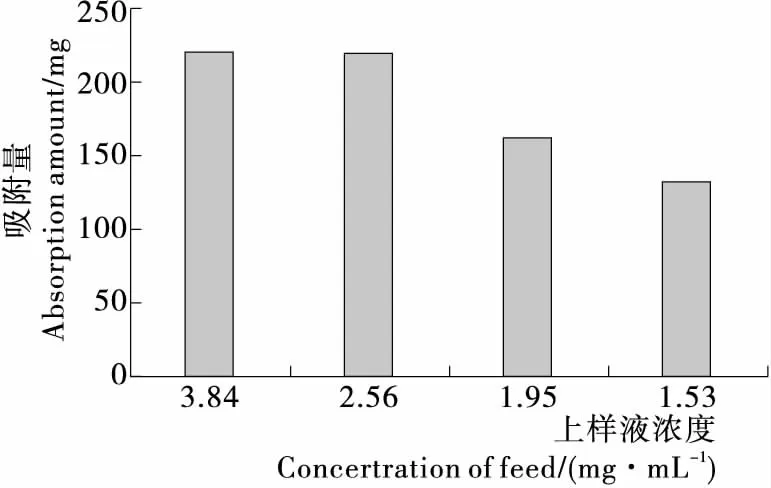
图1 不同上样液浓度下树脂对薄荷总黄酮的吸附量
2.3上样量的确定
按上述确定好的上样浓度进行上柱,分别接收各段上样流出液,检测其中黄酮含量,见图2,当上样量达到3 BV时,流出液中薄荷总黄酮浓度达到上样液浓度的10%,并且泄露量逐渐增大,参考前人[14]研究结果并综合薄荷原料价格、薄荷总黄酮产业化生产成本、品价格等经济因素,最终选择上样体积为3 BV。
2.4不同浓度的乙醇对薄荷总黄酮的解析率
如图3所示,随着醇浓度的增大,洗脱液中薄荷总黄酮的洗脱率也依次增大,当洗脱剂醇浓度达30%时,洗脱率达到了60%,继续增加乙醇浓度,洗脱率增加趋势减缓,且部分醇溶性杂质被洗脱下来而导致黄酮纯度降低(图4)。因此综合经济、效率等因素最终选择先用水洗除去多糖、蛋白质等杂质,再用体积分数为30%的乙醇作为洗脱剂,并考虑通过增加洗脱量来提高洗脱率。

图2 泄漏曲线

图3 乙醇梯度洗脱曲线

图4 乙醇梯度解析液中黄酮纯度
2.5洗脱溶剂用量的筛选
选择30%的乙醇作为洗脱溶剂,依次增加洗脱剂的用量,并分别接收每个BV的解析液,进行黄酮含量检测。由图5可知,当洗脱剂用量达到4 BV时,绝大部分黄酮已经被洗脱下来,因此选择4 BV的洗脱剂用量。

图5 洗脱剂用量与洗脱率的关系
3 结论
本试验通过静态吸附及解吸试验进行树脂型号的筛选,确定AB-8型树脂对薄荷总黄酮的吸附量较大且解析率最高,且AB-8树脂再生工艺简单、重复利用批次可达数百次,因此选择AB-8型树脂做后续动态吸附试验并优化其工艺参数,筛选出的最佳工艺条件为:上样浓度2.56 mg/mL,上样体积3 BV,水洗至流出液澄清透亮,再用4 BV 30%的乙醇
进行洗脱,洗脱率为79.49%,将解析液浓缩冷冻干燥,测得干粉中黄酮含量为90.35%。本试验建立的AB-8型大孔吸附树脂分离纯化薄荷总黄酮的工艺,具有绿色环保、操作简便、稳定可靠、高效经济等优点,适合大规模产业化生产。
[1] 中国药典编委会. 中国药典[S]. 2015版. 北京: 化学工业出版社, 2015: 377.
[2] 徐凌玉, 李振麟, 蔡芷辰, 等. 薄荷化学成分的研究[J]. 中草药, 2013, 44(20): 2 798-2 802.
[3] 吕爽, 田呈瑞, 韩莎莎. 薄荷属植物精油和多酚类的抑菌性及抗氧化性研究[J]. 食品与生物技术学报, 2011, 30(6): 827-831.
[4] SHE Gai-mei, XU Chao, LIU Bin, et al. Antioxidant activity of volatile oil from leaves of mentha haplocalyx briq[J]. Journal of Food Science, 2010, 75(4): 359-362.
[5] DONG Wen-jiang, NI Yong-nian, KOKOT S. A novel near-infrared spectroscopy and chemometrics method for rapid analysis of several chemical components and antioxidant activity of mint (Mentha haplocalyx Briq.) samples[J]. Appl Spectrosc, 2014, 68(2): 245-254.[6] 黄华艺, 查锡良. 黄酮类化合物抗肿瘤作用研究进展[J]. 中国新药与临床杂志, 2002, 21(7): 428-433.
[7] 吕燕柏, 王锡宁, 季萍. 保健食品中薄荷脑和冰片含量的测定方法研究[J]. 预防医学文献信息, 2003, 9(6): 677-679.
[8] 朱卫红, 许时婴, 江波. 微胶囊化薄荷油的制备及其热稳定性研究[J]. 食品与机械, 2006, 22(5): 32-39.
[9] 屠鹏飞, 贾存勤, 张洪全. 大孔吸附树脂在中药新药研究和生产中的应用[J]. 世界科学技术: 中医药现代化, 2004, 6(3): 22-28.[10] 黎海彬, 李小梅. 大孔吸附树脂及其在天然产物研究中的应用[J]. 广东化工, 2005, 32(3): 22-25.
[11] 钟昆芮, 张凡, 姜艳艳, 等. 薄荷总黄酮的纯化工艺优选[J]. 中国试验方剂学杂志, 2013, 19(6): 11-14.
[12] 于智峰, 王敏. 大孔吸附树脂在黄酮类化合物分离中的应用[J]. 中草药, 2006, 29(12): 1 380-1 383.
[13] 杜若源, 谢晶, 王婷, 等. 超声波辅助提取银杏叶中总黄酮的工艺优化[J]. 食品与机械, 2015, 31(1): 167-170.
[14] 方贺, 宋旺弟, 陈文. 大孔吸附树脂纯化黄花柳花总黄酮工艺研究[J]. 北方园艺, 2016(6): 120-124.
Optimization of purification technology for total flavonoids from Mentha haplocalyx by macroporous resin
LIU Xue-hui1,2ZHANGSi1,2ZHANGZhi-xu1,2KANGXin-cong1,2LIJian2XIEHong-qi1,2,3,4LIUDong-bo1,2,3,4
(1.CollegeofHorticultureandLandscape,Hunanagriculturaluniversity,Changsha,Hunan410128,China; 2.StateKeyLaboratoryofSubhealthInterventionTechnology,Changsha,Hunan410128,China; 3.HunanProvincialKeyLaboratoryofCropGermplasmInnovationandUtilization,Changsha,Hunan410128,China; 4.NationalresearchCenterofEngineeringTechnologyForUtilizationofFunctionalIngredientsFromBotanicals,Changsha,Hunan410128,China)
Based on the adsorption-desorption rate and the content of total flavonoids, static and dynamic adsorption methods were adopted to evaluate the purification ability of 6 macroporous resins, including ADS-7, ADS-17, NKA-9, AB-8, D101, and HPD-100, for purifying total flavonoids from ofMenthahaplocalyx. The results showed that AB-8 was adsorbed best among all the candidates. The optimum purification condition was as follows. The flow rate was 1 mL/min, and the loading volume of sample was 3 BV containing flavonoids 2.56 mg/mL in it, desorbed by 4 BV 30% ethanol. Finally, 90.35% total flavonoids fromMenthahaplocalyxwere obtained. The method above is characteristic of high separation efficiency, convenient operation and reliable stability. This study could provide theory support for the comprehensive utilization ofMenthahaplocalyx.
Menthahaplocalyx; flavonoids; separation; adsorp-tion; desorption
国家国际科技合作专项项目(编号:2013DFA31790)
刘雪辉,女,湖南农业大学在读硕士研究生。
刘东波(1970-),男,湖南农业大学教授,博士。
E-mail:chinasaga@163.com
2015—10—22
10.13652/j.issn.1003-5788.2016.08.038
