NADPH氧化酶在高脂诱导的MIN6胰岛β细胞损伤中的作用
2016-09-28鲍翠玉
李 晶,陈 丹,周 宇,鲍翠玉
(湖北科技学院1.糖尿病心脑血管病变湖北省重点实验室、2.护理学院,湖北 咸宁 437100)
NADPH氧化酶在高脂诱导的MIN6胰岛β细胞损伤中的作用
李晶1,陈丹1,周宇2,鲍翠玉2
(湖北科技学院1.糖尿病心脑血管病变湖北省重点实验室、2.护理学院,湖北 咸宁437100)
目的探讨NADPH氧化酶在高脂诱导的MIN6胰岛β细胞损伤中的作用。方法不同浓度(0.1、0.3、0.5、0.8 mmol·L-1) 高脂刺激MIN6胰岛β细胞(24、48、72、96 h) ,MTT法检测细胞增殖情况;免疫印迹法检测细胞内p22phox、p47phox、p67phox以及gp91phox等NADPH氧化酶亚基的表达水平及凋亡相关蛋白(Bcl-2及Bax)的表达水平。结果0.5 mmol·L-1高脂刺激MIN6胰岛细胞48 h 时,细胞增殖率出现明显下降;p22phox、p47phox、p67phox以及gp91phox等NADPH 氧化酶亚基和Bax的表达水平明显升高(P<0.05),而Bcl-2表达水平明显降低(P<0.05);NADPH氧化酶抑制剂 diphenyliodonium(DPI,10 μmol·L-1)预处理后并高脂刺激MIN6胰岛β细胞48 h,与高脂刺激组相比,DPI处理组细胞Bcl-2表达明显上升(P<0.05),Bax表达明显下调(P<0.05)。结论NADPH氧化酶活性对高脂引起的MIN6胰岛β细胞损伤的防治有重要意义。
NADPH氧化酶;高脂;MIN6;胰岛β细胞;Bcl-2;Bax
糖尿病是严重影响人类健康的一种内分泌紊乱,以往的研究表明[4],血糖代谢紊乱时通常伴随着活性氧(reactive oxygen species,ROS)产生过量导致的氧化应激,这种应激表现为机体氧化和抗氧化系统间的失衡,在胰岛β细胞功能的衰退中起着重要的作用[1]。因此通过抗氧化机制保护胰岛β细胞功能也是糖尿病治疗的策略之一。ROS作为NADPH氧化酶的催化产物,参与到体内多种防御和信息传递生理过程中,由于过度激活NADPH氧化酶,从而生成过多ROS,易导致氧化应激性损伤[2]。而对于胰岛细胞来说,致病因素包括糖毒性及脂毒性。尤其脂毒性对胰岛β细胞来说是个损伤性刺激[3],可使胰岛β细胞发生凋亡,其发病机制非常复杂,目前尚未完全阐明,且仅有一些少量文献中提到与NADPH氧化酶信号通路之间的相关性报道[5-8]。
基于此,本研究拟评价不同高脂刺激对MIN6胰岛β细胞的NADPH氧化酶体系及凋亡相关蛋白表达的影响,本研究首次较全面地分析了高脂刺激诱导的胰岛β细胞的损伤或凋亡与NADPH氧化应激通路之间的相关性,将为脂毒性胰岛损伤的防治提供新的思路。
1 材料与方法
1.1实验材料
1.1.1细胞系MIN6胰岛β细胞购自上海通派生物有限公司。
1.1.2主要试剂p22phox(sc-271968)、p47phox(sc-17844)、p67phox(sc-374510)以及gp91phox(sc-130543)抗体均购自美国Santa Cruz公司;Bcl-2(#15071)及Bax(#2772)抗体均购自美国CST公司;细胞培养相关高糖DMEM培养基(12100-046)及胎牛血清(16000-044)均购自美国 Gibco 公司。
1.1.3主要设备主要设备包括:超净工作台(苏州安泰空气技术公司) 、二氧化碳培养箱(德国贺利氏公司)、倒置相差显微镜(日本奥林帕斯公司)、紫外分光光度计(美国贝克曼公司)、多功能酶标仪(美国宝特公司)、高速冷冻离心机(德国Sigma公司)、电泳槽(美国伯乐公司)、电转膜仪(美国伯乐公司)、化学发光凝胶成像系统(英国Syngene公司)等。
1.2实验方法
1.2.1游离脂肪酸的配制用0.1 mol·L-1的NaOH溶液在70℃水浴中溶解一定量的棕榈酸(palmitic acid,PA),振荡混匀10 min,然后过滤,配成100 mmol·L-1的PA储存液。在55℃水浴中用去离子水配50 g·L-1的BSA溶液,过滤。然后将上述的PA溶液和BSA溶液按1 ∶19的体积比混合配成PA/BSA复合液,在水浴中振荡10 s后继续水浴10 min,取出后冷却至室温,过滤。然后将上述复合液分别用高糖DMEM培养基进行稀释。
1.2.2细胞培养MIN6细胞培养于高糖DMEM培养基(含有25 mmol·L-1葡萄糖, 10 mmol·L-1的丙酮酸钠,10 mmol·L-1的HEPES,2 mmol·L-1的L-谷氨酰胺,及55 μmol·L-1的β巯基乙醇,10 mL·L-1Antibiotic antimycotic)中,在37℃、5% CO2、饱和湿度的培养箱中静置培养。待细胞生长接近70%融合时,0.25% EDTA-胰酶消化、传代培养。取对数生长期细胞进行实验。
1.2.3实验分组① MIN6细胞分为:对照组(使用不含棕榈酸的高糖DMEM培养基),含0.1、0.3、0.5、0.8 mmol·L-1棕榈酸的高糖DMEM培养基刺激48 h组;② MIN6细胞分为:对照组(使用不含棕榈酸的高糖DMEM培养基)、含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激24、48、72、96 h 组;③ MIN6细胞分为:对照组(使用不含棕榈酸的高糖DMEM培养基)、含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激48 h组、NADPH氧化酶抑制剂diphenyliodonium(DPI)10 μmol·L-1预处理后用0.5 mmol·L-1棕榈酸刺激48 h组。
1.3检测指标
1.3.1MTT检测胰岛β细胞增殖率在96孔板中接种MIN6细胞悬液(每孔1×106cells,每孔100 μL)。将培养板放在培养箱预培养(在37℃,5% CO2的条件下)。实验结束后弃上清液,向每孔加入20 μL的MTT溶液(5 g·L-1),将培养板在培养箱内孵育4 h,用酶标仪测定在570 nm处的吸光度,设6个复孔。
1.3.2免疫印迹法检测细胞内蛋白表达水平各组胰岛细胞在37℃、5% CO2培养箱内培养24 h后,弃上清,PBS清洗细胞。每组加入80 μL细胞裂解液,冰上震荡裂解30 min后,采取重复刮动板底方法,将细胞刮净,收集到离心管中,进行离心(13 000 r·min-1,15 min),BCA法进行蛋白定量,取一定量的总蛋白于10%~12% SDS-PAGE凝胶上进行电泳分离,转膜后,经5%脱脂牛奶封闭1 h,根据不同抗体的效价,加入用TBST适当稀释的一抗4℃孵育过夜,TBST洗膜,二抗37℃孵育1 h,加入ECL荧光显影液,用化学发光凝胶成像系统检测p22phox、p47phox、p67phox以及gp91phox等NADPH 氧化酶亚基的表达水平及凋亡相关蛋白(Bcl-2及Bax)的表达水平。
2 结果
2.1高脂刺激对MIN6胰岛β细胞增殖率的影响Fig 1A结果说明,含0.1、0.3、0.5、0.8 mmol·L-1棕榈酸的高糖DMEM培养基刺激48 h后,高脂所致的胰岛细胞增殖率呈现浓度依赖性降低趋势,棕榈酸浓度在0.5 mmol·L-1时,开始明显降低(P<0.05),与棕榈酸浓度在0.8 mmol·L-1时,差异无显著性(P>0.05)。Fig 1B结果说明,含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激24、48、72、96 h 后,高脂所致的胰岛细胞增殖率呈现时间依赖性降低趋势,刺激时间在48 h时,开始明显降低(P<0.05),刺激时间在72 h及96 h时,差异无显著性(P>0.05)。
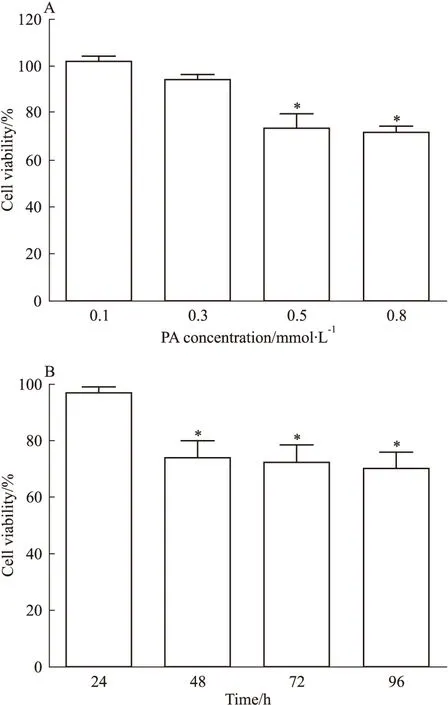
Fig 1 Influence of high palmitic acid on
*P<0.05vs0.1 mmol·L-1group (A) or 24 h group (B)
2.2高脂刺激时MIN6胰岛β细胞NADPH氧化酶亚基表达的变化Fig 2结果说明,用含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激24、48、72、96 h 后,p22phox、p47phox、p67phox以及gp91phox等NADPH氧化酶亚基的表达在高脂刺激48 h后出现持续高水平,均高于正常对照组(P<0.05),而48、72、96 h之间均无明显差异(P>0.05)。
2.3高脂刺激时MIN6胰岛β细胞凋亡相关蛋白表达的变化Fig 3结果说明,用含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激24、48、72、96 h后,Bcl-2表达在高脂刺激48 h后出现持续低水平,Bax表达在高脂刺激48 h后出现持续高水平,与正常对照组相比,差异均有显著性(P<0.05);而48、72、96 h之间Bcl-2及Bax表达差异均无显著性(P>0.05)。

Fig 2 Influence of high palmitic acid on expression
*P<0.05vs0 h group
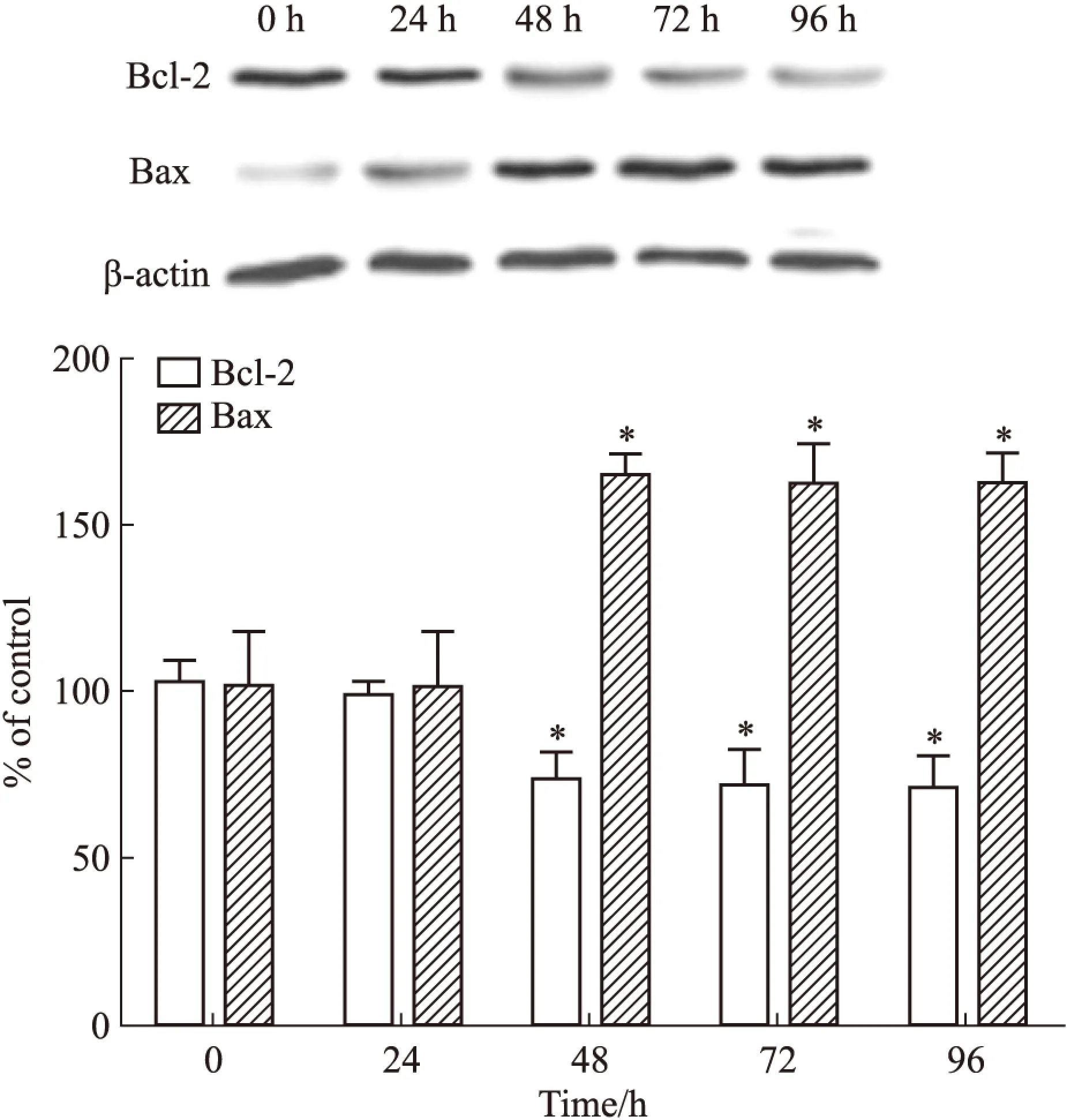
Fig 3 Influence of high palmitic acid on expression of
*P<0.05vs0 h group
2.4NADPH氧化酶抑制剂对高脂刺激下MIN6胰岛β细胞凋亡相关蛋白表达的影响Fig 4结果说明,用含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激48 h后,棕榈酸刺激组Bcl-2表达出现明显低水平,Bax表达出现明显高水平,与正常对照组相比,差异均有显著性(P<0.05);而棕榈酸+DPI组Bcl-2表达明显增高,与对照组差异无显著性(P>0.05),Bax表达明显降低,与对照组相比,差异无显著性(P>0.05)。
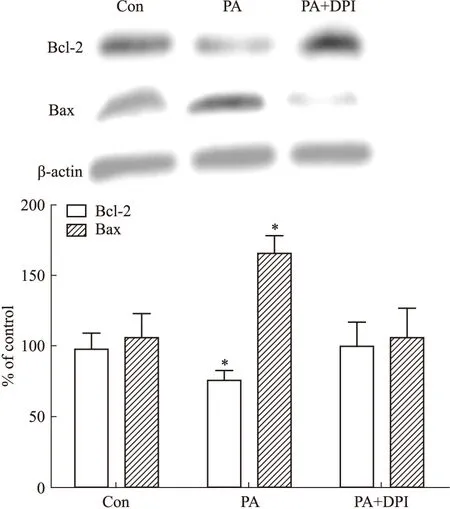
Fig 4 Influence of NADPH oxidase inhibitor(diphenyliodonium,DPI) on expression of Bcl-2 and Bax in MIN6 islet β cells exposed
*P<0.05vscontrol group
3 讨论
糖脂毒性在2型糖尿病发展中起着关键性的作用[9]。尤其近年来,诸多研究证实了脂毒性能导致胰岛β细胞的功能受损甚至凋亡,同时可引起外周组织的胰岛素抵抗,最终发展为糖尿病。脂毒性也会促进如视网膜病变、糖尿病神经病变、糖尿病肾病、大血管病变等糖尿病并发症的发生[10]。关于脂毒性潜在机制,目前认为脂肪细胞分化功能障碍是主要问题,因为一旦脂肪细胞无法增生分化成新的脂肪细胞,营养过量便只能引起脂肪细胞体积的代偿性增大,从而对抗胰岛素的抗脂解作用,导致甘油三酯在脂肪细胞内出现严重水解,血浆中游离脂肪酸(FFA)浓度明显升高。同时,增大的脂肪细胞使脂肪的储备功能受到了阻碍,使多余的脂肪不得不流入胰腺、肌肉及肝脏等器官,出现脂毒性。
据报道,长时间的高脂喂养大鼠氧化应激水平会普遍增高[11-12],导致胰岛出现氧化/抗氧化功能失调,出现胰岛β细胞凋亡增多。当一些有害因素刺激机体时,机体的活性氧(ROS)等氧化应激产物会增多并累积在体内得不到及时清除,使氧化/抗氧化系统平衡受到破坏,最终使机体机能受到损伤,也称氧化应激性损伤。而ROS在机体内主要是来源于NADPH氧化酶及线粒体呼吸链复合体[13]。NADPH 氧化酶的底物为NAD(P)H,脂毒性刺激可增加胞质戊糖途径产生的NADPH及线粒体的NADH,激活NADPH氧化酶,过多的电子传递将促进NADPH源性ROS的生成,最终导致氧化应激体系的失衡及胰岛细胞的损伤。NADPH氧化酶是由p22phox、p47phox、p67phox、gp91phox、p40phox和Rac1等6种亚单位组成的复合体[14]。本研究结果显示,高脂刺激MIN6胰岛β细胞48 h后p22phox、p47phox、p67phox、gp91phox等NADPH氧化酶亚基表达明显增高,提示NADPH氧化酶的激活及其亚单位的表达调控可成为高脂所致胰岛细胞损伤的机制之一。
作为一类独立危险因素,脂毒性刺激对胰岛β细胞是一种直接性损害,可导致胰岛β细胞在数目及功能方面均受到影响,增加胰岛β细胞的凋亡,最终使胰岛分泌功能受到损伤。也就是说胰岛β细胞凋亡是胰岛分泌功能下降的主要因素,而目前为止,已经发现有多种基因参与细胞凋亡的调控,其中Bcl-2家族是近年来细胞凋亡研究中受到瞩目的关键调控因子,它凭借着促凋亡及抗凋亡的协同作用,在细胞凋亡调控中发挥开关的作用。例如Bcl-2是一种抗凋亡蛋白,Bax是一种促凋亡蛋白,正常情况下,抗细胞凋亡蛋白Bcl-2与促细胞凋亡蛋白 Bax维持动态平衡,维持细胞正常的生理过程。当 Bcl-2表达增多,Bax表达减少,细胞凋亡减少,反之凋亡增多。本研究结果显示,用含0.5 mmol·L-1棕榈酸的高糖DMEM培养基刺激24、48、72、96 h后,Bcl-2表达在高脂刺激48 h后出现明显降低,Bax表达在高脂刺激48 h后出现明显升高。本研究另一组数据表明,与高脂刺激48 h组相比,高脂+NADPH氧化酶抑制剂DPI组Bcl-2表达明显增高,Bax表达明显降低,提示胰岛β细胞损伤或凋亡可以排除棕榈酸对细胞的直接作用,也表明NADPH氧化酶途径是高脂刺激导致胰岛损伤的关键机制。
综上所述,高脂刺激可抑制MIN6胰岛β细胞的增殖,升高NADPH氧化酶亚基的表达水平,同时降低抗凋亡蛋白Bcl-2的表达、升高促凋亡蛋白Bax的表达,并成功被NADPH氧化酶抑制剂所阻断。这说明,调控NADPH依赖性氧化应激所致的细胞凋亡对脂毒性胰岛损伤的防治有指导意义。
(致谢:本文实验在湖北科技学院糖尿病心脑血管病变湖北省重点实验室完成,感谢参与人员鲍翠玉教授、陈丹硕士生及周宇硕士生对本实验的帮助与指导。)
[1]Kanda Y, Hashiramoto M, Shimoda M. Dietary restriction preserves the mass and function of pancreatic β cells via cell kinetic regulation and suppression of oxidative/ER stress in diabetic mice[J].JNutrBiochem,2015, 26(3): 219-26.
[2]Du Z, Li S, Liu L. NADPH oxidase 3-associated oxidative stress and caspase 3-dependent apoptosis in the cochleae of D-galactose-induced aged rats[J].MolMedReport, 2015, 12(6): 7883-90.
[3]易岚,伍尤华,谭晖.二烯丙基二硫活化NADPH氧化酶诱导人白血病K562细胞凋亡[J].中国药理学通报,2014,30(8):1107-12.
[3]Yi L, Wu Y H, Tan H. Diallyl disulfide induces apoptosis in human leukemia K562 cells through activation of NADPH oxidase[J].ChinPharmacolBull, 2014, 30(8): 1107-12.
[4]余薇,闵清,郭霜.NADPH氧化酶在高糖诱导的H9c2心肌细胞损伤中的作用[J].中国药理学通报,2015,31(10):1379-82.
[4]Yu W, Min Q, Guo S. Role of NADPH oxidase in high glucose-induced injury in H9c2 cardiac cells[J].ChinPharmacolBull, 2015, 31(10): 1379-82.
[5]Graciano M F,Valle M M,Curi R,Carpinelli A R.Evidence for the involvement of GPR40 and NADPH oxidase in palmitic acid-induced superoxide production and insulin secretion[J].Islets,2013,5(4):139-48.
[6]Michalska M,Wolf G,Walther R,Newsholme P. Effects of pharmacological inhibition of NADPH oxidase or iNOS on pro-inflammatory cytokine,palmitic acid or H2O2-induced mouse islet or clonal pancreatic β-cell dysfunction[J].BiosciRep, 2010,30(6):445-53.
[7]Rebolledo O R,Raschia M A,Borelli M I,et al.Islet NADPH oxidase activity is modulated unevenly by different secretagogues[J].Endocrine,2010,38(2):309-11.
[8]Saitoh Y,Hongwei W,Ueno H,et al.Telmisartan attenuates fatty-acid-induced oxidative stress and NAD(P)H oxidase activity in pancreatic beta-cells[J].DiabetesMetab, 2009,35(5):392-7.
[9]Tamaki M,Fujitani Y.Role of zinc in type 2 diabetes[J].NihonEiseigakuZasshi,2014,69(1): 15-23.
[10]Vasu S,Moffett R C,McClenaghan N H.Differential molecular and cellular responses of GLP-1 secreting L-cells and pancreatic alpha cells to glucotoxicity and lipotoxicity[J].ExpCellRes,2015,336(1): 100-8.
[11]Sudhakara G, Mallaiah P, Sreenivasulu N,et al. Beneficial effects of hydro-alcoholic extract of Caralluma fimbriata against high-fat diet-induced insulin resistance and oxidative stress in Wistar male rats[J].JPhysiolBiochem, 2014, 70(2): 311-20.
[12]Crescenzo R, Bianco F, Coppola P,et al. Subsarcolemmal and intermyofibrillar mitochondrial responses to short-term high-fat feeding in rat skeletal muscle[J].Nutrition, 2014, 30(1): 75-81.
[13]Wen H, Xu W J, Jin X,et al. The roles of IP3 receptor in energy metabolic pathways and reactive oxygen species homeostasis revealed by metabolomic and biochemical studies[J].BiochimBiophysActa, 2015, 1853(11 Pt A): 2937-44.
[14]Qin S, Shimamoto S, Maruno T. Thermodynamic and NMR analyses of NADPH binding to lipocalin-type prostaglandin D synthase[J].BiochemBiophysResCommun, 2015, 468(1-2): 234-9.
Role of NADPH oxidase in high fat-induced injury in MIN6 islet β cells
LI Jing1,CHEN Dan1,ZHOU Yu2,BAO Cui-yu2
(1.HubeiProvinceKeyLaboratoryonCardiovascular,Cerebrovascular,andMetabolicDisorders,2.NursingCollege,HubeiUniversityofScienceandTechnology,XianningHubei437100,China)
AimTo explore the role of nicotinamide adenine dinucleotide phosphate(NADPH) oxidase in high fat-induced injury in MIN6 islet β cells.MethodsMIN6 islet β cells were exposed to different concentrations of palmitic acid(0.1,0.3,0.5,0.8 mmol·L-1) for 48 h and different time points of 0.5 mmol·L-1palmitic acid(24,48,72,96 h). Cell viability was measured by MTT,the protein expression of NADPH oxidase subunits such as p22phox,p47phox,p67phoxand gp91phoxand apoptosis related proteins such as Bcl-2 and Bax were determined by Western blot.ResultsMIN6 islet cells exposed to palmitic acid at 0.5 mmol·L-1for 48 h showed a decrease in their viability and an increase in the expression of NADPH oxidase subunits(p22phox、p47phox、p67phoxand gp91phox) and Bax(P<0.05), while Bcl-2 expression was significantly reduced. the pretreat with NADPH oxidase inhibitor diphenyliodonium(DPI,10 μmol·L-1)significantly inhibited high fat-induced Bcl-2 and Bax expression(P<0.05 ).ConclusionActivated NADPH oxidase might play an important role in the treatment of high fat-induced injury in MIN6 islet cells.
NADPH oxidase;high fat;MIN6;islet β cells;Bcl-2;Bax
2016-05-16,
2016-06-26
湖北省教育厅科学研究计划项目(No B2016197);湖北省自然科学基金计划项目(No 2015CFC773)
李晶(1979-),女,博士,讲师,研究方向:糖尿病心脑血管病变,E-mail:lijing790629@:163.com;
鲍翠玉(1969-),女,博士,教授,研究方向:糖尿病心肌缺血的防治,通讯作者,E-mail:bcy_tiaopi@126.com
10.3969/j.issn.1001-1978.2016.09.025
A
1001-1978(2016)09-1317-05
R322.57;R329.24;R345.4;R587.1;R977.3;R977.6
网络出版时间:2016-8-23 14:29:00网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.050.html
