茜草素激活Wistar大鼠肾叶间动脉平滑肌细胞大电导钙激活钾通道
2016-09-28王家宁干艳捷王元媛张传林
何 琼,王家宁,干艳捷,王元媛,张传林
(湖北医药学院附属人民医院心脏中心,湖北 十堰 442000)
茜草素激活Wistar大鼠肾叶间动脉平滑肌细胞大电导钙激活钾通道
何琼,王家宁,干艳捷,王元媛,张传林
(湖北医药学院附属人民医院心脏中心,湖北 十堰442000)
目的研究茜草素对大电导钙激活钾通道(large conductance calcium activated potassium channels,BKCa)的调节作用。方法在快速分离的Wistar大鼠肾叶间动脉平滑肌细胞上,应用膜片钳技术研究茜草素对BKCa介导的外向电流的调节情况。结果BKCa特异性抑制剂伊比利亚毒素(ibTX)抑制茜草素的增强作用(P<0.01);去除细胞外液中的钙离子,L-钙通道抑制剂尼莫地平(nimodipine)、钙离子螯合剂BAPTA-AM和ryanodine均能抑制茜草素对肾叶间动脉平滑肌细胞外向电流的增强作用(P<0.05)。结论茜草素通过激活L-钙通道,促进钙离子由细胞膜外进入胞质,内流的钙离子进一步激活ryanodine受体,引起胞质中钙离子浓度快速升高,激活平滑肌细胞膜BKCa通道。
茜草素;膜片钳;肾叶间动脉;BKCa通道;钙离子;平滑肌
在肾叶间动脉平滑肌细胞膜上的BKCa激活后,介导细胞内钾离子外流,导致细胞膜电位超极化,引起血管扩张[1]。但是高血压状态下,动脉平滑肌细胞膜BKCa功能和表达障碍致其介导的舒张血管功能减弱[2],导致肌源紧张性高血压的产生[3]。中药茜草是治疗高血压的重要中药材之一,研究发现茜草提纯后的有效成分是1-2-二羟基-9-10-蒽二酮[4],但是含有1-2-二羟基-9-10-蒽二酮的番泻叶可以激活L型钙离子通道,导致钙离子由细胞膜外进入胞质[5]。在平滑肌细胞中,钙离子内流可导致平滑肌细胞去极化,引起动脉血管收缩,这与茜草在中医临床治疗高血压相矛盾[6]。但是细胞内钙离子浓度的变化是BKCa激活的重要条件。因此我们应用膜片钳技术研究茜草素对大鼠肾叶间动脉及其平滑肌细胞BKCa介导的外向电流的调节机制。
1 材料与方法
1.1实验动物Wistar大鼠购自北京维通利华实验动物中心(许可证编号SCXK京2007-0001),动物质量符合清洁级动物标准,10~12周龄,♀♂不拘,体质量(283.0±21.2)g。
1.2试验药物及主要试剂茜草素批号及规格:122777-100 g;使用二甲基亚砜(DMSO)将茜草素配置为10-2mol·L-1的母液,再使用预先配置的PSS液体稀释。二甲基亚砜(DMSO)批号及规格:D2650-100 mL。BAPTA-AM批号及规格:A1076-25 mg;Ryanodine批号及规格:R128-25 mg;伊比利亚毒素(ibTX)批号及规格:15904-100 μg;均使用预先配置的PSS液体溶解。以上药物均购自Sigma公司。配置PSS液体使用的试验试剂均是国产分析纯试剂,高效液相色谱法(HPLC)分析纯度不小于97%,(2~8)℃保存。
1.3方法全细胞膜片钳实验方法参照王洋等[7]及李新芝等[8]方法。
2 结果
2.1ibTX抑制茜草素的增强作用细胞封接稳定后孵育30 s,平滑肌细胞外向电流(60 mV)是(258.0±8.5) pA, 给予10-5mol·L-1茜草素预灌流15 s后,外向电流是(354.0±11.4) pA,预灌流10-8mol·L-1ibTX 3 min,再给予10-5mol·L-1茜草素预灌流15 s,平滑肌细胞外向电流是(122.6±5.5) pA(n=6,P<0.01),细胞外液洗脱3 min后外向电流是(243.0±8.8) pA,见Fig 1。
2.2细胞膜外钙离子介导茜草素增强肾叶间动脉平滑肌细胞外向电流将肾叶间动脉平滑肌细胞在无钙外液孵育30 min后,给予10-5mol·L-1茜草素预灌流15 s前后电流(60 mV)分别是:(65.3±9.4)pA和(64.8±8.1)pA,预灌流前后无统计学差异;含有钙离子的细胞外液茜草素预灌流15 s前后电流(60 mV)分别是:(258±8.5)pA和(354±11.4)pA(n=6,P<0.01),见Fig 2。

Fig 1 ibTX inhibits alizarin mediated outward currents(n=6)
*P<0.05,**P<0.01vscontrol

Fig 2 Ca2+ inhibits alizarin enhancing effect in extra-cellular fluid(n=6)
*P<0.05vscontrol
2.3尼莫地平抑制茜草素的增强作用预灌流尼莫地平(L-钙通道抑制剂,10-5mol·L-1) 前后,给予茜草素(10-5mol·L-1),肾叶间动脉平滑肌细胞外向电流(60 mV)分别是(551.0±71.0)pA和(54.1±11.0)pA (n=6,P<0.01),见Fig 3。
2.4细胞内钙离子介导茜草素增强的外向电流将BAPTA-AM(钙离子螯合剂,20 μmol·L-1) 加入电极内液,待细胞封接稳定后孵育30 s,待细胞内离子螯合,再给予茜草素(10-5mol·L-1)预灌流15 s,预灌流前后肾叶间动脉平滑肌细胞的外向电流(60 mV)分别为(70.2±8.1)pA和(67.8±11.2)pA(n=6,P>0.05),见Fig 4。
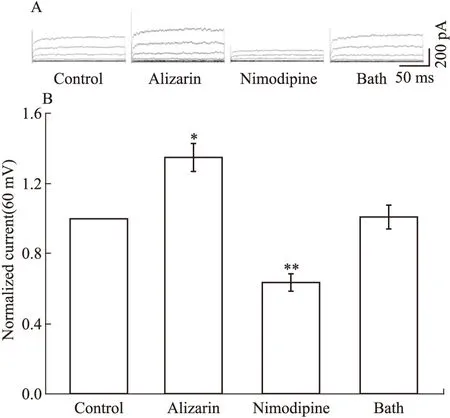
Fig 3 Nimodipine inhibits alizarin
*P<0.05,**P<0.01vscontrol
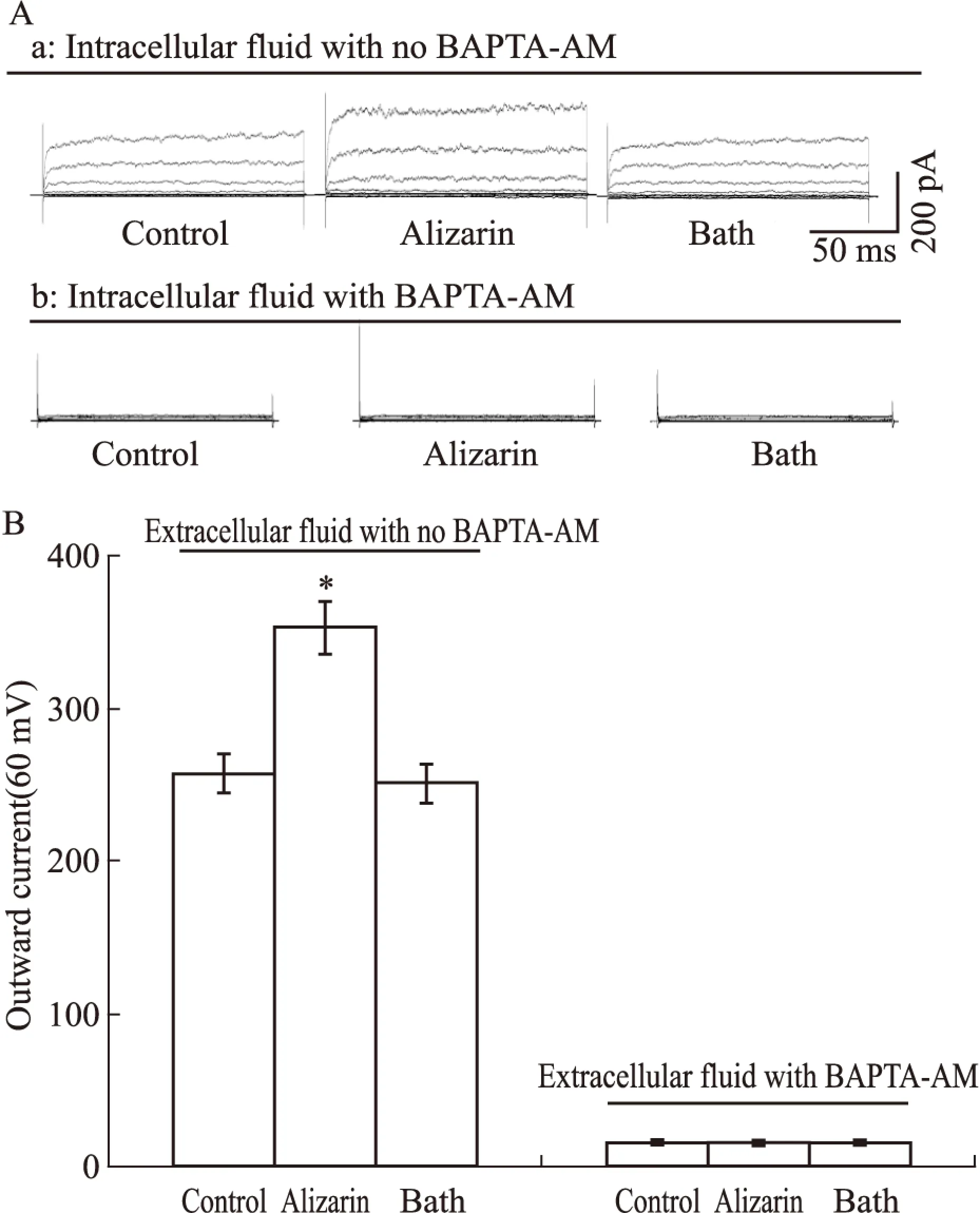
Fig 4 Ca2+ inhibits alizarin enhancing effect in intracellular fluid(n=6)
*P<0.05vscontrol
2.5ryanodine受体介导茜草素增强肾叶间动脉平滑肌细胞外向电流将ryanodine加入(ryanodine受体调节剂,10 μmol·L-1)电极内液,待细胞封接稳定后孵育30 s,再给予茜草素(10-5mol·L-1)预灌流15 s,预灌流前后肾叶间动脉平滑肌细胞的外向电流(60 mV)分别为(56.2±9.4)pA和(54.8±7.7)pA(n=6,P>0.05),见Fig 5。
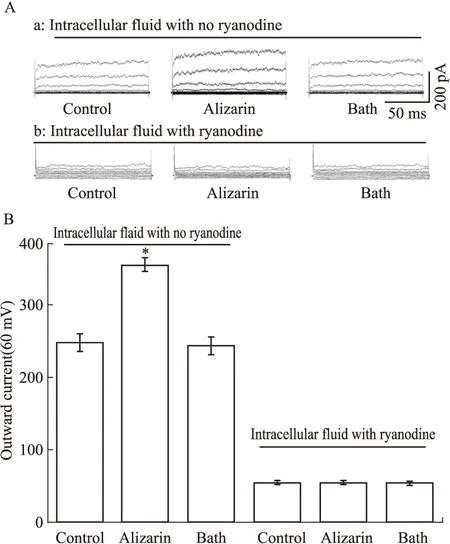
Fig 5 10 μmol·L-1 ryanodine inhibits alizarin mediated outward currents(n=6)
*P<0.05vscontrol
3 讨论
茜草素舒张肾叶间动脉,增强其平滑肌细胞膜介导的外向电流,导致细胞膜超极化,从而引起肾叶间动脉舒张,特异性BKCa抑制剂伊比利亚毒素(ibTX)抑制茜草素的增强作用提示茜草素增强的肾叶间动脉平滑肌细胞膜外向电流由BKCa介导[9]。
有研究发现平滑肌细胞质内钙离子浓度的升高是BKCa激活的重要条件[10],去除细胞外液中的钙离子,将消化分离的单个平滑肌在无钙的细胞外液中孵育30 min,茜草素对肾叶间动脉平滑肌细胞的外向电流增加作用消失,间接提示茜草素增强BKCa介导的外向电流所需的钙离子来源于细胞膜外。
L-钙通道抑制剂尼莫地平(nimodipine)抑制茜草素增强的BKCa介导的外向电流提示细胞膜外的钙离子通过激活L-钙通道后进入细胞质内,这与Wu等[4]研究结果相一致。
有研究表明[12],胞质中钙离子浓度达到5 μmol·L-1时BKCa被激活。在电极内液中加入钙离子螯合剂BAPTA-AM,茜草素对叶间动脉的增强作用被抑制,也提示细胞质中钙离子浓度在激活BKCa中的重要作用。
Plüger等[13]研究发现平滑肌内肌浆网ryanodine受体被激活后,引起平滑肌细胞胞质中发生“钙火花”,进一步激活其周围的BKCa,我们在电极内液中加入ryanodine(选择性ryanodine受体调节剂,10 μmol·L-1),茜草素的增强作用被抑制,提示茜草素间接激活ryanodine受体[13],引起细胞内钙离子浓度升高,最终激活BKCa,引起钾离子外流,平滑肌细胞超极化,肾叶间动脉血管舒张[9]。茜草素是否在平滑肌细胞内引起“钙火花”,尚需进一步研究证实。
细胞质中钙离子的升高有两个途径:细胞外流入和细胞内肌质网释放[4,13]。在静息状态下,平滑肌细胞质内游离的钙离子浓度是0.1 μmol·L-1,当肌细胞兴奋出现后,胞质内钙离子浓度快速上升至1~10 μmol·L-1[11]。即当细胞外钙离子通过相应通道进入胞质后触发“钙内流激活钙释放”:即“细胞外钙离子内流诱导细胞内肌质网释放钙离子进入胞质”[13],胞质中快速升高的钙离子浓度是平滑肌细胞收缩的重要条件,同时也是BKCa激活[12]的重要条件。因此,我们推测:平滑肌细胞兴奋后,钙离子由细胞外通过钙通道进入细胞内,在钙离子浓度尚未达到激活BKCa的条件下,平滑肌细胞发生收缩,但为了保持生理平衡,当钙离子浓度达到5 μmol·L-1时,BKCa被激活[12],钾离子外流,平滑肌细胞复极化,血管舒张。
总之通过本研究发现:茜草素通过激活L-钙通道,促使细胞膜外钙离子进入胞质中,细胞外钙离子内流,进一步激活肌浆网上ryanodine受体,导致内钙释放,可能导致胞质中产生 “钙火花”,“ 钙火花”附近BKCa被激活[13],导致钾离子外流,平滑肌细胞超极化,最终引起肾叶间动脉舒张。
[1]England S K, Wooldridge T A, Stekiel W J, et al. Enhanced single-channel K+currents in arterial membranes from genetically hypertensive rats[J].AmJPhysiol, 1993, 264: H1337-45.
[2]Nelson M T, Quayle J M. Physiological roles and properties of potassium channels in arterial smooth muscle[J].AmJPhysiol, 1995, 268:C799-822.
[3]罗兴林, 何川, 杨艳, 等. 原发性高血压患者血压参数与血管平滑肌细胞钙激活钾通道活性的相关性研究[J]. 中国循环杂志, 2005, 2(20):126-9.
[3]Luo X L, He C, Yang Y,et al. Relationship of parameters of blood pressure and calcium activated potssium channels of Vessel smooth muscle in patienst with essential hypertension[J].ChinCirculJ, 2005, 2(20):126-9.
[4]Wu Z X, Yu B P, Xia H, Xu L. Emodin increases Ca(2+) influx through L-type Ca(2+) channel in guinea pig gallbladder smooth muscle[J].EurJPharmacol, 2008, 24(595):95-9.
[5]林秀珍, 靳珠华. 番泻甙、大黄多糖和大黄素对脑细胞内游离钙浓度的影响[J]. 药学学报, 1995, 30:307-10.
[5]Lin X Z, Jin Z H. Effects of Sennosides, rhubarb polysaccharides and emodin on the cytoplasmic free cacium in isolated rat brain cells[J].ActaPharmSin, 1995, 30:307-10.
[6]周继胡, 丁涛, 温富春, 等. 钩藤总生物碱胶囊降压作用研究[J].长春中医药大学学报,2013,29(12):1117-8.
[6]Zhou J H, Ding T,Wen F C, et al. Antihypertensive effects of rhynchophylla total alkaloids capsules[J].JChangchunUnivTraditChinMed,2013,29(12):1117-8.
[7]王洋, 马克涛, 张传林, 等. 奎尼丁增强大鼠软脑膜动脉平滑肌细胞BKCa通道介导的外向电流[J].中国药理学通报,2013,29(4): 43-6.
[7]Wang Y, Ma K T, Zhang C L, et al. Quinidine enhance BKCachannel mediated outward current in pial artery smooth muscle cell of SD rat[J].ChinPharmacolBull,2013, 29(4): 43-6.
[8]李新芝, 司军强, 张忠双, 等. 急性缺氧增强豚鼠小脑前下动脉平滑肌细胞外向电流并抑制缝隙连接[J].生理学报,2011,63(6): 533-9.
[8]Li X Z, Si J Q, Zhang Z S, et al. Acute hypoxia increases outward current and decreases gap junction of VSMCs in guinea-pig inferior cerebellar artery[J].ActaPhysiolSin,2011, 63(6): 533-9.
[9]张传林, 李晓雯, 何琼, 等. 茜草素增强Wistar大鼠平滑肌细胞BKCa介导的外向电流舒张肾叶间动脉[J].中药药理与临床,2016,32(1):33-5.
[9]Zhang C L, Li X W, He Q, et al. Alizarin enhanced BKCa-induced outward currents relaxed renal interlobar artery in Wistar rats[J].PharmacolClinChinMatMed,2016, 32(1):33-5.
[10]Wei A, Solaro C, Lingle C, et al. Calcium sensitivity of BK type KCachannels determined by a separable domain[J].Neuron, 1994, 13:671-81.
[11]姚泰, 曹济民, 樊小力, 等. 生理学[M].第2版. 北京: 人民卫生出版社, 2010: 61.
[11]Yao T, Cao J M, Fan X L, et al.Physiology[M]. 2nd Edition. Beijing: People’s health publishing, 2010: 61.
[12]Gollasch H, Haller F C, Luft H, et al. Mice with disrupted BK channel beta1 subunit gene feature abnormal Ca2+spark/STOC coupling and elevated blood pressure[J].CircRes,2000,87: E53-E60.
[13]Plüger S, Faulhaber J, Fürstenau M, et al. Mice with disrupted BK channel beta1 subunit gene feature abnormal Ca(2+) spark/STOC coupling and elevated blood pressure[J].CircRes,2000, 87(11): E53-60.
Alizarin activates large-conductance Ca2+-activated K+channels on renal interlobar arterial vascular smooth muscle cells in Wistar rat
HE Qiong, WANG Jia-ning,GAN Yan-jie, WANG Yuan-yuan,ZHANG Chuan-lin
(HeartCenter,RenminHospital,HubeiUniversityofMedicine,ShiyanHubei442000,China)
AimTo investage the regulatory effect of alizarin on renal interlobar arterial smooth muscle cells.MethodThe effect of alizarin on BKCachannels was observed by whole-cell patch clamp recording technique.ResultsSelective BKCachannel blocker ibTX inhibited alizarin-induced outward current(P<0.05); single smooth muscle cells were incubated in extracellular fluid with no Ca2+30 minutes, selective L-Ca2+channel blocker nimodipine, selective calcium ion chelating agent BAPTA-AM and ryanodine inhibited the alizarin-induced BKCachannels current, too(P<0.05).ConclusionAlizarin relaxes renales interlobar arterial smooth muscle via activation of L-Ca2+channel firstly, which lead to Ca2+flowed into cytoplam, and rising of Ca2+in cytoplam ryanodine receptor indirectly, and BKCais activated at last.
alizarin; patch clamp recording; renal interlobar arterial; BKCa; Ca2+; smooth musclecell
2016-05-09,
2016-06-21
国家自然科学基金资助项目(No 81270221);十堰市科技局项目(No 15Y34)
何琼(1976-),女,硕士,副主任医师,研究方向:心脏电生理,E-mail:zcllovexq@126.com;
张传林(1985-),男,硕士,研究方向:心脏和血管电生理学,通讯作者,E-mail:drzhangchuanlin@126.com
10.3969/j.issn.1001-1978.2016.09.015
A
1001-1978(2016)09-1264-04
R-332;R284. 1;R322. 74; R329.24
网络出版时间:2016-8-23 14:29:00网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.030.html
