栀子黄色素提取工艺优化及品质评价研究
2016-09-27王帆林武巧胡娜娜程旭韩婷王沫
王帆林,武巧,胡娜娜,程旭,韩婷,王沫,*
(1.华中农业大学药用植物研究所,湖北武汉 430070;2.湖北省荆楚药材研究院,湖北武汉 430073)
栀子黄色素提取工艺优化及品质评价研究
王帆林1,武巧1,胡娜娜1,程旭2,韩婷2,王沫1,2*
(1.华中农业大学药用植物研究所,湖北武汉 430070;2.湖北省荆楚药材研究院,湖北武汉 430073)
以栀子为材料,O D比值为指标,研究乙醇浓度、温度和时间对栀子黄色素提取效果影响,优化栀子黄色素提取工艺;以藏花素为对照品,分光光度法测不同产地栀子中栀子黄色素含量和色价,评价不同产地栀子的品质;用大孔树脂AB-8纯化色素,研究高色价栀子黄色素的制备。结果表明:栀子黄色素最佳提取条件为60%乙醇,于40℃静置浸提60m in;山栀子中栀子黄色素含量(13.07%)低于水栀子(平均为19.37%),栀子黄色素含量存在品种差异;经纯化,栀子黄色素色价平均提高了3倍左右,通过纯化可获得高品质栀子黄色素。
栀子黄色素;提取工艺;含量;色价
栀子是茜草科(Rubiaceae)植物栀子(Gardenia jasminoides Ellis)的成熟果实,具有护肝、利胆、降压等多种药理作用,是我国传统中药,在国内分布广泛[1]。山栀子(G. jasminoidesEllis)和水栀子(G. jasminoides Ellis. f. logicarpa Z.W.Xie et Okada)是 栀子的2个主要栽培品种,其化学成分相近,但各组分含量存在差异[2]。栀子黄色素是从栀子中提取的一种优良水溶性天然色素,属类胡萝卜素,主要成分是藏花素[3],因其着色自然、性质稳定且具有一定的医疗保健作用而广泛应用于食品行业。栀子中还含有栀子苷等化学组分,而栀子苷的存在常会引起栀子黄色素的绿变,由此限制了栀子黄色素产品的广泛应用[4]。栀子苷和藏花素分别在238nm和440nm处有最大吸收峰,栀子苷的最大吸光值A238nm与藏花素的最大吸光值A440nm比值即OD比值小于0.4时,可防止栀子黄色素的绿变。获取栀子黄色素的工艺流程为果实粉碎、浸提、浓缩和纯化[5],优良的提取工艺结合后续高效的纯化加工过程才能实现栀子黄色素的高效优质生产。因此,优化栀子黄色素提取工艺,提高色素提取效率和纯度,具有重要实践意义。
1 材料与方法
1.1 材料
栀子采自湖北省孝感市和长阳县栀子种植基地,经华中农业大学药用植物研究所王沫教授鉴定,分别为山栀子(G. jasminoidesEllis)和水栀子(G. jasminoides Ellis f. logicarpa Z.W.Xie et Okada)的干燥果实。
藏红素标品:东京化成工业株式会社;大孔树脂AB-8:天津市光复精细化工研究所;梅特勒万分之一天枰;N-1100旋转蒸发仪;PK-BD恒温水浴锅;紫外可见分光光度计;80-2台式离心机。
1.2 方法
1.2.1 前处理
栀子经剔除杂物、次果,于45℃烘干至恒重,粉碎,过40目筛,密封避光保存备用。
1.2.2 提取工艺优化
准确称取0.5g栀子粉末于具塞三角瓶中,料液比1∶10加入乙醇溶液,采用一次浸提方式,提取30min,离心,取上清液并稀释到适当浓度后,分光光度计测其在238nm和440nm处吸光值并计算OD比值,每处理3次重复,选取最佳乙醇提取浓度。同样的方法考察浸提方式、时间和温度对栀子黄色素提取效果的影响。
1.2.3 方差分析
试验数据统计分析采用SPSS 19.0软件,用ANOVA (Analysis of Variance,LSD检验法)进行方差分析。
1.2.4 绘制标准曲线
精密称取藏花素对照品,用60%乙醇溶解并配置成浓度分别为0.000 0、0.022 4、0.044 8、0.067 2、0.089 6mg/mL和0.112 0mg/mL的藏花素对照溶液,以溶剂为空白对照,测其在440nm的吸光值,以浓度为横坐标,吸光值为纵坐标绘制标准曲线,并给出回归方程。
1.2.5 栀子黄色素纯化与色价测定
准确称取栀子样品粉末0.5g于具塞三角瓶中,按上述试验所得最优提取方法提取栀子黄色素,每个样品提取4次。合并提取液,适当稀释后,用分光光度计测其在440nm处吸光值,根据标准曲线计算出样品中栀子黄色素含量(以占栀子干重百分比计),每重复试验3次。
大孔树脂AB-8用60%乙醇浸泡过夜,湿法装柱,蒸馏水洗至无醇味并溶液澄清,上样,控制流速约80滴/min,蒸馏水洗脱未被吸附部分,20%乙醇洗去杂质,80%乙醇洗脱色素,收集洗脱液,真空挥干乙醇,于蒸发皿中45℃烘干至粉末。按国标GB7912-2010法测栀子黄色素在440nm处吸光值,按色价计算公式(1)计算色价:
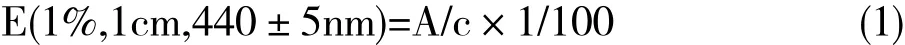
式中,E(1%,1cm,440nm)指试样液浓度为1%,用1cm比色皿,在(440±5)nm范围内的最大吸收波长处测得的吸光值;A为实际测定试样液的吸光值;c为被测试样液的浓度,单位为g/mL。
2 结果与分析
2.1 乙醇浓度与栀子黄色素提取效应
乙醇浓度对栀子黄色素提取有显著影响(P <0.05),浓度高于25%时,随着醇浓度增大,所得栀子黄色素的A238nm值和A440nm值增大,但同时OD比值也明显增大(见表1)。以OD比值相对较小,同时A440值相对较大综合考虑,60%乙醇为栀子黄色素最佳提取溶剂条件。
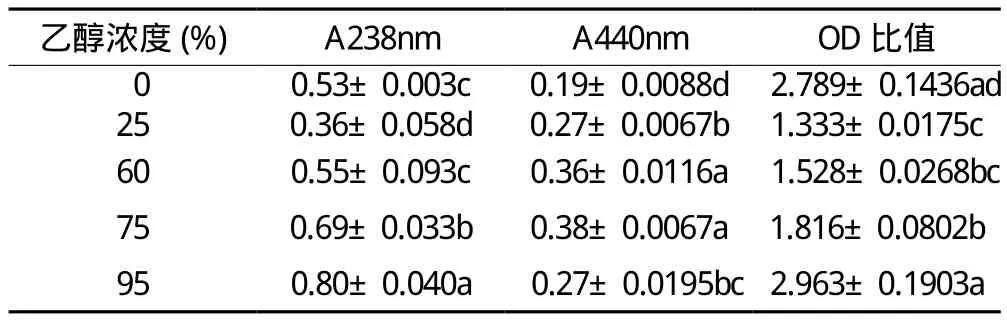
表1 乙醇浓度对栀子黄色素提取的影响
2.2 浸提方式和时间与栀子黄色素提取效应
以60%乙醇为溶剂,室温条件下,静置和震荡(140r/min)2种浸提方式所得栀子黄色素在440nm处吸光值及OD比值没有显著差异(P﹤0.05),且在150min内,静置或震荡时间的延长不影响栀子黄色素提取效应(见表2)。
2.3 时间和温度与栀子黄色素提取效应
高温条件下,时间和温度对栀子黄色素提取效应有显著影响(P﹤0.05),高温导致OD比值随着浸提时间的不同产生明显变化。其余条件相同时,就提取时间而言,浸提60min所得色素在440nm处吸光值相对较大,且OD比值相对较小(见表3),综合考虑色素提取效率及高温对色素可能造成的影响,可取的栀子黄色素提取的温度和时间为40℃、60min。
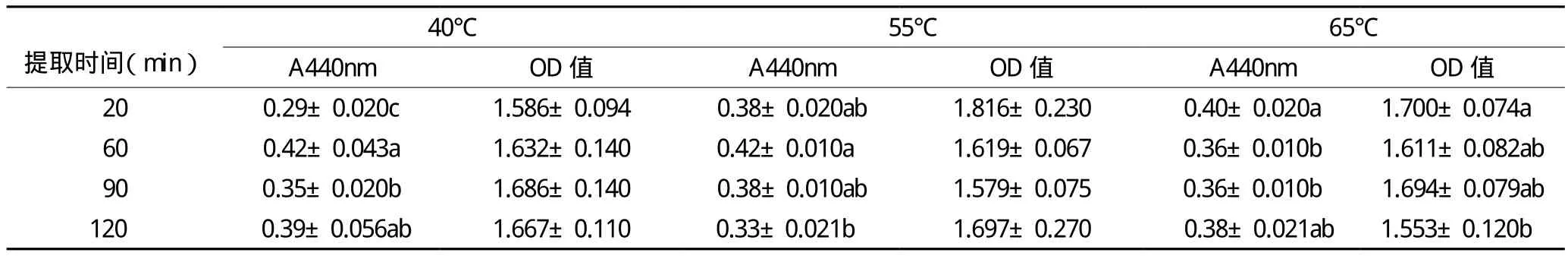
表3 温度和时间对栀子黄色素提取的影响
综上所述,本试验选用60%乙醇,40℃静置浸提60min作为栀子黄色素最佳提取条件。
2.4 标准曲线
根据方法1.2.4绘制得到藏花素标准曲线(见图1),回归方程为y=13.809x - 0.003 6(R2= 0.999 9)。
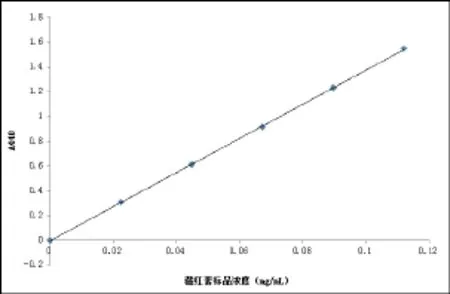
图1 藏红素在440nm吸光值与浓度关系标准曲线
2.5 栀子黄色素纯化与色价测定
桅子中栀子黄色素含量测定结果显示,水桅子高于山栀子,不同水栀子间的栀子黄色素含量无显著差异(P﹤0.05)。水桅子的粗提色素经大孔树脂AB-8一次纯化后,色价平均由60.64提高到了232.55,提高了3倍左右(见表4)。
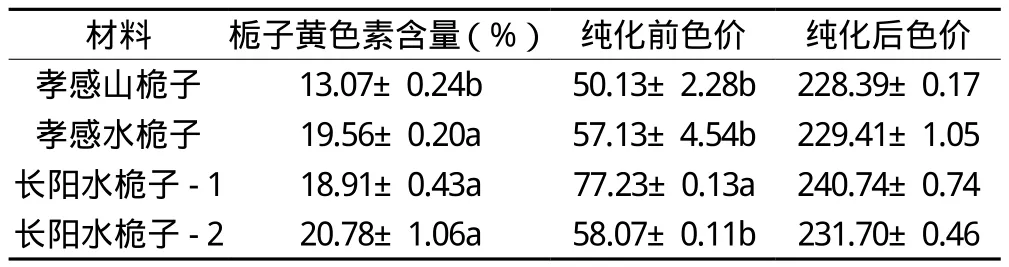
表4 4批样品栀子黄色素含量及色素纯化前后色价平均值
3 结论与讨论
乙醇浓度对栀子黄色素提取效应有显著影响,浸提方式和时间对栀子黄色素提取效果无显著影响,栀子黄色素表现出良好的水溶性和醇溶性。由此,60%乙醇,40℃静置浸提60min为栀子黄色素最佳提取条件。
本文所选用的4个栀子样品,包括1个山栀子样品和3个水栀子样品,山栀子的栀子黄色素含量明显低于水桅子,3个水栀子样品间栀子黄色素含量无差异,但粗提色价差异显著,可能与栀子的生长环境不同导致其化学组分相对含量发生变化[6,7]。在实际生产过程中,多种因素,包括栽培条件、产地、品种和采收时间等都会对栀子黄色素含量及色价产生影响[8,9],以栀子为原料得到的色素产品由于化学组分不单一、各化学成分间相互作用,导致高纯度栀子黄色素产品获取困难,产品质量难以控制,本研究以大孔树脂AB-8对粗提色素作一次纯化,即可将其色价平均提高到232.55,体现出高色价栀子黄色素获取的可操作性,为进一步建立一套操作简便、低成本、高纯度的栀子黄色素制备体系提供了参考。
[1]陈顺伟,滕水明,柏明娥,等.栀子黄色素浸提条件的优化选择研究[J].浙江林业科技,2002,22(6):15-18.
[2]付小梅,周光雄,葛菲,等.栀子类药材的研究概况及展望[J].中国野生植物资源,2001,20(2):24-26.
[3]阎少辉,张德权.栀子色素研究进展与开发[J].食品研究与开发,2000,20(6):28-31.
[4]赵祥军,曹琳,韩玉梅,等.不同产地栀子的质量研究[J].时珍国医国药,2005,16(6):508.
[5]刘成佐,刘富梁,梁华正,等.高色价栀子黄色素的提取工艺研究[J].东华理工学院学报,2005,28(3):255-258.
[6]吴红娟,王清波,谭朝阳,等.不同来源栀子中栀子苷含量测定[J].湖南中医药大学学报,2010,30(5):35-37.
[7]侯志飞,王刚,孙国祥.水栀子与栀子高效液相色谱指纹图谱比较研究[J].时珍国医国药,2010,21(11):2943-2945.
[8]贺鹏,罗旭璐,阚欢,等.3种栀子中栀子黄色价、栀子苷及总皂苷含量比较[J].江苏农业科学,2014,42(8):287-289.
[9]胡晓妹,谢媛媛,梁洁,等.栀子药材质量综合评价研究[J].中药与临床,2015,6(1):8-12.
Gardenia Yellow Pigment Extraction Process Optimization and Quality Evaluation
Wang Fan-Lin1, Wu Qiao1, Hu Na-na1, Cheng Xu2, Han Ting2, Wang Mo1,2 *
(1.Institute of Medicinal Plant Huazhong Agricultural University, Hubei Wuhan 430070; 2.Hubei Jingchu Herbs Institute, Hubei Wuhan 430073)
Gardenia as materials, OD ratio as an indicator, this paper studied ethanol concentration, temperature and time on the effect of gardenia yellow pigment extracted, and optimizated the extraction process of gardenia yellow pigment; Taking crocin as reference, the content and color value of gardenia yellow pigment were determined by spectrophotometry, and the quality of Gardenia from different habitats was evaluated; this paper purified pigment with macroporous resin AB-8, and study on preparation of gardenia yellow pigment with high color value. The results show that the gardenia yellow pigment optimum extraction conditions was 60% ethanol, and allowed to stand in the extraction 60 min 40 ℃; The content of gardenia yellow pigment (13.07%) was lower than that of water gardenia (average 19.37%), the content of gardenia yellow pigment was different in different varieties; After purification, gardenia yellow plain average price increased about 3 times, high quality can be obtained by purification of gardenia yellow pigment.
Gardenia yellow pigment; Extraction process; Content; Color value
TQ611
A
2096-0387(2016)01-0004-03
王帆林(1990-),女,甘肃靖远人,硕士研究生,研究方向:药用植物资源利用与开发。
王沫,教授,博士生导师,研究方向:药用植物资源研究。
