响应面分析法优化纤维素酶提取陈皮中橙皮苷工艺的研究
2016-09-27林敏欣
肖 南,林敏欣
(华南农业大学食品学院,广东广州 510642)
响应面分析法优化纤维素酶提取陈皮中橙皮苷工艺的研究
肖南1,林敏欣2
(华南农业大学食品学院,广东广州510642)
采用响应面分析法优化了陈皮中橙皮苷的提取条件。在单因素试验基础上,选取酶添加量、酶解温度、浸提温度、酶解pH值为自变量,橙皮苷提取率为响应值,采用中心组合设计的方法,研究各自变量及其交互作用对橙皮苷提取率的影响。结果表明,酶解法提取陈皮中橙皮苷的最佳工艺条件为酶添加量21 mg/g,酶解pH值5.5,酶解温度42℃,浸提温度90℃时,橙皮苷的提取率可达10.78%,预测模型较合理。
纤维素酶;橙皮苷;陈皮;响应面
0 引言
陈皮被誉为广东三宝之一,是新鲜成熟的四会柑取其果皮经自然晒制后而得。陈皮是一味常见中药,具有通气健脾、燥湿化痰、解腻留香、降逆止呕等药理功效。现代医学研究表明,陈皮中含有橙皮苷、类柠檬苦素、挥发油等多种成分,其中橙皮苷为主要成分。橙皮苷具有消炎、抑菌、增强免疫力、防辐射等生理作用[1]。国外有研究表明,橙皮苷还具有抗焦虑、抗氧化、抗癌[2]等药理作用。此外,作为一种二氢黄酮苷物质,橙皮苷常应用于维生素类药物中,起到增强毛细管韧性、防止毛细血管破裂出血的作用,在临床上多用于心血管疾病的治疗。鉴于橙皮苷的多种药理和疗效作用,2015版《中国药典》中规定陈皮的品质检测指标为橙皮苷[3]。
许多研究已表明,植物性中药的有效成分通常分布在细胞壁包裹着的细胞内部[4],要提高目标产物的提取率和充分利用资源,需采取有效方法破坏其细胞壁而使细胞中有效成分析出,同时不会对有效成分结构等造成太大的破坏。柑橘皮细胞壁的主要成分是纤维素和果胶,纤维素酶具有专一性和高效性,是破坏细胞壁的良好选择。王岩岩等人[5]用薄层层析法对纤维素酶酶解提取的陈皮黄酮类物质进行检测,证明酶法提取黄酮时不会破坏其有效成分。喻明洁等人[6]对橙皮苷的提取分离及检测方法进行了整理,传统的浸提法、回流法和索氏提取法等提取方法提取时间长、提取效率低,其中回流法和索氏提取法还需使用有机溶剂,不符合环境友好要求。本试验利用纤维素酶破坏陈皮细胞壁结构,使橙皮苷析出到溶剂中,从而提高橙皮苷的提取率,以改善传统提取工艺的不足。
1 材料与方法
1.1材料与试剂
陈皮(东鹏特饮公司提供),经过烘箱进一步干燥后,用中草药粉碎机打成粉末,过60目筛,得陈皮粉。
纤维素酶,酶活力1 500 NCU/g,诺维信(中国)生物技术有限公司提供;橙皮苷标准品(Hesperidin,HPLC>98%,20 mg),宝鸡市辰光生物有限公司提供;乙醇、柠檬酸、柠檬酸钠,均为分析纯。
1.2仪器与设备
UV-1800型紫外分光光度计,日本岛津公司产品;HH-4型数显恒温水浴锅,金坛市富华仪器有限公司产品;Centrifuge 5804R型台式高速离心机,德国艾本德(中国) 股份有限公司产品;SHZ-III型循环水真空抽滤机,上海亚荣生化仪器厂产品;BSA1245型电子分析天平、PB-10标准型pH计,Sartorius科学仪器(北京)有限公司产品。
1.3试验方法
1.3.1酶解辅助水工艺从陈皮中浸提橙皮苷的操作过程
称取1.000 g陈皮粉于100 mL烧杯中,加入纤维素酶,按液料比加入合适pH值的柠檬酸-柠檬酸钠缓冲液,放入水浴锅中水浴酶解一定时间后,再放入另一温度的水浴锅中浸提一定时间,取出冷却至室温,以转速4 000 r/min离心分离5 min,抽滤,量取体积,稀释100倍,于紫外分光光度计中测吸光度。
1.3.2单因素试验及设计方案
对酶添加量、液料比、酶解pH值、酶解温度、酶解时间、浸提温度、浸提时间这7个单因素分别进行单因素试验。每个因素取5个梯度,每个梯度各做3个平行处理,结果取平均值。
各单因素变量的梯度水平见表1。

表1 各单因素变量的梯度水平
1.3.3响应面设计
根据单因素试验的结果,选取酶添加量、酶解pH值、酶解温度、浸提温度4个对橙皮苷提取率影响较显著的单因素变量进行响应面设计试验,以探求在各单因素共同作用的条件下获得最大橙皮苷提取率的最佳工艺参数。
1.3.4橙皮苷标准曲线的绘制
准确称取10 mg橙皮苷标准品,置于100 mL容量瓶中,加乙醇充分溶解,定容至刻度,摇匀,配制成橙皮苷标准品溶液,质量浓度为0.1 mg/mL[7]。
以乙醇为空白对照液,用紫外分光光度计于200~600 nm波长对橙皮苷标准品溶液进行光谱扫描,确定波长吸收峰。
橙皮苷标准品吸收峰见图1。

图1 橙皮苷标准品吸收峰

式中:C——橙皮苷质量浓度,mg/mL,可根据测得的实际吸光度代入橙皮苷标准曲线方程求得;
V——体积,mL;
m——陈皮粉质量,mg。
2 结果与分析
2.1单因素试验结果及分析
2.1.1酶添加量对橙皮苷提取率的影响
准确称取 1.000 g陈皮粉,在液料比 30∶1 (V∶W),酶解pH值5.0,酶解温度60℃,酶解时间90 min,浸提温度100℃,浸提时间45 min的条件下,探讨酶添加量分别为10,20,25,30,40 mg/g时对橙皮苷提取率的影响。
不同酶添加量对橙皮苷提取率的影响见图2。
由图2可知,对1.000 g陈皮粉进行上述处理,其他条件不变的情况下,橙皮苷提取率随着酶添加量的增加而增大。在酶添加量为20 mg/g时橙皮苷提取率达到最大值5.90%,随后提取率随着酶添加量的
由图1可知,标准品溶液于284 nm处有最大吸收峰,因此确定284 nm为检测波长。
配制一组不同质量浓度的标准液,于波长284 nm处分别测定上述稀释溶液各自的吸光度,绘制吸光度A(Y)与橙皮苷质量浓度C(mg/mL) (X)的标准关系曲线,得到回归方程:Y=11.62X+0.083(R2= 0.999)。
1.3.5橙皮苷提取率的计算增加而降低。其原因可能是在酶浓度较高情况下发生了竞争性抑制作用,竞争性抑制作用可通过增加底物浓度得以解除[8];当酶添加量低于20 mg/g时,底物浓度相对较高,反应体系内不存在竞争性抑制作用,因此橙皮苷提取率与酶添加量呈正相关;当酶添加量高于20 mg/g时,底物浓度相对较低,无法解除竞争性抑制作用,导致橙皮苷提取率下降。由此可初步得知,酶解辅助水浸提工艺的最佳酶添加量为20 mg/g。
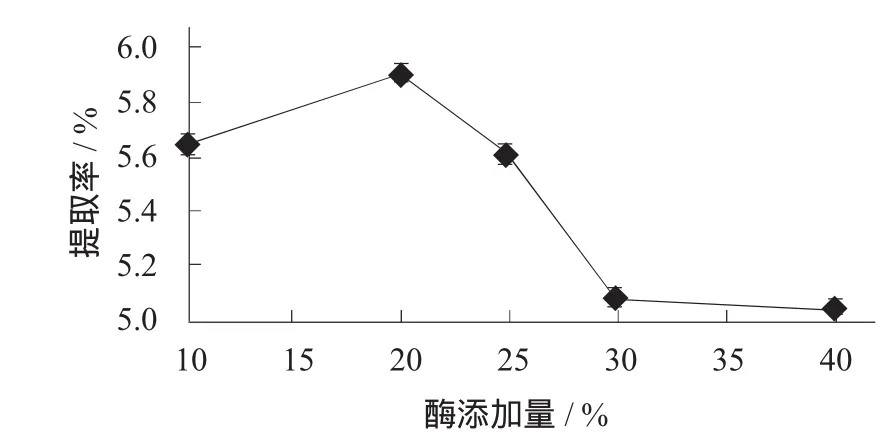
图2 不同酶添加量对橙皮苷提取率的影响
2.1.2酶解pH值对橙皮苷提取率的影响
准确称取1.000 g陈皮粉,在酶添加量10 mg/g,液料比30∶1(V∶W),酶解温度60℃,酶解时间90 min,浸提温度100℃,浸提时间45 min的条件下,探讨酶解pH值分别为4.0,4.5,5.0,5.5,6.0时对橙皮苷提取率的影响。
不同酶解pH值对橙皮苷提取率的影响见图3。

图3 不同酶解pH值对橙皮苷提取率的影响
由图3可知,对1.000 g陈皮粉进行上述处理,其他条件不变的情况下,橙皮苷提取率随着酶解pH值的增大而缓慢增大。在酶解pH值达到5.5时橙皮苷提取率达到最大值6.36%,随后提取率随着酶解pH值的增大而降低。由此可初步得知,酶解辅助水浸提工艺的最佳酶解pH值为5.5。
2.1.3酶解温度对橙皮苷提取率的影响
准确称取1.000 g陈皮粉,在酶添加量10 mg/g,液料比30∶1(V∶W),酶解pH值5.0,酶解时间90 min,浸提温度100℃,浸提时间45 min的条件下,探讨酶解温度分别为30,40,50,60,70℃时对橙皮苷提取率的影响。
不同酶解温度对橙皮苷提取率的影响见图4。
由图4可知,对1.000 g陈皮粉进行上述处理,其他条件固定的情况下,橙皮苷提取率随着酶解温度的上升而增大。在酶解温度为40℃时橙皮苷提取率达到最大值7.05%,随后提取率随着酶添加量的增加而降低;当酶解温度达到60℃后,橙皮苷提取率较低且趋于稳定,原因可能是酶解温度过高使酶失活,从而导致低提取率。由此可初步得知,酶解辅助水浸提工艺的最佳酶解温度为40℃。

图4 不同酶解温度对橙皮苷提取率的影响
2.1.4酶解时间对橙皮苷提取率的影响
准确称取1.000 g陈皮粉,在酶添加量10 mg/g,液料比30∶1(V∶W),酶解pH值5.0,酶解温度60℃,浸提温度100℃,浸提时间45 min的条件下,探讨酶解时间分别为40,60,80,100,120 min时对橙皮苷提取率的影响。
不同酶解时间对橙皮苷提取率的影响见图5。

图5 不同酶解时间对橙皮苷提取率的影响
由图5可知,对1.000 g陈皮粉进行上述处理,其他条件不变的情况下,橙皮苷提取率随着酶解时间的增加而增大。在酶解时间达到60 min时橙皮苷提取率达到最大值5.72%;随后提取率随着酶添加量的增加而趋于稳定,基本维持在5.6%~5.7%的提取率范围内,即酶解时间达到60 min后延长酶解时间对橙皮苷提取率影响不大。由此可初步得知,酶解辅助水浸提工艺的最佳酶解时间为60 min。
2.1.5浸提温度对橙皮苷提取率的影响
准确称取1.000 g陈皮粉,在酶添加量10 mg/g,液料比30∶1(V∶W),酶解pH值5.0,酶解温度60℃,酶解时间90 min,浸提时间45 min的条件下,探讨浸提温度分别为60,70,80,90,100℃时对橙皮苷提取率的影响。
不同浸提温度对橙皮苷提取率的影响见图6。
由图6可知,对1.000 g陈皮粉进行上述处理,其他条件不变的情况下,橙皮苷提取率随着浸提温度的增加而增大。在浸提温度为80℃时,橙皮苷提取率达到最大值5.98%;随后提取率随着酶添加量的增加而降低,原因可能是浸提温度过高使橙皮苷分解。胡玉梅等人[9]的研究表明,橙皮苷在温度较低的条件下较稳定,而在浸提温度较高的条件下(80℃以上)降解率则超过20%,100℃加热2 h,降解率达28.9%。可见浸提温度过高会导致橙皮苷分解、提取率下降。因此,酶解辅助水浸提工艺的最佳浸提温度为80℃。

图6 不同浸提温度对橙皮苷提取率的影响
2.1.6浸提时间对橙皮苷提取率的影响
准确称取1.000 g陈皮粉,在酶添加量10 mg/g,液料比30∶1(V∶W),酶解pH值5.0,酶解温度60℃,酶解时间90 min,浸提温度100℃的条件下,探讨浸提时间分别为15,25,35,45,55 min时对橙皮苷提取率的影响。
不同浸提时间对橙皮苷提取率的影响见图7。

图7 不同浸提时间对橙皮苷提取率的影响
由图7可知,对1.000 g陈皮粉进行上述处理,其他条件不变的情况下,橙皮苷提取率随着浸提时间的增加而增大。在浸提时间为35 min时,橙皮苷提取率达到最大值6.51%;随后提取率随着浸提时间的增加而降低。浸提时间达到35 min后提取率开始下降,其原因可能是随着浸提时间的增长,有部分橙皮苷开始分解。文赤夫等人[10]的研究表明,在加热温度相同的情况下,加热时间0~30 min内橙皮苷较稳定,加热时间达到35 min后橙皮苷含量开始下降。可见浸提时间过长可能会使橙皮苷分解,导致提取率下降。因此,酶解辅助水浸提工艺的最佳浸提时间为35 min。
2.1.7液料比对橙皮苷提取率的影响
准确称取1.000 g陈皮粉,在酶添加量10 mg/g,酶解pH值5.0,酶解温度60℃,酶解时间90 min,浸提温度100℃,浸提时间45 min的条件下,探讨液料比分别为25∶1,30∶1,40∶1,50∶1,55∶1 (V∶W)时对橙皮苷提取率的影响。
不同液料比对橙皮苷提取率的影响见图8。
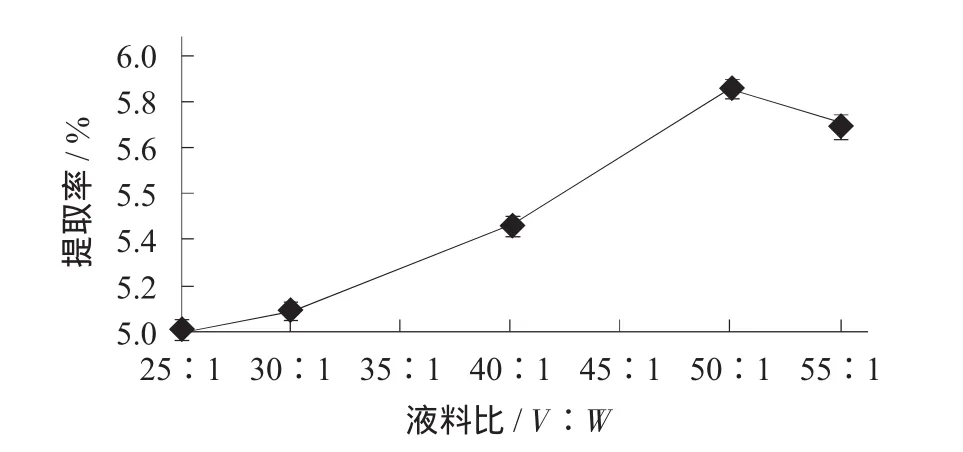
图8 不同液料比对橙皮苷提取率的影响
由图8可知,对1.000 g陈皮粉进行上述试验处理,其他条件不变的情况下,橙皮苷提取率随着液料比的增大而增大,在液料比为50∶1(V∶W)时橙皮苷提取率达到最大值5.88%;随后提取率随着液料比的增加而降低。由此可初步得知,酶解辅助水浸提工艺的最佳液料比为50∶1(V∶W)。
2.2响应面设计试验结果及分析
2.2.1响应面设计试验的结果
在单因素试验的基础上,利用Design Expert中的Box-Behnken Design,从7个单因素中选取4个对试验结果影响较显著的因素进行响应面设计试验。根据单因素试验结果,液料比、酶解时间及浸提时间3个因素对试验结果影响不显著,主要表现在这3个因素取最优值时,与取最优值前后2个值的结果相比,橙皮苷提取率的变化小于0.5%,用于响应面优化不符合实际意义;此外,根据实践经验,酶添加量及其受温度、pH值的影响比其受时间的影响更显著,因此本试验选取酶添加量、酶解温度、酶解pH值和浸提温度4个因素进行响应面设计,设计方案共包括29个组合试验,试验方法按照1.3.1的方法,固定条件为酶解时间60 min,浸提时间35 min,液料比50∶1(V∶W),每组试验进行3个平行处理,结果取平均值。
响应面试验设计方案及结果见表2。
2.2.2回归方程方差分析及处理
根据表2的试验组合及实际试验数据,利用Design Expert建立四元二次回归方程,得到的四元二次回归方程为:
Y=0.012BC+0.000 1BD+0.031CD-0.001 9A2+ 0.001 3B2+1.95C2+0.003 675D2.
此为本设计方案的全模型回归方程,对此方案进行方差分析。
方差分析(全模型)见表3。

表2 响应面试验设计方案及结果
由表3可知,回归方程的F值为43.82,说明回归方程显著,即方程预测值与试验所得实际值接近或吻合;失拟检验F值为2.03,表示水平不显著,说明试验受未知因素干扰的概率很小,即模型符合要求;显著水平p<0.05说明该项显著,即A,B,C,D,AD,CD,A2,B2,C2,D2均为显著项,其中B,D,C2,D2达到高度显著水平;显著水平p>0.1说明该项不显著,即AB,AC,BC,BD均为不显著项。
为简化模型,可于α=0.1显著水平剔除不显著因素[11],得到缩减模型。
方差分析(缩减模型)见表4。
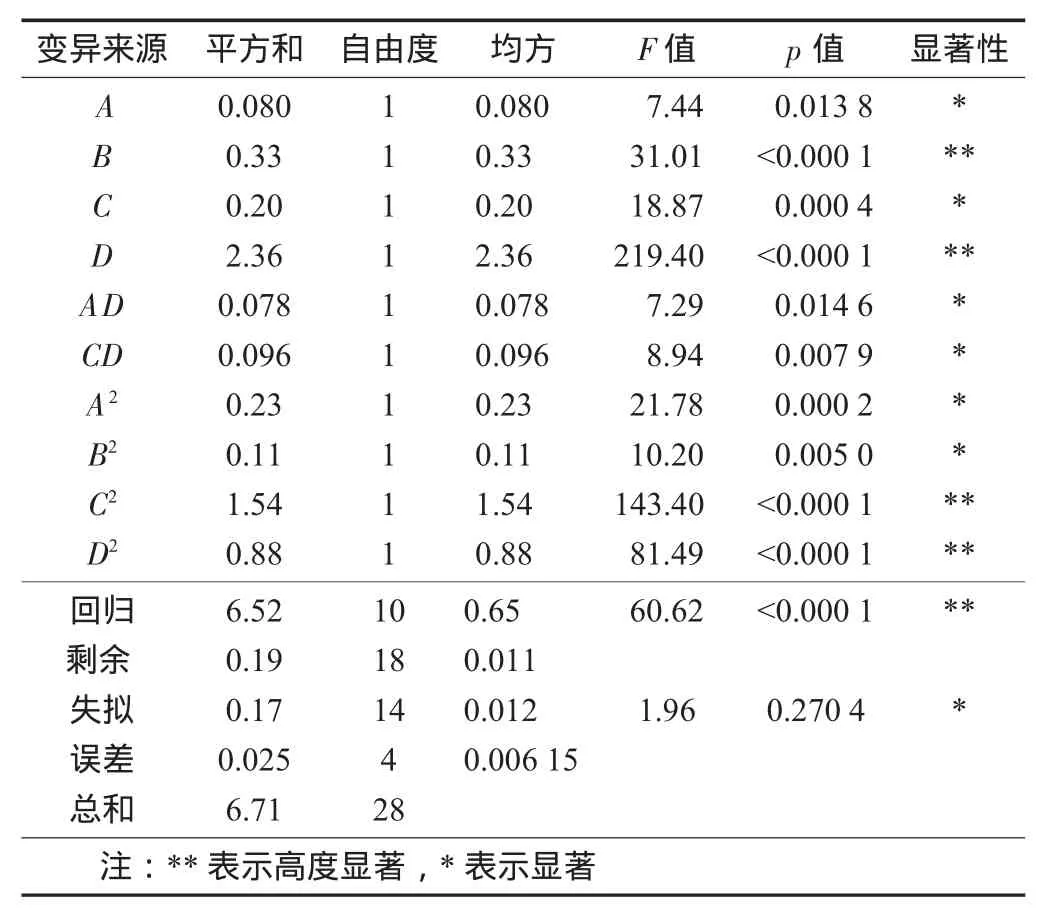
表4 方差分析(缩减模型)
由表4可知,优化后的方程如下:
Y=0.001 3B2-1.95C2+0.003 675D2.
缩减模型后所得的回归方程显著性检验F值为60.62,说明回归方程显著,即方程预测值与试验所得实际值接近或吻合;失拟检验F值为1.96,表示失拟水平不显著,说明试验受未知因素干扰的概率较小,试验误差较小,即缩减后的模型仍符合要求,可用于对试验结果的分析。该模型的回归变异占总变异的97.2%,目标函数与自变量之间具有明显的线性关系,能较好地反映酶添加量、酶解温度、酶解pH值及浸提温度对橙皮苷提取率的影响。
2.2.3响应面图分析
酶添加量、酶解温度、酶解pH值、浸提温度两两交互作用对橙皮苷提取率的影响见图9。
从单个因素的角度观察,随着酶添加量(A)的增加,橙皮苷提取率先增大后减小,当酶添加量处于中间水平时,橙皮苷提取率达到最大值;橙皮苷提取率随酶解温度(B)和酶解pH值(C)变化而变化的情况与酶添加量类似,当酶解温度与酶解pH值处于中间水平时,橙皮苷提取率最大;随着浸提温度(D)的增大,橙皮苷提取率逐渐增大,浸提温度水平较低时,橙皮苷提取率增长明显、速率较快,当浸提温度达到80℃,橙皮苷提取率达到最大值,随后随着浸提温度的升高,橙皮苷提取率趋于稳定。单因素试验中,浸提温度达到80℃后随着温度升高,橙皮苷提取率呈下降趋势;但在响应面试验中,浸提温度达80℃后随着温度升高,橙皮苷提取率趋于稳定,原因可能是当其他因素在响应面试验中均取较优值时,与浸提温度相比,橙皮苷提取率受其他因素的影响更大,导致浸提温度对橙皮提取率的影响不显著。

图9 酶添加量、酶解温度、酶解pH值、浸提温度两两交互作用对橙皮苷提取率的影响
分析各因素两两交互作用的结果,当酶添加量、酶解温度、酶解pH值均处于中间水平时,橙皮苷提取率有较大值;当浸提温度处于较高水平、其他因素处于中间水平时,橙皮苷提取率有较大值。
根据曲线的陡峭或平滑程度,可得知各因素对橙皮苷提取率的影响程度[12],结合表4的方差分析,可知其他条件不变的前提下,各因变量对橙皮苷提取率的影响大小排列顺序为酶解pH值>酶解温度>酶添加量>浸提温度。浸提温度取较高值,酶添加量、酶解温度、酶解pH值取中间值时,橙皮苷提取率有最大值,各因素的具体取值则利用Design Expert的Optimization优化分析对模型进行处理,得出最佳工艺条件为酶添加量21 mg/g,酶解pH值5.5,酶解温度42℃,浸提温度90℃,预测橙皮苷提取率为10.88%。
2.3优化验证试验的结果及分析
根据Design Expert分析预测所得的最佳工艺条件进行验证试验,试验方法按照1.3.1的方法,固定条件为酶解时间60 min,浸提时间35 min,料液比50∶1(V∶W),每组试验进行3个平行处理,结果取平均值。
验证试验结果显示橙皮苷提取率为10.78%,与预测值10.88%接近。《中国药典》中规定陈皮的最低橙皮苷含量为3.5%,本试验橙皮苷提取率10.78%,符合陈皮中最低橙皮苷含量要求,可见响应面优化模型合理可行。提取橙皮苷的最佳工艺条件为酶添加量21 mg/g,酶解pH值5.5,酶解温度42℃,浸提温度90℃,酶解时间60 min,浸提时间35 min,液料比50∶1(V∶W)。
3 结论
通过单因素试验可得出,在其他条件相同的情况下每个单因素对橙皮苷提取率的影响情况及其最佳取值,试验结果显示,单因素试验中最佳液料比为50∶1(V∶W),最佳酶添加量为20 mg/g,最佳酶解pH值为5.5,最佳酶解温度为40℃,最佳酶解时间为60 min,最佳浸提温度为80℃,最佳浸提时间35 min。
设计响应面优化试验对酶解辅助水浸提工艺进行优化,最终得到的最佳组合工艺条件为液料比50∶1(V∶W),酶添加量21 mg/g,酶解pH值5.5,酶解温度42℃,酶解时间60 min,浸提温度90℃,浸提时间为35 min。经过验证试验,该组合处理所得的橙皮苷提取率10.78%与预测值10.88%十分接近,因此可判定响应面优化模型合理可行。
相比传统的橙皮苷提取方法,优化后的工艺具有提取率高、耗时较短、效率较高等优点,且此工艺主要试剂为水和纤维素酶,纤维素酶添加量较少,因此较符合环境友好要求及经济效益要求。
[1]钱俊臻,王伯初.橙皮苷的药理作用研究进展 [J].天然产物研究与开发,2010(1):48-51.
[2]Amirhossein Ahmadi,Amir Shadboorestan.Oxidative stress and cancer;the role of hesperidin,a citrus natural bioflavonoid,as a cancer chemoprotective agent[J].Nutrition and Cancer,2016,68(1):29-39.
[3]国家药典委员会.中华人民共和国药典2015年版第一部 [M].北京:中国医药科技出版社,2015:191.
[4]吴文博,董占军.中药制剂中细胞破壁技术探讨 [J].中国药房,2011,22(3):285-287.
[5]王岩岩,李文娟.纤维素酶提取陈皮黄酮的工艺条件 [J].食品与生物技术学报,2008,27(2):71-74.
[6]喻明洁,吕圭源,陈素红.橙皮苷提取分离及检测方法研究进展 [J].亚太传统医药,2011,7(5):171-173.
[7]曾柏全,周小芹,谢西玉.纤维素酶-微波法提取脐橙皮橙皮苷工艺优化 [J].食品科学,2010,31(4):85-89.
[8]黄卓烈,朱利泉.生物化学 [M].第2版.北京:中国农业出版社,2012:92-93.
[9]胡玉梅,孟兆青,张珊,等.橙皮苷在碱性溶液中的稳定性研究 [J].世界科学技术-中医药现代化,2014,16(10):2 270-2 273.
[10]文赤夫,李国章,董爱文,等.橙皮苷的提取及其稳定性分析 [J].生物质化学工程,2006,40(3):37-40.
[11]肖南,辛修锋,余小林.杨梅渣多酚的提取及其抗氧化作用 [J].食品与发酵工业,2014,40(6):236-240.
[12]李盈蕾,陈建华,孙吉佑,等.响应面分析法优选黄花菜多糖提取工艺 [J].中国酿造,2010(7):72-75.◇
Study on Cellulose Enzyme-assisted Extraction of Hesperidin from Pericarpium Citri Reticulatae with Response Surface Analysis
XIAO Nan1,LIN Minxin2(Food College,South China Agricultural University,Guangzhou,Guangdong 510642,China)
To optimize the cellulose enzyme-assisted extraction of hesperidin from Pericarpium citri reticulatae,on the base of the single factor investigation,amount of enzyme added,reaction pH,hydrolysis temperature,extraction temperature are studied with the central composite design and their interactions on the yield of hesperidin from Pericarpium citri reticulatae are also investigated.Optimal conditions can be concluded as follows:enzyme dosage 21 mg/g,hydrolysis pH 5.5,hydrolysis temperature 42℃,extraction temperature 90℃,purified water as the solvent.On these conditions,the yield of the hesperidin is up to 10.78%.
cellulose enzyme;hesperidin;Pericarpium citri reticulatae;response surface analysis
R284.2
A
10.16693/j.cnki.1671-9646(X).2016.08.034
1671-9646(2016)08b-0018-06
2016-06-21
广东省科技计划项目“岭南特色陈皮饮料的技术研究及产业化”(2013B090600040)。
肖南(1979— ),女,硕士,实验师,研究方向为食品加工工艺。
