海鲈鱼腌制过程中产胺菌的分离筛选与生物学特性研究
2016-09-26钱茜茜吴燕燕魏涯林婉玲戚勃荣辉
钱茜茜,吴燕燕,魏涯,林婉玲,戚勃,荣辉
1(中国水产科学研究院 南海水产研究所 农业部水产品加工重点实验室,广东 广州,510300) 2(上海海洋大学 食品学院,上海,201306)
海鲈鱼腌制过程中产胺菌的分离筛选与生物学特性研究
钱茜茜1,2,吴燕燕1*,魏涯1,林婉玲1,戚勃1,荣辉1
1(中国水产科学研究院 南海水产研究所 农业部水产品加工重点实验室,广东 广州,510300) 2(上海海洋大学 食品学院,上海,201306)
为探明海鲈腌制加工过程生物胺产生菌的菌相,通过生物胺对培养基进行初筛,采用高效液相色谱进行分析以,并通过VITEK 2 菌种鉴定系统,对海鲈腌制加工过程中的产胺菌进行分离鉴定,研究了温度、pH和NaCl浓度对产胺量较高的菌株生长和产胺能力的影响。结果表明,海鲈腌制加工过程中不仅存在假单胞菌(Pseudomonas)、弧菌(Vibrio)以及葡萄球菌(Staphylococcus)等常见的产胺菌,而且还分离到新的产胺菌——麻疹孪生球菌(Gemellamorbillorum)、琼氏不动杆菌(Acinetobacterjunii)、皮氏罗尔斯顿菌(Ralstoniapickettii)和格氏乳球菌(Lactococcusgarvieae)。这些生物胺产生菌生长和产胺的最适温度是30 ℃,pH值对其影响不大,具有较高的耐盐性,100~200 g/L的食盐质量浓度可以抑制产胺菌的生长,100 g/L的食盐质量浓度下可以抑制组胺的产生,但200 g/L的食盐才可以抑制腐胺、尸胺和酪胺的形成。
海鲈鱼;腌制加工;产胺菌;分离与鉴定
产胺菌普遍存在于海水鱼的体表及活鱼的鳃和内脏中,鱼体存活时并不会对其造成危害,一旦死亡,随着防御系统的破坏,产胺菌在适宜的条件下迅速生长繁殖并产生大量生物胺。过量的生物胺会对人体产生伤害,会出现诸如头痛,恶心,痉挛等一系列中毒性状,严重的甚至会危及生命[1-2]。其中,组胺对人体的毒害作用是最大的,是人们对水产品安全问题关注的热点[3-4]。其次是酪胺,这两种生物胺可以让人体产生明显的中毒反应。腐胺和尸胺本身毒性很低,但它们会加强组胺和酪胺的毒性,同时,它们还是致癌物质亚硝胺类的前体[5-6]。微生物产生物胺需要具备3个条件[7]:1)必须要有充足的游离氨基酸;2)具有氨基酸脱羧酶活性的微生物;3)具有适合微生物生长及氨基酸脱羧酶合成的环境条件。国内外研究发现,一些假单胞菌可以产生腐胺、组胺和酪胺,肠细菌是腐胺、尸胺最主要的产生菌,有的还可以产生酪胺和组胺[8]。另外,一些葡萄球菌属和弧菌属也是发酵肉制品中的主要产胺菌[9]。
海鲈鱼肉质鲜嫩,洁白嫩滑,滋味醇香,营养丰富,富含蛋白质和多种营养维生素、DHA等对人体健康有益的微量元素。近年来,淡水养殖海鲈鱼获得成功,并且产量剧增,已成为今年水产养殖品种中比较出彩的一个品种。但是,目前还没有关于海鲈鱼深加工过程中产胺菌的研究报道。本课题组通过生物胺筛选培养基,并结合高效液相色谱技术对海鲈鱼在传统腌制加工过程中的产胺菌进行分离鉴定,研究温度、pH和盐含量对所分离菌株生长和产生物胺能力的影响,为水产品在腌制加工过程中生物胺的控制提供参考依据。
1 材料与方法
1.1材料、试剂与设备
1.1.1原料
海鲈鱼(Japanese Sea Bass),500~600 g/条,体长30~40 cm,购自广州华润万家超市。
1.1.2主要试剂
生物胺标准品:腐胺(PUT)(≥98%);尸胺(CAD)(≥95%);组胺(HIS)(≥99%);酪胺(TYR)(≥99%),均购自美国Sigma公司;乙腈(色谱纯)、丹磺酰氯(Dns-Cl,≥99%)、甲醇(色谱纯)购自上海安谱科学仪器有限公司;L-组氨酸、L-酪氨酸、L-鸟氨酸、L-赖氨酸均为分析纯,购自BIOSHARP公司;其他试剂均为化学纯或分析纯,购于广州粤申化学试剂厂;实验用水均为超纯水。
1.1.3培养基
生物胺初筛培养基:蛋白胨5 g,酵母浸粉5 g,L-组氨酸18.5 g,NaCl 5 g,CaCO31 g,琼脂20 g,溴甲酚紫0.06 g,蒸馏水1000 mL。pH5.3,121 ℃高压灭菌20 min。
营养肉汤培养基:蛋白胨10 g,牛肉酵粉3 g,NaCl 5 g,蒸馏水1 000 mL。pH 7.4±0.2,121 ℃高压灭菌20 min。
1.1.4仪器设备
Agilent 1100高 效 液 相 色 谱 仪,美国Agilent 公司;立式蒸汽压力灭菌锅388型,上海申安医疗器械厂;VITEK 2 Compact菌种鉴定系统,法国生物梅里埃公司;3K30冷冻离心机,美国Sigma公司;SW-CJ-1FD超净工作台,江苏苏净安泰公司;SPX-320生化培养箱,宁波东南仪器厂;BX53显微镜,日本OLYMPUS;TU-1990 紫外-可见分光光度计,北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1传统腌干鱼工艺[10]
鲜海鲈鱼→加盐(200 g/L)腌制→浸泡脱盐→干燥成品
取海鲈鱼腌制加工过程中4个阶段的产品作为样品,每个阶段随机抽取2条鱼,装入无菌自封袋中,于4 ℃保存。这4个加工阶段分别以A、B、C、D表示。
1.2.2产胺菌株的初步分离与纯化
无菌剪取10 g鱼肉,剪碎后置于装有90 mL灭菌生理盐水的三角瓶中,混合均匀,用无菌生理盐水依次稀释为102、103、104倍,取0.1 mL上述不同浓度的稀释液涂布于生物胺初筛培养基上,30 ℃培养3 d,观察菌落。挑出各培养基上的蓝色或紫色菌落,在初筛培养基上纯化2次以上,取单菌落保存菌种。
1.2.3产胺菌生物胺检测[11-12]
将纯化后的细菌接种于营养肉汤培养基中培养18 h,取1 mL菌悬液接种于9 mL添加了0.1%氨基酸(组氨酸、酪氨酸、赖氨酸、鸟氨酸)的营养肉汤培养基中,30 ℃,140 r/min摇床振荡培养2 d后,取培养液1 mL,加入1 mL 5%的三氯乙酸,用冷冻离心机于4 ℃、12 000 r/min离心5 min,取1 mL上清液,加入200 L 2 mol/L NaOH 溶液使之成碱性,再加入300 μL饱和NaHCO3缓冲溶液进行缓冲,然后加入丹磺酰氯(10 mg/mL 溶于丙酮)2 mL,转移至5 mL的容量瓶中,于40 ℃恒温水浴锅中避光反应45 min后,再加100 L氨的体积分数为25%的氨水于暗处静置30 min,终止衍生反应,最后用乙腈定容至5 mL,衍生处理后用0.22 μm滤膜过滤,用高效液相色谱测定生物胺含量。通过与生物胺标准品的液相色谱图进行对照,最终确定样品中的生物胺成分。色谱条件如下:色谱柱:C18柱(5 μm,250 mm×4.6 mm);柱温40℃;进样量10 μL;流速1 mL/min;荧光激发波长为350 nm,发射波长为520 nm。流动相A为0.1 mol/L乙酸铵溶液,B为甲醇,C为乙腈,D为超纯水。
1.2.4产胺菌的鉴定
挑取产胺菌进行革兰氏染色实验,确定细菌鉴定卡的选择。然后将其接种于3 mL无菌盐水(4.5 g/L NaCl,pH4.5~7.0)中,混匀,用VITEK 2比浊仪配制相当于0.80~0.10 麦氏单位的菌悬液,使用VITEK 2 全自动微生物分析系统进行菌种鉴定[13]。
1.2.5温度对产胺菌生长和产生物胺的影响
取1 mL产胺菌的菌悬液接种至9 mL添加氨基酸的营养肉汤培养基中,分成6组分别于0,4,20,25,30,35 ℃下静置培养24 h,每个温度均设置空白对照;取一定量的菌液,用紫外分光光度计测定其在605 nm处的吸光值(OD值);另取1 mL通过高效液相色谱测定生物胺含量。生物胺含量的测定参照1.2.3中的方法。
1.2.6pH对产胺菌生长和产生物胺的影响
取1 mL产胺菌的菌悬液接种至9 mL pH分别为4,5,6,7,8含氨基酸的营养肉汤培养基中,每个pH值均设置空白对照,30℃培养箱中静置培养24 h;采用1.2.5中的方法测定菌液的OD值和生物胺含量。
1.2.7NaCl质量浓度对产胺菌生长和产生物胺的影响
取1 mL产胺菌的菌悬液接种至9mL NaCl质量浓度分别为5,50,100,150,200 g/L含氨基酸的营养肉汤培养基中,每个NaCl质量浓度均设置空白对照,30 ℃培养箱中静置培养24 h;采用1.2.4中的方法测定菌液OD值和生物胺含量。
1.2.8数据处理方法
所有数据采用Excel与JMP软件进行处理和分析,其中显著性分析采用Tukey法进行两两比较,以P<0.05 说明变化显著。
2 结果与讨论
2.1产胺菌的初步分离与纯化
通过初步的分离筛选共获得不同菌落形态的细菌14株,其中样品A获得4株,B获得2株,C获得6株,D获得2株,将初步筛选到的菌株在生物胺初筛培养上纯化,均能使培养基变成蓝紫色,按照分离的时间顺序分别编号为A1~A4,B1~B2,C1~C6,D1~D2。
2.2产胺菌的生物胺检测及菌种鉴定
如图1所示,腐胺、尸胺、组胺和酪胺4种生物胺的分离效果良好。
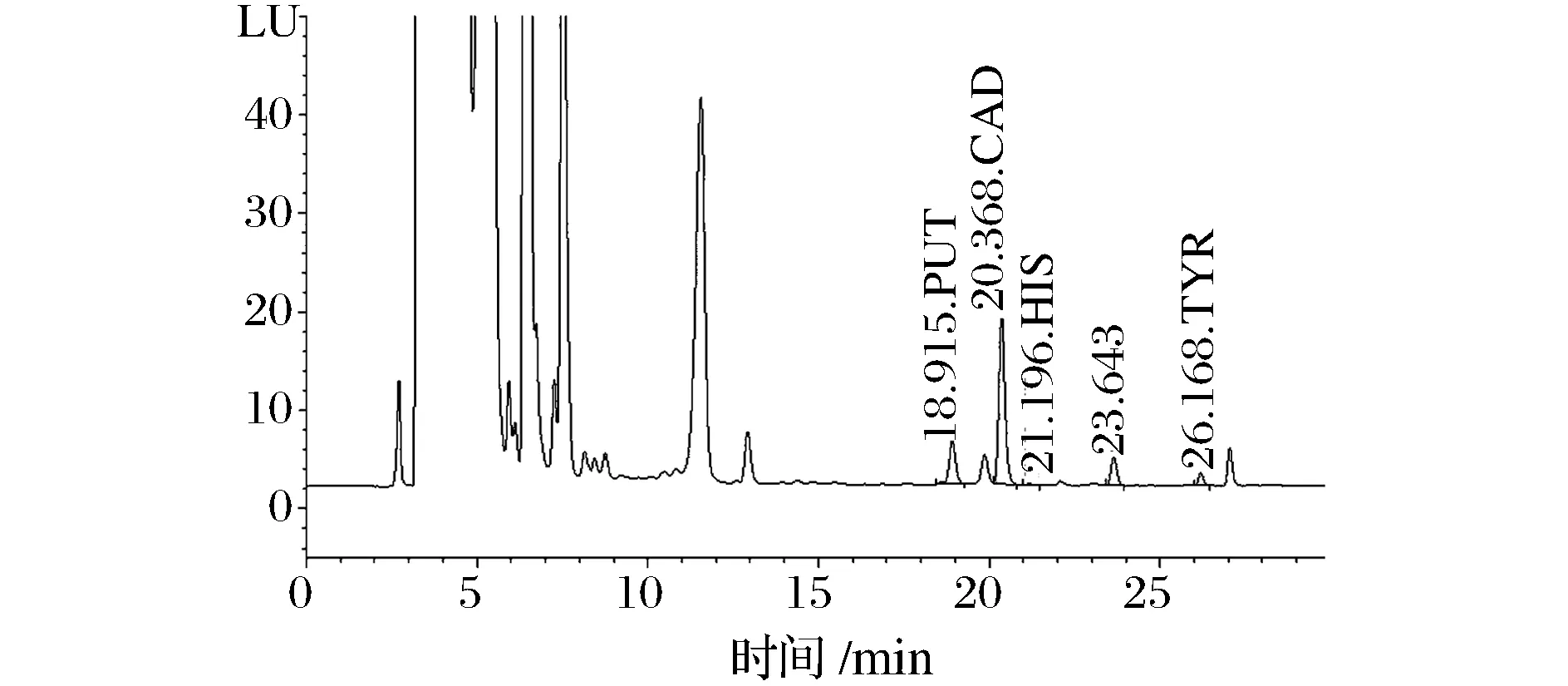
PUT-腐胺;CAD-尸胺;HIS-组胺;TYR-酪胺图1 生物胺样品图谱Fig.1 HPLC chromatographic profiles of biogenic amines
产胺菌的生物胺含量及菌种鉴定结果如表1所示。由表1可以看出,样品C中产胺菌的检出率最高(6株),并且大多数具有较强的产生物胺能力。而样品B和D产胺菌的检出率最低。原因是腌制过程中随着食盐的不断渗入,高浓度的食盐抑制了微生物的生长,漂洗阶段鱼肉中食盐浓度迅速下降,鱼肉暴露于空气中且肌肉水分含量较高而易于产胺菌生长。到了干燥阶段,鱼肉中水分含量的降低导致水分活度下降,抑制了细菌的生长。
通过对培养液中细菌代谢物的检测,发现所分离的各产胺菌产生物胺种类和浓度存在很大差异,LOPER-SABATER 等[14]在研究金枪鱼中组胺产生菌时也发现鱼体中组胺的产生及产量跟鱼体内组胺产生菌的种属与数量有密切关系。产胺菌的种类有很多,发酵鱼制品中主要有弧菌属、假单胞菌属、葡萄球菌属、乳酸菌中的乳杆菌属等[15],这些菌种都能够产生氨基酸脱羧酶,本实验不仅分离到了假单胞菌属,葡萄球菌属和弧菌属,而且还分离出琼氏不动杆菌、麻疹孪生球菌、皮氏罗尔斯顿菌等新的产胺菌。分离的弧菌均具有较强的产尸胺能力,但不产组胺。周卫枫等[16]用TCBS培养基和组胺选择性培养基来筛选鲭鱼鱼肉中产组胺的弧菌,结果也发现分离出来的弧菌在组胺选择性培养基中呈阴性。其他产胺菌均可同时产生4种生物胺,但含量各不一样。格氏乳球菌C5和C6分别具有最高的产腐胺量和产尸胺量,沃氏葡萄球菌C1的产组胺量最高,溶血葡萄球菌D1的产酪胺量最高,因此继续对C5、C6、C1、和D1这4株菌进行分析,探究温度、pH、食盐质量浓度对其生长和产胺量的影响。
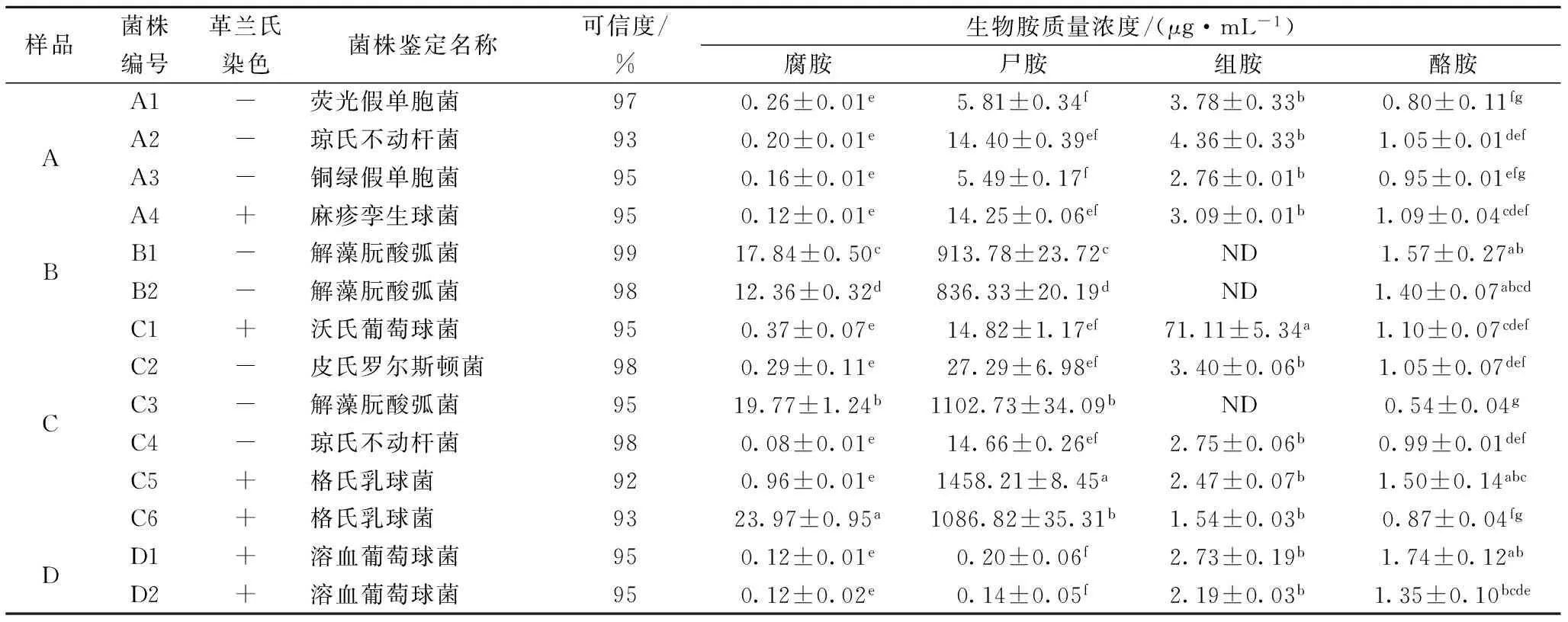
表1 14株细菌的生物胺产生情况及鉴定结果
注:ND表示未检出,同一列相同字母表示差异不显著(P>0.05)。
2.3温度对产胺菌生长和产生物胺的影响
通常情况下,25~35 ℃的温度范围对产胺菌的生长最有利,且在该温度范围内产胺量也最大[17],温度低于4℃时,产胺菌的生长和产胺能力均会受到抑制[18]。这与本研究的结论一致,由图2可以看出,20~35 ℃温度范围最适合4株产胺菌的生长,在30 ℃下,4株产胺菌的OD值均达到最大且均有最大的产生物胺量。低温对产胺菌的生长和产胺量均有明显的抑制作用,温度低至4℃时,产胺菌株仍能生长,但产胺量明显减少。当温度低至0 ℃时,4株产胺菌株的生物胺能力明显被抑制,几乎不产生物胺。但在20~30 ℃范围内,产胺菌的生长和产胺量均随着温度的上升而增加,之后,随温度的上升而减少。由此可见,30 ℃对产胺菌的生长最有利,同时,在该温度下,4株产胺菌均有最大产胺量。因此,尽量避免将海鲈鱼暴露在30 ℃左右的环境中,另外,低温贮藏也可以抑制生物胺的产生。
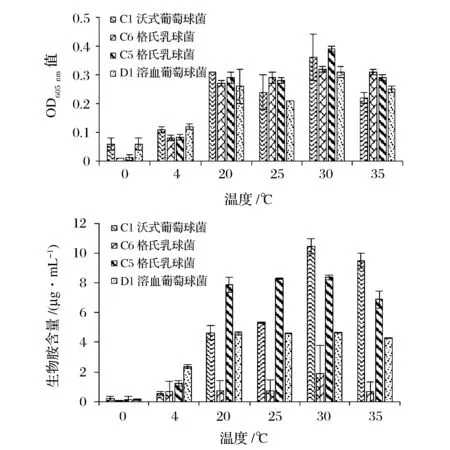
图2 温度对菌株生长和产生物胺的影响Fig.2 Effect of the temperature on growth and biogenic amine production of strains (C1菌株的生物胺含量指组胺含量C6菌株的生物胺含量指腐胺,C5指尸胺,D1指酪胺。图3和图4与此相同。)
2.4pH对产胺菌生长和产生物胺的影响
由图3可以看出,在6~8的pH范围内,4株产胺菌均有较大吸光度值,且在pH6时吸光度值均达到最大,同时,沃氏葡萄球菌在pH6时也达到最大产组胺量,但是,其他3株产胺菌的产生物胺含量受pH变化的影响很小。在pH4~5范围内,吸光度值基本没有变化,说明低pH值可以抑制产胺菌的生长。总的来说,pH变化对产胺菌生长和产组胺能力有一定的影响,但是对其产腐胺、尸胺和酪胺能力的影响并不明显。
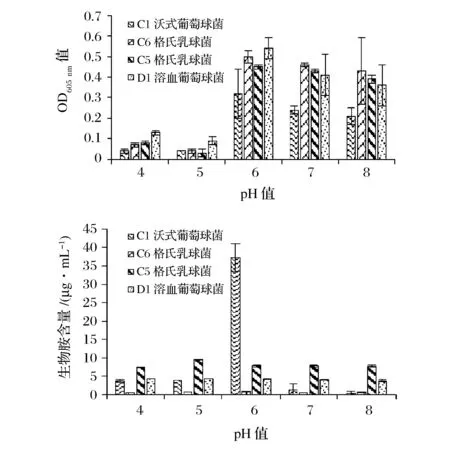
图3 pH对菌株生长和产生物胺的影响Fig.3 Effect of the pH on growth and biogenic amine production of strains
2.5食盐浓度对产胺菌生长和产生物胺的影响
由图4可以看出,食盐质量浓度<50 g/L,产胺菌均能正常生长,但随着食盐浓度增大,对产胺菌的抑制作用也越明显。在100 g/L食盐质量浓度下,沃氏葡萄球菌虽然能缓慢生长,但其产组胺能力明显被抑制,几乎不产组胺。溶血葡萄球菌耐盐性最强,在200 g/L的食盐质量浓度下仍能生长,但产酪胺量为0,同时,在该食盐浓度下腐胺和尸胺含量也为0。由以上结果可知,100~200 g/L的食盐质量浓度可以抑制产胺菌的生长,100 g/L食盐浓度可以抑制组胺的产生,但是,200 g/L的食盐质量浓度才可以抑制腐胺、尸胺和酪胺的形成。据资料显示,当培养基中的食盐浓度从0增加到60 g/L时,保加利亚乳杆菌(Lactobacillusbulgaricus)的数量和产生物胺能力大大降低[19]。LATORRE-MORATALLA 等[20]发现食盐质量浓度在35~55 g/L能够抑制组胺的积累。而本研究中得出100 g/L以上的食盐浓度才可以抑制产胺菌可能是由于这些产胺菌本身来源于传统腌制海鲈,自身的耐盐性比较强。
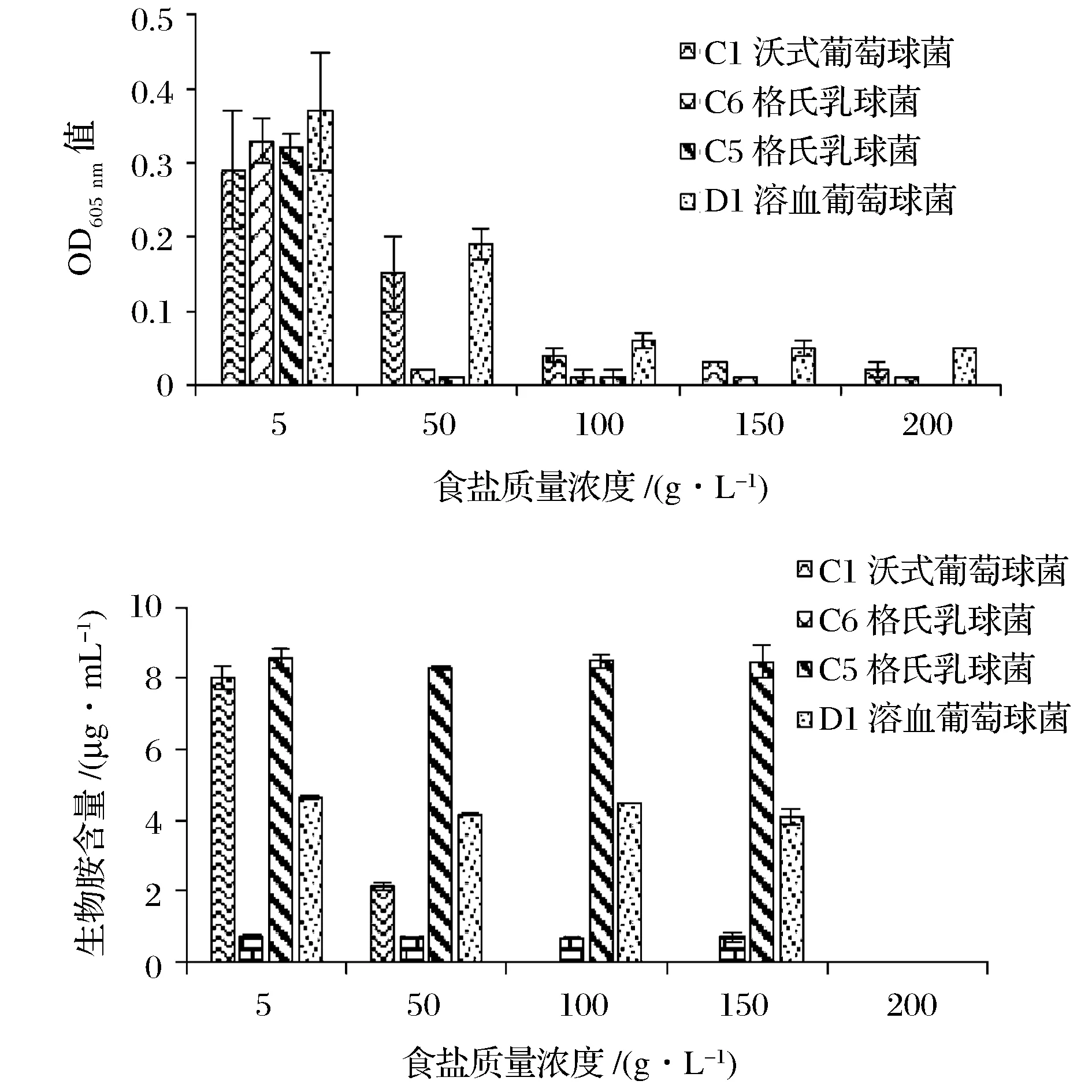
图4 食盐质量浓度对菌株生长和产生物胺的影响Fig.4 Effect of the salt concentration on growth and biogenic amine production of strains
3 结论
(1)本研究利用生物胺初筛培养基,并结合高效液相色谱技术,从海鲈鱼传统腌制加工过程中不仅分离得到假单胞菌、弧菌以及葡萄球菌等常见的产胺菌,而且还分离到了麻疹孪生球菌、琼氏不动杆菌、皮氏罗尔斯顿菌和格氏乳球菌这些新的产胺菌。
(2)温度和盐度的变化对产胺菌的生长和产生物胺的影响较大,pH变化对其影响较小。低温对产胺菌的生长和产胺能力均有明显抑制作用,30 ℃是其生物胺产生菌生长和产胺的最适温度。100~200 g/L的食盐含量对产胺菌株也有明显的抑制作用,100 g/L的食盐含量可以抑制组胺的产生,200 g/L的食盐含量才可以抑制腐胺、尸胺和酪胺的形成。所以高盐度对生物胺的形成有一定的控制作用。
(3)分离到的产胺菌在低温环境下生长缓慢,并且具有较高的耐盐性,因此,可以采用低温和高食盐浓度来控制生物胺的产生。大量研究报道,细菌对生物胺的产生非常重要,研究生物胺菌的生物学特性,从而抑制这类细菌的生长,是减少腌制水产品中生物胺含量一种有效的方法。
[1]CINQUINA A L,CALA,LONGO F,et al.Determination of biogenic amines in fish tissues by ion-exchange chromatography with conductivity detection[J].Journal of Chromatography A, 2004,1 032(1):73-77.
[2]于长青,姚笛,满永刚,等.发酵肉制品中生物胺的危害及控制[J].肉类研究,2010(1):41-45.
[3]魏涯,吴燕燕,李来好,等.船上加工日本鳀的质量安全管理研究[J].南方水产科学,2011,7(2):61-67.
[4]MAH J,HWANG H.Effects of food additives on biogenic amine formation in Myeolchi-jeot,a salted and fermented anchovy (Engraulisjaponicus)[J].Food Chemistry,2008,114(1):168-173.
[5]ÖNAL A.A review:Current analytical methods for the determination of biogenic amines in foods[J].Food Chemistry,2006,103(4):1 475-1 486.
[6]FUNEL A L.Biogenic amines in wines:role of lactic acid bacteria[J].FEMS Microbiology Letters,2006,199(1):9-13.
[7]KORAL S,TUFAN B,AR A,et al.Investigation of the contents of biogenic amines and some food safety parameters of various commercially salted fish products[J].Food Control,2013,32(2):597-606.
[9]AUERSWALD L,MORREN C,LOPATA A L.Histamine levels in seventeen species of fresh and processed South African seafood[J].Food Chemistry,2005,98(2):231-239.
[10]任中阳,吴燕燕,李来好,等.腌干鱼制品热泵干燥工艺参数优化[J].南方水产科学,2015,11(1):81-88.
[11]陈玉峰,吴燕燕,李来好,等.腌干鱼制品中8种生物胺测定方法的优化[J].中国渔业质量与标准,2014,4(4):41-48.
[12]杨贤庆,翟红蕾,郝淑贤,等.高效液相色谱法测定生物胺衍生条件的优化研究[J].南方水产科学,2012,8(1):49-53.
[13]王瑞旋,耿玉静,冯娟,等.杂色鲍哈维弧菌耐药质粒的鉴定和分析[J].南方水产科学,2012,8(2):1-6.
[15]LANDETE J M,de LAS Rivas B,MARCOBAL A,et al.Molecular methods for the detection of biogenic amine-producing bacteria on foods[J].International Journal of Food Microbiology,2007,117(3):258-269.
[16]周卫枫,汤海青,贺林娟,等.鲭鱼鱼肉中组胺产生菌的筛选与鉴定[J].食品科学,2012,33(13):225-229.
[17]杨健,吴祖芳,周秀锦,等.冷冻鲣鱼中产组胺菌的分离筛选及其生物学特性研究[J].中国食品学报,2012,12(8):25-31.
[18]杨健,吴祖芳,周秀锦,等.鲐鱼中产组胺菌的分离筛选与生物学特性初步研究[J].食品工业科技,2012,33(9):190-193.
[19]王永丽,李锋,陈肖,等.传统发酵肉制品中生物胺形成机理及检测控制技术[J].肉类研究,2013,27(6):39-43.
[20]LATORRE-MORATALLA L M,BOVER-CID S,VIDAL-CAROV M C.Technological conditions influence aminogenesis during spontaneous sausage fermentation[J].Meat Science,2010,85(3):537-541.
Study on isolation and biological characteristics of biogenic amine-forming bacteria during the pickled processing of Japanese Sea Bass
QIAN Qian-qian1,2,WU Yan-yan1*,WEI Ya1,LIU Wan-ling1,QI Bo1,RONG Hui1
1(South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Lab of Aquatic Product Processing,Ministry of Agriculture,Guangzhou 510300,China) 2(Shanghai Ocean University,Shanghai 201306,China)
In order to explore the bacterial analysis during the pickled processing of Japanese Sea Bass, biogenic amine-forming bacteria during that processing were isolated and identified by primary screening with biogenic amine-forming bacteria isolation agar, high performance liquid chromatography analysis and VITEK 2 strain identification system. Effects of temperature, pH and salt concentration on growth and biogenic amine production of strains producing higher biogenic amine were studied. The results showed that not only existed common biogenic amine-forming bacteria such asPseudomonas,VibrioandStaphylococcuswere existed in the Japanese Sea Bass during the pickled processing, but also new strains includingGemellamorbillorum,Acinetobacterjunii,RalstoniapickettiiandLactococcusgarvieaewere isolated. The optimal growing temperature for production of biogenic amine in biogenic amine-forming bacteria were 30 ℃. The effect of pH was little on biogenic amine production of strains. These strains could tolerate relatively high salt concentration. 100~200 g/L salt concentration could inhibit the growth of biogenic amine-forming bacteria. 100 g/L salt concentration could inhibit the production of histamine. Furthermore, 200 g/L salt concentration could inhibit the production of putrescine, cadaverine, tyramine.
Japanese Sea Bass; pickled processing; biogenic amine-forming bacteria; isolation and identification
10.13995/j.cnki.11-1802/ts.201601013
硕士研究生(吴燕燕博士为通讯作者,E-mail: wuyygd@163.com)。
广东省海洋渔业科技与产业发展专项(A201501C02);国家自然科学基金项目(31371800);中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院南海水产研究所)资助项目(2015YD02)
2015-07-22,改回日期:2015-09-14
