维格列汀有关物质检查
2016-09-26杨梅,陈红
杨 梅,陈 红
(成都市食品药品检验研究院,四川 成都 610045)
维格列汀有关物质检查
杨梅,陈红
(成都市食品药品检验研究院,四川成都610045)
建立了测定维格列汀有关物质检查方法。用十八烷基硅烷键合硅胶为填充剂,以磷酸盐缓冲液(取磷酸氢二铵2.64 g,溶于1000 mL水中,用稀氨水或磷酸溶液调节pH值至8.0±0.05)-甲醇(90:10)为流动相A,甲醇为流动相B;进行梯度洗脱。流速1.0 mL·min-1,柱温40 ℃,检测波长210 nm。对维格列汀3种杂质进行定量检查。结果表明:各杂质与主成分能完全分离,杂质Ⅰ、Ⅱ、Ⅲ检测限分别为1.1、1.2、1.2 ng(S/N=3),回收率分别为96.8%、103.6%、107.1%,浓度与峰面积均呈线性(r>0.999)。结论 本法准确、简便、快速,可用于维格列汀有关物质检查。
维格列汀;有关物质;维格列汀杂质Ⅰ、Ⅱ、Ⅲ
新型降糖药维格列汀(Vildagliptin,(S)-1-[2-(3-羟基金刚烷-1-氨基)乙酰基]吡咯烷-2-腈)是一种的选择性二肽基肽酶-4(DPP-4)抑制剂。通过抑制DPP-4对内源性肠促胰岛激素的降解,提高内源性胰高血糖素样肽(GLP-1)的浓度,促进β细胞释放胰岛素,抑制α细胞分泌胰高血糖素,使胰岛素水平升高。该类药物不引起低血糖或体重增加等不良反应[1-3]。

图1 维格列汀和杂质Ⅰ、Ⅱ、Ⅲ结构式
目前,EP8.0、USP38、CHP2015均未收载维格列汀。为此,本文采用高效液相色谱法对其进行有关物质检查,以控制杂质,提高质量。维格列汀和杂质Ⅰ、Ⅱ、Ⅲ结构式见图1。其中,杂质Ⅱ为维格列汀合成的中间体,杂质Ⅰ是维格列汀与杂质Ⅱ的反应产物,杂质Ⅲ是维格列汀合成过程中酰胺脱水不完全或分子中的氰基水解转化成的[4-5]。
1 实 验
1.1仪器与试药
Waters e2695-2998高效液相色谱仪,美国Waters公司;BP211D电子天平,北京赛多利斯公司。
维格列汀原料(批号:1302001667、1402003781、1402003806),维格列汀对照品(批号:WS/VID/03,含量:99.49%),杂质Ⅰ(批号:CG-3188/dimer/1767/06-B,含量:91.05%),杂质Ⅱ(批号:CG-3188/KSM-Ⅱ/1820/08,含量:99.60%),杂质Ⅲ(批号:CG-3188/Imp/1751/23,含量:98.51%),均由Alembic Pharmaceuticals Ltd. 提供。
磷酸二氢铵、磷酸、氨水为分析纯;乙腈、甲醇为色谱纯;水为超纯水。
1.2色谱条件
采用Waters Xbridge C18(4.6 mm×250 mm,5 μm);Thermo BDS HYPERSIL C18(4.6 mm×250 mm,5 μm);ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 μm)色谱柱;以磷酸盐缓冲液(取磷酸氢二铵2.64 g,溶于1000 mL水中,用稀氨水或磷酸溶液调节pH值至8.0±0.05)-甲醇(90:10)为流动相A,甲醇为流动相B。线性梯度洗脱程序为0 min A 80%,5 min A 80%,20 min A 50%,25 min A 50%,27 min A 80%,32 min A 80%;流速1.0 mL·min-1;检测波长210 nm;柱温40 ℃。
1.3溶液的制备
(1)稀释剂。0.1%磷酸溶液-乙腈(90:10)。
(2)混合对照品溶液贮备液。取维格列汀和杂质Ⅰ、Ⅱ、Ⅲ对照品适量,加稀释剂溶解并稀释制成每1 mL中约含维格列汀和杂质Ⅰ、Ⅱ、Ⅲ各0.02 mg的溶液,作为混合对照品溶液贮备液,见图2。

图2 维格列汀及其杂质混合对照色谱图
(3)对照品溶液。取维格列汀对照品适量,精密称定,用稀释剂制成每1 mL中约含2 μg的溶液,作为对照品溶液。
(4)供试品溶液.取维格列汀原料药适量,精密称定,用稀释剂溶解并定量稀释制成每1 mL中约含2 mg的溶液,作为供试品溶液,见图3。

图3 维格列汀供试品色谱图
1.4有关物质检查法
精密量取供试品溶液和对照品溶液各20 μL,分别注入液相色谱仪,记录色谱图,杂质Ⅰ、杂质Ⅱ和杂质Ⅲ相对于维格列汀峰(保留时间为约12 min)的相对保留时间分别为1.5、0.3和0.6。供试品溶液色谱图中如有杂质峰,按外标法以峰面积计算,杂质Ⅰ校正因子为0.7,杂质Ⅱ校正因子为0.4,杂质Ⅲ及其他各杂质校正因子均为1.0。
2 结果与讨论
2.1分析方法的验证
2.1.1专属性考察
空白无干扰。
为了考察该方法能否有效检测出本品在生产及贮存过程中可能产生的降解产物,进行适度的强制降解试验,以验证分析方法对相关降解产物检查的专属性。
加热、光照和强酸破坏使杂质Ⅲ峰略升高;强碱破坏使杂质Ⅲ峰明显升高;氧化破坏使杂质峰个数和含量均明显升高,见图4~图8。上述试验结果表明,该方法具有良好的专属性,适用于维格列汀在生产及贮存过程中因各种影响因素所产生的杂质检查。
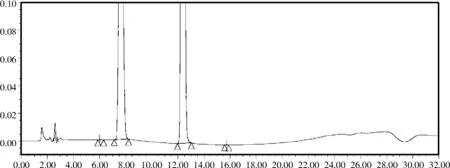
图4 维格列汀强碱破坏色谱图
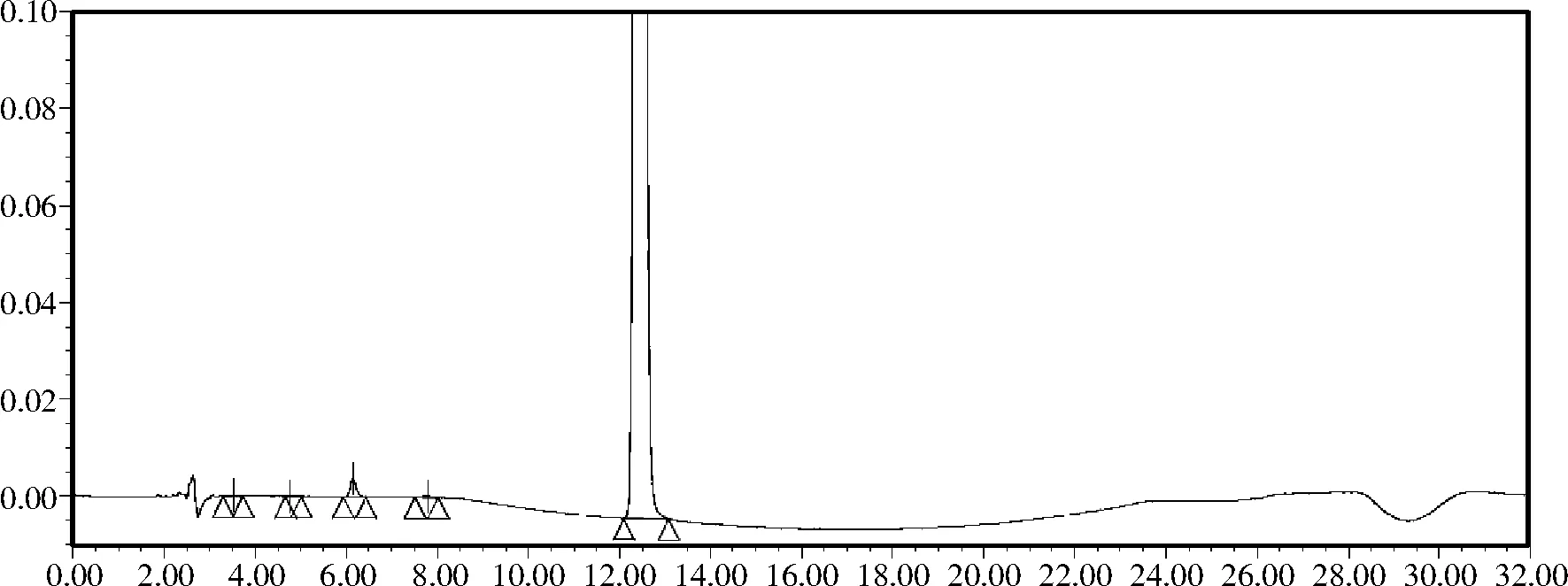
图5 维格列汀加热破坏色谱图

图6 维格列汀强酸破坏色谱图

图7 维格列汀强氧化破坏色谱图

图8 维格列汀强光照破坏色谱图
2.1.2检测限、定量限及线性
精密量取混合对照品溶液贮备液适量,用稀释剂稀释成一系列不同浓度的混合对照品溶液,以浓度(μg/mL)为横坐标,峰面积为纵坐标作回归直线。维格列汀及杂质Ⅰ、Ⅱ、Ⅲ分别在0.218~5.457、0.184~4.603、0.196~4.895、0.205~5.127 μg/mL范围内线性良好(r>0.999)。维格列汀及杂质Ⅰ、Ⅱ、Ⅲ的检出限分别为1.3、1.1、1.2、1.2 ng(S/N=3);定量限分别为4.4、3.7、3.9、4.1 ng(S/N=10)。
2.1.3回收率试验
取维格列汀约10 mg,精密称定,置10 mL量瓶中,分别加混合对照品溶液贮备液0.375、0.75、1.125 mL,按有关物质检查法测定。杂质Ⅰ、Ⅱ、Ⅲ回收率分别为95.1%~99.0%、102.3%~105.3%、103.4%~109.4%,均值分别为96.8%、103.6%、107.1%(n=9)。
2.1.4溶液的稳定性
供试品溶液室温放置24 h,杂质峰的个数与含量基本无变化;室温放置48 h,除杂质Ⅲ峰略升高外,其余杂质峰的个数与含量和0 h基本一致。
2.1.5精密度与重复性
对照品溶液连续进样,维格列汀峰面积的RSD为0.4%(n=6)。
取1302001667批样品重复测定6次,总杂质含量一致(0.02%),各杂质峰面积的RSD均<10%。
2.1.6耐用性
选用三根不同型号色谱柱试验,杂质Ⅰ、Ⅱ、Ⅲ相对保留时间(RRT)与校正因子(f)几乎一致(偏差<10%),各色谱峰的效能指标基本一致,杂质之间以及主成分间分离度良好(分离度>3)。三根色谱柱测定的杂质Ⅰ、Ⅱ、Ⅲ相对保留时间(RRT)均值分别为1.5、0.3、0.6,校正因子(f)均值分别为0.7、0.4、0.9。
2.2测定结果
三批样品的测定结果如表1所示。
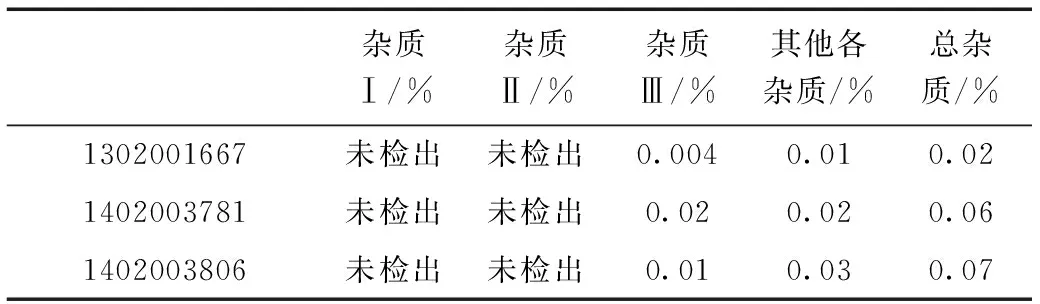
表1 有关物质测定结果
2.3讨论
(1)测定波长的选择
对维格列汀及杂质Ⅰ、Ⅱ、Ⅲ进行DAD扫描,维格列汀、杂质Ⅰ和杂质Ⅲ均在210 nm的波长处有最大吸收,杂质Ⅱ为末端吸收。随着测定波长降低,基线噪音增大,因此选择210 nm波长处测定维格列汀及其杂质,此时基线较平滑,各杂质检出限较高,能满足测定要求。
(2)校正因子的确定 根据耐用性实验结果,以三根不同型号色谱柱测定的均值得出。按照杂质检查的相关规定(校正因子在0.9~1.1之间的杂质可以1.0计),确定“1.4 有关物质检查法”中各杂质的校正因子,分别为杂质Ⅰ为0.7,杂质Ⅱ为0.4,杂质Ⅲ及其他各杂质均为1.0。
3 结 论
本法准确、简便、快速,可用于维格列汀原料药的有关物质检查。
[1]樊新星,徐珽,卢静,等. 抗糖尿病新药维格列汀[J]. 中国新药杂志, 2008, 17(14):1272-1274.
[2]蔡倩,刘蕾. 新型降糖药物二肽基肽酶-4抑制剂的研究进展[J]. 中国新药杂志, 2014, 23(3):302-307.
[3]安富荣,崔岚,王勤. 治疗2型糖尿病新药——维格列汀[J]. 中国新药与临床杂志, 2012, 31(10):574-578.
[4]韩春明,殷剑,王风云,等. 维达列汀的合成工艺改进[J]. 精细化工, 2015, 32(1):69-72.
[5]丁景伟,王秋艳,张勇. 维格列汀降解杂质的合成[J]. 中国医药工业杂志, 2015, 46(11):1169-1172.
Study on Determination of the Related Substances in Vildagliptin
YANG Mei, CHEN Hong
(Chengdu Institute of Food and Drug Control, Sichuan Chengdu 610045, China)
A method for determination of the related substances in Vildagliptin was established. It was determined on HPLC. The C18was used as analytical column. Phosphate buffer (containing 2.46 g of diammonium hydrogen phosphate in 1 litre of water, adjusted to pH 8.0±0.05 with ammonium hydroxide solution or phosphoric acid) and methanol (90:10) were used as mobile phases A, methanol were used as mobile phases B, with gradient elution. The column temperature was kept at 40 ℃. The flow rate was 1.0 mL·min-1. The detection wavelength was set at 210 nm. Results showed that Vildagliptin and its impurities could be separated with all related substances completely. The limits of detection was 1.1, 1.2, 1.2 ng(S/N=3) for impurity Ⅰ, Ⅱ, Ⅲ. Their linearities were good, with their recoveries 96.8%, 103.6%, 107.1%, respectively. The method is accurate and sensitive, and can be used for the related substances in Vildagliptin.
Vildagliptin; related substance; Vildagliptin impurityⅠ, Ⅱ, Ⅲ
杨梅(1979-),女,主管药师,主要从事药物分析及质量控制。
R917
A
1001-9677(2016)016-0149-03
